LABORATORIUM PRATRANSFUSI
UP DATE
Undang-Undang Republik Indonesia Nomor 28 Tahun 2014 Tentang Hak Cipta Lingkup Hak Cipta
Pasal 1
1. Hak Cipta adalah hak eksklusif pencipta yang timbul secara otomatis berdasarkan prinsip deklaratif setelah suatu ciptaan diwujudkan dalam bentuk nyata tanpa mengurangi pembatasan sesuai dengan ketentuan peraturan perundang-undangan.
Ketentuan Pidana Pasal 113
1. Setiap Orang yang dengan tanpa hak melakukan pelanggaran hak ekonomi sebagaimana dimaksud dalam Pasal 9 ayat (1) huruf I untuk Penggunaan Secara Komersial dipidana dengan pidana penjara paling lama 1 (satu) tahun dan / atau pidana denda paling banyak Rp. 100.000.000,00 (seratus juta rupiah).
2. Setiap Orang yang dengan tanpa hak dan / atau tanpa izin Pencipta atau pemegang Hak Cipta melakukan pelanggaran hak ekonomi Pencipta sebagaimana dimaksud dalam Pasal 9 ayat (1) huruf c, huruf d, huruf f, dan / atau huruf h untuk Penggunaan Secara Komersial dipidana dengan pidana penjara paling lama 3 (tiga) tahun dan / atau pidana denda paling banyak Rp. 500.000.000,00 (lima ratus juta rupiah).
dr. Ni Kadek Mulyantari, Sp.PK(K) Dr.dr. I Wayan Putu Sutirta Yasa, MSi
Udayana UnIveRSIty PReSS 2016
LABORATORIUM PRATRANSFUSI
UP DATE
Hak Cipta pada Penulis.
Hak Cipta Dilindungi Undang-Undang :
dilarang mengutip atau memperbanyak sebagian atau seluruh isi buku ini tanpa izin tertulis dari penerbit.
Penulis:
dr. ni Kadek Mulyantari, Sp.PK(K) dr.dr. I Wayan Putu Sutirta yasa, MSi
Editor:
Jiwa atmaja Cover & Ilustrasi:
Repro Design & Lay Out:
I Wayan Madita Diterbitkan oleh:
Udayana University Press Kampus Universitas Udayana denpasar Jl. P.B. Sudirman, denpasar - Bali telp. (0361) 255128 [email protected] http://udayanapress.unud.ac.id
Cetakan Pertama:
2016, xvii + 154 hlm, 15 x 23 cm ISBN: 978-602-294-151-4
LABORATORIUM PRATRANSFUSI
UP DATE
Special for our family “Thank you for the time we spent together, Thank you for never leaving me in the bad times,
Thank you for understanding me and all the motivation.
However, the most important is thanks for loving me like you love yourself.”
Suami tercinta dr. I Ketut Widiyasa, MPH Ananda Putu Bagus Alden Putra Naresha
Kadek Ellisya Ayu Heradiva Naresha Komang Aqila Dharmaswari Naresha dr. Ni Kadek Mulyantari, Sp.PK(K)
Istri tercinta Ni Putu Sudani. S.IP. MM Ananda dr. Gede Agus Eka Tirta Putra Gede Agus Ari Tirta Yasa, S.Farm. Apt Dr. dr. I Wayan Putu Sutirta Yasa, MSi
PRAKATA
Laboratorium pratransfusi merupakan serangkaian pemeriksaan lab. yang dilakukan sebelum produk darah didistribusikan ke ruang perawatan pasien. Bagian ini merupakan tahapan akhir yang menentukan apakah produk darah layak atau tidak ditransfusikan kepada pasien.
Seluruh prosedur dapat menjadi komponen kritis dalam menentukan keselamatan pasien.
Dalam pelaksanaannya, tidak semua hasil pemeriksaan laboratorium pratransfusi memberikan hasil sesuai dengan harapan.
Sangat banyak permasalahan baik yang disebabkan oleh faktor teknis maupun faktor pasien dan donor, sehingga hasil pemeriksaan menyimpang dari yang seharusnya. Dalam buku ini, dibahas secara rinci mengenai prosedur teknis pemeriksaan laboratorium pratranfusi, permasalahan yang muncul, serta cara mengatasinya.
Penulis berharap buku ini dapat membantu berbagai pihak yang terlibat dalam pelayanan transfusi darah baik teknisi laboratorium, dokter laboratorium, klinisi maupun pihak manajemen sehingga menambah wawasan dan memiliki persepsi yang sama tentang pemeriksaan laboratorium terkait transfusi.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam penyusunan buku ini.
Akhir kata, tidak ada sesuatu yang sempurna. Mohon maaf apabila ada kesalahan dalam penulisan. Kritik atau saran dari pembaca sangat kami harapkan untuk perbaikan penulisan di kemudian hari.
Denpasar, Januari 2017 Penulis
SAMBUTAN
REKTOR UNIVERSITAS UDAYANA
Om Swastiastu
Perkembangan ilmu kedokteran begitu pesat, agar para dokter dapat memberikan pelayanan kesehatan kepada para penderita dengan baik dibutuhkan pemutahiran ilmu pengetahuan. Pembaruan dan pemutahiran (updating) ilmu kedokteran, khususnya dalam bidang laboratorium pratransfusi akan membantu kecermatan dan keselamatan serta menghindarkan bahaya transfusi kepada individu yang memerlukan.
Saya menyambut baik terbitnya buku yang berjudul
“Laboratorium Pratransfusi Up Date”. Besar harapan saya agar buku ini mampu menjadi pedoman dan solusi bagi sebagian besar permasalahan terkait pelayanan transfusi darah, dan membuka wawasan semua pihak yang terlibat dalam kegiatan pelayanan darah sehingga bisa membangun kesatuan persepsi dalam penatalaksanaan pasien. Buku ini juga diharapkan menjadi bahan bacaan bagi para mahasiswa kedokteran sebagai bekal pengetahuan setelah mereka lulus sebagai dokter.
Akhir kata saya mengucapkan selamat kepada penulis dan penghargaan yang setinggi-tingginya atas waktu, upaya dan kerja kerasnya dalam penulisan buku ini. Semoga niat baik ini mampu membuahkan hasil semaksimal mungkin, membantu dalam peningkatan kualitas pelayanan kesehatan khususnya dibidang transfusi darah yang berujung pada keamanan dan keselamatan pasien.
Om Shanti, Shanti, Shanti
Denpasar, Januari 2017 Rektor Universitas Udayana
Prof. Dr. dr. Ketut Suastika, SpPD-KEMD
DAFTAR ISI
Prakata ... vi
Sambutan Rektor Universitas Udayana ... vii
Daftar Isi ... viii
Daftar Tabel ... xi
Daftar Gambar ... xiii
Daftar Singkatan ... xvi
BAB I. PENDAHULUAN ... 1
BAB II. UJI PRATRANSFUSI ... 4
2.1 Definisi ... 4
2.2 Jenis Uji Pratransfusi ... 5
2.3 Persiapan Uji Pretransfusi ... 6
2.4 Pemisahan Serum atau Plasma, Pencucian Sel Darah Merah dan Pembuatan Suspensi Sel Darah ... 13
2.5 Uji Pratransfusi Pada Kondisi Emergency ... 16
2.6 Beberapa Kasus Terkait Tahapan Uji Pratransfusi ... 18
Daftar Pustaka ... 22
BAB III. PEMERIKSAAN GOLONGAN DARAH ABO ... 24
3.1 Definisi ... 24
3.2 Sistem Antigen dan Antibodi Pada Golongan darah ... 24
3.3 Jenis Pemeriksaan Golongan Darah ... 26
3.4 Pemeriksaan Golongan Darah Dengan Slide Test atau Tile Method ... 27
3.5 Pemeriksaan Golongan Darah Dengan Tube Test ... 30
3.6 Pemeriksaan Golongan Darah ABO Dengan Mcroplate Test ... 35
3.7 Pemeriksaan Golongan Darah Dengan Column Technique (Sephadex Gel) ... 40
3.8 Pemeriksaan Golongan Darah ABO Dengan Solid Phase Tests ... 45
3.9 Faktor-faktor Yang Mempengaruhi Reaksi Antigen
Antibodi Pada Pemeriksaan Golongan Darah ... 46
3.10 Permasalahan Pada Pemeriksaan Golongan Darah ... 48
3.11 Penanganannya Discrepancy Golongan Darah ABO ... 50
3.12 Contoh Kasus Terkait Pemeriksaan Golongan Darah ABO ... 53
Daftar Pustaka ... 57
BAB IV. PEMERIKSAAN GOLONGAN DARAH RHESUS ... 60
4.1 Golongan Darah Rhesus ... 60
4.2 Tujuan Pemeriksaan Golongan Darah Rhesus ... 61
4.3 Prinsip Pemeriksaan Golongan Darah Rhesus ... 61
4.4 Metode Pemeriksaan Golongan Darah Rhesus ... 61
4.5 Pemeriksaan Golongan Darah Rhesus Dengan Metode Slide Test ... 62
4.6 Pemeriksaan Golongan Darah Rhesus Dengan Metode Tube Test ... 65
4.7 Pemeriksaan Golongan Darah Rhesus Dengan Metode Microwell Plate atau Microplate ... 67
4.8 Weak D atau Du Phenotype ... 68
4.9 Pemeriksaan weak D (Rhesus Du) ... 69
4.10 Discrepancies dan Permasalahan Pada Pemeriksaan Golongan Darah Rhesus ... 70
4.11 Contoh Kasus Terkait Golongan Darah Rhesus ... 72
Daftar Pustaka ... 80
BAB V. UJI COCOK SERASI (CROSSMATCHING) ... 82
5.1 Definisi ... 82
5.2 Tujuan Uji Cocok Serasi (Crossmatching) ... 83
5.3 Jenis-jenis Uji Cocok Serasi (Crossmatching) ... 83
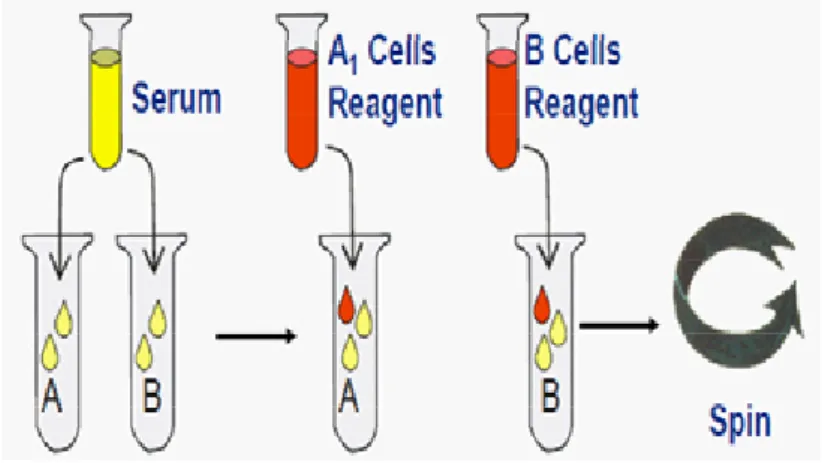
5.4 Immediate-Spin (IS) Crossmatch ... 84
5.5 Crossmacthing Dengan Tube Test ... 86
5.6 Crossmacthing dengan Column Agglutination Test ... 88
5.7 Computer (Electronic) Crossmatch ... 93
5.8 Crossmatching Pada Kondisi Khusus ... 95
5.9 Penyebab dan Penanganan Inkompatibilitas Pada Hasil Crossmatching ... 96
5.10 Contoh Kasus Terkait Crossmatching ... 99
Daftar Pustaka ... 102
BAB VI. ANTIGLOBULIN TEST (COOMB’S TEST) ... 104
6.1 Definisi Coomb’s Test ... 104
6.2 Tujuan Coomb’s Test ... 104
6.3 Prinsip Pemeriksaan Coomb’s Test ... 105
6.4 Metode Pemeriksaan Coomb’s Test ... 106
6.5 Pemeriksaan DCT Dengan Metode Tabung (Tube Test) ... 107
6.6 Pemeriksaan ICT Dengan Metode Tabung (Tube Test) .... 109
6.7 Interpretasi Hasil Coomb’s Test ... 111
6.8 Faktor-faktor yang mempengaruhi hasil pemeriksaan Coomb’s Test ... 111
6.9 Sumber Kesalahan Pemeriksaan Coomb’s Test ... 114
6.10 Pemeriksaan ICT menggunakan medium LISS ... 115
6.11 Beberapa modifikasi dan automatisasi pemeriksaan Coomb’s Test ... 116
6.12 Contoh Kasus Terkait Coomb’s Test ... 118
Daftar Pustaka ... 125
BAB VII. PEMERIKSAAN SKRINING DAN IDENTIFIKASI ANTIBODI ... 127
7.1 Definisi ... 127
7.2 Tujuan Pemeriksaan ... 128
7.3 Prinsip Pemeriksaan ... 128
7.4 Metode Pemeriksaan ... 129
7.5 Alat dan Bahan ... 129
7.6 Prosedur Pemeriksaan ... 130
7.7 Interpretasi Hasil ... 139
7.8 Faktor-faktor Yang Mempengaruhi Sensitivitas Skrining Antibodi ... 146
7.9 Penyebab Kesalahan Hasil Pemeriksaan Skrining dan Identifikasi Antibodi ... 148
Daftar Pustaka ... 149
INDEK ... 150
DAFTAR TABEL
Tabel 2.1 Prosedur rutin uji pratransfusi ... 15 Tabel 2.2 Perbandingan jumlah sel darah merah dan NaCl
pada prosedur pembuatan suspensi sel ... 15 Tabel 3.1 Perbedaan antara IgG dan IgM ... 26 Tabel 3.2 Interpretasi hasil pemeriksaan golongan darah
dengan metode slide test ... 29 Tabel 3.3 Interpretasi hasil pemeriksaan golongan darah
ABO pada sampel eritrosit dan serum ... 34 Tabel 3.4 Contoh ABO discrepancy antara cell grouping dan
serum grouping ... 52 Tabel 3.5 Pemeriksaan golongan darah dengan slide test ... 53 Tabel 3.6 Pemeriksaan golongan darah ulang dengan tube test 54 Tabel 3.7 Pemeriksaan golongan darah ulang setelah
pencucian sel dan dikerjakan dengan metode
tabung, inkubasi 37 o C ... 54 Tabel 3.8 Hasil pemeriksaan golongan darah dengan slide test 55 Tabel 3.9 Hasil pemeriksaan golongan darah ulang pada
sampel yang sama dengan tube test ... 55 Tabel 3.10 Hasil pemeriksaan golongan darah dengan slide test 56 Tabel 3.11 Hasil pemeriksaan golongan darah ulang pada
sampel yang sama dengan tube test ... 56 Tabel 4.1 Contoh pembacaan titer antibodi Rhesus ... 77 Tabel 4.2 Derajat dan skor aglutinasi ... 77 Tabel 5.1 Penyebab dan penanganan inkompatibilitas pada
hasil crossmatching ... 98 Tabel 6.1 Tujuan dari masing-masing tahapan
pemeriksaan ICT ... 110
Tabel 6.2 Panel DCT: pola hasil pemeriksaan DCT pada
Autoimmune Hemolytic Anemia (AIHA) ... 111 Tabel 6.3 Sumber kesalahan hasil pemeriksaan coomb’s test ... 114 Tabel 6.4 Pemeriksaan golongan darah dengan blood
grouping plate ... 118 Tabel 6.5 Pemeriksaan golongan darah ulang dengan metode
tabung ... 118 Tabel 6.6 Pemeriksaan golongan darah ulang setelah pencucian
sel dan dikerjakan dengan metode tabung,
inkubasi 37 o C ... 119 Tabel 6.7 Hasil pemeriksaan crossmatch dengan sejumlah
donor ... 119 Table 6.8 Persentase kasus dan hasil DCT pada masing-
masing tipe AIHA ... 121 Tabel 7.1 Contoh fenotif eritrosit dari individu homozigot dan
heterozigot ... 141 Tabel 7.2 Jenis antibodi yang bereaksi optimal pada masing-
masing fase pemeriksaan skrining antibodi ... 147
DAFTAR GAMBAR
Gambar 2.1 Mencocokan identitas sampel darah dengan
gelang identitas pasien ... 7 Gambar 2.2 Contoh pelabelan sampel darah untuk uji
pretransfusi ... 8 Gambar 2.3 Tabung tutup merah dan tutup ungu
untuk menampung sampel uji pratransfusi ... 9 Gambar 2.4 Contoh prosedur pembuatan suspensi sel 5% ... 15 Gambar 2.5 Contoh label penggunaan produk darah yang
belum dilakukan pemeriksaan crossmatch
dalam situasi emergency ... 16 Gambar 2.6 Hasil pemeriksaan crossmatch dengan
metode gel menunjukan hasil kompatibel ... 18 Gambar 2.7 Hasil pemeriksaan crossmatch dengan
metode gel menunjukan hasil kompatibel
dengan warna kemerahan pada permukaan gel .. 19 Gambar 3.1 Struktur molekul IgG dan IgM ... 25 Gambar 3.2 Prosedur pemeriksaan golongan darah
dengan metode slide test ... 28 Gambar 3.3 Contoh hasil pemeriksaan golongan darah
dengan metode slide test ... 29 Gambar 3.4 Prosedur pemeriksaan cell grouping atau
forword grouping dengan metode tube test ... 31 Gambar 3.5 Prosedur pemeriksaan serum grouping atau
reverse grouping dengan metode tube test ... 32 Gambar 3.6 Derajat aglutinasi pada pemeriksaan golongan
darah dengan metode tube test ... 33 Gambar 3.7 V-type well, flat bottom dan U-type well ... 35 Gambar 3.8 U-shaped bottom microplate ... 37
Gambar 3.9 Pola reaksi pada pemeriksaan golongan darah
dengan microplate test ... 39 Gambar 3.10 Derajat aglutinasi hasil pemeriksaan golongan
darah dengan column technique ... 43 Gambar 3.11 Contoh hasil pemeriksaan golongan darah
ABO/D dan reverse grouping dengan
column technique ... 44 Gambar 3.12 Algoritme penanganan kasus discrepancy
golongan darah ... 51 Gambar 3.13 Rouleaux dan agglutination ... 53 Gambar 4.1 Rh viewbox untuk pemeriksaan golongan
darah Rhesus dengan metode slide test ... 62 Gambar 4.2 Contoh hasil pemeriksaan golongan darah
Rhesus dengan slide test ... 64 Gambar 4.3 Pengenceran serum secara serial dengan
larutan salin ... 76 Gambar 5.1 Prosedur pemeriksaan IS dengan motode
tube test ... 85 Gambar 5.2 Prosedur pemeriksaan croosmatch fase III ... 88 Gambar 5.3 Prinsip pemeriksaan crossmatch metode
column agglutination test ... 89 Gambar 5.4 Sentrifus dan inkubator yang sesuai dengan
ukuran plastic card ... 90 Gambar 5.5 Prosedur pemipetan sampel pada microtube ... 91 Gambar 5.6 Derajat aglutinasi pada pemeriksaan crossmatch
dengan metode column agglutination test ... 92 Gambar 6.1 Prinsip pemeriksaan Direct Coomb’s Test ... 105 Gambar 6.2 Prinsip pemeriksaan Indirect Commb’s Test ... 106 Gambar 6.3 Prosedur pemeriksaan DCT dengan motode
tube test ... 108 Gambar 6.4 Prosedur pemeriksaan IAT dengan motode
tube test ... 110 Gambar 7.1 Contoh komposisi sel panel primer ... 130
Gambar 7.2 Prosedur pemeriksaan skiring dan identifikasi
antibodi dengan metode tabung ... 132 Gambar 7.3 Contoh hasil pemeriksaan identifikasi antibodi .. 134 Gambar 7.4 Hasil pemeriksaan dengan metode gel ... 135 Gambar 7.5 Sistem solid phase adherence test ... 136 Gambar 7.6 Prosedur pemeriksaan skrining dan identifikasi
antibodi menggunakan metode solid phase
adherence ... 137 Gambar 7.7 Perbandingan derajat positif pemeriksaan
skrining dan identifikasi antibodi antara metode tabung dan metode solid phase adherence ... 138 Gambar 7.8 Beda gambaran antibodi yang diekspesikan
secara homozigot dan heterozigot ... 141 Gambar 7.9 Contoh teknik eksklusi atau rule out pada
tahapan interpretasi identifikasi antibodi ... 142 Gambar 7.10 Contoh pemberian tanda pada jenis antigen yang
tidak ada coretan setelah tahap rule out ... 143 Gambar 7.11 Contoh teknik inklusi ... 144 Gambar 7.12 Rule of three terpenuhi ... 144
DAFTAR SINGKATAN
AABB : American Association of Blood Bank ANC : Antenatal care
AHG : Anti Human Globulin ARV : Anti Retro Viral
AIHA : Auto Immune Hemolytic Anemia HDN : Hemolytic Disease of New Born BDRS : Bank Darah Rumah Sakit CS : Caesarean Section CAS : Cold Agglutinin Syndroma PCH : Paroxysmal Cold Hemoglobinuria CAD : Cold Aglutinin Disease
CCC : Coomb’s Control Cells DCT : Direct Coombs’ test DAT : Direct Antiglobulin Test DL : Darah Lengkap
ICT : Indirect Coomb’s test
EDTA : Ethylene Diamine Tetraacetic Acid ELAT : Enzyme-Linked Antiglobulin Test ELISA : Enzyme-linked immunosorbent assay FDA : Food and Drug Administration FFP : Fresh Frozen Plasma
HDFN : Hemolytic Disease of the Fetus and Newborn HDN : Hemolytic Disease of the New born
HIV : Human Immunodeficiency Virus HSV : Herpes Simplex Virus
IAT : Indirect Antiglobulin Test ICT : Indirect Coomb’s Test LISS : Low Ionic Strength Solution LIP : Low-Ionic Polybrene technique LDH : Lactic Dehydrogenase
MCV : Mean Cells Volume PCR : Polymerase Chain Reaction PRC : Packed Red Cell
PEG : Polyethylene glycol RhIG : Rh immune globulin RCFs : Relative Centrifugal Forces SPRCA : Solid-Phase Red Cell Adherence RSUD : Rumah Sakit Umum Daerah SPO : Standard Operating Procedures GLIAT : The gel low ionic antiglobulin test UTD : Unit Transfusi Darah
UGD : Unit Gawat Darurat
WAIHA : Warm Autoimmune Hemolytic Anemia WRC : Wash Red Cells
WBC : White Blood Cells
WHO : Word Health Organization
BAB I
PENDAHULUAN
Transfusi darah merupakan salah satu komponen terapi yang sangat penting dalam penatalaksanaan pasien. Pemberian transfusi darah harus berpegang pada prinsip bahwa manfaat yang akan diterima oleh pasien jauh lebih besar dibandingkan risiko yang akan ditanggung, sehingga semboyan “Getting the right blood to the right patient at the right time and the right place” harus benar-benar dilaksanakan.
Transfusi darah sudah dikenal sejak ratusan tahun yang lalu.
Pada awal diperkenalkan, kegiatan transfusi darah sering mengalami kegagalan, bahkan menimbulkan kematian pada sejumlah pasien.
Semakin lama kegiatan transfusi darah semakin menemukan titik terang sehingga cukup banyak nyawa yang bisa terselamatkan. Titik terang tersebut mulai terlihat saat ditemukannya sistem golongan darah ABO oleh Karl Landsteiner pada abad ke-19. Tahun 1904, Charles Richard Drew menemukan bahwa plasma darah atau cairan yang tidak mengandung sel darah merah dapat dibekukan dan disimpan dalam waktu lama tanpa mengalami kerusakan. Berdasarkan temuan tersebut mulailah dilakukan pemisahan komponen darah dan dibuka bank penyimpanan darah. Pada 1950 Carl Walter dan W.P. Murphy memperkenalkan kantong plastik untuk mengumpulkan darah donor sehingga darah dapat dikemas dengan lebih aman dan praktis. Pada tahun 1953 mulai dikembangkan refrigerated centrifuge untuk memisahkan komponen darah menjadi beberapa jenis komponen dan saat ini pemisahan tersebut sudah dapat dilakukan secara otomatis dengan mesin apheresis.
Meskipun telah ditemukan teknik dan peralatan yang menunjang dalam kegiatan pelayanan transfusi, ternyata masih ditemukan banyak masalah terkait transfusi darah. Misalnya, meskipun golongan darah ABO antara pasien dan donor sudah sama, tetapi sejumlah reaksi selama dan setelah transfusi tetap terjadi. Berdasarkan berbagai permasalahan
yang muncul di lapangan, akhirnya ditemukanlah sejumlah pemeriksaan laboratorium yang dapat mencegah munculnya efek samping transfusi darah.
Pemeriksaan laboratorium sebelum pemberian transfusi darah (pretransfusion testing) merupakan bagian yang sangat vital dalam kegiatan transfusi. Uji pratransfusi inilah yang menentukan apakah produk darah yang akan ditransfusikan dapat memberikan manfaat yang optimal atau tidak kepada pasien. Selain itu, uji pratransfusi juga dapat memprediksi apakah transfusi akan memberikan efek samping yang fatal atau tidak sehingga pencegahan terjadinya efek samping pemberian transfusi dapat lebih awal dilakukan.
Laboratorium pratransfusi terus mengalami perkembangan.
Perkembangan terjadi mulai dari pemeriksaan yang sangat sederhana sampai pemeriksaan otomatis pun telah berhasil dilakukan. Pada awal abad ke-19, laboratorium pratransfusi hanya bisa dikerjakan terbatas pada pemeriksaan golongan darah dan crossmatching dengan menggunakan metode slide test dan tube test. Pada 1945 Coombs, Mourant dan Race menemukan pemeriksaan antiglobulin untuk mendeteksi antibodi yang mensensitisisasi sel darah merah maupun antibodi yang bebas dalam serum. Pada 1946 Coombs dan Cowokers melaporkan penggunaan Anti Human Globulin (AHG) untuk mendeteksi sensitisasi sel darah merah secara in vivo pada bayi baru lahir dengan kelainan hemolitik dan selanjutnya dikenal dengan Direct Antiglobulin Testing (DAT).
Pada 1960 mulai digunakan metode micoplate testing untuk mendeteksi adanya antigen sel darah merah dan antibodi dalam serum secara rutin terutama di Unit Transfusi Darah (UTD). Metode micoplate testing ini terdiri dari 96 wells yang digunakan untuk menggantikan metode tube test pada pemeriksaan dengan jumlah test yang banyak.
Selanjutnya, pada 1985, Dr. Yves Lapierre dari Perancis mengembangkan teknik gel test menggunakan berbagai media seperti gelatin, acrylamide gel, dan glass beads. Dr. Lapierre menemukan adanya aglutinasi selama sedimentasi dan sentrifugasi standar serta menemukan adanya partikel gel sebagai materi yang ideal untuk mendeteksi aglutinasi.
Perkembangan selanjutnya pada 1978 Rosenfield dan Coworker pertama
kali berhasil mengaplikasikan prinsip solid-phase immunoassay untuk pemeriksaan golongan darah dan antibodi skrining. Selanjutnya solid- phase immunoassay mengalami perkembangan sehingga dikenal adanya solid-phase red cell adherence (SPRCA), solid-phase protein A dan solid- phase enzyme-linked immunosorbent assay (ELISA). Tahun 1988, Dr.
Lapierre dan DiaMed A.G mengembangkan produksi gel di Eropa dan September 1994 Food and Drug Administration (FDA) memberikan ijin produksi dan distribusi antiglobulin anti-IgG gel card. Penemuan terus berlanjut sehingga saat ini pemeriksaan laboratorium immunohematology sudah berjalan dengan sistem automation technology.
Dalam buku ini akan dibahas secara rinci mengenai berbagai pemeriksaan laboratorium sebelum produk darah ditransfusikan kepada pasien. Buku ini diharapkan dapat meningkatkan pemahaman serta keterampilan para petugas yang terlibat dalam pelayanan transfusi darah.
Selain itu, buku ini diharapkan dapat menciptakan persepsi yang sama baik antar petugas teknis, dokter laboratorium, para klinisi maupun pihak manajemen yang terlibat dalam pelayanan transfusi darah sehingga pada akhirnya pasien akan mendapatkan manfaat transfusi secara maksimal dan risiko seminimal mungkin.
BAB II
UJI PRATRANSFUSI
2.1 Definisi
Uji pratransfusi memiliki beberapa istilah lain seperti pretransfusion testing atau compatibility testing. Uji pratransfusi adalah serangkaian pemeriksaan yang dilakukan sebelum produk darah ditransfusikan pada pasien. Uji pratransfusi ini identik dengan crossmatching (direct compatibility test) meskipun dalam aplikasinya pada uji pratransfusi ini terdapat pemeriksaan awal serta ada pemeriksaan lanjutan yang harus dilakukan apabila hasil crossmatching tidak sesuai. Jadi crossmatching hanya merupakan salah satu bagian dari uji pratransfusi (Stoe, 2011). Uji pratransfusi di internal laboratorium pada umumnya menghabiskan waktu sekitar satu jam. Waktu pengerjaan dapat lebih pendek ataupun lebih panjang tergantung jenis dan metode pemeriksaan serta kendala yang dihadapi selama prosedur berjalan.
Berdasarkan standar American Association of Blood Bank (AABB), tahapan-tahapan uji pratransfusi tidak hanya terbatas pada pemeriksaan laboratorium saja, tetapi juga meliputi cakupan yang lebih luas. Mulai dari permintaan darah sampai pelabelan produk darah sebelum didistribusikan ke pasien. Ada pun tahapan uji pratransfusi menurut standar AABB adalah sebagai berikut:
1. Pengisian formulir permintaan darah,
2. identifikasi pasien dan pengambilan sampel darah pasien,
3. pemeriksaan terhadap sampel pasien (kelayakan sampel untuk diperiksa, pemeriksaan golongan darah ABO dan Rhesus, pemeriksaan skrining dan identifikasi antibodi, membandingkan hasil pemeriksaan saat ini dengan hasil pemeriksaan sebelumnya),
4. pemeriksaan terhadap sel darah merah donor (konfirmasi pemeriksaan golongan darah ABO dan Rhesus),
5 5. pemilihan darah donor, pilih komponen darah dengan golongan
darah ABO dan Rhesus yang kompatibel dengan pasien dan tidak mengandung unexpected allogeneic antibodies,
6. melakukan pemeriksaan crossmatch baik dengan cara serologi maupun komputer atau elektronik,
7. melakukan pelabelan komponen darah sesuai dengan identitas pasien dan pendistribusian produk darah (zundel, 2012).
2.2 Jenis Uji Pratransfusi
Word Health Organization (WHO) merekomendasikan uji pratransfusi minimal yang harus dikerjakan di laboratorium adalah pemeriksaan golongan darah sistem ABO dan Rhesus serta crossmatching (WHO, 2002). Sumber lain menyebutkan bahwa uji pratransfusi (pretransfusion testing) meliputi pemeriksaan golongan darah ABO dan Rhesus (D phenotype), antibodi skrining dan crossmatching (Zundel, 2012; Blaney and Howard, 2013). Berikut adalah rangkuman prosedur rutin uji pratransfusi yang dilakukan di laboratorium imunohematologi.
Tabel 2.1 Prosedur rutin uji pratransfusi (Stoe, 2011; Blaney and Howard, 2013).
Tabel 2.1 Prosedur rutin uji pratransfusi (Stoe, 2011; Blaney and Howard, 2013).
Jenis pemeriksaan Tujuan Sumber antigen Sumber antibodi ABO/D typing
(forward grouping)
Mendeteksi adanya antigen A,B dan D
Sel darah merah pasien
Anti-A, Anti-B, Anti D komersial ABO serum testing
(reverse grouping)
Deteksi antibodi ABO Suspensi sel donor Serum atau plasma pasien
Skrining antibodi Mendeteksi antibodi dengan antigen spesifik pada sel darah merah
Sel panel Serum atau plasma pasien
Crossmatching Menentukan kompatibilitas serologi antara donor dan pasien sebelum transfusi
Sel darah merah donor dan pasien
Serum atau plasma donor dan pasien
Gambar 2.3 Tabung tutup merah dan tutup ungu untuk menampung sampel uji pratransfusi (Saluju and Singal, 2014).
2.3 Persiapan Uji Pratransfusi
Langkah-langkah uji pratransfusi merupakan sebuah proses yang dimulai dari pasien dan berakhir pada pasien juga. Proses tersebut membutuhkan sebuah rancangan yang dapat menjamin keamanan baik bagi donor maupun pasien (recipient). Berikut adalah tahapan-tahapan tentang persiapan uji pratransfusi.
1. Melakukan identifikasi pasien dengan akurat
Salah satu penyebab mayor reaksi transfusi hemolitik yang fatal adalah pemberian darah dengan golongan yang tidak sesuai akibat kesalahan identifikasi saat pengambilan dan pelabelan sampel pasien.
Pengambilan dan pelabelan sampel darah pasien dianggap sebagai bagian yang kritis dalam menjamin keamanan transfusi. Angka kesalahan pelabelan sampel mencapai 1:2.900 sampai 1:6.000 kasus. Sedangkan angka kesalahan identifikasi dan pelabelan sampel mencapai 1:15.000 sampai 1:30.000, dan 70% di antara kejadian tersebut berlangsung secara bedside (McCullough, 2012).
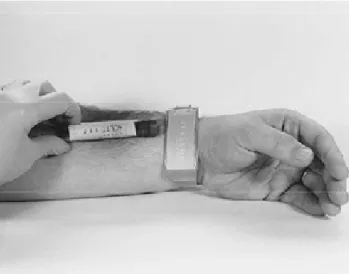
Salah satu fasilitas yang menunjang ketepatan identifikasi adalah gelang identitas pasien. Pada gelang pasien akan tercantum nama lengkap, tanggal lahir dan nomor rekam medik pasien. Informasi yang ada pada permintaan dan sampel darah harus dicocokkan dengan gelang pasien.
Bila terdapat ketidaksesuaian maka sampel darah tidak bisa digunakan.
Bila pasien tidak menggunakan gelang identitas maka petugas harus mengikuti prosedur identifikasi yang ditetapkan oleh rumah sakit dan seharusnya petugas rumah sakit memasang gelang identitas pasien sebelum pengambilan sampel dilakukan (WHO, 2002; Judd, 2009).
Gambar berikut mengilustrasikan salah satu prosedur standar yang harus dilakukan petugas ruangan untuk memastikan identitas sampel darah pasien.
Gambar 2.1 Mencocokan identitas sampel darah dengan gelang identitas pasien (Zundel, 2012).
Pada umumnya, petugas bank darah tidak terlibat dalam pengambilan sampel darah maupun dalam proses pengisian formulir permintaan darah. Sampel darah pasien biasanya dikumpulkan oleh perawat di ruang perawatan dan penyiapkan formulir permintaan darah dilakukan bersama dengan dokter penanggung jawab pasien. Untuk itu, kewajiban pertama yang harus dilakukan oleh petugas di bank darah pada saat menerima sampel dan permintaan adalah wajib melakukan pengecekan kembali kesesuaian identitas dan kelengkapan formulir permintaan darah. Jika ditemukan ketidaksesuaian, maka harus dilakukan pengambilan sampel ulang. Petugas bank darah tidak diperbolehkan melakukan perubahan atau koreksi pada data pasien. Akurasi data pada sampel dan formulir permintaan merupakan faktor utama dalam menjamin keamanan dan keakuratan uji pratransfusi (McCullough, 2012; Blaney and Howard, 2013).
Label sampel minimal harus mencantumkan 2 identitas, yaitu nama lengkap pasien dan nomor catatan medik. Standar pelabelan sampel yang lengkap harus mencantumkan nama lengkap pasien, nomor rekam medik, tanggal pengambilan sampel, tanda tangan dan inisial nama
petugas pengambil sampel. Hal lain yang perlu diperhatikan pada label adalah label harus terbaca dan tidak terhapus. Berikut adalah contoh pemberian label sampel untuk uji pratransfusi (Blaney and Howard, 2013).
Gambar 2.2 Contoh pelabelan sampel darah untuk uji pratransfusi (Blaney and Howard, 2013).
Saat ini banyak rumah sakit telah menerapkan sistem teknologi barcode untuk membantu pencatatan identitas pasien. Sistem ini diharapkan dapat mengurangi kesalahan akibat pencatatan ulang yang dilakukan secara manual. Selain itu pelabelan sampel harus dilakukan secara bedside, segera setelah sampel diambil dan petugas tidak diperkenankan melakukan pekerjaan apapun sebelum proses pelabelan selesai dilakukan (Blaney and Howard, 2013).
Informasi pada label sampel harus sama dengan informasi pada permintaan darah. Formulir juga harus mencantumkan jenis produk yang diminta, nama dan tanda tangan dokter yang meminta, lokasi perawatan pasien, diagnosis, jenis kelamin, tanggal permintaan, jenis permintaan berdasarkan indikator prioritas (cito, rutin, preoperatif, siap pakai) (Blaney and Howard, 2013).
2. Mengecek kondisi sampel
Proses mengecek kondisi sampel adalah kegiatan yang dilakukan oleh petugas bank darah untuk memastikan kondisi sampel layak atau
NAMA NO.CM
TANGGAL SAMPLING PHLEBOTOMIS
tidak diperiksa. Proses ini dilakukan setelah dipastikan data yang tercantum pada label sampel sudah sesuai dengan data pada formulir permintaan darah. Selain itu, seluruh data pada formulir permintaan sudah terisi dengan lengkap sebelum proses ini dimulai. Beberapa kondisi yang perlu diperiksa pada sampel antara lain:
a. Tabung penampungan sampel
Sampel untuk uji pratransfusi umumnya diambil dari darah vena menggunakan tabung tanpa antikoagulan (tutup merah) atau tabung dengan antikoagulan EDTA (Ethylenediaminetetraacetic acid) yang bertutup ungu. Antikoagulan lain tidak direkomendasikan karena dapat bersifat sebagai anti-komplemen dan kemungkinan akan menyebabkan adanya fibrin dalam plasma sehingga beberapa antibodi yang bermakna secara klinis tidak dapat dideteksi.
Pada kasus-kasus kegawatdaruratan, penampungan sampel pada tabung dengan tutup merah perlu dipertimbangkan. Sampel pada tabung tutup merah harus didiamkan beberapa menit (sekitar 30 menit) agar darah membeku untuk mendapatkan serum. Sedangkan pada tabung dengan antikoagulan EDTA, darah dapat segera disentrifugasi untuk mendapatkan plasma (Blaney and Howard, 2013). Penampungan sampel dengan menggunakan tabung yang mengandung clot activator atau tabung dengan lapisan silikon juga tidak direkomendasikan (Stoe, 2011).
Gambar berikut adalah gambar jenis tabung yang bisa digunakan untuk menampung sampel uji pratransfusi.
Gambar 2.3 Tabung tutup merah dan tutup ungu untuk menampung sampel uji pratransfusi (Saluju and Singal, 2014).
b. Umur sampel
Sampel untuk uji pratransfusi seharusnya mencerminkan status antibodi saat itu. Umur sampel yang digunakan untuk uji pratransfusi tidak boleh lebih dari 3 hari dengan perhitungan tanggal pengambilan sampel merupakan hari ke-0. Pada kondisi pasien membutuhkan transfusi berulang atau sampel yang dikirim sebelumnya tidak mencukupi, dapat dilakukan pengambilan sampel baru (Judd, 2009; Blaney and Howard, 2013).
Apabila uji pratransfusi sudah selesai dilakukan, sampel darah pasien dan segmen selang dari unit donor yang digunakan untuk crossmatching wajib disimpan selama 7 hari pada suhu 1-6oC.
Penyimpanan ini dilakukan untuk mengantisipasi dibutuhkannya kembali sampel darah untuk penelusuran kasus-kasus reaksi transfusi (Judd, 2009; Blaney and Howard, 2013).
c. Penampilan atau makroskopis sampel
Sampel darah yang lisis selama proses pengambilan sampel tidak bisa diterima dan seharusnya dilakukan pengambilan sampel ulang.
Hemolisis secara mekanik dapat disebabkan beberapa faktor seperti penggunaan jarum dengan ukuran yang terlalu kecil, trauma pada pembuluh darah kecil atau kesulitan melakukan akses vena, tekanan saat memasukkan sampel ke dalam tabung di mana sampel harus melewati ulang ukuran jarum yang kecil, atau sentrifugasi dilakukan pada saat darah belum membeku sempurna (khusus untuk sampel serum).
Hemolisis mekanik dapat menutupi deteksi hemolisis yang diinduksi oleh antibodi. Beberapa antibodi yang diketahui dapat menyebabkan hemolisis antara lain ABO, P1, Lewis, Kidd, atau Vel blood group system (Stoe, 2011; Blaney and Howard, 2013).
Sampel yang potensial terdilusi oleh cairan infus (misal ringer laktat) juga tidak dapat diterima karena berpotensi menghilangkan antibodi lemah atau menginduksi reaksi positif palsu yang disebabkan oleh molekul pada cairan intravena. Sampel untuk bank darah dan semua pemeriksaan laboratorium idealnya diambil dari lengan yang tidak terpasang infus. Jika lokasi infus merupakan satu-satunya lokasi yang dapat diakses untuk pengambilan sampel, maka aliran infus harus
dihentikan sementara dan dibilas dengan salin serta 5-10 ml darah pertama harus dibuang (Stoe, 2011; Blaney and Howard, 2013).
Selain adanya kemungkinan sampel mengalami lisis dan potensial terdilusi oleh cairan infus, sampel yang lipemik (serum tampak berlemak) juga tidak layak diterima. Sampel yang lisis dan lipemik dapat menyulitkan dalam melaksanakan interpretasi hasil crossmatching (Blaney and Howard, 2013).
3. Membandingkan dengan data pasien sebelumnya
Standar American Association of Blood Bank (AABB) menganjurkan untuk melakukan perbandingan hasil pemeriksaan golongan darah sistem ABO dan Rhesus (D typing) selama 12 bulan terakhir. Beberapa indikator yang harus ditelusuri adalah data golongan darah, riwayat kelainan golongan darah, adanya antibodi yang secara signifikan bermakna klinis, kejadian reaksi transfusi dan kebutuhan transfusi yang khusus. Adanya riwayat inkonsistensi atau permasalahan lain yang dijumpai dalam proses ini harus segera dilacak dan diselesaikan sebelum transfusi dilakukan (Stoe, 2011; Blaney and Howard, 2013).
4. Pemilihan reagen untuk menunjang uji pratransfusi
Food and Drug Administration (FDA) telah menetapkan standar minimum terkait sensitivitas dan spesifisitas reagen yang digunakan di bank darah atau unit transfusi darah. FDA menetapkan standar ini sebelum ijin peredaran reagen dikeluarkan secara komersial. Spesifisitas reagen berkaitan dengan kemampuannya mengenali antigen determinan secara spesifik sesuai dengan jenis molekul antibodi yang ditambahkan.
Sebagai contoh adalah anti-D dalam reagen yang mampu bereaksi dengan sel darah merah yang memiliki antigen D namun tidak akan bereaksi dengan sel darah merah yang tidak memiliki antigen D. Contoh lainnya adalah anti-A dalam reagen akan menunjukkan aglutinasi kuat (3+ atau 4+) hanya dengan sel darah merah yang memiliki antigen A (Blaney and Howard, 2013).
Dalam memilih reagen yang akan digunakan, ada beberapa hal yang perlu diperhatikan. Selain rekomendasi FDA, reagen yang
dipilih juga harus mencantumkan masa kadaluwarsanya serta harus mencantumkan nomor ijin produk pada label produk. Berdasarkan ketentuan FDA, reagen yang rutin dipakai di bank darah tidak dapat digunakan apabila telah memasuki masa kadaluwarsa. Namun, hal ini dikecualikan pada antisera atau sel darah merah langka. Pada kedua kondisi tersebut, reagen masih dapat digunakan jika hasil kontrol kualitas (quality control) dapat diterima.
Reagen yang dipilih juga harus dilengkapi dengan product insert.
Product insert memuat informasi detail tentang reagen seperti tujuan penggunaan, ringkasan, jenis sampel yang direkomendasikan, prinsip pemeriksaan, prosedur penggunaan, dan keterbatasan reagen. Jika reagen diproduksi dan digunakan sendiri di internal pelayanan, ijin tidak diperlukan tapi FDA mewajibkan agar spesifisitas dan kemampuan reagen terpenuhi dan didokumentasikan (Blaney and Howard, 2013).
5. Melakukan kontrol kualitas reagen dan peralatan
Kontrol kualitas (quality control) adalah pemeriksaan yang dilakukan untuk menentukan akurasi dan presisi (ketepatan dan ketelitian) peralatan dan reagen yang digunakan serta prosedur yang dilakukan. Quality control dilakukan sebelum melakukan pemeriksaan sampel pasien dan donor (Blaney and Howard, 2013).
Kontrol kualitas terhadap peralatan meliputi kalibrasi alat seperti sentrifus, mikropipet, refrigerator dan alat-alat penunjang lainnya. Kalibrasi sebaiknya dilakukan secara rutin minimal setahun sekali dan kalibrasi dapat dipercepat apabila frekuensi penggunaan alat semakin sering. Quality control juga dilakukan dengan melakukan monitoring suhu dan kelembaban ruangan, penyimpanan reagen dan sampel serta pengawasan terhadap jalannya pelaksanaan pemeriksaan sesuai dengan dengan standar yang tercantum dalam SPO (Standard Operating Procedures).
Khusus untuk reagen, indikator dalam program quality control terdiri atas:
a. Kriteria penerimaan reagen
Kriteria penerimaan reagen wajib dituangkan dalam SPO.
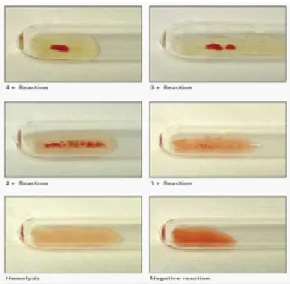
Secara umum, indikator untuk menentukan kualitas reagen adalah kemampuannya untuk menimbulkan reaksi aglutinasi terhadap antigen eritrosit. Seperti saat pengujian reagen anti-A, aglutinasi positif terjadi jika reagen ditambahkan eritrosit golongan A (terjadi aglutinasi 3+ atau 4+) dan aglutinasi negatif bila direaksikan dengan eritrosit golongan B.
Reagen tersebut dianggap layak untuk digunakan. Bila derajat aglutinasi kurang dari 3+ (misal 2+ atau lebih rendah) maka kemampuan reagen anti-A dianggap tidak baik atau tidak layak digunakan. Hilangnya kemampuan menimbulkan aglutinasi kuat (3+ atau 4+) selama jangka waktu tertentu juga dapat dipakai sebagai indikator bahwa reagen tersebut tidak layak digunakan (Blaney and Howard, 2013).
Selain pengujian tersebut, reagen juga wajib dilihat secara visual. Adanya perubahan warna atau kekeruhan pada reagen dapat mengindikasikan terjadinya kontaminasi bakteri. Khusus untuk reagen suspensi sel darah merah, inspeksi ada tidaknya hemolisis juga wajib dilihat. Suspensi sel yang sudah mengalami hemolisis tidak dapat digunakan untuk pemeriksaan (Blaney and Howard, 2013).
b. Dokumentasi penggunaan reagen
Reagen yang sudah dievaluasi dan hasil dari kontrol kualitas yang telah dilakukan harus dicatat dan didokumentasikan. Pencatatan tersebut meliputi hasil quality control, interpretasi, tanggal pemeriksaan, dan identitas petugas yang melakukan pemeriksaan (Blaney and Howard, 2013).
c. Prosedur yang dilakukan bila terjadi permasalahan pada reagen
Semua prosedur yang harus dilakukan bila perjadi permasalahan pada reagen seharusnya dituangkan dalam SPO (Blaney and Howard, 2013).
2.4 Pemisahan Serum atau Plasma, Pencucian Sel Darah Merah dan Pembuatan Suspensi Sel Darah
1. Pemisahan serum atau plasma
Pemisahan serum atau plasma dari sel darah merah bertujuan untuk mendapatkan serum atau plasma yang bebas dari sel darah
merah. Beberapa peralatan yang dibutuhkan untuk prosedur tersebut di antaranya: sentrifus, pipet pasteur, dan tabung reaksi ukuran 12 x 75 mm beserta raknya. Darah yang akan dipisahkan dapat berupa darah beku atau darah dengan antikoagulan (whole blood).
Ada pun prosedur pemisahan serum atau plasma adalah sebagai berikut:
a. Masukan darah ke dalam tabung yang telah diberi label sesuai dengan sampel,
b. putar/sentrifugasi 3000 selama 1 menit,
c. pisahkan serum/plasma yang jernih dari sel darah merah dengan pipet pasteur ke dalam tabung lain yg sudah diberi label sesuai dengan sampel.
Hasil pemisahan adalah serum atau plasma dan sel darah merah pekat (Mehdi, 2013).
2. Pencucian sel darah merah
Pencucian sel darah merah bertujuan untuk mendapatkan sel darah merah yang bebas dari protein atau globulin yang dapat mengganggu sejumlah pemeriksaan serologi. Ada pun prosedur pencucian sel adalah 0,5 mL sel darah merah pekat dimasukkan ke dalam tabung kemudian tambahkan larutan salin atau Natrium Clorida 0,9% (NaCl 0,9%) sampai mengisis 3/4 bagian tabung. Lakukan sentrifugasi dengan kecepatan 3000 rpm selama 1 menit dan buang seluruh supernatant. Lakukan pencucian sebanyak 3 kali atau sesuai kebutuhan dan buang seluruh supernatan pada akhir pencucian, sehingga hasil akhirnya adalah sel darah merah yang sudah dicuci (Mehdi, 2013).
3. Pembuatan suspensi sel
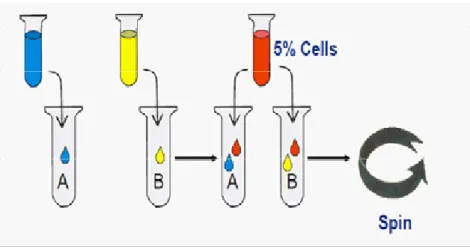
Pada beberapa jenis uji pratransfusi membutuhkan suspensi sel darah merah. Pembuatan suspensi sel bertujuan untuk mengoptimalkan reaksi antigen-antibodi sehingga reaksi yang muncul dapat diamati dengan jelas. Beberapa kepustakaan menyebutkan bahwa suspensi sel 3% banyak dipakai untuk pemeriksaan serologi. Namun, berdasarkan Word Health Organization, suspensi sel 5% umum dipakai untuk prosedur serologi (WHO, 2013).
Berikut adalah contoh prosedur pembuatan suspensi sel 5%.
Label 3 buah tabung masing-masing dengan label A, B, O Teteskan 1 tetes sel darah merah pada tabung pertama yang sudah dilabel A
Teteskan 1 tetes sel darah merah pada tabung kedua yang sudah dilabel B Teteskan 1 tetes sel darah merah pada tabung ketiga yang sudah dilabel O Tambahkan ke masing-masing tabung larutan NaCl 0,9% sampai terisi ¾ tabung
Sentrifugasi ketiga tabung dengan kecepatan 3000 rpm selama 1 menit (lakukan pencucian sebanyak 3 kali)
Buang seluruh supernatant yang ada pada permukaan tabung Untuk membuat suspensi sel 5% tambahkan NaCl 0,9% sebanyak 19 tetes
Gambar 2.4 Contoh prosedur pembuatan suspensi sel 5% (WHO, 2013).
Untuk hasil pemeriksaan terbaik gunakan suspensi sel darah merah pada hari pembuatan setelah dilakukan uji validasi dengan menambahkan antisera A dan B dan hasil pemeriksaan menunjukkan derajat aglutinasi kuat (3+ atau 4+). Jadi teknisi laboratorium seharusnya menyiapkan suspensi sel darah merah golongan A, B dan O setiap pagi untuk penggunaan rutin. Suspensi sel masih dapat digunakan pada hari berikutnya bila hasil uji validasi masih baik (WHO, 2013).
Tabel 2.2 Perbandingan jumlah sel darah merah dan NaCl pada prosedur pembuatan suspensi sel.
Suspensi Prosentase
Perbandingan
Keterangan Diperkecil (eritrosit:salin) Sel Darah Merah NaCl
Pekat 100% 0,9%
3% 3:100 3 tetes 97 tetes 1:32,3
5% 5:100 5 tetes 95 tetes 1:19
10% 10:100 10 tetes 90 tetes 1:9
40% 40:100 40 tetes 60 tetes 2:3
50% 50:100 50 tetes 50 tetes 1:1
2.5 Uji Pratransfusi Pada Kondisi Emergency
Pada kondisi emergency dan waktu untuk melakukan uji pratransfusi sangat terbatas, maka darah dapat dikeluarkan setelah dilakukan pemeriksaan golongan darah ABO dan Rhesus baik pada donor maupun pada pasien dan diikuti dengan immediate-spin crossmatch. Namun, sebisa mungkin dianjurkan untuk tetap dapat melakukan crossmatch secara komplit sebelum darah didistribusikan.
Pada situasi yang ekstrim (hanya tersedia waktu 10-15 menit), jika tidak mungkin dilakukan pemeriksaan crossmatch maka komunikasi dengan dokter yang meminta tentang prosedur penyiapan darah tanpa melalui pemeriksaan rutin wajib dilakukan (Makroo, 2009; WHO, 2009).
Langkah-langkah berikut dapat digunakan sebagai panduan untuk menangani kebutuhan darah dalam situasi emergency.
1. Lakukan pemeriksaan golongan darah ABO dan Rhesus pada sampel darah pasien dengan menggunakan motode cepat (rapid test) kemudian pilihlah produk darah donor yang sesuai dengan golongan ABO dan Rhesus pasien.
2. Lakukan pelabelan produk darah secara benar dan detail dan cantumkan label “UNCROSS-MATCHED BLOOD” dengan jelas. Contoh label dapat seperti gambar berikut.
Gambar 2.5 Contoh label penggunaan produk darah yang belum dilakukan pemeriksaan crossmatch dalam situasi emergency (WHO, 2009).
PERINGATAN: “UNCROSS-MATCHED BLOOD”
No kantong darah :
Nama Pasien :
Tanggal lahir :
No Rekam Medik : Nama Ruangan : Golongan Darah :
Tanggal: Tanda tangan
SEGERA KEMBALIKAN KE BANK DARAH BILA TIDAK DIGUNAKAN
PERINGATAN: “UNCROSS-MATCHED BLOOD”
No kantong darah :
Nama Pasien :
Tanggal lahir : No Rekam Medik :
Nama Ruangan :
Golongan Darah :
Tanggal: Tanda tangan
SEGERA KEMBALIKAN KE BANK DARAH BILA TIDAK DIGUNAKAN
3. Ambil sampel darah dari selang produk darah donor untuk dilakukan uji pratransfusi pada kesempatan selanjutnya.
4. Distribusikan produk darah sesuai dengan standar distribusi yang sudah ditetapkan.
5. Jika produk darah tidak segera ditransfusikan dalam waktu 30 menit, biasanya cukup untuk melakukan pemeriksaan crossmatch menggunakan a low-ionic strength indirect antiglobulin test (WHO,2009; Zundel, 2012; Mehdi, 2013).
Dokter yang meminta darah wajib menandatangani formulir permintaan darah dan label uncrossmatched blood sebagai petanda bahwa dokter setuju untuk segera memberikan respon atau penanganan bila terjadi efek yang tidak diinginkan dari pemberian uncrossmatched blood. Dalam situasi tertentu jika sampel darah pasien tidak bisa didapatkan dan waktu untuk pemeriksaan golongan darah cepat tidak bisa dilakukan, maka golongan darah O Rhesus negatif dalam bentuk Packed Red Cells (PRC) dapat dijadikan pilihan (Makroo, 2009; WHO, 2009).
Apabila PRC golongan darah O Rhesus negatif sulit didapatkan, maka untuk pasien laki-laki dan wanita bukan anak-anak dan usia reproduktif pemberian PRC golongan O Rhesus positif dapat dipertimbangkan (Judd, 2009; Zundel, 2012).
Beberapa hal penting lainnya yang perlu diperhatikan terkait kebutuhan darah dalam keadaan emergency, antara lain:
1. Selalu pastikan bahwa dokter atau staf senior mengetahui setiap keadaan emergency yang terjadi,
2. bila produk darah dikirim dari Unit Transfusi Darah (UTD) atau rumah sakit lain, pastikan bahwa semua petugas yang terlibat mengetahui adanya keadaan emergency,
3. jika pengumpulan darah dilakukan dari donor yang dibawa sendiri, lakukan persiapan dengan baik dan hubungi lebih banyak donor, 4. selalu menjaga komunikasi dengan dokter atau staf yang terlibat
dalam penanganan pasien dan selalu waspada terhadap setiap efek samping yang potensial terjadi,
5. pastikan bahwa seluruh data telah lengkap dan akurat untuk selanjutnya seluruh data tersebut disimpan dengan baik. Semua
keputusan yang dibuat dan prosedur yang dilakukan oleh dokter harus dicatat dengan jelas, termasuk nama dan tanda tangan staf yang terlibat (WHO, 2009).
2.6 Beberapa Kasus Terkait Tahapan Uji Pratransfusi Kasus 1.
Pasien laki-laki , 54 tahun, datang ke Unit Gawat Darurat (UGD) pada malam hari dan merupakan kiriman dari Rumah Sakit Umum Daerah (RSUD) Kabupaten dengan diagnosis peritonitis, suspek gastic ulcer.
Rencana akan dilakukan tindakan laparotomi. Dari hasil pemeriksaan darah lengkap didapatkan kadar hemoglobin 6,41 g/dl, sehingga pasien direncanakan untuk transfusi 4 kantong Packed Red Cell (PRC) selama operasi. Sampel darah dan formulir permintaan darah dikirim ke bank darah.
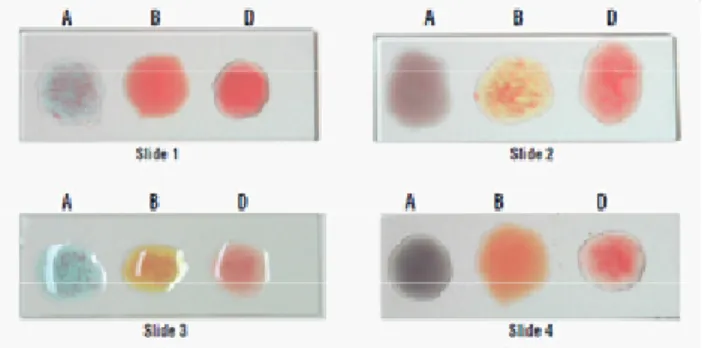
Setelah dilakukan pencocokan identitas sampel dan formulir permintaan, langkah selanjutnya dilakukan pemeriksaan golongan darah awal dengan metode slide test dan didapatkan hasil B Rhesus positif.
Tidak ada catatan riwayat transfusi sebelumnya. Disiapkan komponen darah donor PRC golongan B Rhesus positif. Pemeriksaan golongan darah baik pasien maupun donor dilanjutkan dengan metode tube test dan didapatkan golongan darah sama yaitu B Rhesus positif. Hasil pemeriksaan crossmatch dengan 2 donor adalah kompatibel.
Gambar 2.6 Hasil pemeriksaan crossmatch dengan metode gel menunjukan hasil kompatibel.
Mayor, donor 1 minor,
donor 1 Mayor, donor 2 minor,
donor 2 Auto
control Auto pool
INR, cm 1500121, 4/9/2016
PRC dikeluarkan dari bank darah dan selanjutnya transfusi diberikan sebanyak 2 kantong selama operasi. Tanda-tanda reaksi transfusi agak sulit dilacak karena pasien sedang dalam pengaruh obat anestesi. Secara klinis dijumpai adanya perdarahan dan hematuria. Pasien direncanakan untuk diberikan transfusi berikutnya dengan komponen PRC dan Fresh Frozen Plasma (FFP). Dikirim permintaan darah yang kedua dengan sampel baru.
Hasil pemeriksaan golongan darah pada sampel kedua didapatkan golongan O Rhesus positif dan crossmatch dengan donor golongan O menunjukkan hasil kompatibel, tetapi pada permukaan gel terlihat kemerahan. Berbeda dengan hasil crossmatch pada gambar 2.6 Hal tersebut kemungkinan disebabkan oleh adanya proses hemolitik setelah proses transfusi sebelumnya.
Gambar 2.7 Hasil pemeriksaan crossmatch dengan metode gel menunjukan hasil kompatibel dengan warna kemerahan pada permukaan gel.
Karena dijumpai adanya perbedaan golongan darah antara sampel pertama dan kedua, maka petugas bank darah meminta sampel ulang.
Hasil pemeriksaan pada sampel ketiga didapatkan golongan O Rhesus positif. Transfusi ditunda dan pasien ditangani sebagai kasus reaksi transfusi berat, tetapi penanganan tersebut tidak berhasil menyelamatkan pasien dan pasien meninggal.
Setelah ditelusuri kembali waktu pengiriman sampel yang pertama ke bank darah, dijumpai ada 2 permintaan darah dari UGD yang dikirim
Mayor, donor 1
Mayor, donor 2
minor, donor 1
minor, donor 2
Auto kontrol
Auto pool
secara bersamaan. Satu pasien didapatkan golongan O Rhesus positif, satu pasien dengan golongan B Rhesus positif. Pasien dengan golongan O Rhesus positif dilakukan pengambilan sampel ulang dan didapatkan hasil pemeriksaan golongan darah B Rhesus positif. Berdasarkan informasi dari petugas yang mengambil sampel darah pertama, memang dalam waktu yang bersamaan ada 2 pasien yang membutuhkan darah dan sampel diambil pada jam yang hampir sama. Pasien yang akan dioperasi dengan permintaan cito dan pasien yang lagi satu rencana transfusi besok pagi.
Dari kasus tersebut telah terjadi reaksi transfusi yang fatal yang kemungkinan besar disebabkan oleh kesalahan identifikasi dan pelabelan sampel darah pasien.
Kasus 2.
Pasien wanita, 48 tahun dirawat dengan diagnosis anemia (hemoglobin 5 g/dL). Pasien ini direncanakan akan mendapat transfusi PRC sebanyak 3 kantong. Permintaan darah dikirim dari UGD. Hasil pemeriksaan golongan darah didapatkan bahwa golongan darah pasien A Rhesus positif. Crossmatching dilakukan terhadap 3 darah donor dan menunjukkan hasil kompatibel. PRC kemudian ditransfusikan sebanyak 3 kantong dan tidak ada laporan reaksi transfusi.
Satu minggu kemudian pasien di rawat di ruang rawat biasa dan oleh petugas ruangan dikirimkan lagi permintaan darah kedua, yaitu PRC sebanyak 2 kantong. Hasil pemeriksaan golongan darah pada sampel kedua adalah AB Rhesus positif. Crossmatch dengan donor golongan darah AB kompatibel, tetapi darah belum dikeluarkan. Dalam waktu yang berdekatan, keluarga pasien datang membawa donor dan menunjukkan catatan bahwa pasien membutuhkan darah golongan A.
Hal ini menunjukkan bahwa golongan darah pasien tersebut sebelumnya adalah A Rhesus positif. Oleh petugas bank darah, kemudian dilakukan pengambilan sampel ulang dan didapatkan golongan darah A Rhesus positif.
Penelusuran selanjutnya ditemukan bahwa dalam waktu yang bersamaan ada 2 permintaan darah dari ruang rawat tersebut. Permintaan
tersebut adalah satu pasien dengan golongan AB dan satu pasien lagi dengan permintaan golongan darah A. Pasien yang sebelumnya didapatkan A juga dilakukan pengambilan sampel ulang dan golongan darah pada sampel kedua adalah AB.
Dari kasus tersebut hampir terjadi reaksi transfusi berat yang juga disebabkan oleh kesalahan identifikasi dan pelabelan sampel darah pasien. Ketepatan identifikasi dan pelabelan sampel darah merupakan poin yang sangat kritis dalam menentukan keamanan transfusi.
Selain hal tersebut, catatan tentang riwayat transfusi dan hasil-hasil pemeriksaan lab. sebelumnya juga menjadi penentu keselamatan pasien (McCullough, 2012).
DAFTAR PUSTAKA
Blaney, K.D., Howard, P.R. 2013. Compatibility Testing. Basic&Applied Concepts of Blood Banking and Transfusion Practices. Third Edition. United States: Elsevier Mosby. p. 188-201.
Makroo, R.N. 2009. Compatibility Testing (Pre Transfusion Testing).
Practice of Safe Blood Transfusion Compendium of Transfusion Medicine. New Delhi: Kongposh. p. 123-133.
Judd, W.J. 2009. Red Cell Immunology and Compatibility Testing.
Rossi’s Principles of Transfusion Medicine Fourth Edition. UK:
Wiley-Blackwell. p. 69-87.
McCullough, J. 2012.Techniques of Blood Transfusion. Transfusion Medicine Third Edition. UK: Wiley-Blackwell. p. 362- 375.
Mehdi, S.R. 2013. ABO Blood Group System. Essentials of Blood Banking A Handbook for Students of Blood Banking and Clinical Residents. Second Edition. New Delhi: Jaypee Brothers Medical Publishers. p. 7-17.
Mehdi, S.R. 2013. Cross-matching (compatibility testing). Essentials of Blood Banking A Handbook for Students of Blood Banking and Clinical Residents. Second Edition. New Delhi: Jaypee Brothers Medical Publishers. p. 46-49.
Saluju, G.P., Singal, G. L. 2014. Collection of Blood Sample for Grouping/Cross-matching. Standard Operating Procedures and Regulatory Guidelines Blood Banking. New Delhi: Jaypee Brothers Medical Publishers. p. 46-54.
Stoe, M. 2011. Pretransfusion Testing. Immunohematology Principles and Practice Third Edition. Philadelphia: Lippincott Williams &
Wilkins. p. 107- 117.
Zundel, W.B. 2012. Pretransfusion Testing. Blood Groups and Serologic Testing. In: Harmening, D.M. Modern Blood Banking
& Transfusion Practices 6th Edition. Philadelphia: F.A Davis company. p. 241-259.
WHO, 2002. Clinical Transfusion Procedures. The Clinical Use of Blood Handbook. Genewa: WHO. p. 37- 58.
WHO, 2009. Compatibility Testing and Issuing Blood. Safe Blood and Blood Product. Genewa: WHO. p. 41-73.
WHO, 2013. Standar Operating Prosedure for Blood Transfusion.
Genewa:WHO. p. 18-20.
BAB III
PEMERIKSAAN GOLONGAN DARAH ABO
3.1 Definisi
Yang dimaksud dengan pemeriksaan golongan darah adalah suatu prosedur laboratorium yang dilakukan untuk menentukan jenis golongan darah. Pada uji pratransfusi, pemeriksaan golongan darah minimal yang harus dikerjakan adalah golongan darah sistem ABO dan Rhesus (D typing). Pemeriksaan golongan darah dilakukan baik pada donor maupun pada pasien (WHO, 2002).
Meskipun telah dilakukan uji konfirmasi golongan darah donor dan darah sudah dilabel ABO dan Rhesus dengan benar, pemeriksaan golongan darah ulang tetap harus dilakukan pada semua unit darah sebelum ditransfusikan.
3.2 Sistem Antigen dan Antibodi pada Golongan Darah
Sebelum membahas tentang teknis pemeriksaan golongan darah, sangat penting untuk memahami sistem antigen dan antibodi pada golongan darah. Pemahaman tersebut merupakan dasar untuk melakukan prosedur test dan menginterpretasikan hasil pemeriksaan.
Antigen adalah setiap zat yang dianggap sebagai benda asing yang masuk ke dalam tubuh dan merangsang sistem kekebalan tubuh untuk merespon masuknya antigen tersebut. Antibodi adalah produk dari respon imun dan akan bereaksi dengan antigen dengan beberapa cara yang dapat diamati. Nama lain dari antibodi adalah imunoglobulin (Ig) dan merupakan bagian dari protein plasma. Ada 5 jenis immunoglobulin, yaitu IgG, IgM, IgA, IgD, IgE, tetapi yang banyak berperanan dalam sistem golongan darah adalah immunoglobulin G dan M (WHO, 2009).
IgG hanya memiliki 4 rantai yang terdiri atas 2 rantai kecil yang disebut dengan rantai ringan (light chains) dan 2 rantai besar yang disebut dengan rantai berat (heavy chains). Dibandingkan dengan IgM, struktur
IgG jauh lebih kecil. IgM memiliki 10 rantai ringan dan 10 rantai berat sehingga berat molekulnya jauh lebih besar dibandingkan IgG (WHO, 2009). Perbedaan antara kedua molekul antibodi tersebut tampak pada gambar berikut.
Gambar 3.1 Struktur molekul IgG dan IgM (WHO, 2009).
Imunoglobulin G
Merupakan jenis immunoglobulin terbanyak, membentuk sekitar 73% dari total immunoglobulin dalam tubuh. IgG memiliki berat molekul hanya sekitar 150.000 kilo Dalton (kD), dapat menembus plasenta dan sering dikaitkan dengan kejadian Hemolytic Disease of the New born (HDN). HDN dapat terjadi bila ibu memiliki antibodi yang dapat melewati plasenta dan antibodi tersebut mengaglutinasi sel darah merah janin yang mengandung antigen yang sesuai. IgG tidak menyebabkan aglutinasi sel darah merah yang tersuspensi pada medium salin (WHO, 2009).
Imunoglobulin M
IgM membentuk sekitar 8% dari total immunoglobulin dalam tubuh. Berat molekul sekitar 900.000 kD. IgM tidak mampu melewati plasenta sehingga tidak menimbulkan penyakit hemolitik pada bayi baru lahir. Memiliki sifat mudah mengaglutinasi sel darah merah yang tersuspensi dalam medium salin. IgM dapat mengaktifkan komplemen selama terjadi reaksi antigen-antibodi sehingga menyebabkan hemolisis sel darah merah (WHO, 2009).
Tabel 3.1 Perbedaan antara IgG dan IgM (WHO, 2009).
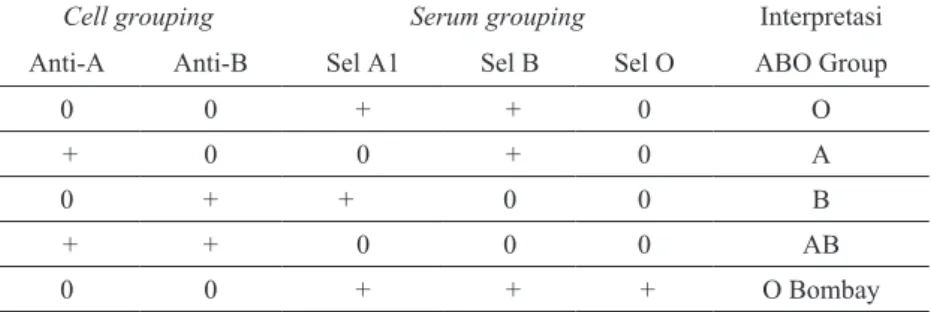
Berdasarkan sistem ABO, ada 4 jenis golongan darah sesuai dengan jenis antigen dan antibodi yang dimiliki masing-masing golongan. Individu dengan golongan darah A memiliki antigen A pada sel darah merahnya dan antibodi B dalam plasmanya. Individu dengan golongan darah B memiliki antigen B dan antibodi A, sedangkan individu golongan darah AB mempunyai antigen A maupun antigen B dan tidak memiliki antibodi A maupun B dalam plasmanya. Individu dengan golongan darah O tidak memiliki antigen A maupun B tetapi mempunyai antibodi A dan B dalam plasmanya (McClelland, 2007).
3.3 Jenis Pemeriksaan Golongan Darah
Berdasarkan jenis peralatan penunjang yang digunakan, pemeriksaan golongan darah secara manual dapat dikerjakan dengan tiga metode, yaitu
1. Slide test atau glass slide atau white porcelain tile 2. Tube test
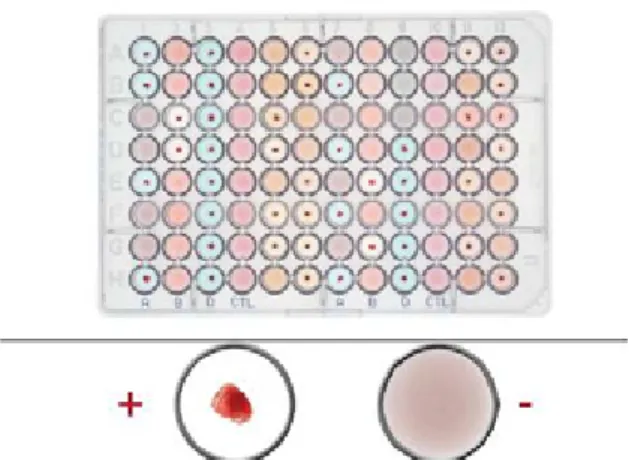
3. Microwell plate atau microplate test.
Beberapa teknik lain yang sudah dikembangkan saat ini dan dapat dikerjakan secara otomatis, antara lain:
1. Column technique (sephadex gel) 2. Solid phase tests (NIB, 2013).
Gambar 2.5 Contoh label penggunaan produk darah yang belum dilakukan pemeriksaan crossmatch dalam situasi emergency (WHO, 2009).
Tabel 3.1 Perbedaan antara IgG dan IgM (WHO, 2009).
IgG IgM
Jumlah dalam tubuh 73% 8%
Berat molekul 150.000 kD 900.000 kD
Mengaglutinasi eritrosit dalam salin Tidak Ya
Mampu melewati plasenta Ya Tidak
Mengaktivasi komplemen Ya Ya
Reaksi optimal pada suhu 37 oC 4 oC
Jenis antibodi Imun Alamiah
PERINGATAN: “UNCROSS-MATCHED BLOOD”
No kantong darah :
Nama Pasien :
Tanggal lahir :
No Rekam Medik : Nama Ruangan : Golongan Darah :
Tanggal: Tanda tangan
SEGERA KEMBALIKAN KE BANK DARAH BILA TIDAK DIGUNAKAN
Berikut akan dibahas satu per satu mengenai teknik pemeriksaan golongan darah.
3.4 Pemeriksaan Golongan Darah dengan Slide Test atau Tile Method
1. Prinsip pemeriksaan
Prinsip pemeriksaan adalah apabila sel darah merah mengandung antigen yang sesuai dengan jenis antibodi yang ditambahkan pada reagen, maka akan terjadi aglutinasi atau hemolisis. Aglutinasi adalah penggumpalan sel darah merah yang disebabkan oleh ikatan antibodi dengan antigen pada sel darah merah sehingga menghasilkan ikatan yang menggandeng beberapa sel secara bersama-sama. Ada 2 tahapan untuk pembentukan aglutinasi, yaitu:
Tahap 1: Antibodi mengikat antigen sel darah merah segera setelah terjadi kontak antigen antibodi, ikatan tersebut belum menimbulkan aglutinasi. Hanya sebatas melapisi atau mensensitisasi sel.
Tahap 2: Pembentukan lattice yang menghasilkan gumpalan atau aglutinasi, merupakan kelanjutan dari tahap 1(WHO, 2009).
Hemolisis sel darah merah dapat disebabkan oleh antibodi jenis IgM dan hanya sedikit yang disebabkan oleh IgG. Setelah antigen berikatan dengan antibodi, jalur komplemen akan diaktivasi sehingga menyebabkan sel darah merah ruptur atau lisis. Lisis juga mengindikasikan adanya reaksi antara antigen dan antibodi seperti pada aglutinasi (WHO, 2009).
2. Jenis sampel
Jenis sampel yang dipakai disesuaikan dengan rekomendasi sampel yang tercantum pada insert kit reagen yang digunakan. Ada reagen yang merekomendasikan sampel whole blood atau suspensi sel (Cooling, 2014).
3. Reagen
Reagen yang digunakan mengandung anti-A, anti-B dan anti-AB yang bersifat opsional (Cooling, 2014).