Bahan Seminar Hasil
Bidang Studi Kimia Bahan Alam
ISOLASI SENYAWA FLAVONOIDA DARI KULIT
BUAH TUMBUHAN JENGKOL
(Pithecollobium lobatum Benth.)
OLEH :
JOKO ELIAS HUTAURUK
060802026
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI KULIT
BUAH TUMBUHAN JENGKOL
(Pithecollobium lobatum Benth.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
JOKO ELIAS HUTAURUK
060802026
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
JuduL
: ISOLASI SENYAWA FLAVONOIDA
DARI KULIT BUAH TUMBUHAN
JENGKOL
(Pithecollobium lobatum Benth.)Kategori
: SKRIPSI
Nama
: JOKO ELIAS HUTAURUK
Nomor Induk Mahasiswa : 060802026
Program Studi
: SARJANA (S1) KIMIA
Departemen
: KIMIA
Fakultas
: MATEMATIKA DAN ILMU
PENGETAHUAN ALAM (FMIPA)
UNIVERSITAS SUMATERAUTARA
Diluluskan di
Medan, Mei 2010
Komisi pembimbing
:
Pembimbing 2
Pembimbing 1
Drs. Phillipus Siregar, M.Si.
Lamek Marpaung,M.Phil, Ph.D.
NIP 131 572 345
NIP 131 126 697
Diketahui/Disetujui oleh
Departemen Matematika FMIPA USU
Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI KULIT
BUAH TUMBUHAN JENGKOL
(Pithecollobium lobatum Benth.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya
Medan, Mei 2010
PENGHARGAAN
Segala puji syukur penulis ucapkan kepada Tuhan yang Maha Esa atas kasih dan anugerah-Nya, penulis bisa menyelesaikan skripsi ini dalam waktu yang telah ditetapkan.
Selanjutnya penulis menyampaikan penghargaan dan cinta kasih yang tulus kepada Ibunda tersayang yang lebih dahulu dipanggil Tuhan untuk selama-lamnaya, dan juga kepada Bapakku yang sangat kukasihi yang sampai saat ini selalu memberikan suggesti dan motivasi yang membuat saya tetap kuat menjalani perkuliahaan. Begitu banyak pengorbanan yang kedua orangtua saya berikan kepada saya secara pribadi, buat ibuku tercinta engkau akan tetap selamanya dihatiku. Hal yang sama juga saya ucapkan kepada abangku tercinta Harapan Hutauruk, Hermanto Hutauruk, Saut Hutauruk, Julianto Hutauruk, dan kepada kakak-kakakku tercinta Herlina Hutauruk, Mesta Hutauruk, Herawati Hutauruk, Rossa Hutauruk yang memberikan dukungan kepada penulis. Juga ucapan terimakasih saya ucapkan kepada Abang Ipar yang saya sayangi M. Tampubolon, J. Hutahaean, S. Silaban, S. Aritonang. Dan tak lupa juga saya ucapkan terimakasih banyak kepada Kakak Ipar yang saya cintai S br Hutabarat, H br Simare-mare. Kepada keponakan saya yang selalu memberikan inspirasi dan motivasi dalam hidup saya Theresia Hutauruk, Debby Tampubolon, Della Tampubolon, Mikael Hutahaean, Steven Joshua Hutauruk, Josh Fabio Hutauruk, Christian Rafael Hutauruk semoga Tuhan Kita Yesus Sang Juru Slamat yang hidup akan senantiasa memberkati kita semua.
Dengan segala kerendahan hati, penulis mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Bapak Lamek Marpaung, M.Phil, Ph.D. selaku dosen pembimbing I dan
Bapak Drs. Phillipus Siregar, M.Si. selaku dosen pembimbing II yang telah banyak memberikan pengarahan dan bimbingan hingga terselesaikannya skripsi ini.
2. Ibu Dr. Rumondang Bulan Nst, MS dan Bapak Drs. Firman Sebayang, MS.
Selaku Ketua dan Sekretaris Jurusan Departemen Kimia FMIPA USU.
3. Ibu Dra. Sudestry Manik, M.Si. selaku dosen wali penulis yang telah banyak
memberikan masukan selama penulis menjalani perkuliahan.
4. Bapak dan Ibu Dosen yang telah memberikan waktu dan motivasi selama masa
studi penulis di FMIPA USU.
5. Kepala, Staf dan seluruh asisten Laboratorium Kimia Bahan Alam
(K’Whendy, K’Eva, K’Evi, K’Beldina, B’Albinur, Saulina, Rony, Ika, Nicholas, Burton, Tria dan Lisbet) yang telah memberikan segala fasilitas terbaik selama penulis melakukan penelitian.
6. Teman-teman tercinta kimia’06 dan adik stambuk yang telah memeberikan
7. Teman dekat saya Junita Manalu yang penulis sayangi senantiasa memberikan semangat positif dalam penyelesaian tugas akhir ini.
8. Kepada Bapak Rusmana dan Achmad Darmawan selaku staf administrasi dan
analis di Pusat Penelitian Kimia LIPI Serpong-Tangerang, penulis mengucapkan terimakasih banyak kepada Bapak yang membantu penulis dalam menganalisis sampel
9. B’Maniur S.Si yang merupakan teman sekaligus abang yang banyak mengajari
penulis saat penelitian.
10.Kak Dewi yang membantu penulis dalam mencari referensi buat tugas akhir
ini.
11.Seluruh pegawai di lingkungan FMIPA USU terutama di Departemen Kimia
yang telah membantu penulis dalam meyelesaikan segala urusan administrasi perkuliahan sampai penyelesaian tugas akhir.
12.Kak Dewi yang membantu penulis dalam mencari referensi buat tugas akhir
ini.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan, karena keterbatasan penulis baik dalam literatur maupun pengetahuan. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini dan semoga skripsi ini bermanfaat bagi yang membaca.
Medan, Mei 2010 Penulis
ISOLASI SENYAWA FLAVONOIDA DARI KULIT
BUAH TUMBUHAN JENGKOL
(Pithecollobium lobatum Benth.)
ABSTRAK
Isolasi senyawa flavonoid yang terkandung di dalam Kulit Buah Tumbuhan Jengkol-
(Pithecollobium lobatum Benth.) telah dilakukan dengan cara ekstraksi maserasi
dengan menggunakan pelarut metanol. Ekstrak metanol yang diperoleh dipekatkan dan diekstraksi partisi dengan n-heksan. Fraksi metanol yang diperoleh dilarutkan dengan aseton secara berulang-ulang. Larutan aseton dipekatkan dan dikromatografi
kolom menggunakan fasa gerak CHCl3 : MeOH (80 : 20)v/v dan fasa diam Silika gel
40 (70-230 mesh ASTM). Senyawa yang telah dimurnikan diperoleh dalam bentuk gum berwarna cokelat 185 mg. Senyawa ini diidentifikasi dengan menggunakan spektroskopi Ultraungu-Tampak (UV-Vis). Spektroskopi Infra Merah (FT-IR) dan
Spektrofotometer Resonansi Magnetik Inti Proton(1H-NMR). Dari data hasil spektrum
ISOLATION OF FLAVONOID COMPOUND FROM
THE SKIN OF FRUIT JENGKOL CROP
(Pithecollobium lobatum Benth.)
ABSTRACT
Flavonoid compound was isolated from the skin of fruit Jengkol crop (Pithecollobium
lobatum Benth.) by using maceration technique with solvent of methanol. Methanol
extract that gained from the maceration was concentrated and partition extracted with n-hexane. Methanol fraction was dissolved with acetone repeteadly. Acetone solution was concentrated and put into column chromatography, elucidated with mobile phase
CHCl3 : MeOH (80 : 20)v/v and stationary phase is Silica gel 40 (70-230 mesh)
ASTM. The Compound was purified like gum form and gained about 185 mg . The Compound was analised by using Spectroscopy Ultraviolet-Visible (UV-Vis), Infra
Red (FT-IR), and Nuclear Magnetic Resonance Proton (1H-NMR). Data from the
DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak iv
Abstract v
Daftar Isi vi
Daftar Lampiran vii
Bab 1. Pendahuluan 1.1. Latar Belakang 1
1.2. Permasalahan 2 1.3. Tujuan Penelitian 2 1.4. Manfaat Penelitian 2 1.5. Lokasi Penelitian 3 1.6. Metodologi Penelitian 3 Bab 2. Tinjauan Pustaka 2.1. Tumbuhan Jengkol 4 2.1.1. Morfologi Tumbuhan Jengko 4
2.1.2. Klasifikasi Ilmiah Jengkol 4 2.1.3. Manfaat Kulit Buah Tumbuhan Jengkol 5 2.2. Senyawa Flavonoida 2.2.1. Pendahuluan 5 2.2.2. Struktur Dasar Senyawa Flavonoida 7
2.2.3. Klasifikasi Senyawa Flavonoida 8 2.2.4. Metoda Isolasi Senyawa Flavonoida 16
2.2.5. Sifat Kelarutan Flavonoida 16 2.3. Teknik Pemisahan 17 2.4. Kromatografi 17 2.4.1. Kromatografi Lapis Tipis 18 2.4.1.1. Pembuatan Lapis Tipis 18 2.4.2. Kromatografi Kolom 20
2.4.2.1. Pengisian Kolom 21
2.4.2.2. Memilih Kemasan Kolom 21
2.4.3. Kromatografi Preparatif 22
2.4.4. Harga Rf (Retension factor) 23
2.4.5. Ekstraksi 24
2.5.1. Spektroskopi UV-Visible 25
2.5.2. Spektroskopi Infra Merah (FT-IR) 29
2.5.3. Spektroskopi 1H-NMR 30
Bab 3. Metoda Penelitian
3.1. Alat-alat 32
3.2. Bahan Penelitian 33
3.3. Prosedur Penelitian 33
3.3.1. Penyediaan Sampel 33
3.3.2. Uji Pendahuluan terhadap Ekstrak Kulit Buah Jengkol 33
3.3.2.1. Uji Busa 34
3.3.2.2. Skrining Fitokimia 34
3.3.3. Prosedur untuk memperoleh Senyawa Kimia dari Ekstrak
Kulit Buah Jengkol 35
3.3.4. Isolasi Senyawa Flavonoida dengan Kromatografi Kolom 35
3.3.5. Pemurnian 36
3.3.6. Uji Kemurnian Hasil Kromatografi dengan KLT 37
3.3.7. Analisis Spektroskopi Senyawa Hasil Isolasi 37
3.3.7.1. Analisis Senyawa Hasil Isolasi dengan
Spektroskopi UV-Visible 37
3.3.7.2. Analisis Senyawa Hasil Isolasi dengan
Spektroskopi FT-IR 37
3.3.7.3. Analisis Senyawa Hasil Isolasi dengan
Spektroskopi 1H-NMR 37
3.4. Bagan Skrining Fitokimia 38
3.5. Bagan Penelitian 39
Bab 4. Hasil dan Pembahasan
4.1. Hasil Penelitian 40
4.2. Pembahasan 42
Bab 5. Kesimpulan dan Saran
5.1. Kesimpulan 44
5.2. Saran 44
DAFTAR LAMPIRAN
Lampiran A. Foto Kulit Buah Tumbuhan Jengkol
Lampiran B. Determinasi Tumbuhan Jengkol
Lampiran C. Kromatogram Lapisan Tipis Ekstrak Metanol Kulit Buah Tumbuhan Jengkol
Lampiran D. Kromatogram Lapisan Tipis Senyawa Hasil Isolasi melalui penampakan noda dengan penambahan pereaksi
Lampiran E. Spektrum Ultraviolet-Tampak (UV-Vis) Senyawa hasil isolasi
Lampiran F. Spektrum Ultraviolet-Tampak (UV-Vis) Senyawa pembanding
Lampiran G. Spektrum Inframerah (FT-IR) senyawa hasil isolasi
Lampiran H. Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa
hasil isolasi
Lampiran I. Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa
pembanding untuk proton pada cincin A
Lampiran J. Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa
pembanding untuk proton metoksi, -OCH3
Lampiran K. Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa
pembanding untuk proton pada cincin B
Lampiran L. Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa
pembanding untuk proton pada cincin C
ISOLASI SENYAWA FLAVONOIDA DARI KULIT
BUAH TUMBUHAN JENGKOL
(Pithecollobium lobatum Benth.)
ABSTRAK
Isolasi senyawa flavonoid yang terkandung di dalam Kulit Buah Tumbuhan Jengkol-
(Pithecollobium lobatum Benth.) telah dilakukan dengan cara ekstraksi maserasi
dengan menggunakan pelarut metanol. Ekstrak metanol yang diperoleh dipekatkan dan diekstraksi partisi dengan n-heksan. Fraksi metanol yang diperoleh dilarutkan dengan aseton secara berulang-ulang. Larutan aseton dipekatkan dan dikromatografi
kolom menggunakan fasa gerak CHCl3 : MeOH (80 : 20)v/v dan fasa diam Silika gel
40 (70-230 mesh ASTM). Senyawa yang telah dimurnikan diperoleh dalam bentuk gum berwarna cokelat 185 mg. Senyawa ini diidentifikasi dengan menggunakan spektroskopi Ultraungu-Tampak (UV-Vis). Spektroskopi Infra Merah (FT-IR) dan
Spektrofotometer Resonansi Magnetik Inti Proton(1H-NMR). Dari data hasil spektrum
ISOLATION OF FLAVONOID COMPOUND FROM
THE SKIN OF FRUIT JENGKOL CROP
(Pithecollobium lobatum Benth.)
ABSTRACT
Flavonoid compound was isolated from the skin of fruit Jengkol crop (Pithecollobium
lobatum Benth.) by using maceration technique with solvent of methanol. Methanol
extract that gained from the maceration was concentrated and partition extracted with n-hexane. Methanol fraction was dissolved with acetone repeteadly. Acetone solution was concentrated and put into column chromatography, elucidated with mobile phase
CHCl3 : MeOH (80 : 20)v/v and stationary phase is Silica gel 40 (70-230 mesh)
ASTM. The Compound was purified like gum form and gained about 185 mg . The Compound was analised by using Spectroscopy Ultraviolet-Visible (UV-Vis), Infra
Red (FT-IR), and Nuclear Magnetic Resonance Proton (1H-NMR). Data from the
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Penggunaan tumbuhan baik sebagai obat, bahan makanan, bumbu, kosmetik,
maupun sebagai bahan ramuan untuk upacara ritual keagamaan telah dikenal sejak
zaman kuno seperti yang telah ditemukan di dalam berbagai catatan bangsa Cina,
Mesir, Mesopotamia, Yunani, dan Roma. Bahkan penemuan terbaru di Pakistan
membuktikan bahwa penggunaanya telah berlangsung selama 5000 tahun.
(Wiryowidagdo, 2007)
Dalam hal ini dapat dikatakan bahwa tumbuh-tumbuhan termasuk salah satu
sumber , yang terdapat di alam. Kimia bahan alam selalau menarik perhatian para ahli
kimia dan ahli biologi. Struktur dari alkaloida, flavonoida, terpena, poliketida, pigmen
dari tumbuhan sangatlah bervariasi. Ahli kimia organic berpendapat bahwa metabolit
sekunder adalah bahan alam yang penting.
Hampir seluruh daerah Indonesia mengenal beberapa jenis tumbuhan yang
digunakan sebagai ramuan obat-obatan secara tradisional, bahkan tumbuh-tumbuhan
ini dibudidayakan oleh sebagian masyarakat tertentu sebagai apotek hidup dan
merupakan sumber bahan obat-obatan secara tradisional. Penggunaan obat-obatan
tradisional ini merupakan warisan nenek moyang yang secara turun-temurun bagi
masyarakat tertentu dan saat ini masih digunakan sebagian masyarakat sebagai jamu.
(Rismunandar, 1986).
Salah satu tumbuhan yang digunkan sebagai tumbuhan obat adalah tumbuhan
Jengkol (Pithecollobium lobatum Benth.) Bagian yang digunakan adalah kulit buah
dari tumbuhan Jengkol yang digunakan sebagai obat untuk mencegah diabetes dan
bersifat diuretik serta baik untuk kesehatan ( id.wikipedia.org/wiki/Jering). Selain
digunakan sebagai obat diabetes atau anti gula darah ternyata kulit jengkol dapat juga
dimanfaatkan sebagai (salep) obat
juga telah dilakukan penelitian terhadap kulit buah jengkol dimana dimanfaatkan
sebagai herbisida alami untuk menekan pertumbuhan gulma
1.2. Permasalahan
Jenis flavonoida apa yang terkandung dalam kulit buah tumbuhan Jengkol
(Pithecollobium lobatum Benth.)
(http://bdpunib.org/bdp/abstrak/2005/budinur.html).
Tumbuhan ini sudah pernah diteliti pada bagian kulitnya sebelumnya dimana
mengandung beberapa senyawa kimia metabolit sekunder antara lain flavonoida,
saponin, tannin, kalsium, steroid, glikosida, fosfor,(Puspita,H. 1988). Dalam hal ini
kami melakukan penelitian untuk mengetahui jenis flavonoida yang terkandung di
dalamnya karena belum pernah kami jumpai jurnal yang membahas penelitian ini.
Menurut perkiraan, kira-kira 2 % dari seluruh karbon yang difotosintesis oleh
tumbuhan diubah ,menjadi flavonoida. Jadi flavonoida merupakan salah satu golongan
fenol alam terbesar. Sebenarnya flavonoida terdapat pada semua tumbuhan hijau
sehingga pastilah ditemukan pula pada setiap ekstrak tumbuhan. (Markham, 1988).
Dari hasil fitokimia yang dilakukan terhadap kulit buah tumbuhan Jengkol
dengan menggunkan pereaksi-pereaksi flavonoida memeberikan hasil yang positif
terhadap flavonoida. Oleh karena itu penulis tertarik untuk mengisolasi senyawa kimia
bahan alam hayati dari golongan flavonoida yang terkandung di dalam kulit buah
tumbuhan.
1.3. Tujuan Penelitian
Untuk mengisolasi senyawa flavonoida dari kulit buah tumbuhan Jengkol
(Pithecollobium lobatum Benth.)
1.4. Manfaat Penelitian
Hasil dari peneltian ini diharapkan dapat memberikan sumber informasi ilmiah pada
bidang kimia bahan alam hayati dan farmasi dalam pengembangan ilmu kimia
Serta memberikan sumber referensi baru buat para peneliti lainnya dalam
mengembangbangkan dan memanfaatkan kulit buah tumbuhan jengkol sebagai
sumber produk baru yang bernilai ekonomis dan tidak hanya dianggap sebagai sumber
polusi sampah (bulky waste).
1.5. Lokasi Penelitian
1. Tempat Pengambilan Sampel
Sampel yang digunakan diperoleh dari hasil pembuangan kulit jengkol di Pasar
Central, Medan.
2. Tempat Melakukan Penelitian
Penelitian dilakukan di Laboratorium Kimia Bahan Alam, FMIPA-USU,
Medan.
1.6. Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida menggunakan kulit buah tumbuhan
Jengkol, berupa serbuk halus kering sebanyak 1900 gram. Tahap awal dilakukan uji
skrining fitokimia dengan menggunakan pereaksi-pereaksi untuk senyawa flavonoida
yaitu dengan pereaksi FeCl3 1 %(aq), NaOH 10 %(aq), MgHCl(aq), H2SO4(p).
Tahap Isolasi yang dilakukan :
1. Ekstraksi Maserasi
2. Ekstraksi Partisi
3. Analisis Kromatografi Lapis Tipis
4. Analisis Kromatografi Kolom
5. Kromatografi Lapis Tipis Preparatif
Tahapan analisis hasil isolasi yang dilakukan adalah :
1. Analisis Kromatografi Lapis Tipis
2. Identifikasi dengan menggunakan Spektrofotometer UV-Visible,
Spektrofotometer Infra Merah (FT-IR), dan Spektrofotometer Resonansi
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Jengkol
2.1.1. Morfologi Tumbuhan Jengkol
Tumbuhan Jengkol atau lebih dikenal dengan tumbuhan Jering adalah termasuk dalam
Famili Fabaceae (suku biji-bijian). Tumbuhan kulit buah jengkol atau Jering dengan
nama latinnya yaitu (Pithecellobium lobatum Benth.) dengan sinonimya yaitu A.
Jiringa, Pithecollobioum jiringa dan Archindendron pauciflorum adalah tumbuhan
khas di wilayah Asia Tenggara. Jengkol merupakan salah satu tumbuhan dengan
ukuran pohon yang tinggi yaitu ± 20 m , tegak bulat berkayu, licin, percabangan
simpodial, cokelat kotor. Bentuk majemuk, lonjong, berhadapan , panjang 10 - 20 cm,
lebar 5 - 15 cm, tepi rata, ujung runcing, pangkal membulat, pertulangan menyirip,
tangkai panjang 0,5 – 1 cm, warna hijau tua. Struktur majemuk, berbentuk seperti
tandan, diujung dan ketiak daun, tangkai bulat, panjang ± 3 cm , berwarna ungu
kulitnya, bentuk buah menyerupai kelopak mangkok, benang sari kuning, putik
silindris, kuning mahkota lonjong, putih kekuningan. Bulat pipih berwarna cokleat
kehitaman, berkeping dua dan berakar tunggang. Pohon Jengkol sangat bermanfaat
dalam konservasi air disuatu tempat hal ini dikarenakan ukuran pohonnya yang sangat
tinggi.
2.1.2. Klasifikasi Ilmiah Jengkol adalah sebagai berikut :
Kingdom : Plantae
Subkingdom : Tracheobionta
Divisi : Magnoliophyta (berbunga)
Kelas : Magnoliopsida (dikotil)
Ordo : Fabales
Famili : Mimosaceae (polong-polongan)
Genus : Pithecollobium
2.1.3. Manfaat kulit buah tumbuhan Jengkol
Salah satu tumbuhan yang digunakan sebagai tumbuhan obat adalah kulit buah
tumbuhan Jengkol (Pithecollobium lobatum Benth.). Bagian dari Jengkol yang
digunakan adalah kulit buahnya yang dapat dimanfaatkan sebagai obat diabetes (gula
darah).(id.wikipedia.org/wiki/Jering) dan dapat digunakan sebagai herbisida alami
untuk menekan pertumbuhan gulma yang mengganggu pertanian.
2.2. Senyawa Flavonoida
2.2.1. Pendahuluan
Istilah senyawa fenol meliputi aneka ragam senyawa yang berasal dari tumbuhan,
yang mempunyai ciri sama yaitu cincin aromatik yang mengandung satu atau dua
penyulih (pengganti) hidroksil. Senyawa fenol cenderung mudah larut dalam air
karena umumnya mereka sering kali berikatan dengan gula sebagai glikosida, dan
biasanya terdapat vakuola sel (membran sel).
Beberapa ribu senyawa fenol alam telah diketahui strukturnya. Flavonoida
merupakan golongan terbesar, tetapi fenol monosiklik sederhana, fenilpropanoida, dan
kuinon fenolik juga tertdapat dalam jumlah besar. Beberapa golongan bahan polimer
penting alam tumbuhan lignin, melanin, dan tanin adalah senyawa polifenol dan
kadang-kadang satuan fenolik dijumpai pada protein, alkaloida, dan diantara
terpenoida. Peranan beberapa golongan senyawa fenol sudah diketahui (misalnya
lignin sebagai bahan pembangun dinding sel, antosianin sebagai pigmen bunga),
sedangkan peranan senyawa yang termasuk golongan lain masih merupakan hasil
dugaan belaka. Flavonol. Misalnya, tampaknya penting pada pengaturan pengendalian
tumbuh pada tanaman kacang, Pisum sativum. Pengaruhnya yang merugikan terhadap
kebiasaan makan serangga telah menunjukkan bahawa flavonoida mungkin
Bagi biokimiawan tumbuhan, senyawa fenol tumbuhan dapat menimbulkan
gangguan besar karena kemampuannya membentuk kompleks dengan protein melalui
ikatan hidrogen. Bila kandungan sel tumbuhan bercampur dan membran menjadi
rusak selama proses isolasi, senyawa fenol cepat sekali membentuk kompleks dengan
protein. Akibatnya, sering terjadi hambatan terhadap kerja enzim pada ekstrak
tumbuhan kasar. Sebaliknya, fenol sendiri sangat peka terhadap oksidasi enzim dan
mungkin hilang pada proses isolasi akibat kerja enzim fenolase yang terdapat dalam
tumbuhan. Ekstraksi senyawa fenol-tumbuhan dengan etanol mendidih biasanya
mencegah terjadinya oksidasi enzim, dan prosedur ini seharusnya dilakukan secara
rutin.
Cara klasik untuk mendeteksi senyawa fenol sederhana ialah dengan
menambahkan larutan besi (III) klorida 1% dalam air atau etanol kepada larutan
cuplikan, yang menimbulkan warna hijau, merah, ungu, biru, atau hitam yang kuat.
Cara ini, yang dimodifikasi dengan menggunakan campuran segar larutan besi (III)
klorida 1% dalam air dan kalium heksasianoferat (III) 1%, masih tetap digunakan
secara umum untuk mendeteksi senyawa fenol pada kromatogram kertas. Tetapi,
kebanyakan senyawa fenol (terutama flavonoida) dapat dideteksi pada kromatogram
berdasarkan warnanya atau fluoresensinya dibawah lampu UV, warnanya diperkuat
atau berubah bila diuapi amonia. Pigmen fenolik berwarna dan warnanya ini dapat
terlihat jadi, mudah disimak (dipantau) selama proses isolasi dan
pemurnian.(Harborne, 1987)
Senyawa-senyawa flavonoida adalah senyawa-senyawa polifenol yang
mempunyai 15 atom karbon, terdiri dari dua cincin benzene yang dihubungkan
menjadi satu oleh rantai linier yang terdiri dari tiga atom karbon. Senyawa-senyawa
flavonoida adalah senyawa 1,3 diaril propana, senyawa isoflavonoida adalah 1,1 diaril
propana. Istilah flavonoida deiberikan pada suatu golongan besar senyawa yang
berasal dari kelompok senyawa yang paling umum, yaitu senyawa flavon; suatu
jembatan oksigen terdapat diantara cincin A dalam kedudukan orto, dan atom karbon
benzil yang terletak disebelah cincin B. Senyawa heterosiklik ini, pada tingkat
yang mempunyai cincin C dengan tingkat oksidasi paling rendah dan dianggap
sebagai struktur induk dalam nomenklatur kelompok senyawa-senyawa ini. (Manitto,
1981)
Semua varian falvonoida saling berkaitan karena alur biosintesis yang sama,
yang memasukkan substrat dari alur ‘sikimat’ dan alur ‘asetat-malonat’ (Hahlbrock &
Grisebach, 1975; Wong, 1976), flavonoida pertama dihasilkan segera setelah kedua
alur itu bertemu. Sekarang, flavonoid yang dianggap pertama kali terbentuk pada
biosintesis ialah khalkon (Hahlbrock, 1980), dan semua bentuk lain diturunkan
darinya melalui berbagai alur. Modifikasi flavonoida pengurangan) hidroksilasi;
metilasi gugus hidroksil atau inti flavonoida; isoprenilasi gugus hidroksil atau inti
flavonoida; metilenasi gugus orto- dihidroksil; dimerisasi (pembentukan
biflavonoida); pembentukan bisulfate; dan
O 7 O A C B 8 6 5 6' 5' 4' 3' 2' 1' 2 1 9 10 4 3 (8a) (4a)
yang terpenting, glikosilasi gugus hidroksil (pembentukan flavonoida O-glikosida)
atau inti flavonoida (pembentukan flavonoida C-glikosida).(Markham, 1988)
2.2.2. Struktur dasar Senyawa Flavonoida
Senyawa flavonoida adalah senyawa yang mengandung C15 terdiri atas dua inti
fenolat yang dihubungkan dengan tiga satuan karbon. Struktur dasar flavonoida dapat
C
C C
A B
Kerangka dasar senyawa flavonoida
Cincin A adalah karakteristik phloroglusinol atau bentuk rosorsinol tersubstitusi.
HO
O
C
3A
C
6(B)
Namun sering terhidroksilasi lebih lanjut :
OCH3
O
C3
OCH3
H3CO
H3CO
C6 (B)
A
Cincin B adalah karakteristik 4-,3,4-,3,4,5- terhidroksilasi
R
R
R C3
C6
(A) B R = R' =H, R' = OH
R = H, R' = R" = OH R = R' = R" = OH
(juga, R = R' = R"= H) (Sastrohamidjojo, 1996)
2.2.3. Klasifikasi Senyawa Flavonoid
Flavonoid mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita
serapan yang kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak,
umumnya dalam tumbuhan terikat pada gula yang disebut dengan glikosida.
(Harborne, 1996). Pada flavonoida O-glikosida, suatu gugus hidroksil flavonoida (atau
HO O
C3
OH A
C6 (B)
HO O
C3
A
C6(B)
HO
lebih) terikat pada satu gula (lebih) dengan ikatan yang tahan asam. Glukosa
merupakan gula yang paling umum terlibat dan gula lain yang sering juga terdapat
adalah galaktosa, ramnosa, silosa, arabinosa, dan rutinosa. Waktu yang diperlukan
untuk memutuskan suatu gula dari suatu flavonoida O-glikosida dengan hidrolisis
asam ditentukan oleh sifat gula tersebut.
Pada flavonoida C-glikosida, gula terikat pada atom karbon flavonoida dan
dalam hal ini gula tersebut terikat langsung pada inti benzene dengan suatu ikatan
karbon-karbon yang tahan asam. Gula yang terikat pada atom C hanya ditemukan
pada atom C nomor 6 dan 8 dalam inti flavonoida, misalnya pada orientin. (Markham,
1988).
Flavonoid memiliki dua cincin benzene yang dipisahkan oleh sebuah unit
propane dan diturunkan dari senyawa flavone. Secara umum merupakan golongan
senyawa yang mudah larut dalam air. Kebanyakan senyawa terkonjugasi yang pada
umumnya berwarna cerah. Secara umum dapat dijumpai pada tumbuhan sebagai
glikosidanya yang meiliki struktur yang rumit. Perbedaan kelas antara golongan
senyawa flavonoida ini adalah adanya tambahan oksigen yang terikat pada cincin
heterosiklik dan gugus hidroksil. Senyawa yang termasuk dalam golongan tersebut
adalah katekin, leukoantosianidin, flavanone, flavanonol, flavone, antosianidin,
flavonol, khalkone, aurone, dan isoflavone. Struktur antara katekin dan
leukoantoasianidin memiliki struktur yang mirip dan jarang dijumpai bentuk
glikosidanya. Dan akan mengalami polimerisasi membentuk tanin yang terkandung
pada daun teh.
Flavanon dan flavanonol jarang dijumpai dalam bentuk glikosidanya. Flavon
dan flavonol secara luas terdistribusi sebagai senyawa fenolik. Antosianin adalah
pigmen tumbuhan yang secara umum berwarna merah dan jarang dijumpai berwarna
biru pada suatu bunga. Dan dapat dihasilkan sebanyak 30% dari bunga kering. Dapat
dijumpai sebagai glikosida. Khalkone termasuk butein, dengan cincin furan ditemukan
untuk pH. Auron merupakan pigmen berwarna kuning emas yang secara umum
dijumpai pada bunga. (Kaufman,P. 1999).
Isoflavone yang lebih dikenal sebagai 3- phenylkromon Dapat diketahui ada
sekitar 35 jenis isoflavone yang dikenal, yang mana contoh umumnya sebagai berikut
:Daidzein, Genistein, Tianlancuayin. Isoflavone dapat mengalami degradasi dengan
danya penambahan basa sehingga menghasilkan Desoxybenzoin dan asam formiat
selanjutnya Desoxybenzoin terpisah dan mengalami fusi (penggabungan dua inti
ringan menjadi inti yang lebih berat molekulnya) basa dan metilasi. Isoflavone banyak
digunakan sebagai estrogenic, insectidal, dan sebagai anti jamur, beberapa dari
senyawa itu adalah berpotensi dihasilkan dari racun ikan. (Raphael,I. 1991)
Menurut Robinson (1955), flavonoid dapat dikelompokkan berdasarkan keragaman
pada rantai C3 yaitu :
1. Flavonol
Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida, dan aglikon
flavonol yang umum yaitu kamferol, kuersetin, dan mirisetin yang berkhasiat sebagai
antioksidan dan antiimflamasi. Flavonol lain yang terdapat di alam bebas kebanyakan
merupakan variasi struktur sederhana dari flavonol. Larutan flavonol dalam suasana
basa dioksidasi oleh udara tetapi begitu cepat sehingga penggunaan basa pada
pengerjaannya masih dapat dilakukan.
O
O
OH H
H
2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan
3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi
warnaya. Flavon terdapat juga sebagai glikosidanya lebih sedikit daripada jenis
glikosida pada flavonol. Flavon yang paling umum dijumpai adalah epigenin dan
luteolin. Luteolin merupakan zat warna yang pertama kali dipakai Eropa. Jenis yang
paling umum adalah 7-glikosida dan terdapat juga flavon yang terikat pada gula
melalui ikatan karbon-karbon. Contohnya luteolin 8-C-glikosida. Flavon dianggap
sebagai induk dalam nomenklatur kelompok senyawa flavonoid.
7
8 O
O
6 5
10 9
1 2
1'
2'
6' 5'
4' 3'
4 3
Struktur Flavon
3. Isoflavon
Isoflavon merupakan isomer flavon, tetapi jumlahnya sangat sedikit dan sebagai
fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan sebagai
pertahanan terhadap serangan penyakit. Isoflavon sukar dicirikan karena reaksinya
tidak khas dengan pereaksi warna manapun. Beberapa isoflavon (misalnya daidzein)
memberikan warna biru muda cemerlang dengan sinar UV bila diuapi ammonia, tetapi
kebanyakan yang lain tampak sebagai bercak lembayung yang pudar dengan ammonia
O
O
Struktur Isoflavon
4. Flavanon
Flavanon terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun dan bunga.
Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah
jeruk; dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat
dalam buah anggur dan jeruk.
O
O
Struktur Flavanon
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika
dibandingkan dengan flavonoid lain. Sebagian besar senyawa ini diabaikan karena
konsentrasinya rendah dan tidak berwarna.
O
O
OH
6. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu.
Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir
dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat sebagai
antioksidan.
OH
OH
O
OH HO
HO
Struktur Katekin
7. Leukoantosianidin
Leukoantosianidin merupakan senyawa tidak berwarna, terutama terdapat pada
tumbuhan berkayu. Senyawa ini jarang terdapat glikosida, contohnya melaksidin,
apiferol.
O
OH OH HO
Struktur Leukoantosianidin
8. Antosianin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam
tumbuhan. Pigmen yang berwarna kuat dan larut dalam air ini adalah penyebab
hampir semua warna merah jambu, merah marak, ungu,. dan biru dalam daun, bunga,
dan buah pada tumbuhan tingkat tinggi. Secara kimia semua antosianin merupakan
pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau
dengan metilasi atau glikosilasi.
O
OH
Struktur Antosianin
9. Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna cokelat kuat dengan sinar UV
bila dikromatografi kertas. Aglikon flvon dapat dibedakan dari glikosidanya, karena
hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas
dalam pengembang air. (Harborne, 1996).
O
Struktur Khalkon
10. Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita.
Dalam larutan basa senyawa ini berwarna merah ros dan tampak pada kromatografi
kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah
menjadi merah jingga bila diberi uap amonia. (Robinson, 1995)
O
O
HC
Menurut Harborne (1996), dikenal sekitar sepuluh kelas flavonoida dimana
semua flavonoida, menurut strukturnya, merupakan turunan senyawa induk flavon dan
semuanya mempunyai sejumlah sifat yang sama yakni :
Golongan
Flavonoida Penyebaran Ciri Khas
Antosianin Proantosianidin Flavonol Flavon Glikoflavon Biflavonil
Khalkon dan Auron
Flavanon
Isoflavon
Pigmen bunga merah marak, dan biru juga dalam daun dan jaringan lain.
Terutama tidak berwarna dalam tumbuhan berkayu.
Terutama ko-pigmen tidak berwarna dalam bunga sianik dan asianik; tersebar luas dalam daun.
Seperti flavonol
Seperti flavonol
Tidak berwarna; hampir seluruhnya terbatas pada gimnospermae(tumb.berbiji
terbuka)
-
Kadang-kadang terdapat juga dalam jaringan lain.
Tidak berwarna; dalam daun dan buah (terutama dalam Citrus) tidak berwarna; sering kali akar; hanya terdapat dalam satu suku, Leguminosae(tumb. Kacang-kacangan).
Larut dalam air, λ maks 515-545 nm, bergerak dengan BAA pada kertas.
Menghasilkan antosianidin (warna dapat diekstraksi dengan amil alkohol) bila jaringan dipanaskan dalam HCl 2M selama setengah jam.
Setelah hidrolisis, berupa bercak kuning murup pada kromatogram Forestal bila disinari dengan sinar UV; maksimal spektrum pada 330-350.
Setelah hidrolisis, berupa bercak cokelat redup pada kromatogram Forestal maksimal spektrum pada 330-350 nm.
Mengandung gula yang terikat melalui ikatan C-C; bergerak dengan pengembang air, tidak seperti flavon biasa.
Pada kromatogram BAA berupa bercak redup dengan Rf tinggi.
Dengan ammonia berwarna merah; maksimal spektrum 370-410 nm.
Berwarna merah kuat dengan MgHCl kadang-kadang sangat pahit.
2.2.4. Metoda Isolasi Senyawa Flavonoida
Isolasi konstituen flavonoida dari tumbuhan akar serabut Glyccyrrhiza glabra pada
isolasi ini yang diisolasi adalah senyawa licoagrodin dan turunannya. Pada dasarnya
ekstrak methanol akar serabut tumbuhan G. glabra yang dipartisi antara air dan etil
asetat.Ekstrak etil asetat diteruskan untuk dipisahkan dengan menggunkan
kromatografi kolom dengan menggunakan silika gel dan selanjutkan dimurnikan
dengan menggunakan Fase-Normal HPLC untuk menghasilkan 5 jenis flavonoida
baru, licoagrodin, licoagrokalkone B, licoagrokalkone C, licoagrokalkone D ,
licoagroaurone dan 4 flavonoid yang dikenal lainnya ialah licoakalkone C. Lapisan
air dilanjutkan untuk dianalisa dengan kromatografi kolom Daion HP-20, yang dielusi
dengan menggunakan methanol. Eluate methanol dievaporasi vakum untuk
menghasilkan sebuah fraksi glikosida. Fraksi tersebut akan dianalisa dengan
kromatografi kolom ODS. (Yoshikawa,T.2000).
2.2.5. Sifat Kelarutan Flavonoida
Aglikon Flavonoida adalah polifenol dan karena itu mempunyai sifat kimia senyawa
fenol, yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi harus diingat,
bila dibiarkan dalam larutan basa, dan di samping itu terdapat oksigen, banyak yang
terurai. Karena mempunyai sejumlah gugus hidroksil yang tak tersulih(terganti), atau
suatu gula, flavonoida merupakan senyawa polar, dan seperti kata pepatah lama
mengatakan ‘suatu golongan akan melarutkan golongannya sendiri’ maka
umumnya flavonoida larut cukupan dalam pelarut polar seperti etanol (EtOH),
methanol(MeOH), butanol(BuOH), aseton, dimetilsulfoksida(DMSO),
dimetilformamida(DMF), air, dan lain-lain. Adanya gula yang terikat pada flavonoida
(bentuk yang umum ditemukan) cenderung menyebabkan flavonoida lebih mudah
larut dalam air dan dengan demikian campuran pelarut diatas dengan air merupakan
pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti
isoflavon, flavanon, dan flavon serta flavonol yang termetoksilasi cenderung lebih
2.3. Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang akan
ditentukan berad dalam keadaan murni, tidak tercampur dengan komponen-komponen
lainnya. Ada 2 jenis teknik pemisahan :
1. Pemisahan Kimia
Pemisahan ini berdasarkan adanya perbedaan yang besar dari sifat-sifat
fisika
komponen dalam campuran yang akan dipisahkan.
2. Pemisahan Fisika
Pemisahan ini berdasarkan pada perbedaan-perbedaan kecil dari sifat-sifat
fisik antara senyawa-senyawa yang termasuk dalam suatu golongan.
(Muldja, 1995).
2.4. Kromatografi
Kromatografi merupakan suatu cara pemisahan fisik dengan unsur-unsur yang akan
dipisahkan terdistribusikan antara 2 fase, satu dari fase-fase ini membentuk lapisan
stasioner dengan luas permukaan yang besar dan yang lainnya merupakan cairan yang
merembes lewat.
Fase stasioner mungkin suatu zat padat atau suatu cairan dan fase yang
bergerak mungkin suatu cairan atau suatu fase gas. Cara-cara kromatografi dapat
digolongkan sesuai dengan sifat-sifat dari fase diam, yang dapat berupa zat padat atau
zat cair. Jika fase diam berupa zat padat disebut kromatografi serapan, jika berupa zat
cair atau gas maka ada empat macam system kromatografi yaitu :
1. Fase gerak cair-fase diam padat (kromatografi serapan)
a. Kromatografi Lapis Tipis
b. Kromatografi Penukar Ion
2. Fase gerak gas-fase diam padat, yakni kromatografi gas padat
3. Fase gerak cair-fase diam cair (kromatografi partisi), yakni kromatografi
kertas
4. Fase gerak gas-fase diam zat cair, yakni :
a. Kromatografi Gas-Cair
Semua pemisahan dengan kromatografi tergantung pada kenyataan bahwa
senyawa-senyawa yang dipisahkan terdistribusi diantara fase gerak dan fase diam dalam
perbandingan yang sangat berbeda-beda dari suatu senyawa terhadap senyawa yang
lain. (Sastrohamidjojo, 1991).
2.4.1. Kromatografi Lapis Tipis
Teknik kromatografi lapis tipis (KLT) dikembangkan oleh Egon Stahl dengan
menghamparkan penyerap pada lempeng gelas, sehingga merupakan lapisan tipis.
KLT merupakan kromatografi serapan, tetapi dapat juga merupakan kromatografi
partisi karena bahan penyerap telah dilapisi air dari udara. Sistem ini segera popular
karena memberikan banyak keuntungan, misalnya peralatan yang diperlukan sedikit,
murah, sederhana, waktu, analisis cepat dan daya pisah cukup baik. (Sudjadi, 1986)
2.4.1.1 Pembuatan Lapisan Tipis
Dalam pembuatan lapisan tipis digunkan plat-plat kaca yang memiliki ukuran 20 x 5
cm atau 20 x 20 cm, dan ukuran ini dianggap “standart”. Plat ini dicuci terlebih dahulu
dengan air dan detergen kemudian dikeringkan dengan aseton. Selanjutnya membuat
penyerap menjadi bubur dengan air, biasanya dalam perbandingan x gram penyerap
dan 2x ml air. Bubur diaduk dengan baik dan dibentangkan di atas plat kaca dengan
berbagai cara. Tebal “standart” adalah 250 mikron. Lapisan-lapisan yang lebih tebal
(0,5 – 2,0 mm) digunakan untuk pemisahan-pemisahan yang sifatnya besar, dengan
menggunakan penyerap hingga 250 mg untuk plat dengan ukuran 20 x 20 cm. Salah
satu keukaran dengan lapisan tebal ialah adanya tendensi mengelupas bila
kering.(Sastrohamidjojo, 1985)
Beberapa contoh penyerap yang digunakan untuk pemisahan dalam
1. Silika gel
Ada beberapa jenis silika gel, yaitu :
a. Silika gel G
Silika gel G adalah silika gel yang mengandung 13 % kalsium sulfat sebagai
perekat. Jenis silika gel ini biasanya mengandung ion logam, terutama ion besi.
Kandungan ion besi dapat dihilangkan dengan mengembangkan plat TLC silika gel G
dengan sstem pelarut metanol : asam HCl pekat 9 : 1.
b. Silika gel H
Perbedaan silika gel G dan silika gel H ialah, bahwa silika gel H tidak
menngandung perekat kalsium sulfat. Silika gel H dipakai untuk pemisahan yang
bersifat spesifik, terutama lipida netral.
c. Silika gel PF
Jenis silika gel ini diketemukan belakangan, yang dibuat sedemikian rupa
sehingga senyawa-senyawa organik terikat pada plat ini dapat mengadakan
fluoresensi. Oleh karena itu visualisasinya dapat dikerjakan dengan menempatkan plat
yang telah dikembangkan di dalam ruangan gelap atau dengan sinar ultra violet yang
bergelombang pendek.
2. Alumina
Penggunaan alumina dalam TLC, yang semula diperkenalkan oleh peneliti dari
Cekoslowakia, tidak sesering silika gel. Sebenarnya alumina netral mempunyai
kemampuan untuk memisahkan bermacam-macam senyawa, seperti terpena, alkaloid,
steroid, dan senyawa-senyawa alisklik, alifatik, serta aromatik. Sebagai zat perekat
alumina tidak mengandung zat perekat, memepunyai sifat alkalis dan dapat
3. Kieselguhr
Kieselguhr merupakan adsorben yang lebih lemah dari silika gel dan alumina,
oleh karena itu lebih cocok untuk memisahkan senyawa-senyawa polar. (Adnan, M.,
1997)
Nilai utama KLT pada penelitian flavonoid ialah sebagai cara analisis cepat
yang memerlukan bahan sangat sedikit. Menurut Markham, KLT memiliki peranan
penting dalam metoda pemisahan dan isolasi yaitu :
a. Mencari pelarut untuk kromatografi kolom
b. Analisis fraksi yang diperoleh dari kromatografi kolom
c. Menyigi arah atau perkembangan reaksi seperti hidrolisis atau metilasi
d. Identifikasi flavonoida secara ko-kromatografi
e. Isolasi flavonoida murni skala kecil.
2.4.2. Kromatografi Kolom
Kromatografi kolom atau tabung merupakan salah satu jenis pemisahan dengan
menggunakan prinsip aliran zat cair (pelarut) yang dipengaruhi oleh gaya tarik bumi
(gravitasi bumi) atau dikenal dengan sistem bertekanan rendah biasanya terbuat dari
kaca yang dilengkapi keran jenis tertentu pada bagian bawahnya untuk mengatur
aliran pelarut.(Gritter, 1991) . Pada isolasi flavonoida sebaiknya digunakan kolom
skala besar karena hal ini dapat meningkatkan proses pemisahan yang baik. Pada
dasarnya cara ini meliputi penempatan campuran flavonoida (berupa larutan) di atas
kolom yang berisi serbuk penyerap (seperti selulose, silika, atau poliamida),
dilanjutkan dengan elusi beruntun setiap komponen memakai pelarut yang cocok.
Kolom yang digunakan umumnya terbuat dari kaca yang dilengkapi dengan keran
pada salah satu ujung, dan ukurannya sedemikian rupa sehingga nisbah garis tengah
terhadap panjang kolom dalam rentang 1:10 sampai 1:30. Kemasan kolom harus
dipilih dari jenis yang dipasarkan khusus untuk kromatografi kolom karena ukuran
partikel penting. Jika ukuran partikel terlalu kecil, laju aliran pengelusi mungkin
kromatografi tidak baik. Kemasan niaga biasanya dalam ukuran 100-300mesh.
Selulosa
(Markham, 1988)
2.4.2.1. Pengisian Kolom
Pengisian kolom harus dikerjakan dengan seragam.Setelah adsorben
dimasukkan dapat diseragamkan kepadatannya dalam kolom dengan menggunakan
vibrator atau dengan plunger (pemadat). Selain itu dapat juga dikerjakan dengan
memasukkan adsorben dalam bentuk larutan (slurry) dan partikelnya dibiarkan
mengendap. Pengisian kolom yang tidak seragam akan menghasilkan rongga-rongga
di tengah-tengah kolom. Cara untuk mengatasi masalah ini adalah dengan
mengadakan back fushing , sehingga terjadi pengadukan, yang seterusnya dibiarkan
lagi mengendap. Pada bagian bawah (dasar) dan atas dari isian kolom diberi wol kaca
(glass wool) atau sintered glass disc untuk menyangga isian. Bila kolom telah diberi
bahan isian, permukaan cairan tidak boleh dibiarkan turun dibawah permukaan bahan
isian bagian atas, karena akan memberikan peluang masuknya gelembung udara
masuk ke kolom. (Adnan,M., 1997)
2.4.2.2. Memilih Kemasan Kolom
Kemasan kolom yang tersedia sangatlah banyak dan senarai di bawah memberikan
pedoman mengenai pemakaian dan cirri sejumlah jenis kemasan yang berguna.
Pemakaian selulosa serupa dengan kertas, yaitu ideal untuk memisahkan
glikosida yang satu dengan yang lain, atau memisahkan glikosida dari aglikon,
serta untuk memisahkan aglikon yang kurang polar. Kapasitasnya rendah.
Silika
Bahan ini paling berguna untuk memisahkan aglikon yang kurang polar,
misalnya isoflavon, flavanon, metal flavon, dan flavanol. Kapasitas
Poliamida
Bahan ini cocok untuk memisahkan semua flavonoid, meski juga ideal untuk
memisahkan glikosida. Merupakan pelengkap untuk KKt karena melibatkan
penyerap dan pengembang yang berlainan. Sebelum dipakai harus dicuci
dengan MeOH dan H2O agar poliamida yang larut tidak mencemari semua
fraksi. Kapasitas tinggi.
Gel sephadex (deret G)
Bahan ini dirancang untuk memisahkan campuran, terutama berdasarkan pada
ukuran molekul (bila digunkan pelarut air); molekul besar terlebih dahulu.
Sephadex berguna untuk memisahkan poliglikosida yang berbeda bobot
molekulnya. Kapasitasnya lebih besar karena ukurannya lebih teratur.
2.4.3. Kromatografi Preparatif
Salah satu metode pemisahan yang memerlukan pembiayaan yang paling
murah dan memakai peralatan yang paling dasar ialah kromatografi lapis titpis
preparatif (KLTP). Walaupun KLTP dapat memisahkan bahan alam dalam jumlah
gram, sebagian besar pemakaian hanya dalam jumlah milligram. KLTP bersama-sama
dengan kromatografi kolom terbuka, masih dijumpai dalam sebagian besar publikasi
mengenai isolasi bahan alam, terutama dari laboratorium yang tidak dilengkapi
dengan cara pemisahan modern. Akan tetapi, seperti yang akan diterangkan kemudian,
tertdapat banyak masalah pada KLTP.
Penyerap
Dalam KLTP digunakan ketebalan adsorbent yang paling sering dipakai yaitu
0,5-2 mm. ukuran plat kromatografi biasanya 20 x 20 cm atau 20 x 40 cm.
Peneyerap yang paling umum ialah silika gel dan dipakai untuk pemisahan
campuran senyawa lipofil maupun campuran senyawa hidrofil.
Cuplikan dilarutkan dalam sedikit pelarut sebelum ditotolkan pada plat KLTP.
Pelarut yang baik ialah pelarut atsiri/organik (heksana, diklorometana, etil
asetat), karena jika pelarut kurang atsiri maka akan terjadi pelebaran pita.
Konsentrasi cuplikan harus sekitar 5-10%.
Pemilihan Fase Gerak
Pilihan pelarut ditentukan berdasarkan pemeriksaan pendahuluan memakai
KLT analitik. Karena ukuran partikel penyerap kira-kira sama, pelarut yang
dipakai pada plat KLT dapat dipakai langsung pada KLTP. Pengembangan
pelat KLTP biasanya dilakukan dalam bejana kaca yang dapat menampung
beberapa plat.
Isolasi senyawa yang sudah terpisah
Kebanyakan penyerap KLTP mengandung indikator fluoresensi yang
membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang
dipisahkan menyerap sinar UV. Akan tetapi, beberapa indikator menimbulkan
masalah yaitu bereaksi dengan asam kadang-kadang bahakan dengan asam
asetat.
Untuk senyawa yang tidak menyerap sinar UV, ada beberapa pilihan :
a). Menyemprot dengan air (misalnya saponin)
b). Menutup pelat dengan sepotong kaca menyemprot salah satu sisi dengan
pereaksi semprot
c). Menambahkan senyawa pembanding. (Hostettman,K.,1995)
2.4.4. Harga Rf ( Retension factor)
Identifikasi dari senyawa-senyawa yang terpisah pada lapisan tipis lebih baik
dikerjakan dengan pereaksi lokasi kimia dan reaksi warna. Lazimnya identifikasi
menggunakan harga Rf meskipun harga-harga Rf dalam lapisan tipis kurang tepat bila
Dapat didefenisikan sbb :
Harga Rf =
Faktor-faktor yang memepengaruhi gerakan noda dalam kromatografi lapis tipis yang
juga mempengaruhi harga Rf :
1). Struktur kimia dari senyawa yang dipisahkan
2). Sifat dari penyerap dan derajat aktifitasnya
3). Tebal keraataan dari lapisan penyerap
4). Pelarut (dan derajat kemurniannya) fasa gerak
5). Derajat kejenuhan dari uap
6). Jumlah cuplikan yang digunakan
7). Suhu
8). Kesetimbangan
9). Teknik percobaan (Sastrohamidjojo, 1985)
2.4.5. Ekstraksi
Ekstraksi dapat dilakukan pada bahan tumbuhan yang akan diisolasi. Umumnya kita
perlu ‘membunuh’ jaringan tumbuhan untuk mencegah terjadinya oksidasi enzim atau
hidrolisis. Mencelupkan jaringan daun segar atau bunga, bila perlu dipotong-potong,.
Kedalam etanol mendidih adalah salah satu cara yang baik untuk mencapai tujuan.
Selanjutnya, bahan dapat dimaserasi dalam suatu pelumat, lalu disaring. Bila
mengisolasi senyawa dari jaringan hijau, keberhasilan ekstraksi dengan alkohol
berkaitan langsung dengan seberapa jauh klorofil tertarik oleh pelarut itu. Bila ampas
jaringan, pada ekstraksi ulang, sama sekali tak berwarna hijau lagi, dapat dianggap
2.5. Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisis kimia-fisika yang mengamati
tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Ada dua macam
instrumen pada teknik spektroskopi yaitu spektrometer dan spektrofotometer.
Instrumen yang memakai monokromator celah tetap pada bidang fokus disebut
sebagai\ spektrometer. Apabila spektrometer tersebut dilengkapi dengan detektor
yang bersifat fotoelektrik maka disebut spektrofotometer. (Muldja, 1955)
Informasi Spektroskopi Inframerah menunjukkan tipe-tipe dari adanya gugus
fungsi dalam suatu molekul dan Resonansi Magnetik Inti yang memberikan informasi
tentang bilangan dari setiap tipe dari atom hidrogen dan juga memberikan informasi
yang menyatakan tentang lingkungan dari setiap tipe dari atom hidrogen.
Kombinasinya dan data yang ada kadang-kadang menentukan struktur yang lengkap
dari molekulnya yang tidak diketahui. (Pavia, 1979)
2.5.1. Spektroskopi Ultra Violet-Visible
Spektrofotometer UV-Vis adalah pengukuran panjang gelombang dan
intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar
ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan
electron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektroskopi UV-Vis
biasanya digunakan untuk molekul dan ion anorganik atau kompleks di dalam larutan.
Sinar ultraviolet berada pada panjang gelombang 200-400 nm sedangkan sinar tampak
berada pada panjang gelombang 400-800 nm. (Dachriyanus, 2004)
Spektrum flavonoida bisanya ditentukan dalam larutan dengan pelarut
methanol (MeOH, AR atau yang setara) atau etanol (EtOH), meski perlu diingat
bahwa spektrum yang dihasilkan dalam etanol kurang memuaskan. Spektrum khas
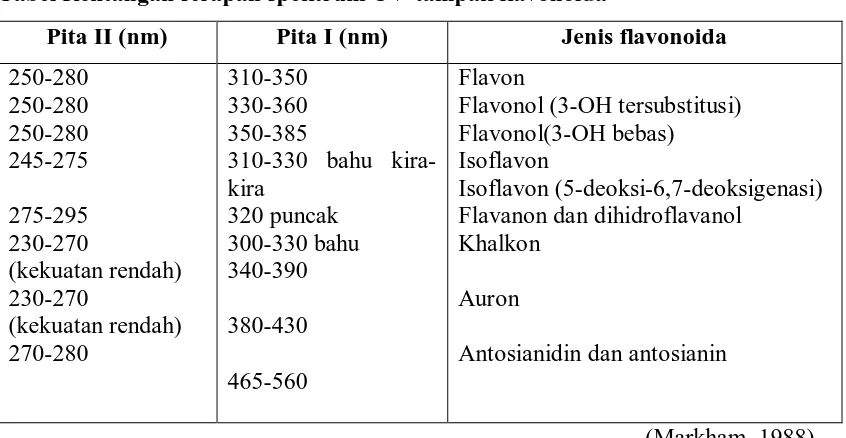
terdiri atas dua maksimal pada rentang 240 – 285 nm (pita II) dan 300-550 nm (pita I).
yang berharga mengenai sifat flavonoida dan pola oksigenasinya. Ciri khas spektrum
tersebut ialah kekuatan nisbi yang rendah pada pita I dalam dihidroflavon,
dihidroflavonol, dan isoflavon serta kedudukan pita I pada spektrum khalkon, auron,
[image:39.595.109.532.246.465.2]dan antosianin yang terdapat pada panjang gelombang yang tinggi.
Tabel Rentangan serapan spektrum UV-tampak flavonoida
Pita II (nm) Pita I (nm) Jenis flavonoida
250-280 250-280 250-280 245-275 275-295 230-270 (kekuatan rendah) 230-270 (kekuatan rendah) 270-280 310-350 330-360 350-385
310-330 bahu kira-kira 320 puncak 300-330 bahu 340-390 380-430 465-560 Flavon
Flavonol (3-OH tersubstitusi) Flavonol(3-OH bebas)
Isoflavon
Isoflavon (5-deoksi-6,7-deoksigenasi) Flavanon dan dihidroflavanol
Khalkon
Auron
Antosianidin dan antosianin
(Markham, 1988)
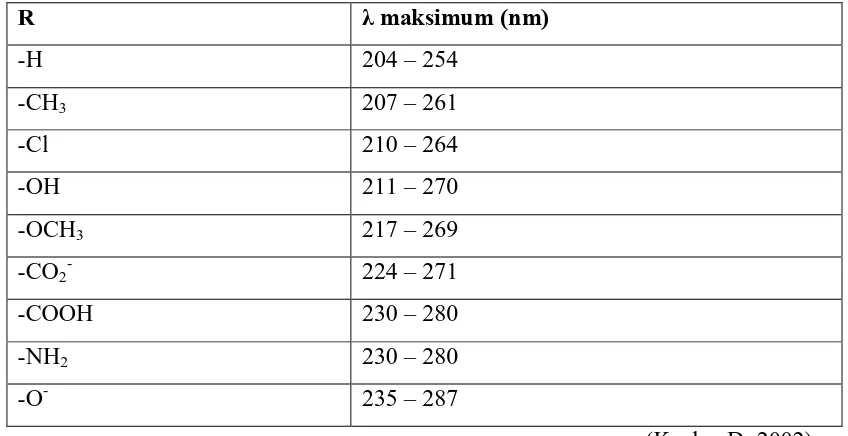
Dibawah ini daftar beberapa pengaruh substituent untuk senyawa aromatik. Hal ini
dapat menjadi catatan bahwa ion phenoxide (-O-), yang dapat dijunpai dalam larutan
basa senyawa fenol, dimana dapat menyerap panjang gelombang yang lebih panjang
dari pada senyawa induk fenol (-OH). Secara umum menyumbangkan elektron dan
substituent pasangan sunyi (lone pair) yang dapat menyebabkan pergeseran kimia
berwarna merah dan penyerapan yang lebih tinggi. Senyawa kompleks memiliki
Tabel. Absorbsi max untuk beberapa monosubstitusi benzene Ph-R (methanol : air)
R λ maksimum (nm)
-H 204 – 254
-CH3 207 – 261
-Cl 210 – 264
-OH 211 – 270
-OCH3 217 – 269
-CO2- 224 – 271
-COOH 230 – 280
-NH2 230 – 280
-O- 235 – 287
(Kealey,D. 2002)
Absorbsi radiasi UV oleh senyawa aromatik yang terdiri dari cincin benzene terpadu
bergeser ke panjang gelombang yang lebih panjang dengan bertambah banyaknya
cincin itu karena bertambahnya konjugasi dan membesarnya stabilisasi-resonansi dari
keadaan eksitasi. Daerah yang paling berguna dari spektrum UV adalah daerah dengan
panjang gelombang di atas 200 nm. Dalam absorbsi yang ditimbulkan oleh senyawa
aromatik dihasilkan warna dalam spektrum tampak. Warna merupakan hasil dari suatu
perangkat kompleks (dari) respons faali maupun psikologis terhadap panjang
[image:40.595.106.537.549.704.2]gelombang cahaya antara 400-750 nm, yang jatuh pada selaput jala.
Tabel. Warna dalam spektrum tampak
λ maks (nm) Warna Warna komplementer(substraksi)
400-424 Ungu Hijau-kuning
424-491 Biru Kuning
491-570 Hijau Merah
570-585 Kuning Biru
585-647 Jingga Hijau-biru
647-700 Merah Hijau
Tabel Pita absorbsi UV dari flavonoida
No. Jenis Flavonoida Struktur Umum Pita II Pita I
1. Flavon
7 8 O O 6 5 10 9 1 2 1' 2' 6' 5' 4' 3' 4 3
240-285 304-350
2. Flavonol
O
O OH
240-285 352-390
3. Flavanon
O
O 270-295 300-350
4. Dihidroflavonol
O
O OH R2
R1 270-295 300-320
5. Khalkon O 220-270 340-390
6. Auron
O
O HC
220-270 370-430
7. Antosianidin
O
OH 270-280 465-550
2.5.2. Spektrofotometri Infra Merah (FT-IR)
Radiasi infra merah ditemukan oleh Sir William Hercshel pada tahun 1880, yang
melaporkan penemuannya kepada Royal Society. Pada waktu itu para saintis belum
memahami secara jelas keadaan transisi. Daerah inframerah terletak antara spektrum
electromagnetic cahaya tampak dan spektrum radio; yakni antara 4.000-400 cm-1.
Mulai tahun 1903 William dan N. Coblentz mahasiswa di Cornel University
memperbaiki teknik-teknik percobaan dan menyusun sederetan spectra serapan zat
murni.
a. Ada beberapa daerah penyerapan terpenting dalam Spektrum Infra Merah :
1. Daerah vibrasi regang hidrogen : 3.700-2.700 cm-1.
• 3.700 – 3.100 cm-1, serapan oleh vibrasi regang O-H dan N-H. Serapan
oleh vibrasi lentur O-H biasanya terdapat pada bilangan gelombang
lebih besar dan pita serapannya dalam spektrum sering lebih lebar dari
pita serapan N-H.
• 3.200 – 2.850 cm-1, daerah vibrasi regang C-H alifatik.
2. Daerah vibrasi regang ikatan ganda tiga, 2.700 – 1.850 cm-1
Gugus fungsional yang menyerap di daerah ini terbatas, karena itu ada atau
tidaknya serapan tersebut dalam suatu molekul dapat dilihat.
3. Daerah ikatan ganda dua, 1.950 – 1.550 cm-1
Vibrasi regang untuk ikatan ganda dua, yaitu :
• - C = C , - C = N -, 1690 – 1600 cm-1
4. Daerah sidik jari “finger print”, 1.500 – 700 cm-1
Beberapa frekuensi gugusan (group frequency) juga bisa ditemukan di daerah sidik
jari ini : C-O-C (vibrasi regang) dalam eter, ester kira-kira 1.200 cm-1 dan vibrasi
regang C-Cl pada 700 – 800 cm-1 . Pada bilangan gelombang dibawah 1.200 cm-1
terdapat puncak-puncak serapan beberapa gugusan anorganik seperti : sulfat, fosfat,
nitrat dan karbonat.
b. Vibrasi kerangka suatu molekul (skeletal vibrations)
Vibrasi kerangka terletak di derah spektrum lebih dari 1.500 cm-1.
Kelompik-kelompok vibrasi di daerah spektrum kecil dari 1.500 cm-1 adalah :
a. Vibrasi regang (stretching) ikatan ganda yang tidak mengandung atom C
b. Vibrasi regang ikatan tunggal
c. Vibrasi-vibrasi lentur (bending) (Noerdin, 1985)
2.5.3. Spektrofotometri Resonansi Magnetik Inti Proton (1H-NMR)
Spektrometri Magnetik Inti (Nuclear Magnetic Resonance, NMR) merupakan
alat yang berguna pada penentuan struktur molekul organik. Teknik ini memberikan
informasi mengenai berbagai jenis atom hidrogen dalam. Struktur NMR memberikan
informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam
setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom
hydrogen.(Cresswell,1982)
Pergeseran kimia adalah pengukuran medan dalam keadaan bebas. Semua
proton-proton dalam satu molekul yang ada dalam lingkungan kimia yang serupa
kadang-kadang menunjukkan pergeseran kimia yang sama. Setiap senyawa
memberikan penaikan menjadi puncak absorbsi tunggal dalam spektrum
NMR.(Bernasconi,1995)
Senyawa yang paling lazim dan paling berguna dipakai sebagai acuan adalah
kimia, isotop magnet, serta larut dalam kebanyakan pelarut organik; TMS meberikan
puncak serapan tajam tunggal serta menyerap pada medan lebih tinggi daripada semua
proton organik. (Silverstein, 1974).
Si
CH3CH
3CH
3H
3C
Pada spektormetri NMR integrasi sangat penting. Harga integrasi
menunjukkan daerah atau luas puncak dari tiap-tiap proton. Sedangkan luas daerah
atau luas puncak tersebut sesuai dengan jumlah proton. Dengan demikian
perbandingan tiap integrasi proton sama dengan perbandingan jumlah proton dalam
molekul. (Muldja, 1955)
Di dalam medan magnet, perputaran elektron-elektron valensi dari proton
menghasilkan medan magnet yang melawan medan magnet yang digunakan. Hingga
setiap proton dalam molekul dilindungi dari medan magnet yang digunakan dan
bahwa besarnya perlindungan ini tergantung pada kerapatan elektron yang
mengelilingnya. Makin besar kerapatan elektron yang mengelilingi inti, maka makin
besar pula medan yang dihasilkan yang melawan medan yang digunakan. Akibat
secara keseluruhan adalah inti/proton merasakan adanya pengurangan medan yang
BAB 3
METODA PENELITIAN
3.1. Alat – alat
1. Gelas ukur 50 ml Pyrex
2. Gelas beaker 250 ml Pyrex
3. Gelas beaker 1000 ml Pyrex
4. Corong saring
5. Corong pisah 1000 ml Pyrex
6. Kolom kromatografi d = 5 cm/p = ±87 cm Pyrex
7. Tabung reaksi Pyrex
8. Plat skrining
9. Neraca analitis Mettler PM 480
10.Hair Dryer Miyako
11.Rotari evaporator Buchi B-480
12.Labu alas 500 ml Pyrex
13.Plat KLT
14.Plat KLTP (Preparatif) d = 0,25 mm p.a E.merck
15.Statif dan klem
16.Lampu UV 254 nm
17.Spatula
18.Batang pengaduk
19.Pipet tetes
20.Botol vial
21.Bejana (Chamber)
22.Pipa Kapiler
23.Spektrofotometer FT-IR Jasco
24.Spektrofotometer NMR-H1 500 MHz
25.Spektrofotometer UV-Vis
26.Botol Perendaman 5000 ml Pyrex
27.Water Bath
3.2. Bahan Penelitian
1. Serbuk kering kulit Buah Jengkol
2. Metanol Destilasi
3. n-Heksana Teknis
4. Kloroform p.a Merck
5. Aseton p.a Merck
6. Etanol Teknis
7. Silika gel 40 (70-230 mesh) ASTM
8. Reagent Feri Klorida 1%
9. Reagent Natrium Hidroksida 10%
10. Reagent Mg-HCl
11. Reagent H2SO4(p)
3.3. Prosedur Penelitian
3.3.1. Penyedian Sampel
Sampel yang diteliti adalah kulit buah Tumbuhan Jengkol yang diperoleh dari Pasar
Central,Medan. Kulit Buah Tumbuhan Jengkol dikeringkan di udara terbuka, lalu
dihaluskan sampai diperoleh serbuk sebanyak 1900 gram.
3.3.2. Uji Pendahuluan Terhadap Ekstrak Kulit Buah Tumbuhan Jengkol
Serbuk kulit buah Tumbuhan Jengkol diidentifikasi dengan menggunakan cara :
1. Uji busa
2. Skrining Fitokimia
3.3.2.1. Uji Busa
Serbuk kulit buah tumbuhan Jengkol sebanyak 5 g dimasukkan kedalam tabung
reaksi. Kemudian ditambah 10 ml akuades dan dipanaskan pada penangas air. Lalu
dikocok-kocok dengan kuat hingga terbentuk busa dan didiamkan selama 10 menit.
Ternyata busa hilang yang membuktikan bahwa didalam kulit buah tumbuhan Jengkol
tidak terdapat senyawa glikosida.
3.3.2.2. Skrining Fitokimia
Untuk mengetahui adanya senyawa flavonoida pada kulit buah tumbuhan Jengkol
maka dilakukan uji pendahuluan secara kualitatif. Serbuk kulit diekstraksi maserasi
dengan metanol, lalui disaring. Filtrat yang diperoleh ditampung dan diteteskan pada
plat skrining untuk diuji dengan pereaksi H2SO4(P), NaOH 10%, FeCl3 1% dan MgHCl
kemudian diperhatikan perubahan warna yang terjadi terhadap ekstrak sampel.
3.3.2.3. Analisis Kromatografi Lapis Tipis (KLT)
Analisis Kromatografi Lapis Tipis dilakukan terhadap ekstrak aseton dengan
menggunakan fasa diam silika gel 60F254. Fasa gerak yang digunakan adalah
campuran CHCl3 : MeOH dengan perbandingan (90 : 10)v/v ; (80 : 20)v/v ; (70 : 30)v/v
.
Prosedur analisis kromatografi lapis tipis :
Dimasukkan 10 ml larutan fase gerak CHCl3 : MeOH dengan perbandingan (90 :
10)v/v kedalam bejana kromatografi, kemudian dijenuhkan. Ditotolkan ekstrak pekat
methanol pada plat KLT. Dimasukkan plat ke dalam bejana yang telah berisi pelarut
yang telah dijenuhkan, lalu ditutup dan dielusi. Plat yang telah dielusi dikeluarkan dari
dalam bejana, lalu dikeringkan. Diamati warna bercak yang dihasilkan dibawah sinar
Ultra Violet dengan λ = 254 nm dan dihitung harga Rf-nya, selanjutnya dimasukkan
kedalam botol pereaksi FeCl3 1%. Perlakuan yang sama dilakukan untuk
menunjukkan bahwa di dalam kulit buah tumbuhan Jengkol terkandung senyawa
flavonoida. Hasil pemisahan yang baik diberikan pada fase gerak CHCl3 : MeOH (80 :
20) v/v. Harga Rf dapat dilihat pada kromaatogram (Lampiran C)
3.3.3. Prosedur untuk memperoleh senyawa kimia dari Ekstrak Kulit Buah Tumbuhan Jengkol
Serbuk kulit buah tumbuhan Jengkol ditimbang sebanyak 1900 g, dimasukkan
kedalam botol perendaman dan ditambahkan pelarut methanol yang telah didestilasi
sampai semua serbuk terendam oleh pelarut dan dibiarkan selama ± 72 jam dan
sesekali diaduk. Maserat ditampung dan diperoleh ekstrak berwarna hijau. Maserasi
dilakukan berulang kali dengan menggunakan pelarut methanol sampai ekstrak
methanol yang diperoleh memberikan hasil uji yang negative pada pereaksi untuk
identifikasi senyawa flavonoid. Ekstrak methanol yang diperoleh dikumpulkan dan
dipekatkan dengan menggunakan alat rotarievaporator pada suhu ± 63oC sehingga
diperoleh ekstrak pekat methanol, kemudian diekstraksi partisi dengan menggunakan
pelarut n-heksana sebanyak ± 7 kali, sehingga terbentuk lapisan n-heksana dan lapisan
methanol. Fraksi metanol ditampung dan dipekatkan, dan dilakukan kemudian
dilarutkan dengan aseton. Dilakukan skrining fitokimia dengan pereaksi yang
menghasilkan uji positif dengan peraksi. Selanjutnya dipekatkan sampai diperoleh
ekstrak pekat aseton sebanyak ± 8,3 gram.
3.3.4. Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Isolasi senyawa flavonoida secara kolom dilakukan terhadap ekstrak pekat aseton kulit
buah Tumbuhan Jengkol yang tealh diperoleh. Fasa diam yang digunakan adalah
silika gel 40 (70-230 mesh) ASTM dan fase gerak adalah campuran pelarut CHCl3 :
MeOH dengan perbandingan (80 : 20) v/v.
Dirangkai alat kromatografi kolom. Terlebih dahulu dibuburkan silika gel dicampur
dengan ekstrak pekat aseton dengan menggunakan pelarut n-heksana, diaduk-aduk
hingga homogen lalu dimasukkan kedalam kolom kromatografi. Kemudian dielusi
dengan menggunakan kloroform 100% hingga silika gel padat dan tidak menghasilkan
gelembung(bubble)/patahan. Lalu ditambahkan fase gerak CHCl3 : MeOH mulai dari
(90 : 10)v/v ; (80 : 20)v/v ; (70 : 30)v/v. secara perlahan-lahan dan diatur aliran fase
gerak yang keluar dari kolom sama banyaknya denga setiap penambahan fase gerak
dengan ratio yang berbeda dari atas kolom. Hasil yang diperoleh ditampung dalam
botol vial setiap 25 ml, lalu di KLT dan digabung fraksi dengan harga Rf yang sama.
Setelah itu diuji flavonoida dan diuapkan sampai pelarutnya habis sehingga terbentuk
kristal.
3.3.5. Pemurnian
Senyawa yang diperoleh dari fraksi yaitu pada fraksi 30 – 51 dilakukan pemurnian
senyawa atau pemurnian untuk memastikan kemurniannya.
Prosedur :
Senyawa pada fraksi 30 – 51 dipreparatif dengan menggunakan KLT Preparatif.
Senyawa tersebut ditotolkan dengan menggunakan pipa kapiler ke plat preparatif pada
batas bawah dengan jarak 2 cm, kemudian dimasukkan kedalam chamber untuk di
elusi dengan menggunakan perbandingan campuran eluent n-heksan dan aseton (120 :
80 )v/v. Dielusi selama ± 2 jam selanjutnya dikeringkan plat dan dilihat kenaikan noda
dibawah lampu UV dengan panjang gelombang lampu yang berbeda, dilakukan
penggerusan dan diambil senyawa dengan jarak noda yang sama, dilakukan pelarutan
dengan menggunakan campuran eluent CHCl3 : MeOH (120 : 180) v/v. ditampung dan
dilakukan rekristlalisasi dengan menggunakan campuran eluent etanol : n-heksan
3.3.6. Uji Kemurnian Hasil Kromatografi dengan KLT
Uji kemurnian senyawa dilakukan dengan Kromatografi Lapis Tipis dengan
menggunakan fase diam silika gel 60 F254 dengan fase gerak CHCl3 : MeOH (80 :
20)v/v.
Prosedur :
Dimasukkan 10 ml larutan fase gerak kedalam bejana kromatografi, lalu dijenuhkan.
Ditotolkan kristal yang sebelumnya dilarutkan pada plat KLT. Dimasukkan plat KLT
tersebut kedalam bejana kromatografi yang telah jenuh. Setelah pelarut fase gerak
merembes sampai batas tanda, plat KLT dikeluarkan dari bejana, dikeringkan, dan
difiksasi dengan menggunakan pereaksi Feri Klorida 1 % menghasilkan bercak hitam
yang menunjukkan uji positif adanya senyawa flavonoida. Perlakuan yang sama
dilakukan, dan difiksasi dengan Natrium Hidroksida 10 % yang menghasilkan bercak
berwarna biru violet. (Lampiran D)
3.3.7. Analisis spektroskopi Senyawa Hasil Isolasi
3.3.7.1. Analisis Senyawa Hasil Isolasi dengan Spektrofotometer UV-Vis
Analisis ini dilakukan di Pusat Penelitian Kimia-LIPI, Serpong-Tangerang
(Lampiran E)
3.3.7.2. Analisis Senyawa Hasil Isolasi dengan Spektrofotometer FT-IR
Analisis ini dilakukan di Pusat Penelitian Kimia-LIPI, Serpong-Tangerang
(Lampiran F)
3.3.7.3. Analisis Senyawa Hasil Isolasi dengan Spektrofotometer Resonansi
Magnetik Inti Proton (1H-NMR)
Analisis ini dilakukan di Pusat Penelitian Kimia LIPI Serpong – Tangerang dengan
menggunakan DMSO-d6 sebagai pelarut dan TMS sebagai standart dalam spektrum
3.4. Bagan Skrining Fitokimia
diekstraksi maserasi dengan methanol
disaring
dipekatkan
ditambahkan ditambahkan ditambahkan ditambahkan pereaksi FeCl3 1% pereaksi NaOH 10% pereaksi Mg-HCl pereaksi H2SO4(p)