ANDALI MAN (
Zanthoxylum acanthopodium
DC)
TERHADAP BAKTERI PATOGEN PANGAN
ADOLF J.N. PARHUSI P
SEKOLAH PASCASARJANA
I NSTI TUT PERTANI AN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa disertasi yang berjudul:
KAJIAN MEKANISME ANTIBAKTERI EKSTRAK ANDALIMAN (Zanthoxylum acanthopodium DC) TERHADAP BAKTERI
PATOGEN PANGAN
adalah karya saya sendiri dibawah bimbingan Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS; Prof. Dr. Ir. Winiaty Pudji Rahayu, MS dan Dr. Ir. Sedarnawati Yasni, M.Agr. dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun.Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka.
Bogor, Januari 2006
ANDALI MAN (
Zanthoxylum acanthopodium
DC)
TERHADAP BAKTERI PATOGEN
ADOLF J.N. PARHUSI P
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi I lmu Pangan
SEKOLAH PASCASARJANA
I NSTI TUT PERTANI AN BOGOR
Judul Disertasi : Kajian Mekanisme Antibakteri Ekstrak Andaliman
(Zanthoxylum acanthopodium DC) Terhadap Bakteri
Patogen
NAMA : ADOLF J.N. PARHUSI P
NRP : P09600002
Disetujui,
Komisi Pembimbing
Prof.Dr.I r. Betty Sri Laksmi Jenie, MS K e t u a
Dr.I r. Sedarnawati Yasni, M.Agr. Prof. Dr.I r.Winiati Pudji Rahayu, MS. Anggota Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana
I lmu Pangan
ABSTRACT
ADOLF JN. PARHUSIP. Antibacterial Mechanisms of Andaliman Extract (Zanthoxylum acanthopodium DC) on Food Pathogenic Bacteria. Supervised by BETTY SRI LAKSMI JENIE, WINIATI PUDJI RAHAYU and SEDARNAWATI YASNI.
Herbs and spices have long been used as flavors in many varieties of traditional foods. Andaliman (Zanthoxylum acanthopodium DC) is a fruit type herbs, belongs to the Rutaceae family, which is often added in foods, to improve its flavor and shelf-life. Some researches had been conducted and reveable the antibacterial activity of andaliman extract. Besides being used as spices, andaliman is also known as traditional medicine. Such as it is, this research is being dedicated to whic h has antibacterial activity. It is expected that andaliman will not only functioned as flavorant but also as food preservatives.
The aims of this research were to study the an tibacterial mechanisms of andaliman extract and to obtain more informations on the effectivity of andaliman considering its potency as natural foods preservatives.
The extraction of the andaliman components was conducted stepwise using three types of organic solvents, i.e. nonpolar solvent (hexane), semipolar solvent (ethyl acetate), and polar solvent (methanol). The extracts obtained were tested on three pathogenic bacteria, i.e. Bacillus cereus, Staphylococcus aureus
and Salmonella Typhimurium on each growth phase. The MIC (Minimum Inhibitor Concentration) and MBC (Minimum Bactericidal Concentration) of the extracts werealso determined. To study the mechanisms of the inhibition effect of the andaliman extracts the disruption of the cell wall and membrane, protease inactivation, and morphology of the cell were observed.
data of the examined bacteria, the lag phase occurred after 1 hour, meanwhile the exponential and stationary phases was after 8 and 16 hours.
The inhibition effect of ethyl acetate extract on the three bacteria was higher than the methanol extract. Meanwhile, the hexan e extract (nonpolar) of the andaliman did not show any inhibition effect on the examined bacteria. The concentration of the extracts (10-50% w/w) effected the diameter of inhibition zone of the bacterial growth. Compared to the lag phase and stationary phase, the cells during exponential phase of B. cereus and S. aureus were more sensitive to the ethyl acetate extract of andaliman. S. Typhimurium was more sensitive during lag and stationary phase. B. cereus, S. aureus and S. Typhimurium were more resistant to the methanol extract compared to the ethyl acetate extract.
The inhibition effect ethyl acetate extract on the growth of B. cereus, was 18.81 ± 0.21 mm, S. aureus was 16.69 ± 0.71 mm and S. Typhimurium was 20.77 ± 0.64 mm. The inhibition zone resulted by the methanol extract was lower compared to the ethyl acetate extract, i.e.15.98 ± 0.14 mm for B. cereus and
11.13 ± 0.14 mm for S. aureus and 16.67 ± 0.49 mm for S. Typhimurium. The inhibition strength of the ethyl acetate and methanol extracts at the concentration of 4000 µg/ml were equivalent to 10 µg/ml antibiotic (penicillin G and polymyxin B) concentration.
Among others, B. cereus was the most sensitive bacteria to the ethyl acetate extract of andaliman, which was shown by the MIC and MBC values i.e. 0.20 and 1.20% (w/w) respectively. S. aureus was the most resistant bacteria to the methanol extract of andaliman with MIC and MBC values at the concentration of 1.60 and 5.00% (w/w) respectively. The ethyl actetate extract performed the highest inhibition diameters on the vegetative cell, spore and the protoplast of
B.cereus. The antibacterial activities of methanol and ethyl acetate extracts at pH 4-7 were not significant. The inhibition effect of the methanol extract at pH 4-7 was lower than the ethyl acetate extract.
The ethyl acetate and methanol extracts of andaliman could increase the hydrophobicity of B. cereus (58.92 -79.58%), S. aureus (62.20-71.95%) and
Analysis on the cell leakage showed that the protein leakage was higher compared to the nucleic acid. Ethyl acetate extract caused protein and nucleic acid leakage on the exponential and stationary phase. The highest protein leakage was observed at the stationary phase of B. cereus, S. aureus and S. Typhimurium. Methanol extract was less disturbing the permeability of the cell compared to the ethyl acetate extract at the same MIC, both on the exponential and stationary phases. Andaliman extract could inhibit the protease activity produced by
B. cereus, S. aureus and S. Typhimurium as much as 0.2414, 0.3771 and 0.3784 unit/ml respectively. The ethyl acetate and the methanolic extracts could reduce the protease activity up to 50%.
ABSTRAK
ADOLF JN. PARHUSIP. Kajian Mekanisme Antibakteri Ekstrak
Andaliman (Zanthoxylum acanthopodium DC) Terhadap Bakteri Patogen
Pangan. Dibimbing oleh BETTY SRI LAKSMI JENIE, WINIATI PUDJI
RAHAYU dan SEDARNAWATI YASNI.
Rempah-rempah umumnya dimanfaatkan sebagai pemberi citarasa makanan. Pada masakan tradisional digunakan berbagai macam rempah sehingga memiliki citarasa yang khas. Buah andaliman merupakan salah satu jenis rempah -rempah yang banyak digunakan dalam masakan khas Sumatera Utara, khususnya masakan batak. Andaliman tidak saja memberikan citarasa pada makanan tetapi juga mengawetkan makanan adat yang umumnya dipersiapkan beberapa hari sebelum acara. Untuk memperluas pemanfaatan andaliman sebagai pengawet alami pada penelitian ini dipelajari mekanisme antibakteri ekstrak andaliman terhadap bakteri patogen.
Penelitian ini bertujuan untuk menggali informasi yang lebih mendasar mengenai efektivitas andaliman sebagai bahan antibakteri, sehingga pemanfaatannya sebagai bahan pengawet pangan alami dapat lebih dioptimalkan. Selanjutnya dikaji potensi dan mekanisme antibakteri ekstrak andaliman terhadap pertumbuhan beb erapa bakteri patogen, kerusakan morfologis sel dan identifikasi senyawa aktif, serta pembandingan aktivitas antibakteri andaliman dengan beberapa jenis antibiotik.
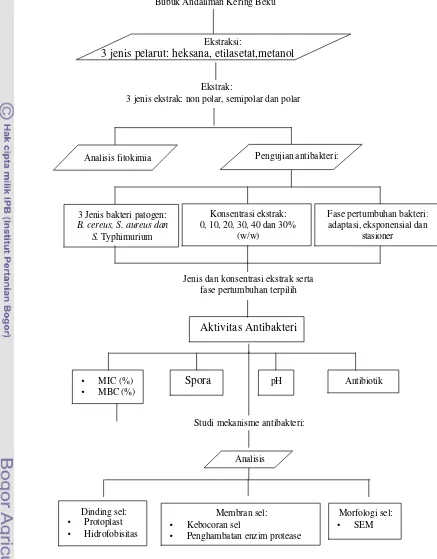
Untuk memperoleh ekstrak andaliman dilakukan ekstraksi bubuk andaliman secara bertingkat d engan 3 jenis pelarut organik, yaitu pelarut nonpolar -heksana, pelarut semipolar-etilasetat dan pelarut polar-metanol. Pengujian antibakteri ekstrak dilakukan terhadap bakteri patogen Bacillus cereus, Staphylococcus aureus dan Salmonella Typhimurium pada setiap fase pertumbuhannya. Pengujian mekanisme penghambatan ekstrak andaliman dikaji dengan mengamati perubahan -perubahan yang terjadi pada dinding dan membran sel, aktivitas enzim protease dan morfologi sel.
uji. Komponen aktif yang terdapat pada ekstrak etilasetat dan metanol adalah alkaloid, fenol hidrokuinon, flavonoid, triterpenoid, saponin, steroid, sedangkan tanin hanya terdapat pada ekstrak metanol. Berdasarkan data fase pertumbuhan bakteri uji dapat ditetapkan fase adaptasi adalah setelah 1 jam, sedangkan fase eksponensial dan fase stasioner masing-masing setelah 8 dan 16 jam.
Daya penghambatan ekstrak etilasetat lebih tinggi dibandingkan dengan ekstrak metanol terhadap B. cereus, S. aureus dan S. Typhimurium, sedangkan ekstrak heksana tidak menunjukkan efek penghambatan terhadap ketiga bakteri uji. Semakin tinggi konsentrasi ekstrak etilasetat dan ekstrak metanol yaitu berkisar konsentrasi 10-50% diameter penghambatan nya juga tinggi. Aktivitas antibakteri ekstrak etilasetat terhadap B. cereus dan S. aureus lebih peka pada fase
eksponensial dibandingkan pada fase adaptasi dan stasioner, sedangkan
S. Typhimurium lebih peka pada fase adaptasi dan fase stasioner.
Pembandingan aktivitas antibakteri andaliman dengan beberapa antibiotik menunjukkan kekuatan daya penghambatan ekstrak etilasetat dan ekstrak metanol terhadap B. cereusdan S. aureus, yaitu pada konsentrasi 4000 µg/ml sekitar 1/8 dari kekuatan penghambatan streptomisin, dan sekitar 1/4 dari daya penghambatan terhadap antibiotik penisilin G dan polimiksin B. Pada bakteri S.
Typhimurium, antibiotik streptomisin dan penisilin G tidak menunjukkan adanya aktivitas penghambatan, sedangkan daya penghambatan ekstrak etilasetat dan ekstrak metanol sekitar 1/4 dari daya penghambatan antibiotik polimiksin B.
Efektivitas antibakteri ekstrak etilasetat terhadap bakteri uji dinyatakan dalam Minimum Inhibitory Concentration (MIC) dan Minimum Bactericidal Concentration (MBC). B. cereus merupakan bakteri yang paling peka terhadap komponen antibakteri ekstrak etilasetat dengan nilai MIC dan MBC sebesar 0.20 dan 1.20% (w/w). S. aureus merupakan bakteri paling tahan terhadap ekstrak etilasetat dengan nilai MIC 1.60% dan nilai MBC 5.00%. Ekstrak etilasetat juga mampu memiliki diameter penghambatan paling tinggi terhadap sel veg etatif, spora dan protoplast sel B. cereus. Ekstrak etilasetat dan metanol andaliman tidak memberikan pengaruh nyata terhadap pH 4 - pH 7.
Ekstrak etilasetat dan ekstrak metanol mampu meningkatkan hidrofobisitas
hidrofobisitas S. aureus sebesar 62,35 -71.95% dan 62.20-66.15%. Sedangkan ekstrak etilasetat dan ekstrak metanol mampu meningkatkan hidrofobisitas terhadap S. Typhimurium sebesar 44.75-53.28% dan 41.44-50.02%.
Pengamatan keboco ran sel menunjukkan bahwa tingkat kebocoran protein sel lebih tinggi dibandingkan dengan kebocoran asam nukleat. Ekstrak etilasetat menyebabkan terjadinya kebocoran protein sel dan asam nukleat pada fase eksponensial dan fase stasioner. Tingkat kebocoran protein sel paling tinggi secara berurutan adalah B. cereus, S. aureus dan S. Typhimurium pada fase stasioner. Ekstrak metanol menggan ggu permeabilitas sel lebih rendah dibandingkan dengan ekstrak etilasetat pada dosis MIC yang sama baik pada fase eksponen sial maupun fase stasioner. Ekstrak andaliman mampu menghambat aktivitas enzim protease yang dihasilkan, yaitu pada B. cereus sebesar 0.2414 unit/ml, S. aureus sebesar 0.3771 unit/ml dan S. Typhimurium sebesar 0.3784 unit/ml. Ekstrak etilasetat dan metanol dapat menurunkan aktivitas enzim protease hingga 50%.
Ekstrak etilasetat dan ekstrak metanol andaliman menyebabkan perubahan morfologi sel S. aureus, B. cereus dan S. Typhimurium.Hal ini menunjukkan dengan permukaan sel yang berlubang besar, ada tonjolan dan terdapat lekukan -lekukan, dan perubahan bentuk menjadi tidak beraturan (mengecil, membengkak dan memanjang). Dengan demikian dapat dikatakan bahwa bakteri S. aureus
paling peka terhadap ekstrak etilasetat, sedangkan bakteri S. Typhimurium merupakan bakteri yang paling tahan terhadap ekstrak andaliman.
PRAKATA
Ucapan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas rahmat dan karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan disertasi ini dengan baik. Disertasi ini merupakan salah satu syarat kelulusan untuk memperoleh gelar doktor pada Program Studi Ilmu Pangan (IPN) Sekolah Pascasarjana Institut Pertanian Bogor.
Pada kesempatan ini, penulis menghaturkan ucapan terima kasih yang mendalam disertai penghargaan yang setinggi-tingginya kepada:
1. Komisi pembimbing, yaitu Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS sebagai ketua, serta Prof Dr. Ir. Winiati Pudji Rahayu, MS dan Dr. Ir. Sedarnawati Yasni, M.Agr sebagai anggota atas segala arahan dan bimbingan serta perhatian yang telah diberikan mulai dari perencanaan dan pelaksanaan penelitian hingga proses penulisan disertasi yang telah memperkaya pengetahuan penulis khususnya di bidang pangan.
2. Pimpinan IPB, terutama kepada pimpinan Program Pascasarjana dan Ketua Program Studi Ilmu Pangan atas kesempatan yang diberikan kepada penulis untuk menempuh pendidikan Program Doktor (S3).
3. Yayasan Santo Thomas, Rektor Unika St. Thomas, Sumatera Utara Medan dan Program BPPS DIKTI atas biaya pendidikan dan penelitian yang diberikan selama studi.
4. Terima kasih kepada Prof. Dr. Ir. Tun Tedja MS selaku penguji luar komisi yang bersedia menguji pada ujian tertutup Program Studi Doktor. Terima kasih juga kepada Dr. drh. Id wan Sudirman dan Dr. Joko Sulistyo, APU selaku penguji luar komisi yang bersedia mengu ji pada ujian terbuka Program studi Doktor.
6. Orang tua penulis Op. Helen doli (JP Parhusip) dan Op. Helen boru (P Siagian), Amang MG Gultom dan Inang T. Simatupang yang telah menghantarkan penulis untuk dapat menempuh pendidikan program doktor ini, serta atas dukungan moril dan materil yang telah penulis terima. 7. Istri penulis - Dra. Ronnia RK. Gultom beserta anak -anak - Helen Cynthia
Parhusip, Andro Cohen Parhusip, dan Sonya Claudia Parhusip atas dukungan, kesabaran dan kasih sayang yang telah diberikan selama melaksanakan pendidikan program doktor.
8. Teman seperjuangan Ir. Asriani, MS; Dra. Suliantari, MS dan Ir. Yuyun MS serta para teknisi yang telah membantu selama berlangsungnya penelitian, khususnya ibu Ari, ibu Martiana, bapak Taufik, bapak Mulyono, dan bapak Sobirin.
9. Semua pihak yang cukup banyak untuk disebutkan satu persatu.
Semoga bantuan, dukungan dan perhatian yang telah diberikan mendapat balasan yang berlipat ganda dari Tuhan. Akh ir kata semoga disertasi ini dapat memberi manfaat bagi yang membacanya.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Dolok Merangir (Sumatera Utara) pada tanggal 07 Januari 1967 sebagai salah anak sulung dari pasangan Johan Pilin Parhusip dan Penina Siagian. Pendidikan sarjana ditempuh di Program Studi Teknologi Hasil Pertanian, Fakultas Pertanian Universitas Katolik st. Thomas Sumatera Utara Medan, lulus pada tahun 1990. Pada tahun 1993, penulis diterima di Program Studi Ilmu Pangan Pascasarjana Institut Pertanian Bogor (IPB) dan menamatkannya pada tahun 1996, dengan beasiswa Yayasan Santo Thomas Medan bekerja sama dengan Asosiasi Perguruan Tinggi Katolik (APTIK). Kesempatan untuk melanjutkan ke Program Doktor pada Program Studi Ilmu Pangan IPB diperoleh pada tahun 2000, dengan Beasiswa Yayasan Santo Thomas bekerja sama dengan Asosiasi Perguruan Tinggi Katolik (APTIK) dan didukung Program Beasiswa BPPS DIKTI sejak tahun 2001-2004.
DAFTAR ISI
Halaman
DAFTAR TABEL..………..… xvi
DAFTAR GAMBAR..………..… xvii
DAFTAR LAMPIRAN ……….... xix
PENDAHULUAN...……….……….. 1
Latar Belakang ………..…….. 1
Tujuan Penelitian………... 2
Manfaat Penelitian……… 3
Hipotesis………... 4
TINJAUAN PUSTAKA... 5
Botani Andaliman (Zanthoxylum acanthopodium DC) ... 5
Senyawa Antibakteri dari Bahan Tanaman ... 7
Ekstraksi Komponen Bioaktif ... . 13
Bakteri Uji Aktivitas Antibakteri... ... 15
Mekanisme Kerja Penghambatan Senyawa Antibakteri... 17
BAHAN DAN METODE ... 32
Tempat dan Waktu………... 32
Bahan dan Alat ………... 32
Metodologi Penelitian ………. 33
PENGARUH POLARITAS EKSTRAK ANDALIMAN TERHADAP PERTUMBUHAN Bacillus cereus. .………..………. 49
Abstrak ………… ……… 49
Pendahuluan ………...…… 49
Metodologi Penelitian ………..………...… 50
Hasil dan Pembahasan ………..……… 53
Simpulan…. ………. 69
Daftar Pustaka ……….. 70
PENGARUH POLARITAS EKSTRAK ANDALIMAN TERHADAP PERTUMBUHAN Staphylococcus aureus…..……….……..…………. 74
Abstrak ………..………... 74
Pendahuluan…….………...……… 74
Metode Penelitian ………...… 75
Hasil dan Pembahasan ………. ……… 77
Simpulan ….……….. 86
PENGARUH POLARITAS EKSTRAK ANDALIMAN TERHADAP
PERTUMBUHAN Salmonella Typhimurium………..…………... 91
Abstrak…... ………... 91
Pendahuluan …….. ………...…… 91
Metodologi Penelitian ………...…. 92
Hasil dan Pembahasan ……….. ………. 94
Simpulan ….………... 105
Daftar Pustaka ……. ……….. 105
PENGARUH ANTIBAKTERI EKSTRAK ANDALIMAN TERHADAP KERUSAKAN DINDING SEL BAKTERI PATOGEN…..………... 110
Abstrak ……… ……….. 110
Pendahuluan ………...………. 110
Metodologi Pen elitian ………...… 111
Hasil dan Pembahasan ……….. ……… 112
Simpulan ….……….. 120
Daftar Pustaka ……… ……….. 121
PENGARUH ANTIBAKTERI EKSTRAK ANDALIMAN TERHADAP PERMEABILITAS SEL DAN ENZIM PROTEASE……..………... 124
Abstrak ….. ………... 124
Pendahuluan …….………...……… 124
Metodologi Penelitian ………...… 126
Hasil dan Pembahasan ……….. ……… 127
Simpulan … ……….. 135
Daftar Pustaka ……… ……….. 136
PENGARUH EKSTRAK ANDALIMAN TERHADAP KERUSAKAN MORFOLOGI SEL………....………... 138
Abstrak….………... 138
Pendahuluan …..………...……… 138
Metodologi Penelitian ………...… 139
Hasil dan Pembahasan …….. ……… 140
Simpulan ……….……….. 148
Daftar Pustaka ……. ……….. 149
PEMBAHASAN UMUM ... 151
SIMPULAN DAN SARAN ... 162
DAFTAR PUSTAKA ... 164
DAFTAR TABEL
Halaman
2.1 Golongan Utama Terpenoid Tumbuhan ……...……… 11
2.2 Beberapa Bagian Tanaman yang Bersifat Antimikroba... 14
2.3 Beberapa Sifat Pelarut Organik untuk Ekstraksi... 15
2.4 Mekanisme Antibiotik Terhadap Kerusakan Sel Bakteri ………. 19
3.1 Penggunaan Pelarut Organik Berdasarkan Kekuatan Polaritasnya..….. 35
3.2 Kriteria Hidrofobisitas Bakteri ………..……….… 45
4.1 Analisis Kadar Air dan Minyak Atsiri Andaliman Segar ….……….… 54
4.2 Rendemen dan Hasil Analisis Kualitatif Komponen Aktif Ekstrak Andaliman……… 54
4.3 Perbandingan Diameter Penghambatan Beberapa Antibiotik dan Ekstrak Andaliman terhadap B. cereus……… 63
5.1 Perbandingan Diameter Penghambatan Beberapa Antibiotik dan Ekstrak Andaliman terhadap S. aureus……….. 83
DAFTAR GAMBAR
Halaman
2.1 Tanaman Andaliman ……….………... 5
2.2 Struktur Licochalcone... 9
2.3 Struktur Peptidoglikan S. aureus……… 20
2.4 Struktur Dinding Sel Bakteri Gram Positif dan Gram Negatif.……… 21
2.5 Struktur Membran Luar Bakteri Gram Negatif ……….……….. 22
2.6 Mekanisme Penghambatan oleh Beberapa Senyawa Antibakteri.….. 24
2.7 Mekanisme Kerja Antibiotik Penisilin G ……… 26
2.8 Mekanisme Kerja Antibiotik pada Sel Bakteri ……… 27
3.1 Diagram Alir Pelaksanaan Penelitian ……….. 34
3.2 Diagram Alir Proses Ekstraksi dengan Metode Maserasi .……… 37
3.3 Penentuan MIC (Bloomfield 1991) ………. . 41
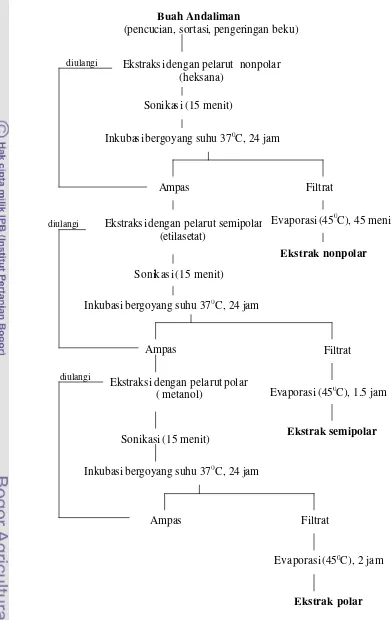
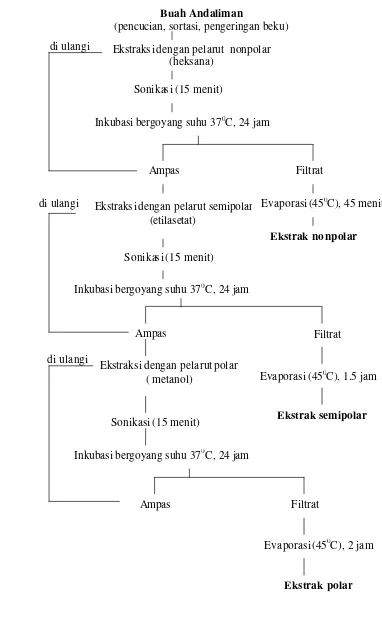
4.1 Diagram Alir Proses Ekstraksi Andaliman dengan Metode Maserasi .. 51
4.2 Kurva Pola Pertumbuhan B. cereus ………. 57
4.3 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman pada Fase Pertumbuhan B. cereus………..… 60
4.4 Pengaruh Konsentrasi Ekstrak Metanol Andaliman pada Fase Pertumbuhan B. cereus ……… 62
4.5 Aktivitas Ekstrak Andaliman terhadap spora B. cereus... 67
4.6 Aktivitas Ekstrak Andaliman terhadap Sel Vegetatif B. cereus... 68
5.1 Kurva Pola Pertumbuhan S. aureus ………. 77
5.2 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman pada Fase Pertumbuhan S. aureus ………. 80
5.3 Pengaruh Konsentrasi Ekstrak Metanol Andaliman pada Fase Pertumbuhan S. aureus ……… 82
6.1 Kurva Pola Pertumbuhan S. Typhimurium……….. 96
6.2 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman pada Fase Pertumbuhan S. Typhimurium ………. 99
6.3 Pengaruh Konsentrasi Ekstrak Metanol Andalim an pada Fase Pertumbuhan S. Typhimurium ……….. 101
7.1 Pengaruh Ekstrak Etilasetat dan Metanol Andaliman terhadap Protoplast dan Sel Vegetatif B. cereus dan S. aureus …… ... 113
7.3 Pengaruh Konsentrasi Ekstrak Andaliman Volume
n-Oktana dan terhadap Hidrofobisitas B. cereus ……… 116 7.4 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman dan Volume
n-Oktana terhadap Hidrofobisitas S. aureus ………... 117 7.5 Pengaruh Konsentrasi Ekstrak Metanol Andaliman Volume
n-Oktana dan terhadap Hidrofobisitas S. aureus ……… 117 7.6 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman Volume
n-Oktana dan terhadap Hid rofobisitas S.Typhimurium.………. 118 7.7 Pengaruh Konsentrasi Ekstrak Metanol Andaliman Volume
n-Oktana dan terhadap Hidrofobisitas S. Typhimurium……… 118 8.1 Pengaruh Ekstrak Etilasetat terhadap Permeabilitas sel B. cereus ….. 128 8.2 Pengaruh Ekstrak Metanol terhadap Permeabilitas sel B. cereus …… 129 8.3 Pengaruh Ekstrak Etilasetat terhadap Permeabilitas sel S. aureus ….. 130 8.4 Pengaruh Ekstrak Metanol terhadap Permeabilitas sel S. aureus …… 131 8.5 Pengaruh Ekstrak Etilasetat terhadap Permeabilitas sel S. Typhimurium 131 8.6 Pengaruh Ekstrak Metanol terhadap Permeabilitas sel S. Typhimurium. 132 8.7 Pengaruh Ekstrak Etilasetat dan Ekstrak Metanol terhadap
Aktivitas Enzim Protease……….. 134 9.1 Pengaruh Ekstrak Etilasetat (b ) dan Metanol (c) Dibandingkan Kontrol
(a) terhadap Struktur Morfologis Sel S. aureus (15.000X)………. 141 9.2 Pengaruh Ekstrak Etilasetat (b) dan Metanol (c) Dibandingkan Kontrol
(a) terhadap Struktur Morfologis Sel B. cereus (10.000X)………. 144 9.3 Pengaruh Ekstrak Etilasetat (b) dan Metanol (c) Dibandingkan Kontrol
DAFTAR LAMPIRAN
Halaman 1 Rekapitulasi Data Pengamatan Pola Pertumbuhan Bakteri Uji…... 171 2 Diameter Penghambatan Konsentrasi Ekstrak Andaliman terhadap
B. cereus pada Fase Adaptasi dengan Beberapa Pelarut... 178 3 Diameter Penghambatan Konsentrasi Ekstrak Andaliman terhadap
B. cereus pada Fase Eksponensial dengan Beberapa Pelarut... 179 4 Diameter Penghambatan Konsentrasi Ekstrak Andaliman terhadap
B. cereus pada Fase Stasioner dengan Beberapa Pelarut... 180 5 Diameter Penghambatan Konsentrasi Ekstrak Andaliman terhadap
S. aureus pada Fase Adaptasi dengan Beberapa Pelarut... 181 6 Diameter Penghambatan Konsentrasi Ekstrak Andaliman terhadap
S. aureus pada Fase Eksponensial dengan Beberapa Pelarut... 182 7 Diameter Penghambatan Konsentras i Ekstrak Andaliman terhadap
S. aureus pada Fase Stasioner dengan Beberapa Pelarut... 183 8 Diameter Penghambatan Konsentrasi Ekstrak Andaliman terhadap
S. Typhimuriumpada Fase Adaptasi dengan Beberapa Pelarut... 184 9 Diameter Penghambatan Konsentrasi Ekstrak Andaliman terhadap
S. Typhimuriumpada Fase Eksponensia l dengan Beberapa Pelarut... 185 10 Diameter Penghambatan Konsentrasi Ekstrak Andaliman terhadap
S. Typhimurium pada Fase Stasioner dengan Beberapa Pelarut... 186 11 Analisis Statistik Diameter Penghambatan B. cereus pada Fase
Adaptasi dengan Ekstrak Etilasetat………. 187 12 Analisis Statistik Diameter Penghambatan B. cereus pada Fase
Eksponensial dengan Ekstrak Etilasetat……….……. 188 13 Analisis Statistik Diameter Penghambatan B. cereus pada Fase
Stasioner dengan Ekstrak Etilasetat……… 189 14 Analisis Statistik Diameter Penghambatan B. cereus pada Fase
Adaptasi dengan Ekstrak Metanol………. 190 15 Analisis Statistik Diameter Penghambatan B. cereus pada Fase
Eksponensial dengan Ekstrak Metanol………. 191 16 Analisis Statistik Diameter Penghambatan B. cereus pada Fase
Stasioner dengan Ekstrak Metanol.………. 192 17 Analisis Statistik Diameter Penghambatan S. aureus pada Fase
Adaptasi dengan Ekstrak Etilasetat………. 193 18 Analisis Statistik Diameter Penghambatan S. aureus pada Fase
19 Analisis Statistik Diameter Penghambatan S. aureus pada Fase
Stasioner dengan Ekstrak Etilasetat……… 195 20 Analisis Statistik Diameter Penghambatan S. aureus pada Fase
Adaptasi dengan Ekstrak Metanol………. 196 21 Analisis Statistik Diameter Penghambatan S. aureus pada Fase
Eksponensial dengan Ekstrak Metanol………. 197 22 Analisis Statistik Diameter Penghambatan S. aureus pada Fase
Stasioner dengan Ekstrak Metanol.………. 198 23 Analisis Statistik Diameter Penghambatan S. Typhimuriumpada Fase
Adaptasi dengan Ekstrak Etilasetat………. 199 24 Analisis Statistik Diameter Penghambatan S. Typhimurium pada Fase
Eksponensial dengan Ekstrak Etilasetat……….……. 200 25 Analisis Statistik Diameter Penghambatan S. Typhimurium pada Fas e
Stasioner dengan Ekstrak Etilasetat……… 201 26 Analisis Statistik Diameter Penghambatan S. Typhimuriumpada Fase
Adaptasi dengan Ekstrak Metanol………. 202 27 Analisis Statistik Diameter Penghambatan S. Typhimurium pada Fase
Eksponensial dengan Ekstrak Metanol………. 203 28 Analisis Statistik Diameter Penghambatan S. Typhimuriumpada Fase
Stasioner dengan Ekstrak Metanol.………. 204 29 Data Penetapan MIC dan MBC Ekstrak Andaliman terhadap B. cereus 205 30 Data Penetapan MIC dan MBC Ekstrak Andaliman terhadap S. aureus 206 31 Data Penetapan MIC dan MBC Ekstrak Andaliman terhadap
S. Typhimurium……… 207 32 Rekapitulasi Data Pengaruh pH terhadap Aktivitas Antibakteri Ekstrak
Etilasetat Andaliman ……….. 208 33 Rekapitulasi Data Pengaruh pH terhadap Aktivitas Antibakteri Ekstrak
Metanol Andaliman ……… 208 34 Diameter Penghambatan Aktivitas Antibakteri Andaliman terhadap
Protoplast ……… 209 35 Diameter Penghambatan Aktivitas Antibakteri Andaliman terhadap
Sel Vegetatif……… 209 36 Data Aktivitas Antibakteri Ekstrak Andaliman terhadap Spora B. cereus 210 37 Data Aktivitas Antibakteri Ekstrak Andaliman terhadap Sel
Vegetatif B. cereus ……….. 210 38 Daya Hambat Ekstrak Etilasetat dan Ekstrak Metanol terhadap Aktivitas
39 Pengaruh Ekstrak Etilasetat terhadap Kebocoran Sel B. cereus selama Fase Eksponensial ……….. 212 40 Pengaruh Ekstrak Etilasetat terhadap Kebocoran Sel B. cereus selama
Fase Stasioner………….……….. 212 41 Pengaruh Ekstrak Metanol terhadap Kebocoran Sel B. cereus selama
Fase Eksponensial ……….. 212 42 Pengaruh Ekstrak Metanol terhadap Kebocoran Sel B. cereus selama
Fase Stasioner….. ……….. 212 43 Pengaruh Ekstrak Etilasetat terhadap Kebocoran Sel S. aureus selama
Fase Eksponensial ……….. 213 44 Pengaruh Ekstrak Etilasetat terhadap Kebocoran Sel S. aureus selama
Fase Stasioner………….……….. 213 45 Pengaruh Ekstrak Metanol terhadap Kebocoran Sel S. aureus selama
Fase Eksponensial ……….. 213 46 Pengaruh Ekstrak Metanol terhadap Kebocoran Sel S. aureus selama
Fase Stasioner….. ……….. 213 47 Pengaruh Ekstrak Etilasetat terhadap Kebocoran Sel S. Typhimurium
selama Fase Eksponensial ……… 214 48 Pengaruh Ekstrak Etilasetat terhadap Kebocoran Sel S. Typhimurium
selama Fase Stasioner…… ……….. 214 49 Pengaruh Ekstrak Metanol terhadap Kebocoran Sel S. Typhimurium
selama Fase Eksponensial ……….. 214 50 Pengaruh Ekstrak Metanol terhadap Kebocoran Sel S. Typhimurium
selama Fase Stasioner….. ……….. 214 51 Pengaruh Ekstrak Etilasetat 2% terhadap Hidrofobisitas B. cereus
pada Hidrokarbon n-Oktana ………. 215 52 Pengaruh Ekstrak Etilasetat 4% terhadap Hidrofobisitas B. cereus
pada Hidrokarbon n-Oktana ………. 215 53 Pengaruh Ekstrak Etilasetat 6% terhadap Hidrofobisitas B. cereus
pada Hidrokarbon n-Oktana ………. 215 54 Pengaruh Ekstrak Metanol 2% terhadap Hidrofobisitas B. cereus
pada Hidrokarbon n-Oktana ………. 216 55 Pengaruh Ekstrak Metanol 4% terhadap Hidrofobisitas B. cereus
pada Hidrokarbon n-Oktana ………. 216 56 Pengaruh Ekstrak Metanol 6% terhadap Hidrofobisitas B. cereus
pada Hidrokarbon n-Oktana ………. 216 57 Pengaruh Ekstrak Etilasetat 2% terhadap Hidrofobisitas S. aureus
58 Pengaruh Ekstrak Etilasetat 4% terhadap Hidrofobisitas S. aureus
pada Hidrokarbon n-Oktana ………. 217 59 Pengaruh Ekstrak Etilasetat 6% terhadap Hidrofobisitas S. aureus
pada Hidrokarbon n-Oktana ………. 217 60 Pengaruh Ekstrak Metanol 2% terhadap Hidrofobisitas S. aureus
pada Hidrokarbon n-Oktana ………. 218 61 Pengaruh Ekstrak Metanol 4% terhadap Hidrofobisitas S. aureus
pada Hidrokarbon n-Oktana ………. 218 62 Pengaruh Ekstrak Metanol 6% terhadap Hidrofobisitas S. aureus
pada Hidrokarbon n-Oktana ………. 218 63 Pengaruh Ekstrak Etilasetat 2% terhadap Hidrofobisitas
S. Typhimurium pada Hidrokarbon n-Oktana ……… 219 64 Pengaruh Ekstrak Etilasetat 4% terhadap Hidrofobisitas
S. Typhimurium pada Hidrokarbon n-Oktana………. 219 65 Pengaruh Ekstrak Etilasetat 6% terhadap Hidrofobisitas
S. Typhimurium pada Hidrokarbon n-Oktana………. 219 66 Pengaruh Ekstrak Metanol 2% terhadap Hidrofobisitas
S. Typhimurium pada Hidrokarbon n-Oktana………. 220 67 Pengaruh Ekstrak Metanol 4% terhadap Hidrofobisitas
S. Typhimurium pada Hidrokarbon n-Oktana………. 220 68 Pengaruh Ekstrak Metanol 6% terhadap Hidrofobisitas
Latar Belakang
Penelitian mengenai aktivitas antibakteri telah banyak dilakukan terutama terhadap berbagai jenis tanaman rempah-rempah. Rempah -rempah dan beberapa jenis tanaman secara empiris mempunyai aktivitas antibakteri dan secara tradisional juga banyak digunakan sebagai alternatif pengobatan. Sediaan berbentuk segar, ekstrak, dan minyak atsiri digunakan sebagai obat, seperti antiradang, analgesik dan antidiare.
Beberapa penelitian mengenai aktivitas antibakteri dari tanaman, baik dalam bentuk ekstrak maupun minyak atsiri, menunjukkan bahwa banyak tanaman yang mempunyai aktivitas antibakteri terhadap bakteri patogen dan perusak bahan pangan. Beberapa diantaranya adalah sereh (Cepeda 2005), biji atung (Moniharopan 1998; Syamsir 2001; Murhadi 2002), daun beluntas (Ardiansyah 2003) dan ekstrak annato (Cuspinera et al. 2003).
Andaliman (Zanthoxylum acanthopodium DC) merupakan jenis tanaman rempah yang sering digunakan sebagai bumbu pada beberapa masakan khas Sumatera Utara, khususnya masyarakat Tapanuli. Andaliman telah lama dipergunakan oleh suku batak sebagai bumbu campuran masakan untuk berbagai jenis makanan, seperti ikan mas arsik (masakan gulai ikan mas tanpa santan),
natinombur (ikan yang dipanggang dengan bumbu sambal andaliman) dan
sangsang (daging yang dimasak dengan bumbu rempah andaliman). Bumbu andaliman memberikan citarasa khas pada makanan yang dapat membangkitkan selera makan dan memperpanjang umur simpan produk pangan tersebut. Penelitian yang dilakukan oleh Parhusip et al. (1999), Ardiansyah (2001) dan Yasni (2001) menunjukkan bahwa bubuk dan ekstrak andaliman bersifat antimikroba.
Minyak atsiri andaliman sebesar 7.15% (w/v) ternyata efektif menghambat bakteri Gram positif (Bacillus cereus dan Staphylococcus aureus) dan bakteri Gram negatif (Pseudomonas) serta menghambat beberapa jenis kapang seperti
2
Analisis minyak atsiri andaliman dengan GC-MS (Gas Chromatography– Mass Spectrophotometer) menunjukkan minimal terdapat 11 komponen dengan 5 komponen utama yang dapat diidentifikasi (Wiley 229 Library). Kelima komponen tersebut adalah alfa-pinen, limonen, geraniol, sitronella dan geranil asetat (Yasni 2001). Komponen aktif alfa-p inen dan limonen memiliki aktivitas antibakteri menghambat pertumbuhan bakteri patogen (Cosentino et al. 2003).
Ardiansyah (2001) mengekstrak andaliman menggunakan metode maserasi dan metode refluks dengan pelarut nonpolar (heksana), semipolar (etilasetat) dan polar (metanol). Masing-masing jen is ekstrak ternyata memiliki daya penghambatan yang berbeda-beda terhadap bakteri patogen. Ekstrak heksana andaliman dengan menggunakan metode maserasi lebih efektif menghambat pertumbuhan sel B. cereus (8.06 mm/0.05 gram ekstrak), d ibandingkan dengan metode refluks pada bakteri yang sama (5.75 mm/0.05 gram ekstrak). Ekstrak etilasetat andaliman dengan metode maserasi efektif menghambat S. aureus
(10.62 mm/0.05 gram ekstrak) dan dengan metode refluks efektif menghambat B. cereus (6.3 mm/0.05 gram ekstrak). Ekstrak metanol dengan metode maserasi lebih efektif menghambat S. Typhimurium (16.25 mm/ 0.05 gram ekstrak) dan dengan metode refluks paling besar penghambatannya terhadap
E. coli (8.85 mm/0.05 gram ekstrak).
Berdasarkan hasil penelitian terdahulu bahwa andaliman berpotensi untuk digunakan sebagai bahan pengawet alami makanan. Untuk tujuan ini, masih perlu dilakukan penelitian mengenai mekanisme kerusakan bakteri patogen oleh ekstrak andaliman. Sehingga dapat diperoleh informasi yang len gkap yang diperlukan untuk aplikasinya pada makanan.
Tujuan Penelitian
Tujuan khusus dari penelitian ini adalah untuk:
1. Mengetahui pengaruh polaritas ekstrak andaliman terhadap aktivitas antibakteri pada B. cereus, S. aureus dan S. Typhimurium selama fase pertumbuhan.
2. Mengetahui pengaruh ekstrak andaliman terhadap sifat hidrofobisitas dan kerusakan dinding sel bakteri B. cereus, S. aureus dan S. Typhimurium. 3. Mengetahui aktivitas penghambatan ekstrak andaliman terhadap
permeabilitas membran sel B. cereus, S. aureus dan S. Typhimurium. 4. Menget ahui aktivitas penghambatan ekstrak andaliman melalui inaktivasi
enzim protease dari B. cereus, S. aureus dan S. Typhimurium.
5. Mengetahui pengaruh ekstrak etilasetat dan ekstrak metanol andaliman terhadap kerusakan morfologi sel bakteri patogen.
Manfaat Penelitian
Pada hasil penelitian ini akan dapat dilihat beberapa fenomena yang menunjukkan beberapa mekanisme penghambatan ekstrak andaliman terhadap pertumbuhan beberapa bakteri patogen sel vegetatif dan spora. Dari hasil tersebut pemanfaatan ekstrak andaliman sebagai salah satu tanaman indigenous Indonesia dapat ditingkatkan, baik tetap sebagai bumbu masakan tradisional Tapanuli, maupun lebih lanjut dikembangkan sebagai industri bahan pengawet alami dalam rangka meningkatkan keamanan pangan. Dengan demikian nilai ekonomis tanaman ini akan meningkat, dan sekaligus dapat mencegah kepunahan tanaman tersebut, karena penggunaannya dalam masakan tradisonal mulai ditinggalkan masyarakat yang cenderung lebih mengutamakan kepraktisan.
Secara spesifik penelitian ini mempunyai beberapa manfaat yaitu:
4
(2) Dari perspektif praktikal, hasil penelitian ini diharapkan dapat dijadikan sebagai dasar untuk meningkatkan nilai ekonomis tanaman andaliman, dengan meningkatkan dan mengembangkan pemanfaatannya sebagai sumber bahan pengawet alami. Hal ini penting, terutama sebagai upaya Pemerintahan Daerah dalam meningkatkan pemanfaatan potensi dan produk unggulan daerah, yang sekaligus mendukung program keamanan pangan yang digalakkan oleh Pemerintah.
(3) Bagi dunia bisnis di Indonesia, hasil penelitian ini dapat dijadikan informasi dasar dalam mengembangkan produk bahan pengawet alami yang siap pakai, khususnya industri yang bergerak di bidang bumbu dan flavor. Dengan demikian perusahaan dapat berkontribusi pada peningkatan budidaya tanaman andaliman, dan pada gilirannya dapat berkontribusi pada peningkatan pendapatan masyarakat, khususnya di daerah Tapanuli.
Hipotesis
Hipotesis mekanisme antibakteri ekstrak andaliman terhadap bakteri patogen dalam penelitian ini adalah :
1. Komponen ekstrak andaliman dengan polaritas dan konsentrasi berbeda akan menghasilkan aktivitas antibakteri yang berbeda pada setiap fase pertumbuhan dan jenis bakteri patogen.
2. Aktivitas antibakteri ekstrak andaliman terhadap pertumbuhan bakteri patogen dipengaruhi oleh pH medium yaitu pH 4- pH7.
3. Ekstrak andaliman dapat mengubah sifat hidrofobisitas sel.
4. Ekstrak andaliman dapat menghambat pertumbuhan spora dan protoplast bakteri patogen.
5. Ekstrak andaliman menyebabkan terjadinya kebocoran komponen protein dan asam nukleat sel.
6. Ekstrak andaliman dapat menginaktifkan protease ekstraseluler bakteri patogen .
Botani Andaliman (Zanthoxylum acanthopodium DC)
Tanaman andaliman adalah tanaman rempah yang tumbuh di pegunungan kawasan Danau Toba dan sekitarnya. Diduga penyebaran tanaman secara liar melalui media kotoran burung. Burung memakan buah andaliman, kemudian melalui kotoran burung tersebut biji andaliman tersebar kemana-mana dan tumbuh secara liar. Menurut Hasairin (1994) dan Siregar (2003), andaliman mempunyai ciri-ciri berperawakan perdu, tegak dengan tinggi 3-8 meter, batang dan cabang merah kasar beralur, berbulu halus dan berduri (Gambar 2.1).
Gambar 2.1 (a) Tanaman Andaliman Terdiri Batang, Cabang, Ranting Berduri (b) Buah Andaliman
Buah andaliman berbentuk bulat kecil berwarna hijau, bila digigit mengeluarkan aroma wangi dan ada rasa getir yang tajam dan khas, serta dapat merangsang produksi air liur. Menurut Sirait et al. (1991) masyarakat Himalaya, Tibet dan sekitarnya menggunakan tumbuhan ini dalam produk pangan sebagai bahan aromatik, perangsang nafsu makan dan sebagai obat sakit perut.
Tumbuhan andaliman berasal dari daerah Himalaya Subtropis, dan distribusi dari tanaman ini terdapat di India Timur, Nepal, Pakistan Timur, Myanmar, Thailand, China, Sumatera Utara dan Jepang (Hsuan Keng 1978). Di Sumatera Utara tanaman ini tumbuh liar pada berbagai tempat, yaitu di daerah Humbang, Silindung, Dairi dan Toba Holbung. Aroma dan rasa yang khas bumbu ini tidak dapat ditinggalkan bagi orang yang telah terbiasa memakannya.
6
Menurut Hsuan Keng (1978) tanaman andaliman dengan nama latin
Zanthoxylum acanthopodium DC dapat diklasifikasikan sebagai berikut: Divisi : Spermatophyta
Sub divisi : Angiospermae Kelas : Dicotyledonae Ordo : Geraniales Famili : Rutaceae Marga : Zanthoxylum
Spesies : Zanthoxylum acanthopodium DC.
Pemanfaatan andaliman sebagai sambal atau bumbu masakan berbagai jenis masakantradisional suku Batak semakin menurun dengan bergesernya pola makan dan gaya hidup masyarakat yang cenderung menginginkan serba praktis. Selama ini telah banyak upaya untuk membudidayakan tanaman andaliman, tetapi tidak menunjukkan hasil yang memuaskan karena sulit tumbuh, walaupun ada yang dapat tumbuh tetapi tidak berbuah. Pengembangbiakan melalui biji tidak berlangsung baik, walaupun perlakuan-perlakuan fis ik dan kimia telah diteliti. Penelitian yang dilakukan Sirait et al. (1991) melaporkan bahwa dari 74 biji andaliman yang dicangkok ternyata hanya ada 7 yang menumbuhkan akar. Cara yang tepat untuk pengembangbiakan tanaman andaliman sampai saat ini belum diketahui. Penelitian ini merupakan dasar pemikiran untuk pengajuan manfaat pengembangan tanaman andaliman pada Pemerintah Daerah.
Di sekitar kawasan Danau Toba Sumatera Utara terdapat tiga jenis varietas tanaman andaliman yaitu :
1. Sihorbo - tanaman andaliman dengan bentuk buah besar, kurang aromatik dan produksi rendah
2. Simanuk - tanaman andaliman dengan bentuk buah kecil, aroma dan rasa lebih tajam dari Sihorbo, dan produksi lebih tinggi
Senyawa Antibakteri dari Bahan Tanaman
Pada beberapa bagian tanaman mengandung senyawa yang dapat bersifat sebagai antibakteri. Senyawa tersebut diproduksi secara biologis oleh tanaman, dan dapat menghambat pertumbuhan dan aktivitas mikroba (Nychas 1995). Senyawa antibakteri yang dewasa ini banyak dikenal sebagai bahan pengawet merupakan senyawa kimia yang mempunyai kemampuan menghambat pertumbuhan bakteri (bakteristatik) atau membunuh bakteri (bakterisidal) (Surekha dan Reddy 2000).
Beberapa bahan lain seperti gula, garam, vinegar, rempah -rempah atau ekstrak minyak dari rempah-rempah, zat -zat dari pengasapan kayu merupakan bahan-bahan yang tidak tergolong dalam bahan pengawet kimia atau sintetik menurut definisi dari Food and Drug Administration (FDA). Pemilihan jenis antimikroba yang cocok tergantung dari beberapa faktor, yaitu sifat-sifat antimikroba yang digunakan, sifat dan komposisi produk pan gan yang akan diawetkan, tipe sistem pengawetan lain yang ada pada bahan pangan, karakteristik dan jumlah mikroorganisme awal, serta keamanan dan harga (Branen 1993).
Senyawa kimia yang digunakan untuk mencegah kerusakan pangan memiliki sifat antiseptik pada kondisi tertentu. Jenis senyawa kimia yang banyak digunakan sebagai bahan pengawet karena mempunyai daya antimikroba antara lain adalah sulfit, nitrat dan nitrit. Senyawa biologis yang mempunyai aktivitas antimikroba digolongkan dalam 3 kelompok, yaitu (1) senyawa antimikroba alami yang berasal dari mikroorganisme seperti bakteriosin; (2) senyawa antimikroba alami yang berasal dari hewan seperti fagosom, antibiotik, peptida, avidin, sistem laktoperoksidase dan lisozim; (3) senyawa antimikroba alami yang berasal dari tanaman seperti fitoaleksin, asam organik, minyak atsiri, senyawa fenolik, pigmen dan senyawa kerabatnya (Gould 1995).
8
Golongan Fenolik
Senyawa fenolik merupakan substansi yang mempunyai satu cincin aromatik dengan satu atau lebih substitusi gugus hidroksi (-OH) yang termasuk turunan fungsional. Senyawa fenol cenderung mudah larut dalam air karena umumnya akan berikatan dengan gula sebagai glikosida, dan biasanya terdapat dalam vakuola sel. Senyawa ini diklasifikasikan menjadi tiga kelompok, yaitu (1) golongan fenol sederhana (vanilin, gingerol, shogaol, guaiakol dan eugenol); asam fenol (p-kresol, 3-etilfenol, hidrokuinon dan asam galat); (2) turunan asam hidroksinamat (p-kumarin, kafein dan firulin); (3) flavonoid (antosianin, flavonon, flavonol dan tanin) (Nychas 1995; Shahidi dan Naczk 1995).
Beberapa senyawa fenolik yang bersifat antibakteri, seperti senyawa fenol sederhana, gingerol dan turunannya dapat menghambat pertumbuhan
Mycobacterium avium dan M. tuberculosis (Hiserodt et al.1998). Eugenol yang juga merupakan fenol sederhana dapat menghambat pertumbuhan Bacillus subtilis. Golongan fenolik dari turunan hidroksinamat seperti kafein diketahui dapat menghambat pertumbuhan Listeria monocytogenes (Conner 1993). Golongan fenolik pada flavonol seperti katekin dapat menghambat pertumbuhan
V. cholerae dan aktivitas toksin yang dihasilkan (Toda et al. 1991).
Kondisi-kondisi yang dapat mempengaruhi aktivitas antibakteri adalah struktur fungsional pada senyawa-senyawa fenolik sederhana, diantaranya: (1) adanya peningkatan ikatan gugus n-alkil (<C5) dalam senyawa yang dapat
meningkatkan aktivitas antibakteri, (2) posisi ikatan gugus alkil diduga juga dapat mempengaruhi aktivitas antibakteri, (3) turunan -turunan polihidroksi umumnya lebih kecil pengaruhnya dibandingkan dengan komponen monohidroksi, dan (4) pemisahan gugus alkil dengan oksigen (contohnya metoksi-) dari senyawa fenolik dapat menurunkan aktivitas antibakteri (Branen dan Davidson 1993 ). Sebagian besar senyawa-senyawa golongan fenolik dalam bentuk glikosida-glikosida cenderung bersifat polar, karena adanya gugus-gugus hidroksil (-OH) pada struktur dasar senyawa fenolik, sehingga mudah larut dalam pelarut polar seperti etanol, metanol, dan air (Houghton dan Raman 1998).
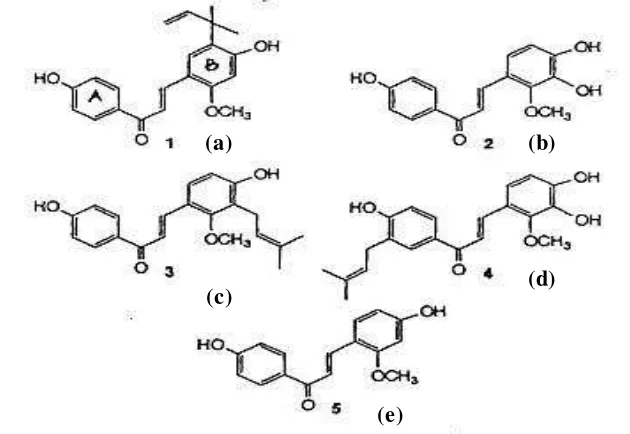
Senyawa-senyawa flavonoid yang memiliki aktivitas antimikroba, seperti:
(Gambar 2.2) yang diisolasi dari akar tanaman Glycyrrhiza inflata, digolongkan ke dalam retrochalcone yaitu khalkon dengan gugus oksigen pada posisi ikatan -2.
Gambar 2.2 Struktur licochalcone A (a), licochalcone B (b), licochalcone C (c),
licochalcone D (d), dan echinatin (e) (Haraguchi et al. 1998).
Senyawa retrochalcone seperti licochalcone A (Gambar 2.2-a) dan
licochalcone C (Gambar 2.2-c) terbukti memiliki aktivitas antibakteri yang tinggi khususnya terhadap bakteri-bakteri Gram positif seperti sel S. aureus, M. luteus
dan B. subtilis dengan nilai MIC rata-rata 5.21 µg/ml. Hal ini erat kaitannya dengan keberadaan gugus prenil pada cincin B struktur retrochalcone yang lebih bersifat hidrofobik, sehingga memudahkan licochalcone A dan licochalcone C berpenetrasi ke dalam membran sel bakteri dibandingkan dengan licochalcone B dan licochalcone D yang lebih bersifat hidrofilik akibat adanya dua gugus hidroksil (-OH) tanpa adanya gugus prenil pada cincin B. Selanjutnya
licochalcone A dan licochalcone C yang berpenetrasi ke dalam membran sel bakteri akan mengganggu sistem transport elektron (O2) dengan cara menghambat
NADH oksidase pada membran sel yang mengakibatkan penghambatan proses -proses respirasi sel bakteri secara keseluruhan (Haraguchi et al. 1998).
(b)
(c) (d)
10
Golongan Terpenoid
Golongan terpenoid dikenal sebagai senyawa utama pada tanaman yang bersifat sebagai penyusun minyak atsiri. Terpenoid mempunyai rumus dasar yaitu: (C5H8)n atau dengan nama lain adalah isoprene-2 metil-2,3 butadiena (Teisser
1994). Golongan terpenoid yang mempunyai aktivitas antibakteri antara lain adalah borneol, sineol, pinene, kamfene, dan kamfor (Conner 1993), nerelidol, linalool, indol dan kadinen (Kubo et al. 1993) dan jus apel (Friedman et al.
2004a). Golongan senyawa ini efektif untuk menghambat pertumbuhan B. subtilis, S. aureus, Salmonella enterica dan E. coli.
Sebagian senyawa-senyawa antibakteri dalam tanaman terdapat dalam fraksi minyak atsiri yang diperoleh dari bahan tanaman melalui destilasi uap atau dengan perlakuan dingin dan destilasi vakum, serta ekstraksi dengan pelarut-pelarut organik (Reineccius 1994). Minyak atsiri (essential oils) didefenisikan sebagai suatu kelompok dari senyawa berbau (odorus), larut dalam alkohol, terdiri dari campuran eter, aldehida, keton, dan terpen (Nychas dan Tassou 2000). Minyak atsiri umumnya merupakan gabungan kelompok-kelompok senyawa volatil yang membentuk aroma spesifik dari spesies tanaman tertentu. Kelompok-kelompok senyawa kimia yang terkandung dalam minyak atsiri, diantaranya adalah: (a) hidrokarbon dengan formula kimia (C5H8)n, sebagai senyawa terpen
rendah seperti monoterpen, diterpen dan seskuiterpen; (b) turunan oksigenasi dari senyawa-senyawa terpen diatas; (c) senyawa-senyawa aromatik dengan struktur benzoid; dan/atau (d) senyawa-senyawa yang mengandung nitrogen atau sulfur (Reineccius 1994). Secara kimia, terpenoid umumnya larut dalam lemak dan terdapat di dalam sitoplasma sel tumbuhan. Kebanyakan terpenoid alam mempunyai struktur siklik dan mempunyai satu gugus fungsi atau lebih (hidroksil, karbonil, dan lain-lain) sehingga pada langkah akhir sintesis terjadi siklisasi dan oksidasi atau pengubahan struktur lainnya (Harbone 1996). Secara rinci golongan utama terpenoid tumbuhan dapat dilihat pada Tabel 2.1.
Senyawa terpen merupakan senyawa antibakteri utama dalam rempah -rempah (Naidu dan Davidson 2000). Senyawa antibakteri aktif dalam sage dan
monoterpen alkohol dan senyawa sesquiterpen alkohol seperti citronelal, geraniol, linalool dan nerol terdapat pada sebagian besar minyak atsiri (Oyen dan Nguyen 1999). Senyawa-senyawa terpen ini telah dibuktikan memiliki sifat antibakteri terhadap Campylobacter jejuni, E. coli, L. monocytogenes dan Salmonella enterica (Friedman et al. 2002).
Tabel 2.1 Golongan Utama Terpenoid Tumbuhan Jumlah Jumlah Golongan Jenis utama dan sumbernya Satuan karbon
Isoprena
1 C5 Isoprena dideteksi dalam daun Hamamelis japobica
2 C10 Monoterpenoid monoterpena dalam minyak atsiri
monoterpena lakton tropolon 3 C15 Seskuiterpenoid seskuiterpena dalam minyak atsiri
seskuiterpena lakton absisin
4 C20 Diterpenoid asam diterpena dalam damar tumbuhan
giberelin
6 C30 Triterpenoid sterol, triterpena, saponin, glikosida
8 C40 Tetraterpenoid karotenoid
n Cn Poliisoprena karet
Sumber : Harbone 1996
Golongan Alkaloid
Secara umum alkaloid merupakan metabolit basa yang mengandung nitrogen dan banyak sekali ragamnya termasuk struktur kimianya. Sebagian besar alkaloid dibentuk dari asam-asam amino seperti lisin, ornitin, fenilalanin, tirosin dan triptofan, serta kerangka asam-asam amino tersebut sebagian besar masih tetap dalam struktur senyawa-senyawa alkaloid dan turunannya (Herbert 1988). Banyak jenis alkaloid yang bersifat terpenoid atau sebagai terpenoid termodifikasi. Beberapa jenis lainnya berupa senyawa aromatik seperti kolkhisina yang mengandung gugus basa sebagai gugus rantai samping (Harbone 1996).
12
alkaloid dari akar tanaman Aphelandra fuscopunctata (Youhnovsky et al. 1999). Saat ini, hanya ada beberapa kelompok peneliti yang telah berhasil menemukan senyawa-senyawa antimikroba dan/atau antibakteri dari alkaloid tanaman, diantaranya adalah: Bhattacharyya et al. (1993), Chakraborty et al. (1995), dan Ramsewak et al (1999). Dari ketiga kelompok peneliti tersebut, semuanya menemukan senyawa-senyawa antibakteri dari alkaloid tanaman yang termasuk dalam kelompok senyawa alkaloid karbazol sebagai struktur dasar.
Secara umum alkaloid merupakan metabolit basa yang mengandung nitrogen dan banyak sekali ragamnya termasuk struktur kimianya (Mann 1996). Aktivitas senyawa-senyawa alkaloid atau senyawa yang mengandung N dari tanaman sebagai senyawa antibakteri, belum banyak diketahui. Salah satu yang telah diketah ui mempunyai aktivitas antibakteri adalah senyawa alkaloid karbazol. Senyawa antibakteri alkaloid karbazol terbukti memiliki aktivitas antibakteri, diantaranya adalah (a) 3-metil-6,7 -metilenadioksidakarbazol, (b) 1,8-d imetoksi-3-formilkarbazol dan (c) beberapa senyawa alkaloid karbazol. S enyawa 3-metil-6,7-metilenadioksidakarbazol (C14H11NO2), bersifat antibakteri kuat dengan nilai MIC
terhadap B. subtilis sebesar 15 µg/ml, E. coli 25 µg/ml, dan S. aureus 33 µg/ml. Senyawa ini diisolasi dari fraksi netral ekstrak dietileter kulit kayu tanaman
Clausena heptaphylla (Bhattacharyya et al. 1993). Senyawa 1,8-d imetoksi-3-formilkarbazol (C15H13NO3), merupakan senyawa antibakteri dan antikapang yang
kuat dengan nilai MIC terhadap S. aureus 6 µg/ml, C. albicans 8 µg/ml,
P. aeruginosa dan S. Typhimuriumsebesar 25 µg/ml, diisolasi dari fraksi netral ekstrak etanol daun tanaman Clausena heptaphylla (Chakraborty et al. 1995). Beberapa senyawa alkaloid karbazol lain seperti mahanimbina, mahanina, dan murayanol, diisolasi dari ekstrak aseton daun tanaman Murraya koenigii, terbukti memiliki aktivitas antibakteri, khususnya terhadap S. aureus, E. coli, dan
Streptococcus pyogenes (Ramsewak et al. 1999).
Penghambatan bakteri oleh suatu senyawa antibakteri dinyatakan dengan nilai Minimum Inhibitory Concentration (MIC) yaitu konsentrasi minimum yang dapat menghambat pertumbuhan bakteri lebih dari 90%, sedangkan nilai
selama inkubasi 24 jam (Baron et al. 1995; Carson dan Riley 1995). Nilai MIC dan MBC senyawa antibakteri ekstrak rempah -rempah maupun tanaman lainnya berbeda-beda tergantung pada jenis mikroba. Nilai MIC senyawa antibakteri yang lebih rendah menunjukkan bakteri lebih rentan terhadap komponen tersebut.
Ekstraksi Komponen Bioaktif
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Senyawa aktif yang terdapat dalam berbagai bahan alami dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain -lain. Struktur kimia yang berbeda-beda akan mempengaruhi kelarutan dan stabilitas senyawa-senyawa tersebut terhadap pemanasan, udara, cahaya, logam berat dan derajat keasaman. Dengan diketahuinya senyawa aktif yang terkandung dalam bahan akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Departemen Kesehatan 2000).
Beberapa metode ekstraksi yang d ilakukan tergantung pada beberapa faktor, antara lain: (1) tujuan dilakukan ekstraksi, (2) skala ekstraksi, (3) sifat-sifat komponen yang akan di ekstraksi, dan sifat-sifat pelarut yang akan digunakan (Houghton dan Raman 1998). Prinsip metode ekstraksi men ggunakan pelarut organik adalah bahan yang akan diekstrak kontak langsung dengan pelarut pada waktu tertentu, kemudian diikuti dengan melakukan pemisahan dari bahan yang telah diekstrak. Metode ekstraksi dengan refluks pelarut organik pada dasarnya adalah ekstraksi dengan pengadukan yang dilakukan pada suhu cukup tinggi (60-700C) dan dilengkapi dengan kondensor (Adawiyah 1998).
14
Tabel 2.2 Beberapa Bagian Tanaman yang Bersifat Antimikroba
Bagian dan
jenis tanaman Ekstraksi Bakteri yang dihambat Pustaka
Biji
Lada Ekstrak metanol S. aureus, C. albican Sutedja dan
Agustina 1994
Atung Ekstrak etilasetat S. aureus, P. fluorescens Moniharapon 1991;
Murhadi 2002; Lavlinesia 2004
Buah
Andaliman Ekstrak heksana
Ekstrak etilasetat
Ekstrak metanol
E. coli, A. flavus, Fusarium S. aureus, P. fluorescens,
S. Typhimurium, E. coli,
P. fluorescens B.stearothermophilus
S. Typhimurium,
Mulia 2000 Ardiansyah 2001
Mobe Ekstrak heksana
Ekstrak etilasetat
Ekstrak metanol
E. coli, A. flavus, Fusarium S. aureus, P. fluorescens,
S. Typhimurium, E. coli,
P. fluorescens B.stearothermophilus
S. Typhimurium,
Yasni et al. 2004
Rimpang
Lengkuas Ekstrak metanol V. cholerae, S. aureus,
L. monocytogenes
Rahayu 1999
Daun
Teh Ekstrak metanol Streptococcus mutan Sakanaka et al.
1989
Sirih Ekstrak metanol E. coli, S. Typhimurium,
S. aureus. L. monocytogenes Sukarminah 1997
Pemilihan pelarut organik yang akan digunakan dalam ekstraksi komponen bioaktif tanaman merupakan faktor penting dan menentukan untuk mencapai tujuan dan sasaran ekstraksi komponen. Beberapa pelarut yang dapat digunakan dalam ekstraksi dapat dilihat pada Tabel 2.3. Semakin tinggi nilai polaritas, konstanta dielektrik, titik didih dan kelarutan dalam air maka pelarut akan semakin polar.
sinambung dengan alat soxhlet, yang merupakan cara yang cepat dan hemat (Hostettmann et al. 1997).
Tabel 2.3 Beberapa Sifat Pelarut Organik Untuk Ekstraksi
Pelarut
Polaritas
(e) a)
Konstanta dielektrik
(Debye) b) Titik didih (0C) a)
Kelarutan dalam air
(%) b)
• Karbondioksida 0.00 - -56.60 -
• Pentana 0.00 1.84 36.20 0.010
• Heksana* 0.00 2.00 68.70 0.010
• Toluen* 0.29 2.40 11.06 0.046
• Benzen* 0.32 2.30 80.10 0.058
• Etilasetat 0.38 6.00 77.10 9.800
• Aseton 0.47 20.70 56.20 larut
• Propan-2-ol (IPA) 0.63 18.30 82.30 larut
• Etanol 0.68 24.30 78.30 larut
• Metanol* 0.73 32.60 64.80 larut
• Air 0.90 78.50 100.00
a)
Moyler (1995 ); b)Houghton dan Raman (1998); * bukan pelarut bahan pangan
Sifat penting yang harus diperhatikan adalah kepolaran senyawa dilihat dari gugus polarnya (seperti gugus OH, COOH dan lain -lain). Senyawa polar lebih mudah larut dalam pelarut polar dan senyawa nonpolar lebih mudah larut dalam pelarut nonpolar. Derajat polaritas tergantung pada tetapan dielektrik, makin besar tetapan dielektrik semakin polar pelarut tersebut. Ekstraksi bertingkat dilakukan secara berturut-turut dimulai dengan pelarut nonpolar (heksana) lalu dengan pelarut yang kepolarannya menengah (etilasetat atau dietileter), kemudian dengan pelarut polar (metanol atau etanol). Dengan cara demikian akan diperoleh ekstrak awal (crude extract) yang mengandung berturut-turut senyawa nonpolar, kepolaran menengah dan polar (Hostettmann et al. 1997).
Bakteri Uji Aktivitas Antibakteri
16
Bakteri Pembentuk Spora
Bacillus cereus merupakan bakteri penyebab keracunan yang terjadi di Eropa sejak tahun 1906 (Jay 1996). Bakteri ini berbentuk batang, bersifat aerob sampai aerob fakultatif, katalase positif dan kebanyakan bersifat Gram positif.
B. cereus dapat tumbuh pada suhu minimum 4-50C, suhu maksimum 48-500C, dan suhu optimal pertumbuhannya 30 -450C, serta pada pH antara 4.9-9.3 (Jay 1996; Granum dan Baird-Parker 2000). Bakteri ini memproduksi spora tahan panas dan tahan radiasi, dan tetap aktif setelah pemanasan selama 4 jam pada suhu 1350C (Cary et al. 2000).
Bacillus cereus dapat menyebabkan beberapa penyakit infeksi dan intoksikasi. Spora sel B. cereus bertunas dan sel vegetatif menghasilkan toksin selama fase eksponensial pertumbuhan atau selama masa sporulasi. Munculnya diare terjadi setelah masa inkubasi 1-24 jam dan terlihat sebagai diare yang terus menerus disertai nyeri dan kejang perut; jarang terjadi demam dan muntah. Enterotoksin dapat ditemukan pada bahan pangan atau dibentuk dalam usus (Granum dan Baird -Parker 2000).
Dua galur B. cereus (CIP 51.27 dan Z 4234) merupakan bakteri yang paling sensitif diantara bakteri Gram positif dengan nilai MIC dan Minimum Lethal Concentration (MLC) pada ekstrak rosemary masing-masing sama yaitu konsentrasi 6 mmol/l (Campo et al. 2000). Contoh lainnya adalah karvakrol yang banyak terdapat pada oregano (Origanum vulgare) dapat mematikan B. cereus
pada konsentrasi 1 mmol/l, sedangkan konsentrasi minimun yang dapat menghambat pertumbuhan B. cereus adalah 0.75 mmol/l (Ultee et al. 1998).
Bakteri Gram positif
S. aureus pada ekstrak rosemary dengan konsentrasi 0.25-1.0% dapat menghambat dan bersifat bakterisidal (Campo et al. 2000). Bakteri Gram positif seperti S. aureus dan L. monocytogenes lebih sensitif terhadap 21 jenis minyak atsiri tumbuh-tumbuhan, seperti minyak kayu putih, kayu manis, cengkeh dibandingkan bakteri Gram negatif seperti Salmonella enteritidis dan E. coli
(Palmer et al. 1998).
Suhu optimum pertumbuhan S. aureus adalah 35-370C, suhu minimum 6.70C dan suhu maksimum 45.50C. Bakteri ini dapat tumbuh pada pH 4.0-9.8 dengan pH optimum sekitar 7.0-7.8. Pertumbuhan pada pH mendekati 9.8 hanya mungkin bila substratnya mempunyai komponen yang baik untuk pertumbuhannya (Supardi dan Sukamto 1999).
Bakteri Gram negatif
Salmonella Typhimurium merupakan bakteri patogen Gram negatif yang banyak menimbulkan gangguan kesehatan manusia. Salmonella Typhimurium merupakan bakteri Gram negatif, selnya berbentuk batang, dan tidak membentuk spora. Bakteri ini bersifat motil dan flagella peritrikat, menghasilkan asam hasil fermentasi dari glukosa, maltosa, manitol, dan sorbitol. Bakteri ini menggunakan sitrat sebagai sumber karbon, tidak dapat memfermentasi salisin, selulosa dan laktosa (Jay 1996). Salmonella Typhimurium tumbuh dengan suhu optimum 370C, meskipun dapat tumbuh pada suhu dibawah 100C, dan pH optimum pertumbuhan adalah 6.5-7.5 walaupun dapat tumbuh pada interval pH 4.5-9.0.
Salmonella mempunyai ketahanan panas yang tinggi pada pH 5.5, aw rendah, dan
terdapat pada makanan dengan kandungan lemak tinggi, serta viabilitasnya akan menurun selama penyimpanan beku (Portillo 2000).
Mekanisme Kerja Penghambatan Senyawa Antibakteri
18
Pengaruh komponen antibakteri terhadap sel bakteri dapat menyebabkan kerusakan sel yang berlanjut pada kematian. Kerusakan sel yang ditimbulkan komponen antibakteri dapat bersifat mikrosidal (kerusakan bersifat tetap) atau mikostatik (kerusakan yang dapat pulih kembali). Suatu komponen akan bersifat mikrosidal atau mikostatik tergantung pada konsentrasi komponen dan kultur yang digunakan (Bloomfield 1991).
Penghambatan aktivitas mikroba oleh komponen bioaktif tanaman dapat disebabkan oleh beberapa faktor, antara lain: (1) gangguan pada senyawa penyusun dinding sel, (2) peningkatan permeabilitas membran sel yang menyebabkan kehilangan komponen penyusun sel, (3) menginaktifasi enzim metabolik, dan (4) destruksi atau kerusakan fungsi material genetik (Brannen dan Davidson 1993). Menurut Kanazawa et al. (1995) terjadinya proses tersebut diatas karena pelekatan senyawa antimikroba pada permukaan sel mikroba atau senyawa tersebut berdifusi ke dalam sel.
Fase pertumbuhan bakteri berpengaruh pada kerentanan bakteri terhadap senyawa antibakteri. Menurut Thomson dan Hinton (1996) bakteri pada fase stasioner lebih rentan terhadap antibakteri asam lemak rantai pendek dari pada bakteri fase pertumbuhan eksponensial.
Kerusakan bakteri merupakan hasil interaksi senyawa antibakteri dengan bagian tertentu pada sel bakteri (Gilbert 1984). Interaksi senyawa antibakteri tersebut dapat menyebabkan sejumlah perubahan atau kerusakan pada sel bakteri yang berpengaruh pada pola inaktivasi bakteri. Pada dosis yang tidak mematikan , bakteri akan mengalami luka (injury), terjadi sejumlah perubahan dan kerusakan struktur sel bakteri yang akhirnya dapat mempengaruhi fungsi metabolisme sel, pada kerusakan yang parah akan menyebabkan kematian. Bentuk dan besarnya perubahan atau kerusakan struktur sel dipengaruhi oleh jenis senyawa antibakteri, jenis bakteri dan besarnya konsentrasi yang digunakan. Perubahan dan kerusakan struktur sel oleh senyawa antibakteri dapat berupa perubahan morfologi sel, perubahan ultrastruktur sel, ukuran sel, kebocoran dinding dan membran sel, ketebalan dinding dan penampakan sitoplasma (Gemmel dan Lorian 1996).
pada Tabel 2.4. Polimiksin B merusak membran sel, penisilin G merusak dinding sel, sedangkan streptomisin merusak ribosom. Penisilin G bersifat aktif terutama terhadap bakteri Gram positif dan negatif , sedangkan bakteri Gram negatif pada umumnya resisten terhadap penisilin G dan streptomisin. Secara umum, mekanisme kerja antibiotik adalah dengan mengganggu sintesis dinding sel, sintesis protein, sintesis asam nukleat dan juga pada fungsi membran (Best 1999).
Tabel 2.4 Mekanisme Antibiotik Polimiksin B, Penisilin G dan Streptomisin terhadap Kerusakan Sel Bakteri
Antibiotik Kerusakan Mekanisme Fase Pertumbuhan
Polimiksin B Membran sel Masuk melalui pori pada Semua fase pertumbuhan membran sel dan induksi
kebocoran sel
Penisilin G Dinding sel Menghambat pembentukan Eksponensial dinding sel dan lisis pada sel
Streptomisin Ribosom Menyebabkan misreading Eksponensial mRNA dan produksi
polipeptida yang salah Sumber: Lin et al. (2000)
Merusak Dinding Sel
Sel bakteri dilindungi oleh dinding sel yang terdiri dari peptidoglikan, ruang periplasma yang merupakan tempat enzim-enzim ekstraseluler dan membran sitoplasma yang terlibat dalam proses respirasi. Peptidoglikan tersusun dari N-asetilglukosamin dan N-asetilmuramat yang saling berikatan satu sama lain serta asam-asam amino L-alanin, D-alanin, D-glutamat dan lisin (Fardiaz 1992). Sintesis dinding sel melibatkan sejumlah enzim untuk menggab ungkan fosfoenolpiruvat dengan N-asetilglukosamin.
Lapisan peptidoglikan merupakan suatu molekul raksasa (Gambar 2.3).
20
Gambar 2.3 Struktur Peptidoglikan S. aureus (a) Satu Lapisan Peptidoglikan (b) Dua Lapisan Peptidoglikan (Jawetz et al. 1996)
Rangka dasar polimer dinding sel terdiri atas rangkaian subunit asam N-asetilglukosamin dan N-asetilmuramat yang berselang-seling, dihubungkan dengan ikatan ß-1,4 (Gambar 2.3a). Residu asam muramat dihubungkan dengan peptida pendek, yang susunannya bervariasi menurut spesies bakteri. Pada beberapa spesies, residu L-lisin digantikan oleh asam diaminopimelat, suatu asam amino yang di alam hanya terdapat pada dinding sel prokariotik (Jawetz et al. 1996). Asam D-amino juga merupakan bagian khas dari dinding sel prokariotik. Rantai peptida pada peptidoglikan dihubungkan menyilang antara rangka-rangka dasar polisakarida yang sejajar seperti terlihat pada Gambar 2.3b. Peptidoglikan yang terbentuk karena adanya ikatan silang, yang terdiri atas rantai peptida pentaglisin, menghubungkan a-karboksil residu D-alanin ujung dari satu rantai dengan kelompok e-amino dari L-lisin rantai berikutnya (De Jounge et al. 1996).
a
[image:42.612.156.489.82.410.2]Struktur dinding sel bakteri Gram positif berbeda dengan dinding sel Gram negatif (Gambar 2.4). Pada bakteri Gram positif dinding sel mengandung 90% peptidoglikan serta lapisan tipis asam teikoat dan asam teikuronat yang bermuatan negatif. Pada bakteri Gram negatif, pada lapisan di luar dinding sel ada yang mengandung 5-10% peptidoglikan, selebihnya terdiri dari protein, lipopolisakarida dan lipoprotein. Lapisan ini merupakan lapisan lipid kedua, yang disebut lapisan lipopolisakarida (LPS). Lapisan ini tidak tersusun semata-mata oleh fosfolipid saja, seperti yang terdapat pada membran sitoplasma, tetapi juga mengandung polisakarida dan protein (Madigan 2003).
Gram positif Gram negatif
Gambar 2.4 Struktur Dinding Sel Bakteri Gram Positif dan Gram Neg atif (Moat et al. 2002)
Sebagian besar dinding sel bakteri Gram positif mengandung sejumlah besar asam teikoat yang dapat merupakan 50% dari bobot kering dinding sel. Selain itu, mengandung protein M yang merupakan molekul panjang bersama dengan lipoteikoat membentuk mikrofibril yang memudahkan pelekatan (Madigan
et al. 2003). Dinding sel bakteri Gram negatif mengandung tiga polimer yang terletak di luar lapisan peptidoglikan: lipoprotein, porin matriks dan lipopolisakarida. Lipopolisakarida dinding sel Gram negatif terdiri atas suatu lipid kompleks yang disebut Lipid A. Lipid A terdiri atas suatu rantai satuan disakarida glukosamin yang dihubungkan dengan ikatan pirofosfat, tempat melekat sejumlah asam lemak berantai panjang.
Lipoprotein Porin
Flagela
Asam lipoteikoat
Hook
Protein M
Lipopolisakarida
Membran Luar
Lipid A
Lapisan Peptidoglikan
Membran Sitoplasma
Fosfolipid
Membran Protein Rotor Flagela Gel Periplasma
22
[image:44.612.97.519.333.612.2]LPS, sangat beracun dinamakan endotoksin yang terikat kuat pada permukaan sel bakteri Gram negatif dan hanya dilepaskan bila sel mengalami lisis. Bila LPS dipecah menjadi lipid A dan polisakarida, semua sifat racun terdapat pada lipid A. Sebaliknya, polisakarida merupakan antigen permukaan utama sel dan disebut antigen O. LPS terdiri dari antigen O, inti bagian luar (N-asetilglukosamin, glukosa dan galaktosa) dan inti bagian dalam (heptosa dan ketodeoksioktonat). Bakteri Gram negatif memiliki lapisan tambahan pada dinding sel yang disebut membran luar (Gambar 2.5) (Madigan et al. 2003). Membran tersebut terdiri dari lapisan lipopolisakarida (LPS) yang terikat satu sama lain dengan kation divalent Ca++ dan Mg++ (Murray et al. 1998). Membran luar berfungsi sebagai penghalang masuknya senyawa-senyawa yang tidak diperlukan sel (bakteriosin, enzim dan senyawa hidrofobik) (Alakomi et al. 2000).
Gambar 2.5 Struktur Membran Luar Bakteri Gram Negatif (Madigan et al. 2003) Asam-asam organik seperti etilen diamin tetraacetic acid (EDTA), asam sitrat, asam malat, asam tartarat, asam laktat (Gao et al. 1999; Stratford 2000) dan asam klorida (Alakomi et al. 2000) dapat menghambat pertumbuhan bakteri Gram negatif dengan mengkelat kation bivalen Ca++ dan Mg++. Terlepasnya kation-Lipopolisakarida
Lipoprotein Membran Luar
Periplasma
Membran Sitoplasma
Sitoplasma Protein
Fosfolipid
Miristatdeoksioktonat
Peptidoglikan Lipid A
Ketodeoksioktonat
Inti Bagian Luar
Porin
Antigen O
N -asetil glukosamin
Glukosa Galaktosa
Heptosa
kation tersebut dari membran luar akan memudahkan masuknya senyawa antibakteri ke dalam sel (Stratford 2000). Mekanisme kerja antibakteri dari komponen fenolik diantaranya dapat bereaksi dengan komponen fosfolipid dari membran sel (P. aeruginosa), sehingga menyebabkan peningkatan status permeabilitas sel membran atau dapat menyebabkan perubahan dalam komponen asam lemak dan kandungan fosfolipid,