PENGARUH PENTOXIFYLLINE TERHADAP FIBROINDEKS PADA PENDERITA HEPATITIS KRONIS B
PENELITIAN UJI KLINIS DI BAGIAN / SMF ILMU PENYAKIT DALAM FAKULTAS KEDOKTERAN USU/ RS H ADAM MALIK MEDAN
FEBRUARI 2008 – AGUSTUS 2008
TESIS
OLEH
ERIC HALIM SUMAMPOW
DEPARTEMEN ILMU PENYAKIT DALAM
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA RSUP H ADAM MALIK / RSUD DR PIRNGADI
DIAJUKAN DAN DIPERTAHANKAN DIDEPAN SIDANG LENGKAP DEWAN PENILAI BAGIAN ILMU PENYAKIT DALAM FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA DAN DITERIMA SEBAGAI SALAH SATU SYARAT UNTUK MENDAPATKAN
KEAHLIAN DALAM BIDANG PENYAKIT DALAM
PEMBIMBING TESIS
(Prof. Dr. LUKMAN HAKIM ZAIN SpPD, KGEH)
Disahkan oleh :
KEPALA DEPARTEMEN ILMU PENYAKIT DALAM FAKULTAS KEDOKTERAN USU
KETUA PROGRAM STUDI ILMU PENYAKIT DALAM FAKULTAS KEDOKTERAN USU
DEWAN PENILAI
1. Prof. dr. Harun Rasyid Lubis, SpPD-KGH 2. Dr. Mabel Sihombing, SpPD-KGEH
3. Dr. Josia Ginting, SpPD-KPTI 4. Dr. Refli Hasan SpPD-SpJP
KATA PENGANTAR
Puji dan syukur saya panjatkan ke hadirat Tuhan Yang Maha Kuasa
yang telah memberikan berkat dan kasihNya, sehingga penulis dapat menyelesaikan tesis/ karya ilmiah akhir ini dengan judul: Pengaruh Pentoxyfilline Terhadap FibroIndeks pada Penderita Hepatitis Kronis B yang merupakan persyaratan dalam menyelesaikan pendidikan dokter ahli dibidang Ilmu Penyakit Dalam pada Fakultas Kedokteran Universitas
Sumatera Utara.
Dengan selesainya karya tulis ini maka penulis ingin menyampaikan rasa terimakasih dan hormat serta penghargaan yang setinggi – tingginya
kepada :
1. Dr Salli Rossefi Nasution, SpPD-KGH, selaku Kepala Departemen
Ilmu Penyakit Dalam FK USU/ RSUP H. Adam Malik Medan, dan Prof. Dr. Lukman Hakim Zein SpPD-KGEH, selaku Kepala Departemen Ilmu Penyakit Dalam FK USU/ RSUP H. Adam Malik Medan periode
1997-2007 dimana penulis memulai pendidikan pada Juli 2004, yang telah memberikan kemudahan dan perhatian yang besar terhadap
pendidikan penulis.
2. Dr. Zulhelmi Bustami, SpPD-KGH sebagai Ketua Program Studi Ilmu Penyakit Dalam dan Dr. Dharma Lindarto, SpPD-KEMD sebagai
3. Khusus untuk karya tulis ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada Prof. Dr. Lukman Hakim Zain SpPD-KGEH
sebagai Kepala DIvisi Gastroenterohepatologi dan selaku pembimbing tesis saya, yang penulis rasakan benar-benar dengan tulus
membantu dan membimbing penulis menyelesaikan penelitian dan karya tulis ini, hanya doa yang dapat penulis berikan kiranya berkat berlimpah dari Yang Maha Kuasa selalu beserta beliau dan keluarga.
4. Seluruh staf Departemen Ilmu Penyakit Dalam FK USU/ RSUD Dr Pirngadi/ RSUP H. Adam Malik Medan : Prof Dr Harun Rasyid Lubis,
SpPD-KGH, Prof Dr T Renardi Haroen SpPD-KKV, MPH, Prof Dr Bachtiar Fanani Lubis, KHOM, Prof Dr Habibah Hanum, SpPD-Kpsi, Prof Dr Sutomo Kasiman SpPD-KKV, Prof Dr Azhar Tanjung,
SpPD-KP-KAI-SpMK, Prof Dr Kariman Sudin, SpPD-KPTI (alm), Prof Dr Pengarapen Tarigan, KGEH, Prof Dr OK Moehadsjah,
SpPD-KR, Prof Dr Lukman Hakim Zain, SpPD-KGEH, Prof Dr M Yusuf Nasution, SpPD-KGH, Prof Dr Azmi S Kar, SpPD-KHOM, Prof Dr Gontar A Siregar, SpPD-KGEH, Prof Dr Harris Hasan SpPD-SpJP(K),
Dr Rusli Pelly, SpPD-KP (alm), Dr Nur Aisyah SpPD-KEMD, Dr A Adin St Bagindo SpPD-KKV, Dr Lufti Latief, SpPD-KKV, Dr Syafii Piliang,
SpPD-KEMD, Dr T Bachtiar Panjaitan, SpPD, , Dr H OK Alfien Syukran SpPD-KEMD (alm), Dr Betthin Marpaung, SpPD-KGEH, Dr Sri M Sutadi SpPD-KGEH, Dr Mabel Sihombing, SpPD-KGEH, Dr Salli
Rasyid Lubis, SpPD-KGH, Dr Abiran Nababan, SpPD-KGEH, Dr Chairul Bahri, SpPD (alm), Dr Alwinsyah Abidin, SpPD, Dr Juwita
Sembiring, SpPD-KGEH, Dr Dharma Lindarto SpPD-KEMD, Dr Umar Zein SpPD-KPTI-DTM&H-MHA, Dr Yosia Ginting, SpPD-KPTI, Dr Refli
Hasan SpPD-SpJP, Dr EN Keliat SpPD-KP, Dr Blondina Marpaung SpPD-KR, Dr Leonardo B Dairi SpPD-KGEH yang merupakan guru-guru saya yang telah banyak memberikan arahan dan petunjuk
kepada saya selama mengikuti pendidikan.
5. Dr Armon Rahimi, SpPD, Dr Heriyanto Yoesoef SpPD, Dr R Tunggul
Ch Sukendar, SpPD-KGH, Dr Daud Ginting SpPD, Dr Tambar Kembaren SpPD, Dr Saut Marpaung SpPD, Dr Mardianto, SpPD, Dr Zuhrial SpPD, Dr Dasril Efendi SpPD, Dr Ilhamd SpPD, Dr Calvin
Damanik SpPD, Dr Zainal Safri SpPD, Dr Rahmat Isnanta, SpPD, Dr Santi Safril, SpPD, Dr Dairion Gatot SpPD, Dr Jerahim Tarigan SpPD,
Dr Endang Sembiring SpPD, Dr Abraham SpPD, Dr Soegiarto Gani SpPD, Dr Savita Handayani SpPD, Dr Franciscus Ginting SpPD sebagai dokter kepala ruangan/ senior yang telah amat banyak
membimbing saya selama mengikuti pendidikan ini.
6. Direktur RSUD. Dr. Pimgadi dan RSUP. H. Adam Malik Medan, Direktur
7. Direktur RS Tanjung Pura , Dr. Agusnadi Tala, SpA yang telah memberi kesempatan kepada penulis selama ditugaskan sebagai konsultan di
bagian Penyakit Dalam di RS Tanjung Pura dalam rangka pendidikan ini.
8. Para Sejawat PPDS Interna, perawat serta paramedis lainnya dan
seluruh karyawan /karyawati dilingkungan SMF / Departemen Ilmu Penyakit Dalam RSUD Dr. Pirngadi Medan / RSUP H. Adam Malik
Medan / RS Tanjung Pura atas kerjasama yang baik selama ini.
9. Para penderita rawat inap dan rawat jalan di SMF/Departemen Ilmu
Penyakit Dalam RSUD. Dr. Pirngadi dan RSUP. H. Adam Malik Medan, karena tanpa mereka mustahil penulis dapat menyelesaikan pendidikan ini.
11. Rasa hormat dan terimakasih yang setinggi – tingginya dan setulusnya penulis tujukan kepada papa dr. Halim dan mama Alice Sumampow
yang saya kasihi, yang telah membesarkan, mengasuh, mendidik dan menyekolahkan penulis, banyak berkorban serta memberikan dorongan secara moril dan materil demi kemajuan penulis. Tiada
kata-kata yang paling tepat untuk mengungkapkan perasaan hati, rasa terima kasih atas segala jasa-jasa ayahanda dan ibunda yang tiada
mungkin terucapkan dan terbalaskan. Semoga ini dapat memberikan kebahagian dan kepuasan batin bagi kedua orang tua saya. Kiranya Tuhan Yang Maha Esa selalu memberikan yang terbaik bagi papa dan
12. Kepada saudara-saudaraku : kakanda Pinkan Djuwita Sumampow dan Barbara Maesi Sumampow dan abang ipar serta seluruh anggota
keluarga yang telah banyak membantu, memberi semangat dan dorongan selama pendidikan, terima kasihku yang tak terhingga untuk
segalanya.
13. Sebenarnya masih banyak lagi kata ucapan terima kasih yang ingin penulis sampaikan buat berbagai pihak yang tidaklah mungkin
disebutkan satu persatu, dan pada kesempatan ini izinkanlah penulis menyampaikan rasa terima kasih yang tulus secara menyeluruh. Bapa
di sorgalah yang membalaskan kebaikan dan ketulusan dari semua pihak yang telah membantu penulis sehingga penelitian dan tulisan ini dapat penulis selesaikan.
Medan, September 2008.
D A F T A R I S I
Halaman
Kata pengantar ... i
Daftar isi ... vi
Daftar tabel dan gambar ... ix
Daftar singkatan ... x
Abstrak ... xi
BAB I : P E N D A H U L U A N ... 1
BAB II : TINJAUAN PUSTAKA 2.1. Hepatitis Kronis B dan Fibrosis Hati ... 3
2.2. Patogenesis Fibrosis Hati ... 4
2.3. P e n t o x i f y l l i n e ... 8
2.3.1. Farmakokinetik Pentoxifylline ... 12
2.4. Penilaian Fibrosis Hati 2.4.1. Biopsi Hati ... 13
2.4.2. Radiologi ... 15
2.4.3. Petanda Serum ... 16
a. Petanda tidak langsung ... 16
b. Petanda langsung... 17
BAB III : PENELITIAN SENDIRI
3.1. Latar Belakang... 22
3.2. Perumusan Masalah ... 23
3.3. Hipotesa ... 23
3.4. Tujuan Penelitian ... 24
3.5. Manfaat Penelitian ... ... 24
3.6. Kerangka Konsepsional ... 24
3.7. Bahan dan Cara 3.7.1. Desain Penelitian ... 25
3.7.2. Definisi operasional ……… 25
3.7.2.1. Hepatitis Kronis B ……… 25
3.7.2.2. Sirosis Hati ……… 25
3.7.2.3. Pentoxifylline ………... 25
3.7.2.4. FibroIndeks .………….……… 26
3.7.3. Waktu dan Tempat Penelitian ……… 26
3.7.4. Populasi Terjangkau ……… 27
3.7.5. Kriteria Inklusi ……… 27
3.7.6. Kriteria Eksklusi ……… 27
3.7.7. Populasi dan Sampel ……… 28
3.7.8. Cara Penelitian ... 28
3.7.10. Kerangka Operasional ... 29
BAB IV : HASIL DAN PEMBAHASAN 4.1. Hasil Penelitian ... 30
4.1.1. Karakteristik Subyek Penelitian ... 30
4.1.2. Efek Terapi Pentoxifylline Selama 4 Minggu ... 32
4.1.3. Efek Samping ... 34
4.2 . Pembahasan ... 34
BAB V : KESIMPULAN DAN SARAN 5.1. K e s i m p u l a n ... 38
5.2. S a r a n ... 38
BAB VI : DAFTAR PUSTAKA... 39
LAMPIRAN 1. Master Tabel ... 47
2. Lembaran Penjelasan Kepada Subyek... 48
3. Formulir Persetujuan Penjelasan ... 49
4. Form Data Peserta Penelitian... 50
5. Surat Persetujuan Bersedia Ikut Penelitian...52
6. Persetujuan Komite Etik ...53
DAFTAR TABEL
Halaman T a b e l 1 : Skoring METAVIR Pada Fibrosis Hati...14
T a b e l 2 : Petanda Langsung terhadap Deposit dan
Pembersihan MES...18 T a b e l 3 : Karakteristik Dasar Subjek Penelitian ...31 T a b e l 4 : Respon Terapi Pentoxifylline ...33
DAFTAR GAMBAR
Gambar 1 : Perubahan Komposisi MES dari Normal ke Sirosis ... 4
Gambar 2 : Komponen utama MES pada Fibrosis Hati Manusia.. 5 Gambar 3 : Perubahan Komposisi Kolagen pada Sirosis ... 6
DAFTAR SINGKATAN
MES : Matriks ekstraseluler
HSC : Hepatic stellate cells
MMP : Metalloproteinase
PINP : Procolllagen I carboxy terminal peptide
PIIINP : Procollagen III amino terminal peptide
TIMP : Tissue inhibitor of metalloproteinase
TGF- : Transforming growth factor beta
PDGF : Platelet-derived growth factor
TNF- : Tumor necrosis factor-
ROS : Reactive oxygen stress
KC : Kupffer cells
IFN- : Interferon-
HBV-DNA (PCR) : Hepatitis B Virus-Deoxyribonucleotide Acid (Polymerase Chain Reaction)
AST : Aspartate aminotranferase
ALT : Alanine aminotranferase
NPV : Negative predictive value
PPV : Positive predictve value
AUROC : Area under receiver operator curve
NASH : Nonalcoholic Steatohepatis
IL : Interleukin
Abstrak
Pengaruh Pentoxifylline Terhadap Perubahan FibroIndeks Penderita Hepatitis Kronis B
Eric Halim Sumampow, Lukman Hakim Zain
Divisi Gastroenterohepatologi, Departemen Penyakit Dalam
Fakultas Kedokteran Universitas Sumatera Utara – RSUP H Adam Malik , Medan Latar Belakang:
Hepatitis kronis B berlanjut menjadi fibrosis hati dan akhirnya berkembang menjadi penyakit hati tahap akhir. Fibrosis hati adalah reversibel dan pemahaman patogenesis fibrosis telah membuka peluang penggunaan terapi anti fibrosis. Saat ini telah dikembangkan penanda hati non invasif disamping biopsi hati sebagai standar baku emas karena banyak keterbatasan biopsi ini. Salah satu penanda ini adalah FibroIndeks. Pentoxifylline diasumsikan sebagai anti-fibrosis dengan menghambat aktivasi HSC dan sintesa kolagen secara invitro dan invivo.
Tujuan:
Untuk mengetahui penurunan FibroIndeks pada penderita hepatitis kronis B setelah pemberian pentoxifylline.
Metode :
Penelitian dilakukan secara uji klinis prospektif dengan perlakuan ulang. Pasien hepatitis kronis B dengan FibroIndeks > 1,25 diikutsertakan dan dilakukan penilaian fibrosis hati dengan FibroIndeks sebelum dan sesudah pemberian pentoxifyllline dengan dosis 3x400 mg selama 4 minggu.
Hasil :
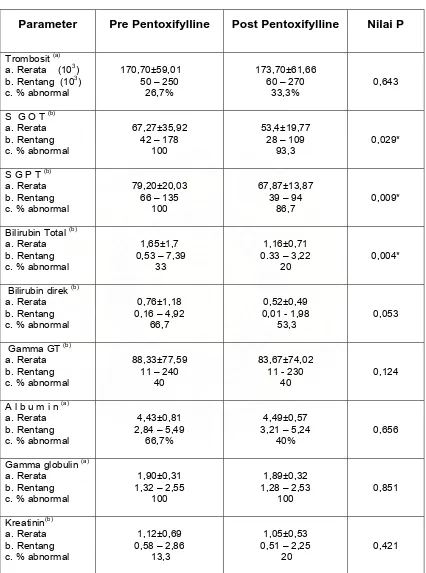
Dari 15 orang pasien yaitu 12 pria dan 3 wanita, setelah 4 minggu pemberian pentoxifylline didapati penurunan bermakna pada GOT (67.3±35.9vs 53.4 ± 19.8 p=0.029), GPT (79.2 ± 20.0 vs 67.9 ± 13.9, p=0.009), billirubin total (1.65 ± 1.7 vs 1.16 ± 0.71, p=0.004). Peningkatan tidak bermakna pada Albumin (4.43 ± 0.81 vs 4.49 ± 0.57,p=0.656), trombosit (170.7 ± 59.0 vs 173.7 ± 61.7,p=0.643). Penurunan tidak bermakna pada gamma globulin (1.90 ± 0,31 vs 1,89 ± 0,32,p=0,851),
FibroIndeks (1.86 ± 0.46 vs 1.77 ± 0.46, p= 0.057). Kesimpulan :
Pemantauan terapi pentoxifyllline selama 4 minggu pada penderita hepatitis kronis B menunjukkan penurunan fibrosis hati berdasarkan FibroIndeks walau tidak bermakna secara statistik. Pentoxifylline dapat juga menurunkan GOT, GPT dan billirubin secara efektif.
Abstract
Pentoxifylline impact for the FibroIndex alteration in Chronic Hepatitis B
Eric Halim Sumampow, Lukman Hakim Zain
Gastroentrologyhepatology division, Internal Department Faculty of Medicine University of Sumatera Utara-H.Adam Malik Hospital
Medan. Background:
Chronic Hepatitis B can lead to liver fibrosis and eventually evolve to end-stage liver disease. Hepatic fibrosis is reversible, understanding the pathogenesis of fibrosis had opened the use of anti-fibrotic therapies. Recently non invasive marker is developed instead of biopsy as gold standard because there are many limitations of this biopsy. One of the non invasive marker is FibroIndex. Pentoxifylline is assumed as anti-fibrosis by inhibiting HSC proliferation and colllagen syntesis on invitro and invivo.
Aim :
To assess the reduction of FibroIndex on chronic hepatitis B patients after pentoxifylline administration.
Method:
The study is conducted with prospective clinical trial and pre-post test design. Chronic hepatitis B patients with FibroIndex > 1,25 were recruited and being evaluate the rate of liver fibrosis with FibroIndex before and after pentoxifylline administration with dose 3x400 mg for 4 weeks.
Results:
From 15 patients consist of 12 males and 3 females, after 4 weeks of pentoxifylline administration we found there were significant reduction on GOT (67.3±35.9vs 53.4 ± 19.8 p=0.029), GPT (79.2 ± 20.0 vs 67.9 ± 13.9, p=0.009), total billirubin (1.65 ± 1.7 vs 1.16 ± 0.71, p=0.004). There were no significant increases on Albumin (4.43 ± 0.81 vs 4.49 ± 0.57,p=0.656), platelet (170.7 ± 59.0 vs 173.7 ± 61.7,p=0.643). There were no significant reduction on gamma globulin (1.90 ± 0,31 vs 1,89 ± 0,32,p=0,851), FibroIndex (1.86 ± 0.46 vs 1.77 ± 0.46, p= 0.057).
Conclusions :
Monitoring of pentoxifylline administration for 4 weeks on chronic hepatitis B patients shows reduction of hepatic fibrosis based on FibroIndex although it is not statistically significant. Pentoxifylline can also reduce ALT, AST and Billirubin effectively.
BAB I PENDAHULUAN 1. Latar Belakang
Hepatitis kronis B merupakan masalah kesehatan bagi seluruh
penduduk dunia. Diperkirakan 2 miliar penduduk dunia pernah terpapar infeksi virus hepatitis B dan sekitar 400 juta orang menderita hepatitis kronis B(1). Di Indonesia menurut data dari Mohamed R dkk terdapat ± 8.700.000 orang
menderita hepatitis B(2). Penderita hepatitis kronis B ini sebanyak 20%
berkembang menjadi sirosis dan penyakit hati terminal (insufisiensi hati dan
hipertensi portal) (3) .
Penyakit hati kronis secara umum berkembang menjadi sirosis hati
melalui mekanisme inflamasi dan respon penyembuhan(4). Sirosis hati dan penyakit hati terminal terjadi disebabkan adanya proses fibrosis pada hati yang
terjadi karena sintesis matriks ekstra selular (MES) sehingga terjadi perubahan
arsitektur hati dengan terbentuknya nodul-nodul pada hati(5).
Penanganan fibrosis hati belum memiliki standar tetap dan sekarang ini belum ada terapi kuratif untuk fibrosis hati sehingga pasien sangat
tergantung pada transplantasi hati(4,6,7) . Penelitian terkini menunjukkan bahwa fibrosis hati dan bahkan sirosis dapat reversibel telah merubah dogma selama ini
dan meningkatkan perhatian untuk mengembangkan terapi antifibrotik(8-11).
Hepatic stellate cell (HSC dengan nama sinonim antara lain :ito cell, liposit,
vitamin A storing cell) pada sel hati normal mempunyai fungsi penting,
pertumbuhan, dan sitokin. Bagaimanapun respon kerusakan sel hati, HSC diaktivasi, peningkatan proliferasi miofibroblas, produksi berlebih dan deposit
komponen MES, hal ini merupakan gambaran patologi fibrosis hati(12). Antifibrosis yang efektif bekerja melalui 3 mekanisme yaitu pencegahan
fibrosis (fibroprevention), fibrostasis dan fibrolisis(4,13). Netralisasi respon – respon HSC melalui inhibisi transduksi sinyal merupakan salah satu cara yang
mungkin memberikan manfaat terapi pada fibrosis hati. Pentoxifylline merupakan salah satu obat yang bekerja melalui cara tersebut dengan cara
memodulasi transduksi sinyal fibrogenik(14,15).
Dengan berkembangnya pengetahuan mengenai fibrosis hati dan evaluasi dinamika fibrogenesis yang menggunakan pemeriksaan non-invasif
meliputi pemeriksaan petanda tidak langsung (indirect marker) dan petanda langsung (direct marker) (16). Studi sebelumnya melaporkan petanda tidak
langsung meliputi: FibroIndeks, Indeks AAR, Skor PGA, Fibrotest, Acti Test, Skor Forns (indeks Forns), indeks APRI, indeks GUCI. Petanda langsung meliputi: TIMP, TGF- . Kombinasi biomarker seperti indeks SHASTA, Fibro
Spect (17). FibroIndeks merupakan salah satu petanda non-invasif diagnosis fibrosis hati telah diuji klinis pada subjek hepatitis kronis C (18,19,20).
Di Indonesia sepengetahuan penulis belum ada penelitian tentang
pengaruh pentoxifylline terhadap kadar serum petanda diagnostik fibrosis hati
non invasif, khususnya FibroIndeks. Oleh karena itu penulis ingin meneliti
pengaruh pentoxifylline terhadap kadar FibroIndeks pada penderita hepatitis
BAB II
TINJAUAN PUSTAKA
2.1. Hepatitis Kronis B dan Fibrosis Hati
Resiko untuk terjadi infeksi hepatitis kronis B berbanding terbalik dengan umur, dimana 90% infeksi terjadi pada bayi baru lahir dari ibu dengan HbeAg positif, 25% - 30% pada bayi dan anak – anak dibawah 5 tahun dan
kurang dari 10% pada orang dewasa (21,22,23). Sebanyak 15% - 40% penderita yang terinfeksi hepatitis kronis B akan mengalami penyakit hati kronis
termasuk sirosis, dekompensasi hati dan karsinoma sel hati (24,25) .
Progresifitas hepatitis kronis B menjadi penyakit hati kronis disebabkan fibrosis hati tahap lanjut . Menurut WHO 1978, fibrosis adalah kolagen
berlebih akibat pembentukan jaringan ikat baru (13). Fibrosis hati adalah proses penyembuhan luka setelah injuri hati kronis, ditandai oleh aktivasi
HSC dan produksi berlebih komponen MES. Radang hati kronis akibat berbagai penyebab seperti virus, autoimun, imbas obat, penyakit metabolik dan keganasan. Infeksi viral hepatitis, terutama hepatitis kronis B dan
hepatitis kronis C merupakan penyebab utama fibrosis hati. Setelah jejas akut pada hati (hepatitis viral) sel – sel hati mengalami regenerasi dan diganti
dengan jaringan nekrotik dan jaringan apoptosis. Proses tersebut terkait dengan respon inflammasi dan terbatasnya penumpukan MES. Jika jejas hati menetap maka terjadi kegagalan regenerasi sel hati dan hepatosit mengalami
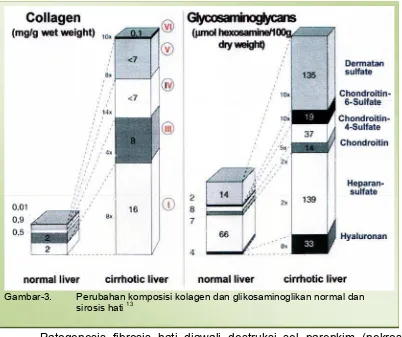
berlanjut maka pada akhirnya akan terjadi sirosis hati. Fibrosis hati sendiri sangat dipengaruhi kuantitas dan komposisi MES (26,27). Hati diperkirakan
mengandung 6 kali lebih banyak MES pada tahap fibrosis hati lanjut dibandingkan keadaan normal, termasuk kolagen (I, III, IV, V dan VI),
fibronektin, undulin, elastin, laminin, asam hialuronat dan proteoglikan. Penumpukan MES terkait dengan peningkatan sintesa dan penurunan degradasi MES tersebut (28).
0
2.2. Patogenesis Fibrosis Hati
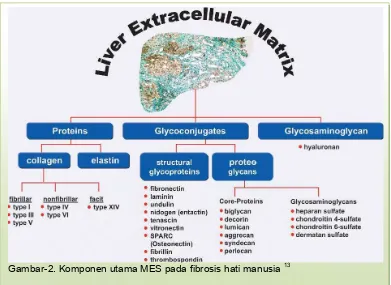
Kolagen dikenal sebagai komponen jaringan ikat paling lazim pada fibrosis hati. Patogenesis fibrosis merupakan produksi dan akumulasi
Gambar-2. Komponen utama MES pada fibrosis hati manusia 13
Akumulasi MES lebih sering berawal pada ruang Disse perisinusoid
terutama pada metabolic zone 3 di asinus hati (perivenous) menuju fibrosis perisentral. Perubahan komposisi dan jumlah MES selama fibrogenesis akan
mengganggu fungsi biologi sel hepatosit. Akumulasi matriks diruang Dise perisinusoid membentuk kapilarisasi inkomplet sehingga menghalangi pertukaran aliran diantara hepatosit dan aliran darah sinusoid. Kemudian
mengganggu fungsi clearence dan fungsi biosintesis sel jaringan parenkim. Penyempitan lumen sinusoid oleh fibrosis perisinusoid merupakan faktor
Gambar-3. Perubahan komposisi kolagen dan glikosaminoglikan normal dan sirosis hati 13
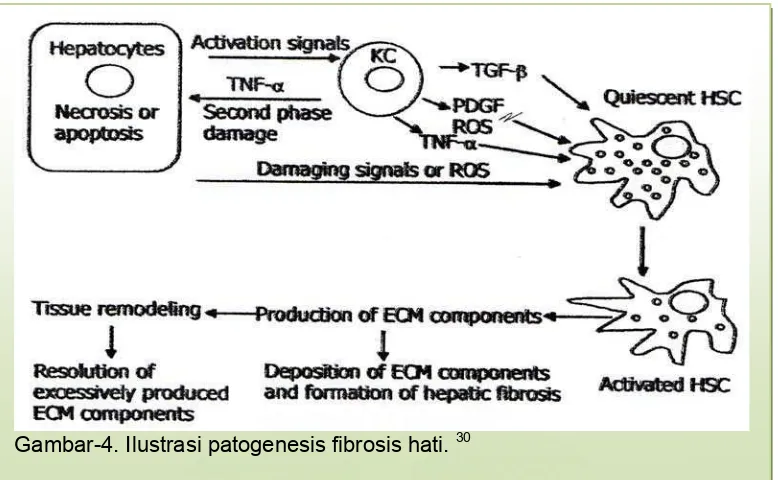
Patogenesis fibrosis hati diawali destruksi sel parenkim (nekrosis lebih banyak daripada apoptosis) akibat injuri diikuti mekanisme inflamasi
kemudian mengaktifkan HSC, yang berperan penting secara patofisiologi pada fibrogenesis dan fibrolisis (13). Injuri di hati mengakibatkan kerusakan sel hepatosit dan reaksi inflamasi. Sel hepatosit rusak, komponen membran,
metabolik zat toksik dan infiltrasi inflamasi akan mengaktifkan sel Kupffer. Kemudian sel Kupffer melepas zat terlarut meliputi sitokin, TGF- , PDGF,
Gambar-4. Ilustrasi patogenesis fibrosis hati. 30
Sitokin akan mempengaruhi HSC, dimana HSC secara normal adalah
quiscent. Pada keadaan aktif akibat terjadinya jejas hati HSC kehilangan lipid droplets, berproliferasi, mengalami transisi morfologi menjadi sel miofibroblas kemudian bermigrasi ke zona 3 asinus lalu berubah menjadi sel miofibroblas
yang memproduksi kolagen tipe I, III, IV dan laminin untuk pembentukan
basement membrane. Transisi ini ditandai produksi sejumlah besar
komponen MES dan penurunan degradasi MES oleh MMP dimana kerja
MMP dihambat TIMP. Kolagen, MMP dan TIMP dihasilkan oleh sel
Miofibroblas. Pada penyakit sirosis akumulasi komponen MES dapat
meningkat sampai 10 kali lipat. Injuri kronis mengakibatkan fibrosis, gangguan arsitektur dan fungsi hati, akhirnya bermanifestasi sebagai sirosis
Pada hepatitis kronis B, patogenesis fibrosis dihubungkan dengan sitokin TNF- , IFN- , IL-4 dan TGF- berdasar studi biopsi hati (33). Infeksi
kronis virus hepatitis B mengakibatkan kerusakan hepatosit yang berkembang menjadi fibrosis, sirosis dan karsinoma sel hati (34,35). Penyakit
hepatitis B bervariasi tingkat keparahan pada masing-masing individu ada yang dapat mengontrol infeksi secara efisien dan virus bersih dari aliran darah tanpa bukti klinis penyakit hati. Sebagian gagal membersihkan virus
dan berkembang menjadi infeksi kronis. Penderita umumnya asimtomatik tanpa penyakit hati yang mengancam, namun 10-30% virus hepatitis B
menjadi sirosis hati dan karsinoma sel hati akibat proses nekroinflamasi kronis (34). Pada hepatitis kronis B, terapi antiviral dengan viral clearence
telah dihubungkan dengan pengurangan fibrosis secara bermakna (36). IFN-
atau lamividune, keduanya menghasilkan remisi viral, biokemikal dan histologikal sekitar 30-45 %. Kombinasi IFN- dan analog nucleoside
dihubungkan dengan efek samping yang serius dan biaya sangat mahal sehingga obat-obatan ini tidak digunakan secara luas di negara-negara berkembang (37).
2.3. Pentoxifylline
Pentoxifyllline, 1-(5-oxohexyl)-3,7-dimethylxanthine, adalah suatu analog methylxanthine theobromine . Pentoxifylline telah digunakan secara klinis di Amerika Utara sejak tahun 1982 untuk memperbaiki aliran darah
pentoxifylline memberikan manfaat terapetik. Pada pemberian jangka panjang menunjukkan 2.7 % efek samping, sebagian besar (2.6%) terkait
dengan gangguan saluran pencernaan (38,39).
Pentoxifylline bekerja melalui protein kinase A (PKA), mengganggu
sinyal platelet-derived growth factor (PDGF) terhadap aktivasi Akt dengan menghambat translokasi membran Akt, Pentoxifylline mempunyai efek fibrostasis dengan menghambat aktivasi dari HSC baik menghambat
langsung sinyal oleh karena nekroinflamasi hepatosit atau menghambat aktivasi sel Kuppfer yang akan menghasilkan sitokin-sitokin seperti PDGF,
TGF- dan TNF- (40,41). Penelitian pada tikus, Raetsch dkk mendapatkan kerja pentoxifylline dapat memacu penurunan kadar prokolagen I mRNA
sebanyak 8 kali dan menekan faktor fibrogenik transforming growth factor β1
(TGF - β1) dan connective tissue growth factor (CTGF) sebanyak 60% –
70% setelah 4 – 6 minggu (42). Pada penelitian lainnya Xiong dkk
memperlihatkan pemberian pentoxifylline dengan dosis tinggi maupun rendah
dapat menurunkan kadar TGF - β1, prokolagen tipe I, III setelah 8 minggu (43).
Beberapa penelitian pentoxifylline pada penyakit hati kronis:
1. Eleftheriadis dkk (1996), pemberian pentoxifylline dosis 1,4 mg/kgBB terhadap 10 pasien sirosis hati dengan varises esofagus dibandingkan
2. Akriviadis dkk (2000) membandingkan pemberian pentoxifylline 3 kali 400 mg sehari dengan plasebo (vitamin B12) pada alcoholic liver disease
(ALD) selama 28 hari, mendapatkan survival penderita ALD dengan pentoxifylline lebih tinggi dibanding plasebo dan diduga hasil tersebut
disebabkan adanya perbaikan sindroma hepatorenal pada kelompok tersebut (45).
3. Adams dkk (2004) memperlihatkan pemberian pentoxifylline pada
penderita NASH dengan dosis 1600 mg/hari selama 12 bulan dapat memperbaiki kadar aminotransferase (46).
4. Austin dkk (2004) memberikan pentoxifylline 1800 mg/hari dengan pada 12 penderita alkoholik sirosis kompensata selama 2 minggu dengan tujuan menilai tekanan hipertensi porta, mendapatkan hasil adanya
kenaikan trombosit (109/L) selama terapi dari 76 (56 – 131) menjadi 80
(66 – 243) disertai penurunan kadar TNF α (pg/mL) dari 295 (211 – 841)
menjadi 210 (181 – 884). Pada penelitian ini didapatkan efek samping
pentoxifylline adalah nausea, anoreksia dan sakit kepala dan keadaan tersebut dapat ditoleransi pasien dengan mengurangi dosis pentoxifylline
menjadi 1200 mg/hari (47).
5. Satapathy dkk (2004), terhadap 18 pasien NASH dengan peningkatan ALT >1,5 kali batas atas normal dan diberi pentoxifylline (3x400 mg) selama 6
47±20 IU/L, p <0.0001) berkurang secara bermakna. Pada bulan ke-1 ALT normal pada 23% (p=0.125), 35 % (p=0.125) pada bulan ke-2, 60 %
(p=0.008) pada bulan ke-6. Dan serum TNF- berkurang secara bermakna setelah terapi (22.15 ± 2.49 vs 17 ± 2.58 pg/ml, p=0.011). Efek
samping yang ditimbulkan dapat ditoleransi dan tidak bermakna. Efek samping nyeri ulu hati ditemukan pada 3 (16%) pasien, membutuhkan
proton pump inhibitor oral dan seluruh pasien menyelesaikan penelitian
tanpa pengurangan dosis (48).
6. Satapathy dkk (2007) terhadap 9 pasien NASH, dengan peningkatan ALT
(>1,5 batas atas normal). Terapi jangka panjang pentoxifylline (3x400mg/hari) selama12 bulan adalah efektif memperbaiki parameter biokimia dan resolusi secara histologis, masing-masing ALT (111 ± 53
IU/L vs 45 ±19 IU/L, p=0.003), AST (61 ± 27 IU/L vs 33 ±12 IU/L, p=0.005). Steatosis dan inflamasi lobular masing-masing berkurang 55%
dan 67% dimana p=0,009 (49).
7. Tanikella dkk ( 2008), pemberian pentoxifylline (400 mg tiap 8 jam) selama 2 minggu terhadap 9 pasien sirosis hepatis dengan hepatopulmonary
syndrome disebabkan hepatitis C kronis dan alkoholik (55%), menghasilkan penurunan kadar TNF dengan bermakna, tidak ada
perubahan bermakna pada PaO2, efek samping dapat ditoleransi dimana nausea (100%) paling dominan (50).
8. Fontaine dkk (2008) di Paris, terapi pentoxifyllline (2x400 mg) kombinasi
hepatitis C kronis yang intoleran dan kontraindikasi terhadap terapi kombinasi interferon alfa dan ribavirin. Tujuan penelitian menilai efikasi
dan keamanan kombinasi pentoxifyllline dan tocopherol sebagai
antifibrosis. Penelitian baru selesai dan hasil belum dipublikasikan (51).
2.3.1. Farmakokinetik Pentoxifylline
Metabolisme pentoxifylline diketahui sebagian besar dihati dan kurang
dari 1% dosis pentoxifylline diekskresikan sebagai bahan tercampur melalui urin (38). Terdapat 7 bentuk metabolit (Gambar 3) dengan M -5 merupakan
bentuk primer metabolit eliminasi. Salah satu metabolit , 1 -(5-hydroxyhexyl)-3,7-dimethyilxanthine (M – 1), diyakini terbentuk diluar hati, kemungkinan oleh eritrosit (38,39).
Bersihan plasma pentoxifylline ternyata lebih besar dibandingkan aliran darah hepatik, yang menguatkan dugaan adanya mekanisme
metabolisme ekstrahepatik tersebut. Bentuk metabolit M – 1 diyakini memiliki aktivitas farmakologi (38,52). Biotransfomasi pentoxifylline diketahui terganggu dengan merokok, penyakit sirosis hati(53) serta berinteraksi dengan
theophylline dan simetidin (54,55,56).
Dosis juga memperlihatkan peranan penting terhadap jumlah
pentoxifylline sebenarnya didalam darah, sebagian besar kepustakaan menyatakan kadar serum setelah pemberian dosis oral tidak menentu dan cenderung sangat rendah. Perbedaan kadar pentoxifylline tersebut akan
Gbr.5. Jalur metabolisme utama pentoxifylline. Pentoxifylline dimetabolisme dengan berkurangnya bentuk M – 1 dan oksidasi menjadi bentuk – bentuk metabolit lainya 46
2.4. PENILAIAN FIBROSIS HATI 2.4.1. Biopsi hati
Biopsi hati merupakan metode tradisional untuk menilai, mendeteksi
dan memonitoring fibrosis hati. Walaupun menjadi baku emas, keterbatasan seperti keengganan pasien dilakukan biopsi menyulitkan untuk memonitor
perkembangan penyakit dan efek terapi yang telah diberikan, biaya lebih mahal, kesalahan sampel, kesalahan interpretasi, risiko yang dimiliki pasien, sirosis makronodular cenderung perdarahan, dan keterbatasan pemahaman
fibrosis bila sampel minimal (57).
Komplikasi akibat biopsi yang memerlukan perawatan dirumah sakit
kemungkinan terjadinya kesalahan sampel cukup besar. Penelitian pada penderita sirosis memperlihatkan kesalahan terjadi pada 10 – 30% kasus
yang dilakukan biopsi hati tunggal tidak terpimpin (single blind biopsy) (57,59). Sebagian besar kesalahan terjadi pada saat penetapan tingkat fibrosis hati
dan lebih sering terjadi pada penderita sirosis hati makronodular. Beberapa studi menyarankan sampel adekuat bila panjang sedikitnya 15 mm dan berisi lebih dari 5 traktus portal. Guide dkk menyarankan tingkat dan stadium
fibrosis lebih adekuat dengan panjang 20 mm dan berisi lebih dari 11 traktus portal. Baik besar ukuran biopsi dan jumlah biopsi yang dilakukan memiliki
efek besar terhadap akurasi pemeriksaan (59).
Bagaimanapun biopsi hati bukan merupakan baku emas yang sempurna karena hasil tergantung ukuran sampel dan variabilitas interpretasi
antara peneliti yang dapat mencapai 33 % (57).
Berbagai jenis sistem penilaian telah dipakai untuk menilai stage
fibrosis hati seperti skor METAVIR, Knodell dkk dan skor Ishak. Skor METAVIR oleh Poynard dkk telah direkomendasikan pada saat ini terdiri dari 5 stage (Tabel 1).
Tabel -1. Skoring METAVIR pada fibrosis hati
60
Stage Gambaran
F0 Tanpa fibrosis
F1 Fibrosis portal tanpa septa
F2 Fibrosis portal dengan sedikit septa F3 Fibrosis septal tanpa sirosis
2.4.2. Radiologi
CT, MRI dan ultrasound mampu merinci gambar dari hati dan struktur
sekitarnya, namum tidak cukup menentukan stadium dini dari fibrosis (17,57). Saat ini modalitas terbaru yaitu transient elastography (FibroScan)
merupakan metoda baru, non-invasif dan cepat yang dapat mengevaluasi fibrosis hati dengan mengukur kekakuan hati. Keuntungan metoda ini antara lain: mudah digunakan, tidak nyeri, tidak perlu anestesi atau rawat inap,
cepat (kecepatan akuisisi <1/10 detik). Kelemahan metoda ini antara lain: kekakuan hati sulit diukur pada orang gemuk atau obese dan tidak mungkin
diukur pada pasien dengan asites. FibroScan ini telah dibandingkan dengan beberapa petanda seperti APRI indeks dan Fibrotest, menunjukkan secara akurat tingkat fibrosis hati yang dievaluasi dengan skor METAVIR (61,62,63).
Setelah FibroScan dikenalkan sebagai metoda non-invasif untuk
fibrosis hati, perkembangan saat ini telah menggunakan sonografi berdasar
real-time elastography yang dapat dilakukan dengan probe ultrasonografi konvensional selama pemeriksaan sonografi rutin. Metoda ini mengukur elastisitas jaringan dengan autokorelasi dan model 3 dimensi jaringan serta
hasil yang didapat setelah dilakukan analisa statistik dengan regresi logistik multivariat berupa skor elastisitas. Akurasi diagnostik dengan areas under
2.4.3. Petanda Serum
Petanda fibrosis non invasif sangat dibutuhkan saat ini mengingat
keterbatasan dari biopsi hati untuk melihat progresifitas penyakit dan fibrosis hati, sebelum dan sesudah pengobatan. Walaupun sampai saat ini belum
didapati tingkat sensitivitas dan spesifisitas yang memuaskan untuk menilai keakuratan tingkatan fibrosis hati dan untuk memonitor perjalanannya.
Adapun petanda non invasif fibrosis hati harus memenuhi persyaratan
seperti; spesifik untuk hati, mudah dilakukan di laboratorium klinik, menggambarkan stadium dari fibrosis, tidak mahal, pemeriksaan
distandarisasi dilaboratorium (57,60,65).
Petanda serum untuk fibrosis hati dibagi atas 2 kelompok: petanda langsung dan tidak langsung. Marker tidak langsung bertanggung jawab
terhadap perubahan fungsi hati tetapi tidak secara langsung bertanggung jawab pada metabolisme MES. Marker langsung menunjukkan secara
langsung pergantian (turnover) MES. Sehingga kombinasi kedua petanda ini adalah pilihan yang menjanjikan terhadap pasien fibrosis hati(17,57).
a. Petanda tidak langsung (indirect marker).
Studi-studi sebelumnya telah mengevaluasi petanda non-invasif untuk memprediksi keberadaan fibrosis atau sirosis pada penderita hepatitis kronis,
seperti:
1. Rasio AST/ ALT (indeks AAR: Rasio AST/ALT lebih besar dari 1 dengan kuat menyarankan sirosis dengan sensitiviti 78 % dan
2. Skor PGA: Kombinasi pengukuran indeks protrombin, GGT dan
apolipoprotein A1 (PGA). Akurasi diagnosa skor PGA untuk
mendeteksi sirosis dilaporkan antara 66%-72%.
3. Fibrotest, pemeriksaan melibatkan alfa-2 makroglobulin, alfa2-globulin,
gamma globulin, apolipoprotein A1, gamma GT, dan Billirubin total. Hasil Formula ditentukan dalam 3 kelompok: ringan (METAVIR F 0-1), fibrosis bermakna (METAVIR F 2-4), dan indeterminate.
4. Acti Test, pemeriksan memodifikasi Fibrotest dengan menyertakan ALT.
5. Skor Forns (indeks Forns), berdasar 4 variabel meliputi jumlah trombosit, umur, level kolesterol, dan GGT.
6. Rasio AST/ trombosit (indeks APRI), model ini konsinten dan objektif
pada laboratorium rutin pasien-pasien dengan penyakit hati kronis. 7. Fibroindeks menggunakan variabel yang umum dijumpai di klinik yaitu
trombosit, AST dan Gamma globulin.
8. Kombinasi AST, INR, trombosit (indeks GUCI) (29,34,57).
b. Petanda langsung (direct marker)
Fibrosis hati mengakibatkan petanda MES berubah secara kualitatif
dan kuantitatif karena petanda MES menggambarkan fibrogenesis dan regresi fibrosis. Petanda langsung yang potensial meliputi produksi sintesa atau degradasi kolagen, enzim yang terlibat pada biosintesa atau degradasi
langsung ideal melibatkan pembentukan dan pembersihan MES. Petanda langsung yang dilaporkan terhadap pergantian MES dilihat pada Tabel-2.
Kombinasi biomarker meliputi European Liver Fibrosis, Fibrospect, serum asam hyaluronat, AST, dan albumin (indeks SHASTA) (17,57).
Tabel-2. Petanda langsung terhadap deposit dan pembersihan MES 57
Petanda deposit MES
• Procollagen I C terminal
• Procollagen III N terminal
• Tenascin
• Tissue inhibitor of metalloproteinase TIMP
• TGF-
Petanda pembersihan MES
• Procollagen IV C peptide
• Procollagen IV N peptide (7-S collagen)
• Collagen IV
• Undulin
• Metalloproteinase MMP
• Urinary demosine and hydroxylysylpyridinoline Belum pasti
• Hyaluronan
• Laminin
• YKL-40 (chonrex)
2.5. FibroIndeks
FibroIndeks adalah penanda hati non invasif yang terdiri atas perhitungan SGOT, trombosit dan gamma globulin. Koda dkk mendapatkan penanda ini dengan membandingkan prediktor dari tingkat fibrosis yaitu usia,
pada analisis multivariat dengan analisis regresi yaitu trombosit, SGOT dan gamma globulin. Maka dirancang FibroIndeks dengan rumus(18)
FibroIndeks = 1,738 – 0,064 (trombosit [x104/mm3]) + 0,005 (SGOT [IU/L]) + 0,463 (gamma globulin [g/dl])
Koda dkk meneliti pada 360 pasien hepatitis kronik C dan menetapkan nilai cutoff untuk fibrosis yang signifikan : ≥ 2,25, fibrosis yang tidak signifikan : ≤ 1,25. Akurasi diagnostik untuk memperkirakan fibrosis tidak signifikan dengan sensitivitas 40,2%, spesifisitas 94,3%, positive predictive value 87%,
negative predicitive value 62,4%. Akurasi diagnostik untuk memperkirakan
fibrosis yang signifikan dengan sensitivitas 35,8%, spesifisitas 97,4%,
positive predictive value 94,3%, negative predicitive value 59,1%. AUROC untuk memprediksi fibrosis yang signifikan adalah 0,83. Koda dkk melakukan
penelitian dengan mono interferon alfa selama 6 bulan dan membandingkan penggunaan 3 penanda non invasif yaitu APRI indeks, Forn indeks dan
Fibroindeks untuk melihat penurunan atau peningkatan dari tingkat fibrosis. Ternyata pada pasien yang ada perbaikan, FibroIndeks menurun signifikan dari 1,82 ± 0,45 awalnya menjadi 1,35 ± 0,56 dengan p=0,0043. Pada pasien
dengan perburukan, FibroIndeks meningkat signifikan dari 1,70 ± 0,66 awalnya menjadi 2,09 ± 0,81 dengan p=0,043. Pada APRI indeks walau ada
penurunan signifikan pada pasien dengan perbaikan dari 1,24 ± 0,77 menjadi 0,69 ± 0,87 dengan p=0,043; tidak ada perbedaan yang signifikan pada APRI indeks pasien yang memburuk dari 1,29 ± 0,97 menjadi 2,22 ± 1,67 dengan
yang membaik dari 7,15 ± 1,74 menjadi 6,96 ± 2,11 dengan p=0,435 atau memburuk dari 7,33 ± 0,87 menjadi 8,66 ± 2,31 dengan p=0,225(18).
Perubahan histologis dari tingkat fibrosis berkorelasi dengan perubahan dari FibroIndeks (Spearman r =0,500 , p = 0,0072); tetapi tidak
dengan perubahan dari APRI indeks (Spearman r = 0.244, P =0,190) atau Forn indeks (Sperman r = 0,361, P=0,052)(18).
Parameter dari FibroIndeks ini tidak berkaitan satu dengan lainnya.
Beberapa studi mengkonfirmasi bahwa SGOT dan jumlah trombosit adalah prediktor independen untuk tingkat fibrosis(66-69). Serum gamma globulin
berhubungan dengan fibrosis hati dan shunt portosistemik. Serum ini menggambarkan inflamasi kronik di hati dan fenomena autoimun yang mengarahkan kepada fibrosis hati. Imbert-Bismuth dkk melaporkan bahwa
serum gamma globulin lebih tinggi pada pasien dengan skor F2-F3 dibanding
F0-F1(70). Ikeda dkk melaporkan bahwa serum gamma globulin adalah
parameter signifikan membedakan sirosis dari hepatitis kronik(71).
Pemeriksaan pada FibroIndeks (trombosit, SGOT dan gamma globulin) ini rutin dilakukan pada kebanyakan rumah sakit dan laboratorium
maka FibroIndeks selain dapat dipercaya juga dapat dilakukan di laboratorium manapun. Asam hyaluronat yang dilaporkan sebagai penanda
fibrosis yang paling berguna tetapi nilai diagnostiknya untuk fibrosis tingkat F2-F3 tidaklah lebih baik dibandingkan FibroIndeks. FibroIndeks mempunyai spesifisitas dan positive predictive value yang tinggi untuk mengidentifikasi
Adapun kelemahan dari FibroIndeks dengan memperhitungkan jumlah trombosit dimana pada pasien-pasien yang mendapatkan terapi interferon
terdapat efek samping penurunan jumlah trombosit sehingga bisa terjadi peningkatan tingkat fibrosis. Indeks ini kurang berguna pada pasien yang
mendapat terapi interferon ataupun kombinasi dengan ribavirin. Tetapi karena efek ini hilang pada akhir pengobatan sehingga indeks ini berguna sebagai penanda dari efek antifibrosis. Indeks ini sangat berguna memberi
informasi perjalanan penyakit pasien hepatitis C dan mengevaluasi efek antifibrosis pada beberapa pengobatan hepatitis C(18).
Penelitian lain yang menggunakan FibroIndeks sebagai petanda fibrosis hati adalah yang dilakukan oleh Halfon dkk pada 125 orang penderita hepatitis C kronik. Didapatkan AUC FibroIndeks untuk fibrosis signifikan lebih
BAB III
PENELITIAN SENDIRI 3.1. Latar Belakang
Hepatitis kronis B adalah penyakit nekroinflammasi hati kronis yang
disebabkan infeksi persisten virus hepatitis B (1). Diseluruh dunia diperkirakan terdapat 400 juta orang menderita hepatitis kronis B (72) dan 15% – 40% penderita berlanjut menjadi sirosis dan karsinoma hepatoseluler (24). Sirosis
dan penyakit hati tahap akhir disebabkan terbentuknya fibrosis hati pada keadaan kerusakan hati kronis yang bersamaan dengan penumpukan
protein matriks ekstraseluler (MES) di hati yang selanjutnya menyebabkan perubahan arsitektur hati dan pembentukan nodul regenerasi (5).
Injuri kronis dengan berbagai etiologi terhadap sel hati menghasilkan
fibrosis hati yang ditandai akumulasi berlebih dari protein MES. Kerusakan sel hati mengakibatkan sintesa protein MES meningkat (fibrogenesis) dan
menurun degradasi protein MES (fibrolisis). Sel yang paling berperan terhadap fibrogenesis hati adalah HSC.
Sekarang ini, belum tersedia terapi kuratif untuk fibrosis hati dan
pasien tergantung pada transplantasi hati (4,6,73). Sedangkan transplantasi hati membutuhkan organ, biaya mahal, problema serius dan gagal hati setelah
transplantasi merupakan beban mortaliti tinggi (74). Penelitian terkini menunjukkan bahwa fibrosis hati dan bahkan sirosis dapat reversibel telah
merubah dogma selama ini dan meningkatkan perhatian untuk mengembangkan
tantangan utama. Intervensi farmakologi terhadap anti-fibrosis yang efektif melalui 3 mekanisme meliputi: pencegahan fibrosis, fibrostasis, dan fibrolisis
(4,13)
. Telah dilaporkan, secara invivo dan invitro bahwa pentoxifylline sebagai anti-fibrosis yang bekerja pada HSC melaui mekanisme fibrostatis dan
fibrolisis pada MES dengan menghambat sitokin inflamasi TNF- , TGF- dan PDGF (6,69,75).
FibroIndeks adalah salah satu penanda non invasif yang terdiri atas
Serum Glutamic Oxaloacetic Transaminase (SGOT), trombosit dan gamma
globulin.Penelitian oleh Koda dkk membandingkan penggunaan FibroIndeks ini
terhadap penanda non invasif lainnya seperti Aminotransferase to Platelet Ratio
Index (APRI) dan Forn index. Ternyata dari hasil penelitian tersebut akurasi
FibroIndeks memprediksi fibrosis signifikan dan fibrosis berat dengan atau tanpa
sirosis lebih baik dibanding APRI dan Forn index.
3.2. Perumusan Masalah
Apakah terdapat perbedaan FibroIndeks pada penderita hepatitis kronis B sebelum pemberian dengan 4 minggu sesudah pemberian pentoxifylline.
3.3. Hipotesa
Penurunan FibroIndeks pada penderita hepatitis kronis B 4 minggu
3.4. Tujuan penelitian
Untuk mengetahui penurunan FibroIndeks pada penderita hepatitis
kronis B setelah pemberian pentoxifylline.
3.5. Manfaat penelitian
Dengan mengetahui penurunan nilai FibroIndeks pada penderita hepatitis kronis, dapat menentukan manfaat pentoxifylline sebagai salah satu alternatif obat antifibrotik pada penderita hepatitis kronis.
3.6. Kerangka Konsepsional
HSC tidak aktif HSC aktif
3.7. BAHAN DAN CARA 3.7.1. Desain Penelitian
Penelitian dilakukan secara uji klinis dengan perlakuan ulang (pre dan
post test design).
3.7.2. Definisi Operasional 3.7.2.1.Hepatitis Kronis B
Adalah hepatitis B dengan HBsAg menetap lebih dari 6 bulan dan
pada pemeriksaan USG abdomen didapatkan gambaran hati membesar atau normal, permukaan regular atau ireguler,
bertambahnya densitas gema parenkim hati yang heterogen, tepi hati tajam atau tumpul dengan peningkatan SGPT 1,3 kali nilai batas atas normal.
3.7.2.2. Sirosis hati (SH)
Kriteria diagnosis SH yang dipakai adalah pada pemeriksaan USG
didapatkan pelebaran vena porta, vena lienalis, splenomegali, permukaan hati noduler, ekostruktur hati heterogen, vena hepatika berkelok-kelok. Sirosis dekompensata bila sirosis hati disertai asites
dengan atau tanpa edema tungkai, ikterik, ensefalopati hepatik dan PSMBA.
3.7.2.3. Pentoxifylline
Tablet Trental® (pentoxifylline) oral mengandung
1) bahan aktif 1-(5-oxohexyl)-3, 7-dimethylxanthine 400 mg
FD&C Red No. 3
Hypromellose USP
Magnesium stearate NF Polyethylene glycol NF
Povidone USP
Talc USP
Titanium dioxide USP
Hydroxyethyl cellulose dalam formulasi lepas lambat
3.7.2.4. FibroIndeks
adalah salah satu penanda non invasif untuk fibrosis hati yang
terdiri atas Serum Glutamic Oxaloacetic Transaminase (SGOT),
trombosit dan gamma globulin. Perhitungan skor FibroIndeks
didapat dari rumus :
FibroIndeks = 1,738 – 0,064 (trombosit [x104/mm3]) +
0,005(SGOT [IU/L]) + 0,463 (gamma globulin [g/dl])
Skor ≤ 1,25 adalah bukan fibrosis, skor > 1,25 adalah fibrosis dan
diikutkan dalam penelitian.
3.7.3. Waktu dan Tempat Penelitian
Waktu penelitian antara bulan Februari 2008 – Juli 2008 di RS Haji
3.7.4. Populasi Terjangkau
Penderita hepatitis kronis B dengan HBsAg positif yang dirawat jalan
ataupun rawat inap dan dilakukan pemeriksaan klinis, darah rutin, fungsi hati, fungsi ginjal, SPE, USG hati.
3.7.5. Kriteria Inklusi
a. Penderita hepatitis kronis B naive
b. Usia diatas 18 tahun
c. Bersedia mengikuti penelitian
3.7.6. Kriteria Eksklusi
Penderita hepatitis kronis B dengan :
a. Riwayat perdarahan serebral b. Riwayat perdarahan retina
c. Riwayat angina pektoris
d. Riwayat pasca operasi 2 minggu
e. Sedang menggunakan obat – obat golongan theophylline,
cimetidine, warfarin
3.7.7. Populasi dan Sampel
Jadi besar sampel minimal 15 orang
3.7.8 . Cara Penelitian
a) Dilakukan skrining untuk kriteria yang dimasukkan dan yang dikeluarkan, kemudian subyek penelitian diminta untuk menandatangani persetujuan tertulis, setelah dilakukan pemeriksaan pendahuluan, termasuk anamnesis, pemeriksaan fisik, pemeriksaan USG dan laboratorium yang meliputi fungsi hati, HBsAg, ureum, kreatinin, darah perifer lengkap dan SPE. Data hasil pemeriksaan dicantumkan didalam kuesioner penelitian kemudian dihitung FibroIndeks.
b) Subyek penelitian satu kelompok yang mendapatkan pentoxifylline
c) Evaluasi pemakaian tablet baik pentoxifylline menggunakan sistim
pill count yaitu pasien diberi tablet untuk 1 minggu dan evaluasinya
dengan cara menghitung tablet yang tersisa.
d) Setelah 4 minggu pemakaian tablet, dilakukan pemeriksaan
laboratorium ulang terhadap subyek meliputi fungsi hati, ureum, kreatinin, darah perifer lengkap dan SPE dan dihitung FibroIndeks.
e) Selama penelitian dilakukan pengamatan terhadap efek samping yang dicatat didalam kuesioner.
3.7.9. Analisa Data
Untuk membandingkan penurunan FibroIndeks sebelum dan sesudah 4 minggu pemberian pentoxifylline dengan menggunakan
uji t berpasangan bila data terdistribusi normal dan uji wilcoxon bila data tidak terdistribusi normal.
3.7.10. Kerangka Operasional
SUBYEK Hepatitis Kronis B
FibroIndeks
Terapi Pentoxifylline 3 x400 mg selama 4 minggu
BAB IV
HASIL DAN PEMBAHASAN
4.1. HASIL PENELITIAN
4.1.1. Karakteristik Subyek Penelitian
Peserta yang menandatangani informed consent untuk mengikuti
penelitian berjumlah 16 orang. Satu orang peserta mengundurkan diri pada
hari kedua setelah mendapat terapi pentoxifylline. Alasan pengunduran diri adalah gejala nyeri ulu hati dan mual – mual yang dialami sehingga tidak
ingin melanjutkan penelitian.
Resume klinis pasien yang keluar dari penelitian adalah seorang perempuan berumur 52 tahun, telah menderita hepatitis B selama 2 tahun
dengan keluhan nyeri ulu hati dan mual – mual. Laboratorium didapatkan Hb 10 gr/dL, trombosit (248.103 u/L), GOT(1.594 u/L), GPT (758 u/L), albumin
(3,45u/L), gamma globulin (2,86 g/dL), kreatinin (1,34 mg/dL), FibroIndeks (9,44). Pada akhir penelitian, subyek berjumlah 15 orang.
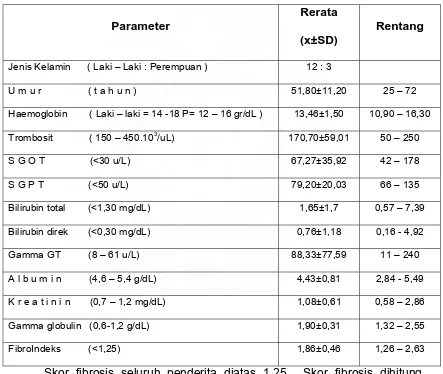
Pada tabel 3 diperlihatkan data dasar seluruh penderita hepatitis
kronis B yang ikut penelitian. Peserta berumur rerata 51,80±11,20 tahun dimana umur termuda 25 tahun dan umur tertua 72 tahun dengan jenis
kelamin 12 orang laki – laki dan 3 orang perempuan. Rerata Hb (gr/dL) adalah 13,46±1,50 (10,90–16,30) dimana didapatkan anemia sebanyak 20%, sedangkan rerata trombosit (103/uL) 170,73±59,01 (50–250). Seluruh peserta
rerata adalah 67,27±35,92 dan 79,20±20,03. Hiperbilirubinemia didapatkan sebanyak 40 % subyek dengan nilai rerata 1,65±1,7 mg/dL. Hipoalbuminemia
sebanyak 60 % dimana rerata albumin (mg/dL) adalah 4,43±0,81 (2,84 – 5,49).
Tabel 3. Karakteristik Dasar Subyek Penelitian
Parameter
Rerata (x±SD)
Rentang
Jenis Kelamin ( Laki – Laki : Perempuan ) 12 : 3
U m u r ( t a h u n ) 51,80±11,20 25 – 72
Haemoglobin ( Laki – laki = 14 -18 P= 12 – 16 gr/dL ) 13,46±1,50 10,90 – 16,30
Trombosit ( 150 – 450.103/uL) 170,70±59,01 50 – 250
S G O T (<30 u/L) 67,27±35,92 42 – 178
S G P T (<50 u/L) 79,20±20,03 66 – 135
Bilirubin total (<1,30 mg/dL) 1,65±1,7 0,57 – 7,39
Bilirubin direk (<0,30 mg/dL) 0,76±1,18 0,16 - 4,92
Gamma GT (8 – 61 u/L) 88,33±77,59 11 – 240
A l b u m i n (4,6 – 5,4 g/dL) 4,43±0,81 2,84 - 5,49
K r e a t i n i n (0,7 – 1,2 mg/dL) 1,08±0,61 0,58 – 2,86
Gamma globulin (0,6-1,2 g/dL) 1,90±0,31 1,32 – 2,55
FibroIndeks (<1,25) 1,86±0,46 1,26 – 2,63
dengan masing-masing nilai rata-rata dan range adalah: 170,73±59,01 (49 – 250), 67,27±35,92 (42 – 178), 1,90±0,31 (1,32 – 2,55)
4.1.2. Efek Terapi Pentoxifylline Selama 4 Minggu
Perubahan parameter klinis selama 4 minggu terapi pentoxifylline ditunjukkan pada tabel 4. Hal menarik dari penelitian ini terjadi penurunan
nilai rerata SGPT (79,20±20,03 vs 67,87±13,87 ; p=0,009),
SGOT(67,27±35,92 vs 53,4±19,77; p=0,029) dan bilirubin total (1,65±1,7 vs
1,16±0,71; p=0,004) yang secara statistik bermakna. Pada penelitian ini
didapatkan peningkatan albumin (4,43±0,81 vs 4,49±0,57; p=0,656) serta trombosit (170,70±59,01 vs 173,70±61,66; p=0,643) tetapi tidak bermakna
secara statistik. Dijumpai penurunan gamma globulin (1,90±0,31 vs
1,89±0,32; p=0,851) walau tidak bermakna secara statistik.
Penilaian efek jangka pendek terapi pentoxifylline sebagai antifibrosis
Tabel 4. Respon Terapi Pentoxifylline
Parameter Pre Pentoxifylline Post Pentoxifylline Nilai P
FibroIndeks(a)
Efek samping pemberian pentoxifylline dapat ditoleransi masing – masing pasien dan tidak dilakukan penyesuaian dosis selama 4 minggu.
Nausea dialami 8 orang (53%) pasien, nyeri ulu hati dialami 12(80%), sefalgia 1 orang(6%), dizzines 1 orang (6%), sedangkan gejala diare tidak ditemukan. Pasien yang mengalami gejala nyeri ulu hati dan nausea
mendapat obat omeprazole dan domperidon.
Pentoxifylline diekskresi melalui ginjal. Terdapat penurunan rerata serum kreatinin (1,12±0,69 vs 1,05±0,53) pada penelitian ini tetapi tidak
bermakna secara statistik dimana nilai p =0,421. Kreatinin bernilai abnormal pre pentoxifylline dan post pentoxifylline masing – masing adalah 1 orang
(2,67) dan 1 orang (2,86). Pada master tabel diperlihatkan masing – masing kreatinin subyek sebelum dan sesudah penelitian adalah 2,67 menjadi 2,25 dan 2,86 menjadi 2,23.
4.2. P E M B A H A S A N
Pada penelitian sebelumnya dilaporkan pentoxifylline berperan sebagai antifibrosis (46,76) yang bekerja dengan cara menghambat proliferasi HSC dan sintesa kolagen (13,75,76). Pada studi eksperimental, pentoxifylline
melalui penekanan respon inflammasi (TNF-α, IFN-γ, IL-4 dan TGF-β)(77,78).
Hasil penelitian Satapathy dkk (2004) pada penderita hati kronis akibat NASH
dilaporkan penurunan jumlah SGPT dan SGOT pada bulan pertama setelah terapi pentoxifylline (48). Penelitian ini mendapatkan penurunan kadar SGPT, SGOT dan bilirubin total yang bermakna secara statistik masing – masing
(79,20±20,03 vs 67,87±13,87 ; p=0,009), (67,27±35,92 vs 51,27±16,42; p=0,001) , (1,65±1,7 vs 1,16±0,71; p=0,004).
Trombositopenia merupakan komplikasi yang sering terjadi pada penyakit hati kronis, dihubungkan dengan memberatnya hipertensi portal sehingga mengakibatkan sekuestrasi dan destruksi trombosit oleh limpa yang
membesar. Selain itu, progresifitas fibrosis dihubungkan dengan menurunnya produksi thrombopoetin oleh hepatosit sehingga mengakibatkan produksi
trombosit berkurang(79,80). Pada penelitian ini didapatkan pengaruh pentoxifylline dapat meningkatkan rerata jumlah trombosit setelah pemberian 4 minggu (170,70±59,01 vs 173,70±61,66) tetapi tidak bermakna secara
statistik (p=0,643).
Serum gamma globulin berhubungan dengan fibrosis hati dan shunt
portosistemik. Serum ini menggambarkan inflamasi kronik di hati dan fenomena
autoimun yang mengarahkan kepada fibrosis hati. Imbert-Bismuth dkk
melaporkan bahwa serum gamma globulin lebih tinggi pada pasien dengan skor
F2-F3 dibanding F0-F1(70). Pada penelitian ini dijumpai penurunan gamma
1,89±0,32; p=0,851) yang sejalan dengan penurunan FibroIndeks walaupun
penurunan ini tidaklah bermakna secara statistik.
Fungsi biologi sel hepatosit sangat dipengaruhi perubahan komposisi
dan jumlah MES selama fibrogenesis. Penumpukan matriks diruang Disse
perisinusoid membentuk kapilerisasi tidak lengkap sehingga menghalangi
pertukaran aliran darah antara hepatosit dan sinusoid yang mengganggu fungsi bersihan dan biosintesis sel hepatosit (13,29). Hasil yang menarik dijumpai pada penelitian ini didapatkan peningkatan rerata jumlah albumin
setelah pemberian pentoxifylline 4 minggu (4,43±0,81 vs 4,49±0,57; p= p=0,656) tetapi tidak bermakna secara statistik .
Beberapa penelitian memperlihatkan hubungan bermakna antara skor FibroIndeks dengan derajat fibrosis hati dan fungsi hati pada penderita hepatitis C (18,19,20). Kami ingin membuktikan hipotesis penelitian, bahwa
terjadi penurunan skor fibrosis dengan terapi pentoxifylline selama 4 minggu. Berdasar uji-t berpasangan, hasil penelitian ini memperlihatkan terjadi
penurunan rerata skor fibrosis (1,86±0,46 vs 1,77 ± 0,46), tetapi tidak bermakna secara statistik (p=0,057).
Pada penelitian ini didapatkan hasil FibroIndeks yang meningkat pada
5 pasien setelah pemberian Pentoxyfilline selama 4 minggu dibanding sebelum pemberian. Walaupun secara rerata keseluruhan FibroIndeks
yang berbeda pada pasien penelitian ini akan mempengaruhi respon terapi dan bersihan virus sehingga mempengaruhi perjalanan dari fibrosis hati.
Fibrosis hati merupakan proses yang kompleks dan telah berlangsung lama. Studi sebelumnya, terapi pentoxifylline jangka panjang adalah efektif
mencapai parameter biokimia, dan resolusi histologi pada pasien NASH dengan pemberian pentoxifylline (3x400 mg) selama 12 bulan(49). Penelitian ini menunjukkan hasil perbaikan GOT, GPT dan billirubin total secara
bermakna. Selain itu peningkatan rerata trombosit dan albumin dijumpai tetapi tidak bermakna secara statistik. Penurunan rerata gamma globulin dan
skor FibroIndeks juga dijumpai walau tidak bermakna secara statistik. Manfaat pentoxifylline sebagai antifibrosis hati terlihat, tapi diperlukan waktu pemberian yang lebih lama dari waktu pemberian yang telah dilakukan agar
efektifitas pentoxifylline sebagai antifibrosis hati dapat tercapai.
Pada penelitian ini, efek samping yang ditimbulkan pentoxifylline
seperti flushing, weakness, nausea, perut gembung, sakit kepala dan muntah, dapat ditoleransi oleh pasien tanpa adanya pengurangan dosis. Hasil ini sesuai dengan penelitian – penelitian sebelumnya yang menemukan
efek samping minimal pada pasien yang diberikan pentoxifylline (47,48). Penelitian Satapathy ditemukan efek samping minimal dan hanya pada
sebagian pasien. Pentoxifylline aman dan berguna pemakaian jangka panjang pada penyakit peripheral vascular disease, ischemic heart disease,
BAB V
KESIMPULAN DAN SARAN
5.1. K E S I M P U L A N
5.1.1. Pada penelitian ini didapatkan bahwa terapi pentoxifylline 400 mg 3 kali sehari selama 4 minggu sebagai antifibrosis terhadap penderita hepatitis kronis B berdasarkan penilaian FibroIndeks
adalah tidak bermakna secara statistik
5.1.2. Parameter rerata SGOT, SGPT, Bilirubin total mengalami perbaikan secara bermakna pada penderita hepatitis kronis B setelah terapi pentoxifylline 400 mg 3 kali sehari selama 4 minggu. Sedangkan rerata albumin dan trombosit menunjukkan
perbaikan tetapi tidak bermakna secara statistik. Gamma globulin juga menunjukkan penurunan tetapi tidak bermakna
secara statistik
5.1.3. Efek samping pentoxifylline dapat ditoleransi seluruh pasien tanpa adanya penyesuaian dosis.
5.2. S A R A N
Pentoxifylline sebagai antifibrosis hati khususnya pada hepatitis kronis B sangat potensial. Diperlukan penelitian lebih lanjut dalam skala yang lebih besar dan jangka waktu yang lebih lama untuk mendapatkan
BAB VI
DAFTAR PUSTAKA
1. Lok ASF, McMahon BJ. AASLD Practice Guidelines Chronic Hepatitis B. Hepatology
2001; 34(6):1225 – 41.
2. Mohamed R, Desmond P, Lee CH, et al. REVIEW. Practical difficulties in the
management of hepatitis B in the Asia–Pacific region. J Gastroenterol Hepatol
2004;19:958-69
3. Ganem D, Prince AM. Review Article: Mechanism of Disease Hepatitis virus B infection
– Natural History and Clinical Consequences. N Engl J Med 2004;350:1118-29.
4. Bovenkamp VM , Groothuis G M M, Meijer D K F, Olinga P. Liver slices as a model
tostudy fibrogenesis and test the effects of anti-fibrotic drugs on fibrogenic cells in
human liver. Toxicology in vitro 2008; 22:771-8
5. Bataller R, Brenner DA. Liver Fibrosis.J. Clin. Invest 2005; 115:209–18.
6. Friedman SL. Molecular regulation of hepatic fibrosis an integrated cellular response to
tissue injury. J Biol Chem 2000; 275:2247 – 50.
7. Loterszjan S, Julien B, Clerc FT, Grenard P, Mallat A. Hepatic fibrosis: Molecular
mechanism and drugs targets. Annu Rev Pharmacol Toxicol 2005;45:605 – 28.
8. Hammel P, et al. Regression of liver fibrosis after biliary drainage in patients with
chronic pancreatitis and stenosis of the common bile duct. N. Engl. J. Med
2001;344:418–23.
9. Arthur M J. Reversibility of liver fibrosis and cirrhosis following treatment for hepatitis C.
Gastroenterology2002; 122:1525–8.
10. Pares A, Caballeria J, Bruguera M, Torres M, Rodes J. Histological course of
alcoholic hepatitis. Influence of abstinence, sex and extent of hepatic damage. J.
11. Dixon JB, Bhathal PS, Hughes NR, O’Brien PE. Nonalcoholic fatty liver disease:
Improvement in liver histological analysis with weight loss. Hepatology 2004;39:1647–
54.
12. Lee M K, Ha N R, Yang H, Sung S H, Kim G H, Kim Y C. Antiproliferative activity of
triter penoids from eclipta prostrata on hepatic stella cells. Phytomedicine 2008;
15:775-80
13. Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest
stellate cells and TGF - β as major players and therapeutic targets. J Cell Mol Med
2006; 10 :76 – 99.
14. Preaux AM, Mallat A, Rosenbaum J, Zafrani S, Mavier P. Pentoxifylline inhibits growth
and collagen synthesis of cultured human hepatic myofibroblast – like cells.Hepatology
1997; 26:315 – 22.
15. Mallat A, Preaux AM, Blazejewski S, Rosenbaum J, Dhumeaux D, Mavier P. Interferon
alfa and gamma inhibit proliferation and collagen synthesis of human Ito cells in
culture. Hepatology 1995;21:1003 – 10.
16. Kellerher TB, Afdhal N. Assesment of liver fibrosis in co – infected patients. J Hepatol
2000;44:126 – 31.
17. Kelleher TB, Afdhal N. Noninvasive assessment of liver fibrosis. Clin Liver Dis 2005;9:
667 – 83.
18. Koda M, Motunaga Y, Kawakami M, et al. FibroIndex, a Practical Index for Predicting
SigniÞcant Fibrosis in Patients with Chronic Hepatitis C. Hepatology 2007;45:297-306.
19. Halfon P, Penaranda G, Renou C, Bourliere M. External Validation of FibroIndex.
Hepatology 2007; 46(1):280-1.
20. Pichard V, Mallet A, Pol V. Predictive value of FIB-4 versus fibrotest, APRI,
FIBROINDEX and FORNS to noninvasively estimate fibrosis in hepatitis C. Hepatology
21. Beasley RP, Hwang LY, Lin CC, Leu ML, Stevens CE, Szmunes W, et al. Incidence of
hepatitis B virus in preschool children in Taiwan. J Infect Dis 1982;146:198 – 204.
22. Corsaget P, Ivonnet B,Chotard J, Vincelot P, Sart M, Diouf C, et al. Age and sex
related study of hepatitis B virus chronic carrier state in infants an endemic area
(Senegal). J Med Virol 1987;22: 1 – 5 .
23. McMahon BJ, Alward WLM, Hall DB, Heyward WL, Bender TR, Francis DP, et al.
Acute hepatitis B virus infection: relation of age to the clinical expression of disease
and subsequent development of the carrier state. J Infect Dis 1985; 151:599 – 605.
24. Maddrey WC.Hepatitis B:an important public health issue.J Med Virol 2000;61:362 – 6.
25. Beasley RP. Hepatitis B virus the major etiology of hepatocellular carcinoma.Cancer
1988;61: 1942 – 56.
26. Friedman SL. Liver fibrosis - from bench to bedside. J. Hepatol 2003; 38(Suppl.
1):S38–S53.
27. Benyon R C,Iredale JP. Is liver fibrosis reversible? Gut 2000; 46:443–6.
28. Arthur MJ. Fibrogenesis II. Metalloproteinases and their inhibitors in liver fibrosis. Am.
J. Physiol.Gastrointest. Liver Physiol2000;279:G245–9.
29. Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis. Clinica Chemical Acta
2006; 364:33–60.
30. Prosser CC, Yen RD, Wu J. Molecular therapy for hepatic injury and fibrosis: Where
are we?. Word J Gastroenterol 2006;12: 509-15.
31. Sato M, Suzuki S, Senoo H. Hepatic stellae cells: Unique characteristics in cell biology
and phenotype. Cell Structure and function. 2003; 28:105-12.
32. Schuppan D, Porov Y. Hepatic fibrosis: from bench to bedside. J Gastroenterol Hepatol
2002; 17:300-5.
33. Akpolat N,Yahsi S, Godekmerdan A, Demerbag K,Yalniz M. Relatioship
betweenserum cystokine levels and histopatological changes of liver in patients with
34. Hung CH, Lu SN, Wang JH, et al. Correlation between ultrasonographic and pathologic
diagnoses of hepatitis B and C virus-related cirrhosis. J Gastroenterol 2003; 38:153–7.
35. Poynard T, Mathurin P, Lai CL, et al. A comparison of fibrosis progression in chronic
liver diseases. J Hepatol 2003; 38:257–65.
36. Reyes GG. Ruiz M C G. Kershenobich D. Liver fibrosis and chronic viral hepatitis.
Archive of medical research 2007; 38:644-51.
37. Liu J, McIntosh H, Lin H. Chinese medical herbs for chronic hepatitis B : a systemic
review. Liver 2001; 21:280-6.
38. Hinze HJ, Bedessem G, Soder A. Structure of excretion products of
3,7-dimethyl-1-{5-oxo-hexyl}-xanthine (BL 191) in man. Arzenimittelforsch 1972;22:1144 – 51 .
39. Ward A, Clissold S. Pentoxifylline. A review of its pharmacodynamic and
pharmacokinetic properties, and its therapeutic efficacy. Drugs 1987;34:50 – 97.
40. Lin SL, Chen RH, Chen YM, Chiang WC, Tsai TJ, Hsieh BS. Pentoxifylline Inhibits
Platelet-Derived Growth Factor- Stimulated Cyclin D1 Expression in Mesangial Cells by
Blocking Akt Membrane Translocation. Mol Pharmacol 2003; 64:811–22.
41. Mei FC, Qiao J, Tsygankova OM, Meinkoth JL, Quilliam LA, Cheng X. Differential
signaling of cyclic AMP: opposing effects of exchange protein directly activated by
cyclic AMP and cAMP protein directly activated by cyclic AMP and cAMP dependent
protein kinase on protein kinase B activation. JBC 2002; 277(13):11497 -504.
42. Raetsch C, Jia JD, Boigk G, Bauer M, Hahn EG, Riecken EO, et al. Pentoxifylline
downregulates profibrogenic cytokines and procollagen I expression in rat secondary
biliary fibrosis. Gut 2002;50;241-7.
43. Xiong LJ, Zhu JF, Luo DD, Zen LL, Cai SQ. Effects of pentoxifylline on the hepatic
content of TGF-b1 and collagen in Schistosomiasis japonica mice with liver fibrosis.
44. Eleftheriadis E, Kotzampassi, Koufogians D. Modulation of intravariseal pressure with
pentoxifylline : a possible new approach in the treatment of portal hypertension. The
Am J Gastroenterol 1998;93:2431 – 51.
45. Akriviadis E, Botla R, Briggs W. Pentoxifylline improves short – term survival in severe
acute alcoholic hepatitis: A double – blind, placebo – controlled trial. Gastroenterology
2000; 119(6):1637 -48 .
46. Adams LA, Zein CO, Angulo P, Lindor KD. A Pilot trial of pentoxifylline in nonalcoholic
steatohepatitis. Am J Gastroenterol2004; 99:2365 – 8.
47. Austin AS, Mahida YR, Clarke D, Ryder SD, Freeman JG. A pilot study to investigate
the use of oxpentifylline (pentoxifylline) and thalidomide in portal hypertension
secondary to alcoholic cirrhosis. Aliment Pharmacol Ther 2004; 19: 79 – 88.
48. Satapathy SK, Garg S, Chauhan R, et al. Benefecial effects of tumor necrosis factor-
Inhibition by pentoxifylline on clinical, biochemical, and metabolic parameters of
patients with nonalcoholic steatohepatis. Am J Gastroenterol 2004; 99:1946-52
49. Satapathy KS,Sakhuja P, Malhotra V, Sharma BJ, Sarin SK. Beneficial effects of
pentoxifylline on hepatic steatosis, fibrosis and necroinflammation in patients with
non-alcoholic steatohepatitis. J Gastroenterol Hepatol 2007; 22:634–38
50. Tanikella R, Philips GM, Faulk DK, Kawut SM,Falllon MB. Pilot study pentoxifyllline in
hepatopulmonary syndrome. Liver Transpl 2008; 14:1199-203.
51. Fontaine H. Efficacy and safety of pentoxifylline and tocopherol on the fibrosis in
patients with chronic hepatitis C. Clinical Trial.gov. Augustus, 2008.
52. Crouch S, Fletcher J. Effect of ingested pentoxifylline on neutrophil superoxide anion
production. Infect and Immun.1992; 60:4504-9.
53. Luke DR, Rocci ML, Hoholick C. Inhibition of pentoxifylline clearance by cimetidine. J
Pharm Sci 1986;75: 155-7.
54. Mauro VF, Mauro LS, Hagernan JH. Alteration of pentoxifylline pharmacokinetics by