LAPORAN PRAKTIKUM BIOKIMIA PERCOBAAN KE VII
KINETIKA REAKSI ENZIM
Disusun Oleh:
Nama dan NPM : Ambar Puspita Madyaningratri 10060313055 : Irma Astri Pebriliani 10060313056
: Tri Marleni 10060313057
: Ramli Maulana Latief 10060313058
Shift : C
Kelompok : 1
Nama Asisten : Ilham Kholikul, S.Farm. Tgl. Praktikum : Selasa, 17 Maret 2015 Tgl. pengumpulan Laporan : Selasa, 24 Maret 2015
LABORATORIUM FARMASI TERPADU UNIT B PROGRAM STUDI FARMASI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS ISLAM BANDUNG
Tujuan dilakukannya praktikum ini adalah agar mahasiswa dapat mengetahui dan memahami kinetika reaksi enzim dan faktor-faktor yang mempengaruhi kondisi optimum suatu enzim.
II. Teori Dasar
Enzim dan Kinetika Reaksi Enzim
Enzim atau biokatalisator adalah katalisator organik yang dihasilkan oleh sel. Enzim sangat penting dalam kehidupan, karena semua reaksi metabolisme dikatalis oleh enzim. Jika tidak ada enzim, atau aktivitas enzim terganggu maka reaksi metabolisme sel akan terhambat hingga pertumbuhan sel juga terganggu. Reaksi-reaksi enzimatik dibutuhkan agar bakteri dapat memperoleh makanan/ nutrient dalam keadaan terlarut yang dapat diserap ke dalam sel, memperoleh energi kimia yang digunakan untuk biosintesis, perkembangbiakan, pergerakan, dan lain-lain. (Poedjiadi, 2006)
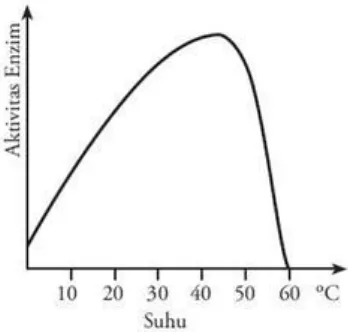
Gambar 1. Pengaruh suhu terhadap fungsi enzim
Gambar 2. Pengaruh pH terhadap fungsi enzim
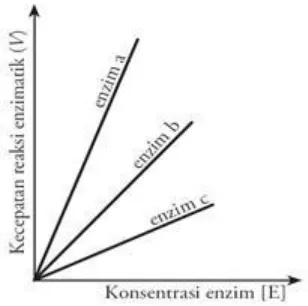
Kadar enzim yang tinggi akan mempengaruhi kecepatan reaksi secara linier (kecepatan bertambah konstan). Dapat dikatakan bahwa hubungan antara konsentrasi enzim dengan kecepatan reaksi enzimatis berbanding lurus. kecepatan reaksi suatu enzim satu dengan yang lain berbeda-beda meskipun mempunyai konsentrasi enzim yang sama. Konsentrasi enzim yang sangat tinggi dalam suatu sistem yang kompleks akan berpengaruh terhadap terhadap kecepatan reaksi. (Dwidjoseputro, 1992)
Gambar 3. Pengaruh konsentrasi enzim terhadap fungsi enzim
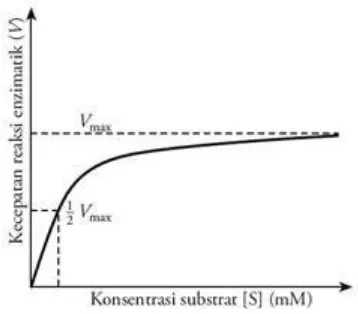
Gambar 4. Pengaruh konsentrasi substrat terhadap fungsi enzim
Mekanisme
Enzim dapat bekerja dengan beberapa cara, yang kesemuaannya menurunkan ΔG‡:
Menurunkan energi aktivasi dengan menciptakan suatu lingkungan yang mana keadaan transisi terstabilisasi (contohnya mengubah bentuk substrat menjadi konformasi keadaan transisi ketika ia terikat dengan enzim.)
Menurunkan energi keadaan transisi tanpa mengubah bentuk substrat dengan menciptakan lingkungan yang memiliki distribusi muatan yang berlawanan dengan keadaan transisi.
Menyediakan lintasan reaksi alternatif. Contohnya bereaksi dengan substrat
sementara waktu untuk membentuk kompleks Enzim-Substrat antara.
Menurunkan perubahan entropi reaksi dengan menggiring substrat bersama pada orientasi yang tepat untuk bereaksi. Menariknya, efek entropi ini melibatkan destabilisasi keadaan dasar, dan kontribusinya terhadap katalis relatif kecil. (Anonim1, 2015)
mengkonsumsi suplemen enzim. Kekurangan enzim akan menyebabkan tubuh mengalami gangguan pencernaan atau dalam istilah kedokteran disebut maldigesti, yang selanjutnya dapat menyebabkan gangguan pencernaan atau malabsorbsi. Di sisi lain, kekurangan enzim juga akan mengakibatkan timbulnya gas yang berlebih di dalam sistem pencernaan, baik di lambung maupun usus halus dan usus besar (Almatsier, 2003).
Kinetika reaksi enzimatis dapat digunakan untuk menentukan kadar enzim. Kinetika reaksi enzimatik dapat diukur dengan mengukur jumlah substrat yang diubah atau produk yang dihasilkan per satuan waktu, dan pada suatu waktu yang sangat pendek, atau pada satu titik tertentu pada grafik disebut kecepatan sesaat (instantaneus velocity). Kecepatan sesaat merupakan tangens dari garis singgung terhadap grafik pada suatu titik tertentu. Kecepatan sesaat pada waktu mendekati nol, yaitu saat grafik masih berupa garis lurus disebut kecepatan awal (Vo). Pada reaksi enzimatis, jika disebut kecepatan, umumnya yang dimaksud adalah kecepatan awal. Hal ini disebabkan karena pada keadaan awal reaksi, kita dapat mengetahui kondisi/ keadaan dengan lebih tepat. Disamping kecepatan sesaat dan Vo, juga dikenal istilah kecepatan rata-rata, yaitu perbandingan antara perubahan jumlah substrat terhadap waktu (Poedjiadi, 1994).
akan meningkat bersamaan dengan peningkatan suhu, laju berbagai proses metabolisme akan naik sampai batasan suhu maksimal. Prinsip biologis utama adalah homeostatis, yaitu keadaan dalam tubuh yang selalu mempertahankan keadaan normalnya. Perubahan relatif kecil saja dapat mempengaruhi aktivitas banyak enzim. Adanya inhibitor non kompetitif irreversibel dan antiseptik dapat menurunkan aktivitas enzim. Kecepatan reaksi mula-mula meningkat dengan menaiknya suhu, hal ini disebabkan oleh peningkatan energi kinetik pada molekul-molekul yang bereaksi. Akan tetapi pada akhirnya energi kinetik enzim melampaui rintangan energi untuk memutuskan ikatan hidrogen dan hidrofobik yang lemah, yang mempertahankan struktur sekunder-tersiernya. Pada suhu ini terjadi denaturasi enzim menunjukkan suhu optimal. Sebagian besar enzim suhu optimalnya berada diatas suhu dimana enzim itu berada. Ada dua metode analisis kuantitatif kinetika reaksi enzim, yaitu asas keseimbangan Michaelis-Menten dan asas teori keadaan tunak (steady state theory) Briggs-Haldone. Persamaan Michaelis-Menten merupakan persamaan kecepatan reaksi enzimatik substrat tunggal yang menyatakan hubungan kuantitatif kecepatan reaksi awal (Vo), kecepatan reaksi maksimum (Vmaks), konsentrasi substrat [S], dan konstanta Michaelis-Menten [KM] (Murray, 2003).
Pada praktikum ini yang digunakan adalah enzim tripsi. Berikut penguraian enzim tipsin:
Tripsinogen merupakan enzim inaktif yang harus diaktifkan terlebih dahulu oleh enzim enterokinase yang dihasilkan oleh usus halus. Tripsinogen berubah menjadi tripsin yang aktif. Tripsin mengubah protein menjadi peptida dan asam amino. (Almatsier, 2003).
Tripsinogen masuk usus kecil, biasanya melalui cairan empedu dimana tripsinogen diubah menjadi tripsin aktif. (Alghamdi, 2010).
Fungsi enzim tripsin adalah mengubah protein menjadi bentuk yang lebih sederhana, seperti pepton dan asam amino. Enzim tripsin dihasilkan oleh kelenjar pankreas dan dialirkan ke usus 12 jari (duodenum).Selain itu fungsi enzim tripsin adalah untuk mengubah tripsinogen menjadi tripsin aktif dan menghidrolisis protein yang dihasilkan oleh pancreas. (Poedjiadi, 2006).
Manfaat enzim tripsin adalah untuk membuat vaksin meningitis dari pankreas babi dan yang berperan adalah enzim tripsin di dalam pankreas babi. (Sectiocadavaris, 2011)
Pada praktikum ini substrat yang digunakan adalah kasein. Berikut penguraian kasein:
Kasein merupakan golongan protein yang komposisinya mencapai 80% dari komposisi keseluruhan protein susu. Protein kasein terbagi menjadi beberapa komponen, komponen yang umum dijumpai adalah αs1-kasein, αs2-kasein, β-kasein, dan κ-kasein. (Anonim, 2014)
Protein kasein memiliki daerah hidrofobik dan hidrofilik yang bervariasi. Kasein relatif tidak sensitif terhadap panas, dibutuhkan temperatur diatas 120°C untuk merusak struktur kasein hingga menjadi tidak larut dalam air. Di sisi lain, kasein cukup sensitif terhadap pH, maka itu protein kasein akan mengendap pada titik isoelektriknya. Protein kasein mempunyai masa molekul sebesar 106 hingga 109
Protein kasein bersama dengan kalsium fosfat, dapat membentuk semacam partikel koloid yang terdispersi, yang disebut misel (micelles). Karena protein kasein berupa suspensi, protein tersebut dapat dipisahkan dari campuran menggunakan
sentrifugasi. Setelah sentrifugasi, beberapa protein tertingal di dalam larutan. Protein yang larut di dalam supernatan tersebut disebut protein whey. (Anonim, 2014)
Kasein mengandung asam beragam asam amino yang diperlukan mamalia
muda untuk tumbuh.Karena memiliki protein berkualitas tinggi seperti kasein, susu sapi dianggap sebagai salah satu makanan manusia yang paling penting.Lebih jauh lagi, protein kasein terdesain untuk berikatan dengan kalsium fosfat, yang secara langsung mengendap pada lambung bayi baru lahir. Hal ini membuat protein tersebut mudah dicerna. Karena protein kasein dinilai mempunyai signifikansi yang besar terhadap kehidupan manusia, struktur kasein telah dipelajari secara menyeluruh, akan tetapi struktur pasti kasein masih diperdebatkan. (Anonim, 2014)
Analisa kuantitatif pada praktikum ini menggunakan instrument spektrofotometer uv-visible, di mana penjabaran tentang sprektrofotometri dan instrument spektrofotometer sebagai berikut:
Hukum Lambert-Beer menyatakan hubungan linieritas antara absorban dengan konsentrasi larutan analit dan berbanding terbalik dengan transmitan. Dalam hukum Lambert-Beer tersebut ada beberapa pembatasan, yaitu :
– Sinar yang digunakan dianggap monokromatis
– Penyerapan terjadi dalam suatu volume yang mempunyai penampang yang sama – Senyawa yang menyerap dalam larutan tersebut tidak tergantung terhadap yang lain dalam larutan tersebut
– Tidak terjadi fluorensensi atau fosforisensi
– Indeks bias tidak tergantung pada konsentrasi larutan
Hukum Lambert-Beer dinyatakan dalam rumus sbb :
A = e.b.c dimana : A = absorban
e = absorptivitas molar b = tebal kuvet (cm) c = konsentrasi
INSTRUMEN SPEKTROFOTOMETRI UV – VIS
PRINSIP KERJA
HAL – HAL YANG PERLU DIPERHATIKAN
1. Larutan yang dianalisis merupakan larutan berwarna
Apabila larutan yang akan dianalisis merupakan larutan yang tidak berwarna, maka larutan tersebut harus diubah terlebih dahulu menjadi larutan yang berwarna. Kecuali apabila diukur dengan menggunakan lampu UV.
2. Panjang gelombang maksimum
Panjang gelombang yang digunakan adalah panjang gelombang yang mempunyai absorbansi maksimal. Hal ini dikarenakan pada panajgn gelombang maksimal, kepekaannya juga maksimal karena pada panjang gelombang tersebut, perubahan absorbansi untuk tiap satuan konsentrasi adalah yang paling besar. Selain itu disekitar panjang gelombang maksimal, akan terbentuk kurva absorbansi yang datar sehingga hukum Lambert-Beer dapat terpenuhi. Dan apabila dilakukan pengukuran ulang, tingkat kesalahannya akan kecil sekali.
3. Kalibrasi Panjang gelombang dan Absorban
Spektrofotometer digunakan untuk mengukur intensitas cahaya yang dipancarkan dan cahaya yang diabsorbsi. Hal ini bergantung pada spektrum elektromagnetik yang diabsorb oleh benda. Tiap media akan menyerap cahaya pada panjang gelombang tertentu tergantung pada senyawa yang terbentuk. Oleh karena itu perlu dilakukan kalibrasi panjang gelombang dan absorban pada spektrofotometer agar pengukuran yang di dapatkan lebih teliti.
(Rohman, 2007)
Alat Bahan
Tabung reaksi Larutan TCA 20%
Batang pengaduk Larutan kasein 2% (b/v)
Pipet ukur 1 mL, 5 mL, 10 mL Larutan dapar fosfat 0,1M pH 8
Pipet tetes Larutan NaOH
Disiapkan 5 tabung reaksi. Dimasukan larutan buffer fosfat dan tripsin dan tambahkan masing-masing 3 mL larutan TCA 20%, aduk perlahan, dan diinkubasi selama 30menit dalam water bath 35oC. Setelah 30 menit di tambahakan larutan kasein dan didiamkan selama 20 menit dalam air es. Seletah itu disentrifugasi 10 menit dan disaring melalui kertas saring untuk diambil supernatannya. Lalu dilakukan metode anson pada hasil filtrate tersebut.
dicampurkan 2mL TCA-Filtrat dengan 4mL NaOH 0.5 M kemudian ditambahkan 1 mL larutan Folin-Ciocalteu ( 1 volume reagen ditambah 1 volume aquadest). Kemudian diamkan 10 menit dan ditetapkan ditambah TCA 20% larutan berwarna bening tidak ada endapan. Kemudian diinkubasi semua tabung tetap berwarna bening.
Tabung Setelah ditambahkan Kasein dan didinginkan
I Larutan bening, sedikit putih keruh diatas II Larutan bening, sedikit putih keruh diatas III Larutan bening, larutan berwarna putih keruh di bagian
atas
IV ¾ bagian putih keruh
Tabung t = 20 menit
Setelah semua tabung diisi dengan kasein yang berwarna putih keruh.
Tabung Setelah didinginkan dan ditambahkan TCA20%
I Bening
II Agak putih
III Keruh, terdapat gumpalan putih tersebar
2. Menghitung V
Vtotal = V setiap tabung
5. Grafik Lineweaver-Burk
0 500 1000 1500 2000 2500 3000 3500 4000 0
Hubungan antara 1/S dengan 1/V
Hubungan antara 1/S dengan 1/V
Linear (Hubungan antara 1/S dengan 1/V)
1/S
1
/V
b
(gradien)=
KM Vmaks 1
Vmaks = a maka, Vmaks = 1 a
Vmaks = 1 79.811
Vmaks = 0.0125 ppm/menit
KM =
b
(gradien)x VmaksKM = 0.9548 x 0.0125
KM = 0.011935
Gambar
Gambar tabung t=0 setelah ditambahkan kasein dan didinginkan.
VI. Pembahasan
Pada praktikum kali ini dilakukan uji untuk mengetahui kinetika reaksi enzim yang berikatan dengan substrat.
Pertama-tama pengujian dilakukan pada saat t = 0 menit.
senyawa berwarna biru kehijauan agar dapat diukur serapannya pada instrument spektrofotometer yang memiliki syarat bahwa larutan harus bersifat netral, tidak boleh asam maupun basa, dan larutan yang diukur serapannya harus memiliki warna agar dapat terbaca.
Setelah kelima supernatant telah berwarna, segera dilakukan pencarian nilai absorbansi yang sebelumnya harus ditunggu selama 10 menit guna mengoptimalkan kerja reagen Folin-Ciocalteu terhadap supernatant. Pengujian dilakukan pada panjang gelombang 650 nm (panjang gelombang sinar tampak). Lalu di dapatlah hasil beberapa serapan seperti yang ada pada data pengamatan.
Pengujian dilakukan pada saat t = 20 menit.
Setelah itu kelima tabung disentrifugasi, kemudian disaring untuk diambil supernatantnya. Filtrate yang sudah didapat selanjutnya dilakukan dengan metode Anson. Perlakuannya sama, ditambahkan NaOH untuk menetralkan asam dari TCA, dan ditambahkan reagen Folin-Ciocalteu untuk member warna pada supernatant agar dapat diuji pada instrument spektrofotometer, dan pengujian juga dilakukan pada panjang gelombang 650 nm. Kemudian data absorbansi dari maing-masing supernatant dapat diperoleh sesuai yang dicantumkan pada data pengamatan.
Penjelasan Kurva
Kurva pertama adalah kurva Michealis-Menten, pada kurva ini terlihat fluktuatif sehingga sulit sekali ditentukan Vmaks dari kurva tersebut. Seharusnya kurva yang terbentuk seperti:
absorbansinya, sehingga tidak memungkinkan praktikan pada kelompok ini untuk memakai data absorbansi dari kelompok 2.
Kurva yang kedua adalah kurva Linewaver-Burk, kurva ini dibuat dengan tujuan agar kurva yang dihasilkan memiliki kemiringan sehingga dapat dengan tepat didapatkan hasil regresi yang digunakan untuk menghitung nilai Vmaks dan KM.
Kesimpulan dari kedua kurva adalah bahwa kemampuan berikatan enzim dan substrat menurun akibat beberapa faktor, baik dari konsentrasi enzimnya, konsentrasi substratnya, senyawa tambahan yang bersifat menghentikan mekanisme kerja ezim berikatan dengan substrat, dan suhu serta pH optimum enzim.
Nilai Vmaks yang dihasilkan seharusnya sedikit lebih besar karena jika konsentrasi substrat meningkat, maka hal tersebut dapat meningkatkan kecepatan awal reaksi serta meningkatkan kemampuan enzim untuk berikatan dengan substrat. Dan saat sudah dalam keadaan enzim yang jenuh akibat banyaknya substrat akan dihasilkan nilai Vmaks yang konstan, nilai ini seharusnya cukup besar jika kemampuan berikatan enzim dan substatnya benar-benar tinggi, namun hasil yang praktikan dapatkan yaitu nilai Vmaks hanya 0,0118 dan nilai KM = 0,01192. Yang menandakan benar bahwa kemampuan berikatan enzim dan substrat menurun ditandai tidak besarnya nilai Vmaks yang dihasilkan. Dan karena nilai Vmaks kecil, maka mempengaruhi hasil dari nilai KM juga, sehingga nilai KM yang didapat juga kecil.
VII. Kesimpulan
1. Kerja enzim dipengaruhi oleh beberapa faktor, yaitu pH, suhu, konsentrasi enzim dan konsentrasi substrat
3. Metode yang dilakukan pada percobaan kinetika kerja enzim ada tiga metode yaitu, metode Michaelis-Menten (penentuan kurva 1), Lineweaver-Burk (penentuan kurva 2) dan metode Anson (pencarian nilai serapan masing-masing supernatant).
4. Nilai absorbansi yang dihasilkan dari percobaan pada tiap tabung t=0 dan t=20 cenderung mengalami peningkatan.
5. Grafil Michaelis-Menten memberikan kurva yang fluktuatif.
6. Grafik Lineweuver-burk yang dihasilkan yang dihasilkan dari praktikum ini tidak linier atau tidak lurus.
7. Nilai Vmax yang didapat = 0.0125 ppm/menit 8. Nilai Km yang didapat = 0.011935
DAFTAR PUSTAKA
Almatsier, Sunita. 2003. Prinsip Dasar Ilmu Gizi.Jakarta: Gramedia PustakaUtama
Dwijoseputro.1992.Pengantar Fisiologi Tumbuhan.Jakarta: Gramedia Pustaka Utama
Murray, R. K., dkk.2003.Harper’s Illustraterd Biochemistry 26th Edition.USA:
McGraw-Hill Companies
Poedjiadi, Anna.1994.Dasar-dasar Biokimia.Jakarta: UI Press
Poedjiadi, Anna. dan F.M. Titin Supriyanti.2006.Dasar-Dasar Biokimia.Jakarta: UI Press
Rohman, Abdul.2007.Kimia Farmasi Analisis.Yogyakarta: Pustaka Pelajar
Alghamdi, Amani. 2010. Trypsin Activity.
http://amanialghamdi.wordpress.com/Trypsin-Activity/
Diakses pada 21 Maret 2015
Pukul 18:15
Anonim.2014.Kasein.http://id.wikipedia.org/wiki/Kasein
Diakses pada 21 Maret 2015
Pukul 18:17
Anonim1.2015.Enzim.http://id.wikipedia.org/wiki/Enzim
Diakses pada 21 Maret 2015
Pukul 18:20
Anonim2.2015.pH Optimum Enzim. http://www.worthington-biochem.com/introbiochem/effectsph.html
Pukul 18:21
Biologipedia. 2011. Cara Kerja Enzim
Tripsin. http://Biologipedia.wordpress.com/2011/0…
Diakses pada 21 Maret 2015
Pukul 18:23
Sectiocadavaris. 2011.Peran Enzim. http://sectiocadaveris.wordpress.com/artikel-
kedokteran/peran-enzim-dalam-metabolisme-dan-pemanfaatannya-di-bidang-diagnosis-dan-pengobatan/
Diakses pada 21 Maret 2015