IDENTIFIKASI FLAVONOIDA HASIL FRAKSINASI
DENGAN KROMATOGRAFI KOLOM VAKUM
EKSTRAK METANOL-AIR HERBA PEGAGAN
EMBUN (Hydrocotyle sibthorpioides Lmk.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh :
Anita Devi Ariesnawati NIM : 038114057
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
“Being Aware of
Ignorance is the First Step
to Develop……”
Dedicated to:
Papa, Mama and Mas Aris…
INTISARI
Pegagan Embun (Hydrocotyle sibthorpioides Lmk.) dipercayai dapat mengobati sakit kuning (hepatitis), batu empedu, kencing batu, infeksi saluran kencing, batuk, sesak nafas, sariawan, radang tenggorokan, amandel, infeksi telinga tengah (Anonim, 2005). Dimungkinkan bahwa flavonoida berperan dalam mengatasi penyakit di atas. Anonim (2005) menyebutkan adanya kandungan flavonoida dalam pegagan embun yaitu hiperin. Penelitian ini diarahkan untuk menentukan golongan flavonoida lain yang ada dalam herba pegagan embun dan diharapkan hasil penelitian ini dapat memberi informasi tentang kandungan aktif senyawa obat alami
Serbuk diekstraksi dengan metanol-air (9:1 dan 1:1) dan penyarian dilakukan dengan maserasi. Fraksinasi flavonoida dari ekstrak dilakukan dengan kromatografi kolom vakum. Fase diam yang digunakan adalah selulosa, sedangkan fase geraknya adalah BAW (4:1:5 v/v,fase atas). Pemeriksaan kandungan flavonoida dilakukan dengan kromatografi lapis tipis dengan menggunakan fase diam dan fase gerak yang sama dengan yang digunakan pada kromatografi kolom. Deteksi bercak dilakukan dengan sinar ultraviolet λ 365 nm dan uap amonia.
Identifikasi menggunakan KLT menghasilkan dua bercak yaitu ungu (Rf
0,86 yang selanjutnya disebut isolat flavonoida) dan biru (Rf 0,76). Isolasi bercak dilakukan dengan KLTP. Bercak ungu dikerok kemudian dilarutkan dalam metanol dan disaring, lalu diuji kemurniannya. Pemeriksaan kemurnian isolat flavonoida menggunakan kromatografi multi eluen yang menunjukkan bahwa isolat flavonoida sudah murni secra kromatografi. Pemeriksaan dilanjutkan menggunakan reaksi warna dan spektroskopi ultraviolet dengan penambahan pereaksi geser.
Berdasarkan analisis data dari KLT, reaksi warna dan spektroskopi ultraviolet menunjukkan bahwa isolat flavonoida diduga mempunyai golongan flavon dengan kemungkinan struktur parsial 7,3’,4’ trihidroksi flavon atau 7,4’,5’ trihidroksi flavon.
Kata kunci : flavonoida, kromatografi, spektroskopi,Hydrocotyle sibthorpioides.
ABSTRACT
Pegagan embun (Hydrocotyle sbthorpioides. Lmk) is believed can cure hepatitis, kidney stone, urethra infection, cough, short winded, ulcer, throat inflammation, tonsil, middle chamber ear infection, (Anonym, 2005). It is possible that flavonoid plays important roles in curing such diseases. Anonym (2005) mentions that pegagan embun contains flavonoid, which is hyperin. This research is aimed at determining another type of flavonoid that exists in the pegagan embun herbs and it is hoped that the finding of the research will provide information to invent new medicine.
Powder is extracted using methanol – water (9:1 and 1:1) and the extraction is done using maseration. Flavonoid fractionation from the extract is done using vacuum column chromatography. Stationer phase used is cellulose, while mobile phase is BAW (4:1:5 v/v, upper phase). The investigation of flavonoid content is done by employing thin layer chromatography (TLC) using stationer and mobile phase similar to what is used in the vacuum column chromatography. The spot detection is done using ultraviolet ray λ 365 nm and ammonia steam.
Identification using TLC results two spots, they are purple ( Rf 0,86 which is called flavonoid isolate then) and blue (Rf 0,76). Spot isolation is done by using Preparative Thin Layer Chromatography (PTLC). The purple spot is scrapped and dissolved in the methanol and filtered, and then the genuineness is tested. The genuineness check up of flavonoid isolate is using multi eluen chromatography that indicates that flavonoid isolate is genuine in terms of chromatography. The check up continues with color reaction and ultraviolet spectroscopy with an addition of shift reagent.
Based on the data analysis from TLC, color reaction and ultraviolet spectroscopy shows that flavonoid isolate has flavone type with the possibility partial structure 7,3’,4’ trihydroxy flavone or 7,4’,5’ trihydroxy flavone.
Keywords: flavonoid, chromatography, spectroscopy, Hydrocotyle sibthorpioides.
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus yang telah
memberikan limpahan kasih-Nya sehingga penulis dapat menyelesaikan skripsi
berjudul “Identifikasi Flavonoida Hasil Fraksinasi dengan Kromatografi Kolom
Vakum Ekstrak Metanol-Air Herba Pegagan Embun (Hydrocotyle sibthorpioides
Lmk.)”. Penyusunan skripsi ini dimaksudkan sebagai salah satu syarat memperoleh
gelar Sarjana Farmasi (S. Farm) pada Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
Dalam penyusunan dan menyelesaikan skripsi ini penulis telah banyak
memperoleh bantuan dari berbagai pihak. Pada kesempatan ini penulis ingin
menyampaikan ucapan terima kasih kepada:
1. Rita Suhadi, M.Si., Apt. selaku Dekan Farmasi Universitas Sanata Dharma
Yogyakarta.
2. Yohanes Dwiatmaka, M.Si. selaku dosen pembimbing yang telah dengan sabar
membimbing dan mengarahkan penulis baik pada penyusunan usulan penelitian,
penelitian dan penyusunan skripsi ini.
3. Erna Tri Wulandari, M.Si. selaku dosen penguji yang memberikan masukan,
kritik, dan saran dalam skripsi ini.
4. Christine Patramurti, M.Si., Apt. selaku Ketua Panitia Skripsi Fakultas Farmasi
Universitas Sanata Dharma sekaligus dosen penguji yang banyak membantu serta
memberikan masukan, kritik, dan saran dalam skripsi ini.
5. Dr. Pudjono selaku dosen Farmasi Universitas Sanata Dharma yang memberikan
bantuan dan masukan yang berharga.
6. Seluruh staf dan karyawan Laboratorium Biologi Fakultas Farmasi Universitas
Sanata Dharma Yogyakarta.
7. Seluruh staf dan karyawan Laboratorium Kimia Analisis dan Kimia Analisis
Instrumen Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
8. Papa, Mama dan Mas Aris yang telah memberikan doanya, dukungan dan cinta
sehingga memotivasi penulis dalam menyelesaikan studi dan skripsi ini.
9. Timur Pamenang dengan segala kesabarannya telah mendampingi dan banyak
membantu dalam menyelesaikan skripsi ini.
10.Mbok Nah dan Yu Dhar, yang sudah setia menemani saya sejak sebelum saya
lahir hingga sekarang.
11.My best friends, Komang, Ocha, Titien, Ratna, Anin, Madya, Hartono, Essy,
Hani, Tata, Silih, Nia, Jule, Bodonx, Phian and Pharmacy 2003 fellows for your
support, time, laughter, hatred and every lesson we have learned to grow together.
12.Every single person that I have met, who has supported me so much so that I can
compile this thesis, who I never met but has given an obvious lesson during my
study, who I cannot mention his or her name here and now.
Penulis menyadari, skripsi ini jauh dari sempurna, untuk itu penulis membuka
diri untuk menerima kritik dan saran demi kesempurnaan skripsi ini.
Akhirnya, penulis berharap hasil peneltitan ini dapat bermanfaat dan
memberikan sumbangan bagi perkembangan ilmu dan pengetahuan.
Yogyakarta, 15 Agustus 2007
Penyusun
Anita Devi Ariesnawati
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN MOTTO DAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
INTISARI ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... xi
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN... xviii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Permasalahan ... 3
C. Keaslian Penelitian ... 3
D. Manfaat Penelitian ... 3
E. Tujuan Penelitian ... 4
BAB II. PENELAAHAN PUSTAKA ... 5
A. Tanaman Pegagan Embun (Hydrocotyle sibthorpioides Lmk.) ... 5
1. Keterangan Botani ... 5
2. Nama Lokal ... 5
3. Morfologi Tanaman ... 5
4. Penyebaran ... 6
5. Kegunaan ... 6
B. Flavonoida ... 7
C. Penyarian ... 9
1. Cairan Penyari ... 9
2. Ekstraksi ... 9
D. Kromatografi Kolom Vakum ……… 11
E. Kromatografi Lapis Tipis ... 12
F. Kromatografi Lapis Tipis Preparatif ... 13
G. Identifikasi Flavonoida ... 13
1. Reaksi Warna ... 13
2. Kromatografi Lapis Tipis……… 14
3. Spektroskopi Ultraviolet ... 15
H. Keterangan Empiris ... 24
BAB III. METODOLOGI PENELITIAN ... 25
A. Jenis dan Rancangan Penelitian ... 25
B. Definisi Operasional ... 25
C. Bahan Penelitian ... 25
D. Alat Penelitian ... 26
E. Jalannya Penelitian ... 26
F. Tata Cara Analisis Hasil ... 32
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 33
A. Determinasi Tanaman ... 33
B. Ekstraksi Herba Pegagan Embun ... 33
C. Isolasi dengan Kromatografi Kolom Vakum ... 34
D. Isolasi Flavonoida dengan Kromatografi Lapis Tipis ... 35
E. Isolasi Flavonoida dengan Kromatografi Lapis Tipis Preparatif ... 37
F. Pemeriksaan Kemurnian Isolat Flavonoida ... 38
G. Identifikasi Flavonoida dengan Reaksi Warna ... 42
H. Identifikasi Spektrum Isolat Flavonoida dengan Spektroskopi Ultraviolet ... 43
BAB V. KESIMPULAN DAN SARAN ... 56
A. Kesimpulan ... 56
B. Saran ... 56
DAFTAR PUSTAKA ... 57
LAMPIRAN ... 59
DAFTAR TABEL
I. Penafsiran bercak dari segi struktur flavonoida ... 14
II. Reaksi warna beberapa golongan flavonoida ... 15
III. Rentangan serapan spektrum UV pada flavonoida... 18
IV. Penafsiran spektrum ultraviolet flavonoida dengan penambahan NaOH... 21
V. Penafsiran spektrum ultraviolet flavonoida dengan penambahan NaOAc.... 22
VI. Penafsiran spektrum ultraviolet flavonoida dengan penambahan NaOAc dan H3BO3 ... 22
VII. Penafsiran spektrum ultraviolet flavonoida dengan penambahan AlCl3 serta AlCl3 dan HCl ... 23
VIII.Data kromatogram dari bercak fraksi herba pegagan embun menggunakan fase diam selulosa dan fase gerak BAW (4:1:5 v/v, fase atas) deteksi dengan sinar UV 365 nm sebelum dan sesudah diuapi amonia ... 37
IX. Reaksi warna isolat flavonoida herba pegagan embun ... 42
X. Data spektrum dan pergeseran yang terjadi setelah diberi pereaksi – pereaksi kimia ... 44
XI. Perbandingan data spektrum isolat flavonoida dengan hiperin dalamn MeOH dan NaOMe... 46
XII. Perbandingan data spektrum isolat flavonoida dengan hiperin dalamn MeOH dan AlCl3/ HCl... 50
XIII.Perbandingan data spektrum isolat flavonoida dengan hiperin dalamn MeOH
dan NaOAc/ H3BO3... 54
DAFTAR GAMBAR
1. Struktur hiperin ……… 6
2. Tata cara penomoran flavonoida ………. 7
3. Penggolongan umum flavonoida ………. 8
4. Kerangka dasar flavonoida ... 17
5. Reaksi antara Flavon dengan amonia ... 36
6. Kromatogram isolasi flavonoida dengan KLTP ... 39
7. Kromatogram pemeriksaan kemurnian isolat flavonoida ... 40
8. Kromatogram pemeriksaan kemurnian isolat flavonoida ... 41
9. Spektrum UV isolat flavonoida dalam MeOH dan NaOH ... 45
10. Spektrum UV hiperin dalam MeOH dan NaOMe ... 46
11. Reaksi antara Flavon dengan NaOH ... 47
12. Spektrum UV isolat flavonoida dalam MeOH dan AlCl3 ... 48
13. Spektrum UV isolat flavonoida dalam AlCl3 dan HCl ... 49
14. Spektrum UV hiperin dalam MeOH dan AlCl3/HCl ... 50
15. Reaksi antara Flavon dengan AlCl3/HCl ... 51
16. Spektrum UV isolat flavonoida dalam MeOH dan NaOAc ... 52
17. Reaksi antara Flavon dengan NaOAc ... 52
18. Spektrum UV isolat flavonoida dalam MeOH dan NaOAc/ H3BO3 ... 53
19. Spektrum UV hiperin dalam MeOH dan NaOAc/ H3BO3 ... 54
20. Reaksi antara Flavon dengan NaOAc/ H3BO3 ... 55
DAFTAR LAMPIRAN
Lampiran 1. Determinasi tanaman pegagan embun
(Hydrocotyle sibthorpioides Lmk.) ... 60
Lampiran 2. Kromatogram pemeriksaan kandungan flavonoida dengan kromatografi lapis tipis... 61
Lampiran 3. Alat kromatografi kolom vakum ... 62
Lampiran 4. Pegagan Embun (Hydrocotyle sibthorpioides Lmk.) ... 63
Lampiran 5. Reaksi warna isolat flavonoida herba pegagan embun... 64
BAB I
PENDAHULUAN
A. Latar belakang
Indonesia yang kaya dengan berbagai macam sumber alam telah
memanfaatkan tumbuh-tumbuhan sebagai bahan obat tradisional secara
turun-temurun. Akan tetapi hanya sedikit tumbuhan yang berkhasiat sebagai bahan obat
tersebut yang telah diteliti kandungan kimia dan efek farmakologinya. Oleh
karena itu perlu dilakukan penelitian tentang zat aktif yang terkandung dalam
tumbuhan tersebut, untuk selanjutnya tumbuhan yang semula digunakan sebagai
obat tradisional dapat digunakan dalam bentuk sediaan obat modern. Tumbuhan
tersebut salah satunya adalah pegagan embun (Hydrocotyle sibthorpioides Lmk.)
yang belum banyak dikenal masyarakat.
Pegagan embun tumbuh merayap, ramping, subur di tempat lembab,
terbuka maupun teduh di pinggir jalan, pinggir selokan, lapangan rumput dan
tempat lain sampai setinggi kira-kira 2.500 m dari permukaan laut (Anonim,
2005).
Pegagan embun dapat dimanfaatkan untuk mengobati sakit kuning
(hepatitis), batu empedu, kencing batu, infeksi saluran kencing, batuk, sesak
nafas, sariawan, radang tenggorokan, amandel, dan infeksi telinga tengah
(Anonim, 2005). Kandungan kimia yang diketahui terdapat dalam pegagan
embun, antara lain minyak atsiri, kumarin, hiperin (Anonim, 2005). Hiperin
(kuersetin 3-O-galaktosida) merupakan salah satu senyawa flavonoida yang
disebutkan sebagai salah satu kandungan kimia yang terdapat dalam pegagan
embun. Pada umumnya suatu tanaman yang memiliki kandungan flavonoida
memiliki lebih dari satu jenis senyawa flavonoida (Markham,1988).
Dimungkinkan masih terdapat kandungan senyawa flavonoida lain yang ada
dalam pegagan embun selain hiperin.
Flavonoida merupakan salah satu kandungan zat aktif yang banyak
terkandung dalam tumbuh-tumbuhan dan mempunyai berbagai macam aktivitas
biologis. Senyawa flavonoida berkhasiat sebagai anti radang, bersifat bakterisid,
anti jamur, dan anti histamin (Harborne, 1984). Kandungan flavonoida di dalam
herba pegagan embun dimungkinkan berperan penting dalam pengobatan
beberapa penyakit yang telah disebutkan di atas. Oleh karena itu perlu dilakukan
upaya untuk mengisolasi dan mengidentifikasi kandungan flavonoida yang ada
dalam suatu tumbuhan.
Penelitian ini dilakukan untuk mengisolasi dan mengidentifikasi
flavonoida lain dalam herba pegagan embun. Metode fraksinasi yang digunakan
adalah kromatografi kolom vakum karena dapat memisahkan suatu senyawa
dengan cepat. Hasil dari penelitian ini diharapkan dapat memberi informasi
3
B. Permasalahan
Permasalahan yang ada dalam penelitian ini adalah :
1. Golongan flavonoida apa yang terdapat dalam herba pegagan embun selain
hiperin ?
2. Bagaimana prakiraan struktur parsialnya ?
C. Keaslian Penelitian
Sejauh pengetahuan peneliti yang berdasar pada penelusuran terhadap
beberapa sumber, telah dilakukan penelitian mengenai kandungan flavonoida
dalam pegagan embun. Hasil penelitian mengenai kandungan flavonoida
sebelumnya menyatakan bahwa hiperin terdapat dalam pegagan embun (Anonim,
2005). Penelitian ini berusaha untuk mengisolasi dan mengetahui golongan
flavonoida lain yang terkandung dalam herba pegagan embun.
D. Manfaat Penelitian
Penelitian yang dilakukan terhadap ekstrak metanol-air herba pegagan
embun diharapkan dapat memberikan manfaat sebagai berikut :
1. Secara praktis
Untuk memberikan informasi dalam bidang ilmu kefarmasian khususnya dalam
bidang farmakognosi tentang golongan flavonoida yang terkandung dalam herba
2. Secara teoritis
Diharapkan dapat memberikan sumbangan ilmiah terhadap eksplorasi
kandungan aktif senyawa obat alami .
E. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui golongan flavonoida yang
terkandung dalam herba pegagan embun selain hiperin dan melakukan prakiraan
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Pegagan Embun 1. Keterangan botani
Pegagan embun (Hydrocotyle sibthorpioides Lmk.) merupakan
salah satu anggota familia Umbelliferae (Apiaceae). Pegagan embun mempunyai
sinonim H.rotundifolia Roxb.,dan H.formosana Masamune (Anonim, 2005).
2. Nama lokal :
Pegagan embun, antanan beurit, antanan lembut (Sunda) ; andem,
katepa’n, rending, semanggi (jawa), salatun ; take cena (Madura), tikim,
patikim ; tian hu sui (China) (Anonim,2005).
3. Morfologi tanaman
Pegagan embun tumbuh merayap, ramping, subur di tempat
lembab, terbuka maupun teduh di pinggir jalan, pinggir selokan, lapangan
rumput dan tempat lain sampai setinggi kira-kira 2.500 m dari permukaan laut
(Anonim, 2005).
Tumbuhan pegagan embun mempunyai batang lunak dan
bercabang-cabang. Daunnya majemuk menjari tiga yang anak daunnya
berbentuk jantung dengan warna hijau muda. Bunga keluar dari ketiak daun,
berwarna kuning berbentuk payung kecil-kecil. Buah berupa kotak lonjong,
tegak, bagian ujungnya seperti paruh, bila sudah masak berwarna coklat
merah yang pecah bila disentuh (Anonim, 2004).
4. Penyebaran
Tanaman pegagan embun tumbuh liar pada tempat-tempat yang
lembab, terbuka maupun yang teduh di sisi jalan atau lapangan rumput. Di
pulau Jawa tumbuhan ini terdapat dari pantai sampai pegunungan dengan
ketinggian 3.000 meter diatas permukaan laut (Anonim, 2004)
5. Kegunaan
Pegagan embun dapat digunakan untuk mengobati sakit kuning
(hepatitis), batu empedu, batu dan infeksi saluran kencing, batuk dan sesak
nafas, sariawan, radang tenggorokan, amandel, infeksi telinga tengah
(Anonim, 2005).
Kandungan kimia yang diketahui terdapat dalam pegagan embun, antara
lain minyak atsiri, kumarin, hiperin (Anonim, 2005). Hiperin mempunyai nama
lain kuersetin 3-O-galaktosida (Gambar 1) (Anonim,2007).
O
OH
OH
O HO
OH
galaktosa
O
7
B. Flavonoida
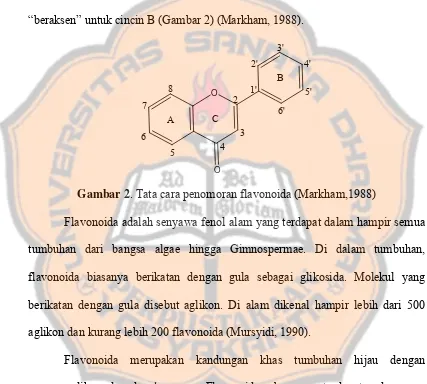
Flavonoida adalah golongan senyawa alam yang strukturnya terdiri dari 2
cincin aromatik yang dihubungkan oleh tiga atom karbon membentuk rangka
dengan sistem C6-C3-C6; masing-masing C6 merupakan cincin benzene. Untuk
memudahkan dalam penomoran cincin diberi tanda A, B dan C, serta angka
“beraksen” untuk cincin B (Gambar 2) (Markham, 1988).
O
Gambar 2. Tata cara penomoran flavonoida (Markham,1988)
Flavonoida adalah senyawa fenol alam yang terdapat dalam hampir semua
tumbuhan dari bangsa algae hingga Gimnospermae. Di dalam tumbuhan,
flavonoida biasanya berikatan dengan gula sebagai glikosida. Molekul yang
berikatan dengan gula disebut aglikon. Di alam dikenal hampir lebih dari 500
aglikon dan kurang lebih 200 flavonoida (Mursyidi, 1990).
Flavonoida merupakan kandungan khas tumbuhan hijau dengan
mengecualikan alga dan hornwort. Flavonoida sebenarnya terdapat pada semua
bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, nektar, bunga,
buah buni, dan biji (Markham, 1988).
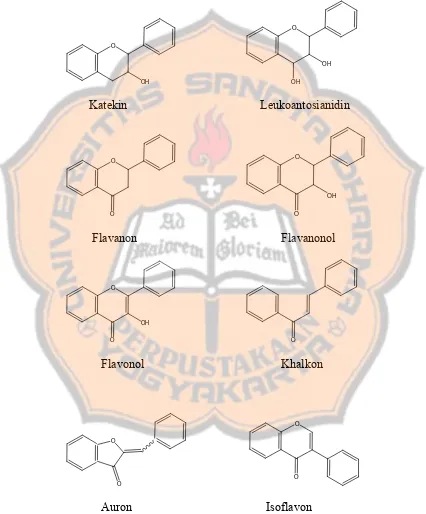
Perbedaan penggolongan di dalam kelompok flavonoida dibedakan
flavonoida meliputi katekin, leukoantosianidin, flavanon, flavanonol, flavon,
antosianidin, flavonol, khalkon, auron, dan isoflavon (Gambar 3) (Kaufman dkk,
1999).
O
OH
O
OH
OH
Katekin Leukoantosianidin
O
O
O
OH
O
Flavanon Flavanonol
O
OH
O O
Flavonol Khalkon
O
O
O
O
Auron Isoflavon
9
Flavonoida mempunyai aktivitas estrogenik, diuretik, hipotensif, anti
histamin, bersifat bakterisida dan anti jamur. Flavonoida juga dapat berkhasiat
sebagai anti radang, zat ini terutama berguna dalam menjaga kesehatan (Harborne,
1984). Flavonoida sering merupakan pereduksi yang baik, menghambat
banyaknya reaksi oksidasi, baik secara enzim maupun nonenzim. Flavonoida
tertentu mempunyai aktivitas anti oksidan yang digunakan secara tradisional
mengobati penyakit hati (Robinson, 1995).
C.Penyarian 1. Cairan penyari
Pemilihan cairan penyari harus mempertimbangkan banyak faktor antara
lain: mudah atau murah diperoleh, mudah menguap, tidak mudah terbakar,
selektif yaitu hanya mengekstraksi zat yang berkhasiat yang diinginkan, dan
tidak mempengaruhi zat berkhasiat, bereaksi netral, stabil secara fisika dan
kimia (Anonim,1986).
2. Ekstraksi
Cara penyarian dapat dibedakan menjadi infundasi, maserasi, perkolasi
dan penyarian berkesinambungan (Anonim,1986).
a.Infundasi
Infus adalah sediaan cair yang dibuat dengan menyari simplisia dengan
air pada suhu 90ْ C selama 15 menit. Infundasi adalah proses penyarian yang
umumnya digunakan untuk menyari zat kandungan aktif yang larut dalam air
tidak stabil dan mudah tercemar oleh kuman dan kapang. Oleh sebab itu sari
yang diperoleh dengan cara ini tidak boleh disimpan lebih dari 24 jam.
b. Maserasi
Maserasi merupakan cara penyarian yang sederhana. Maserasi dilakukan
dengan cara merendam serbuk simplisia dalam cairan penyari. Cairan penyari
akan menembus dinding sel dan masuk ke dalam rongga sel yang
mengandung zat aktif, zat aktif akan larut dan karena adanya perbedaan
konsentrasi antara larutan zat aktif di dalam sel dengan yang di luar sel, maka
larutan yang terpekat didesak ke luar. Peristiwa tersebut berulang sehingga
terjadi keseimbangan konsentrasi antara larutan diluar sel dan di dalam sel.
c. Perkolasi
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan
cairan penyari melalui serbuk simplisia yang telah dibasahi. Prinsip perkolasi
adalah serbuk simplisia ditempatkan dalam suatu bejana silinder, yang bagian
bawahnya diberi sekat berpori. Cairan penyari dialirkan dari atas ke bawah
melalui serbuk tersebut, cairan penyari akan melarutkan zat aktif sel-sel yang
dilalui sampai mencapai keadaan jenuh.
d. Penyarian berkesinambungan
Penyarian berkesinambungan memiliki prinsip menghasilkan ekstrak cair
yang kemudian dilanjutkan dengan proses penguapan cairan penyari. Cairan
penyari diisikan pada labu, serbuk simplisia diisikan pada tabung dari kertas
saring atau tabung yang berlubang-lubang dari gelas, baja tahan karat atau
11
penyari akan mengembun karena didinginkan oleh pendingin balik kemudian
embun turun melalui serbuk simplisia sambil melarutkan zat aktifnya dan
kembali ke labu. Cairan akan menguap kembali berulang proses seperti diatas.
D. Kromatografi Kolom Vakum
Isolasi flavonoida dapat ditingkatkan hampir ke skala industri dengan
menggunakan kromatografi kolom. Pada dasarnya, cara ini meliputi penempatan
campuran flavonoida (berupa larutan) di atas kolom yang berisi serbuk penjerap
(seperti selulosa, silika, poliamida), dilanjutkan dengan elusi beruntun setiap
komponen memakai pelarut yang cocok (Markham, 1988).
Kromatografi kolom vakum merupakan metode yang sederhana dan
memerlukan waktu yang relatif singkat untuk melakukan pemisahan. Metode ini
dapat digunakan untuk pemisahan campuran baik dalam jumlah sedikit maupun
banyak. Pemilihan sistem pelarut yang tepat didapat dengan percobaan analisis
kromatografi lapis tipis. Metode kromatografi kolom vakum menggunakan sebuah
perlengkapan yang sederhana dan murah yang dapat diterapkan pada laboratorium
E. Kromatografi Lapis Tipis (KLT)
KLT merupakan metode pemisahan komponen-komponen atas dasar
perbedaan adsorpsi atau partisi oleh fase diam di bawah gerakan pelarut
pengembang atau pelarut pengembangan campur. Pemilihan pelarut
pengembangan atau pelarut pengembangan campur sangat dipengaruhi oleh
macam dan polaritas zat-zat kimia yang dipisahkan (Mulja, 1995).
Keserbagunaan KLT disebabkan oleh kenyataan bahwa di samping
selulosa, sejumlah penjerap yang berbeda-beda dapat disaputkan pada pelat kaca
atau penyangga lain dan digunakan untuk kromatografi. Kecepatan KLT yang
lebih besar disebabkan oleh sifat penjerap yang lebih padat bila disaputkan pada
pelat dan merupakan keuntungan bila kita menelaah senyawa labil. Akhirnya,
kepekaan KLT sedemikian rupa sehingga bila diperlukan dapat dipisahkan bahan
yang jumlahnya lebih sedikit dari ukuran μg (Harborne, 1987).
Bilangan Rf adalah jarak yang ditempuh senyawa pada kromatografi, nisbi
terhadap garis depan. Bilangan Rf diperoleh dengan mengukur jarak antara titik
awal dan pusat bercak yang dihasilkan senyawa, dan jarak ini kemudian dibagi
dengan jarak antara titik awal dan garis depan (yaitu jarak yang ditempuh cairan
pengembang). Bilangan ini selalu berupa pecahan dan terletak antara 0,01 dan
13
F. Kromatografi Lapis Tipis (KLT) Preparatif
KLT Preparatif dilakukan dengan menggunakan lapisan tebal (sampai 1
mm) sebagai pengganti lapisan penjerap yang tipis (0,10-0,25 mm). Pelat
preparatif yang dibuat oleh pabrik dapat dibeli. Kandungan yang sudah dipisah
dapat diperoleh kembali dengan cara mengerok penjerap di tempat yang sesuai
pada pelat yang telah dikembangkan, lalu serbuk dielusi dengan pelarut seperti
eter, dan akhirnya dipusingkan untuk menghilangkan penjerap (Harborne, 1987).
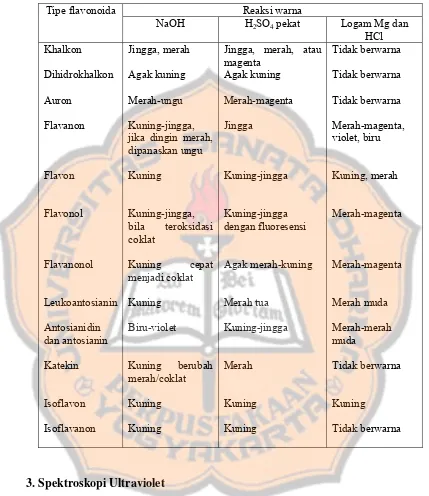
G. Identifikasi Flavonoida 1. Reaksi Warna
Flavonoida dapat dideteksi dengan amoniak, jika tidak bercampur dengan
pigmen lain. Reaksi ini memberikan warna spesifik untuk masing-masing
golongan. Flavon, flavonol dan xantin memberikan warna kuning kemerahan,
antosianin menunjukkan warna biru, flavonol berwarna orange sampai coklat,
warna merah dan lembayung akan timbul mendadak pada suasana asam
disebabkan adanya khalkon dan auron (Robinson, 1995).
Penelitian fitokimia lazimnya diawali dengan pengujian kimiawi tertentu,
seperti larutan natrium hidroksida, asam sulfat pekat, besi (III) klorida, logam
magnesium, asam klorida (Venkataraman, 1962; Harborne,1984).
Uji warna selanjutnya didukung analisis spektroskopi ultraviolet,
inframerah, spektroskopi inti dan massa (Mabry dkk,1970; Markham,1988;
2. Kromatografi Lapis Tipis
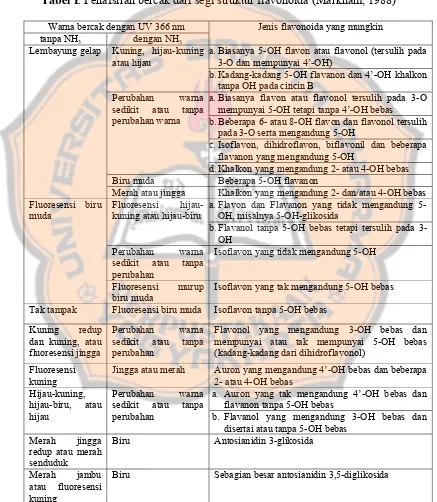
Identifikasi flavonoida dengan kromatografi lapis tipis dilakukan dengan
mengamati warna bercak sebelum dan sesudah diuapi amonia dengan
dibandingkan dengan pustaka (Tabel I) (Markham,1998).
Tabel I. Penafsiran bercak dari segi struktur flavonoida (Markham, 1988)
Warna bercak dengan UV 366 nm Jenis flavonoida yang mungkin
tanpa NH3 dengan NH3
a.Biasanya 5-OH flavon atau flavonol (tersulih pada 3-O dan mempunyai 4’-OH)
Kuning, hijau-kuning atau hijau
b.Kadang-kadang 5-OH flavanon dan 4’-OH khalkon tanpa OH pada cincin B
a.Biasanya flavon atau flavonol tersulih pada 3-O mempunyai 5-OH tetapi tanpa 4’-OH bebas
b.Beberapa 6- atau 8-OH flavon dan flavonol tersulih pada 3-O serta mengandung 5-OH
c.Isoflavon, dihidroflavon, biflavonil dan beberapa flavanon yang mengandung 5-OH
Perubahan warna sedikit atau tanpa perubahan warna
d.Khalkon yang mengandung 2- atau 4-OH bebas
Biru muda Beberapa 5-OH flavanon
Lembayung gelap
Merah atau jingga Khalkon yang mengandung 2- dan/atau 4-OH bebas a.Flavon dan Flavanon yang tidak mengandung
5-OH, misalnya 5-OH-glikosida Fluoresensi
hijau-kuning atau hijau-biru
b.Flavanol tanpa 5-OH bebas tetapi tersulih pada 3-OH
Perubahan warna sedikit atau tanpa perubahan
Isoflavon yang tidak mengandung 5-OH Fluoresensi biru
muda
Fluoresensi murup biru muda
Isoflavon yang tak mengandung 5-OH bebas
Tak tampak Fluoresensi biru muda Isoflavon tanpa 5-OH bebas
Kuning redup dan kuning, atau fluoresensi jingga
Perubahan warna sedikit atau tanpa perubahan
Flavonol yang mengandung 3-OH bebas dan mempunyai atau tak mempunyai 5-OH bebas (kadang-kadang dari dihidroflavonol)
Fluoresensi kuning
Jingga atau merah Auron yang mengandung 4’-OH bebas dan beberapa 2- atau 4-OH bebas
a. Auron yang tak mengandung 4’-OH bebas dan flavanon tanpa 5-OH bebas
Hijau-kuning, hijau-biru, atau hijau
Perubahan warna sedikit atau tanpa
perubahan b. Flavanol yang mengandung 3-OH bebas dan
disertai atau tanpa 5-OH bebas Merah jingga
redup atau merah senduduk
Biru Antosianidin 3-glikosida
Merah jambu atau fluoresensi kuning
15
Tabel II. Reaksi warna beberapa golongan flavonoida (Venkataraman, 1962)
Reaksi warna jika dingin merah, dipanaskan ungu
Jingga, merah, atau magenta
3. Spektroskopi Ultraviolet
Dasar metode ini adalah interaksi antara radiasi elektromagnetik dengan
atom, molekul atau ion, di daerah ultraviolet dan daerah sinar tampak. Energi
yang diserap menyebabkan elektron tereksitasi dari orbital tingkat dasar ke
Beberapa istilah dalam spektroskopi ultraviolet (Sastrohamidjojo, 2001):
a. Kromofor
Suatu gugus tak jenuh kovalen yang dapat menyerap radiasi dalam
daerah-daerah ultraviolet dan terlihat. Contoh: C=C, C=O.
b. Auksokrom
Suatu gugus jenuh yang bila terikat pada kromofor mengubah panjang
gelombang dan intensitas serapan maksimum. Ciri auksokrom adalah
heteroatom yang langsung terikat pada kromofor, misal: -OCH3, -Cl, -OH
dan NH2.
c. Pergeseran batokromik (pergeseran merah)
Pergeseran serapan kearah panjang gelombang yang lebih panjang
disebabkan substitusi atau pengaruh pelarut.
d. Pergeseran hipsokromik (pergeseran biru)
Pergeseran serapan kearah panjang gelombang yang lebih pendek
disebabkan substitusi atau pengaruh pelarut.
e. Efek hiperkromik
Kenaikan dalam intensitas serapan.
f. Efek hipokromik
17
Struktur flavonoida terdiri dari dua cincin aromatik dan ikatan rangkap
terkonjugasi, sehingga dapat menunjukkan pita serapan pada spektrum
ultraviolet dan serapan sinar tampak (Gambar 4). Flavonoida merupakan
senyawa yang mempunyai struktur sebagian besar dengan pola flavon (Mabry
dkk, 1970).
Sistem konjugasi
Benzoil Cinnamoyl
Gambar 4. Kerangka dasar flavonoida (Mabry dkk, 1970)
Energi ultraviolet dapat diukur karena spektrum serapan timbul dari
transisi elektronik tunggal mengandung garis yang tunggal dan terputus-putus.
Garis ini tidak akan terlihat jika serapan elektronik berhimpit pada sub tingkat
putaran dan getaran. Spektrum molekul sederhana mengandung puncak serapan
yang sempit menggambarkan suatu transisi dari kombinasi tertentu dari tingkat
dasar elektronik dengan yang sesuai di dalam tingkat tereksitasi. Kekhasan dari
pita serapan adalah letak dan intensitasnya.
Pola spekrum flavonoida biasanya memberikan dua puncak pada rentang λ
240 – 285 nm (puncak I) dan λ 300 – 350 nm (puncak II). Panjang gelombang
sifat dan pola oksigenasi flavonoida. Ciri khas spektrum tersebut memberikan
puncak relatif rendah pada pita I untuk golongan: hidroflavon, dihidroflavonol,
dan isoflavon dengan kedudukan pita I dalam spektrum: khalkon, auron, dan
antosianin terdapat pada panjang gelombang yang relatif tinggi. Ciri ini tidak
berubah meskipun pada oksigenasi berubah. Petunjuk mengenai letak puncak
maksimum (Tabel III) (Markham, 1988).
Tabel III. Rentangan serapan spektrum UV pada flavonoida (Markham, 1988)
Pita II (nm) Pita I (nm) Jenis Flavonoida
250-280 310-350 Flavon
250-280 330-360 Flavonol (3-OH tersubstitusi)
250-280 350-385 Flavonol 3-OH bebas
245-275 310-330 Isoflavon
320-329 Isoflavon 5-deoksi-6,7 dioksigenasi
275-295 300-330 Flavanon dan dihidroflavonol
230-270
270-280 465-560 Antosianin, antosianidin
Flavon, isoflavon dan dihidroflavanol memberikan spektrum UV yang
mirip karena senyawa ini tidak mempunyai sistem konjugasi cinnamoil dengan
cincin B antara C-2 dan C-3.
Isoflavon memberikan spektrum UV dengan puncak II pada daerah λ 245
– 270 nm dan puncak I pada λ 310 – 330 nm. Flavon dan dihidroflavonol
memberikan puncak II pada λ 275 – 295 nm dan puncak I λ 310 – 330 nm
(Geissman, 1967; Harborne,1984; Markham, 1988).
Senyawa flavon dan flavonol dalam metanol memberikan spektrum UV
19
NaOMe pada senyawa menyebabkan gugus hidroksi pada inti aromatik akan
terionisasi dan mengakibatkan terjadinya pergeseran puncak I dan puncak II
menjadi pergeseran batokromik.
Efek yang timbul akibat penambahan pereaksi geser :
a. Efek hidroksilasi
Penambahan gugus OH dalam cincin A pada flavonol menghasilkan pergeseran
batokromik yang nyata pada pita puncak I dan efek puncak serapan II. Bila
gugus 5-OH tidak terdapat dalam flavonol dan flavon maka puncak tersebut
mempunyai panjang gelombang (λ) yang pendek dibanding gugus 5-OH pada
posisi 3,5,4’ yang mempunyai sedikit atau tidak sama sekali efek pada spektrum
UV.
b. Efek metilasi dan glikosilasi
Terjadi pada pola resapan flavon dan flavonol. Bila gugus 3,5 atau 4’-OH pada
flavon dan pergeseran hipsokromik pada puncak I, maka pergeseran itu terjadi
12-17 nm atau dapat pula mencapai 22 – 25 nm pada flavon yang tidak
mempunyai gugus 5-OH. Efek asetilasi bila gugus OH fenolik diasetilasi maka
efek dari gugus itu akan hilang.
c. Efek natrium metoksida
Penambahan basa menyebabkan pergeseran yang khas pada kebanyakan
flavonoidaa yaitu batokromik. Natrium-metoksida merupakan basa kuat yang
dapat mengionisasi gugus OH pada inti flavonoidaa. Penambahan Na-metoksida
pada flavon dan flavonol dalam metanol menyebabkan pergeseran batokromik
tanpa penurunan intensitas menunjukkan gugus 4’-OH bebas. Flavonol
mengalami pergeseran batokromik 50 – 60 nm pada puncak I dengan penurunan
intensitas disebabkan oleh adanya 3-OH bebas. Flavonol mempunyai 5 dan 4’
OH bebas maka spektrumnya dengan Na-metoksida mengalami dekomposisi.
d. Efek natrium asetat
Merupakan basa lemah akan mengionisasi gugus yang keasamannya tinggi,
digunakan untuk mendeteksi adanya gugus 7-OH bebas. Flavon dan flavonol
dengan gugus 7-OH bebas menunjukkan pergeseran batokromik sebesar 5 – 20
nm pada puncak serapan II dengan natrium asetat. Adanya natrium asetat dan
asam borat akan membentuk kompleks dengan gugus ortohidroksi pada semua
posisi kecuali pada atom C-5 dan C-6 (Mabry dkk, 1970).
e. Efek alumunium klorida
Adanya alumunium klorida maka gugus OH pada C-3 dan C-5 flavon dan
flavonol akan membentuk kompleks yang stabil dengan penambahan asam.
Kompleks antara alumunium klorida dengan C4-keto dan atau 5-OH tetap stabil
dengan adanya asam. Adanya gugus ortohidroksi pada cincin B dapat diketahui
dengan penambahan AlCl3 menghasilkan pergeseran hipsokromik panjang
gelombang 20 -30 nm pada pita I (I.a terdiri dari dua puncak). Adanya
pergeseran batokromik pada I.a dalam AlCl3 dan HCl dibandingkan denga pita I
dalam metanol sebesar panjang gelombang 35 – 55, menunjukkan adanya 5-OH
21
Tabel IV. Penafsiran spektrum ultraviolet flavonoida dengan penambahan NaOH (Markham, 1988)
Pergeseran tampak Mantap ±45-65 nm
kekuatan tidak menurun
4’-OH Mantap ±45-65 nm
kekuatan menurun
3-OH, tidak ada 4’-OH bebas
Flavon Flavonol
Pita baru (bandingkan dengan MeOH) 7-OH
Tidak ada pergeseran
Tidak ada OH pada cincin A
Kekuatan menurun o-di OH pada cincin A (penurunan)
Tabel V. Penafsiran spektrum ultraviolet flavonoida dengan penambahan NaOAc (Markham, 1988)
Pergeseran yang tampak Jenis
Kekuatannya berkurang dengan bertambahnya waktu
-OH di 6,7 atau 7,8 atau 3,4’
+35 nm
+60 nm
7-OH (dengan 5-OH) 7-OH (tanpa 5-OH) Flavanon
Dihidroflavonol
Kekuatannya berkurang dengan bertambahnya waktu
-OH di 6,7 atau 7,8
Pergeseran batokromik atau bahu pada panjang gelombang yang lebih panjang
4’-OH dan atau 4-OH (khalkon) 4’-4-OH dan atau tanpa 6-OH (Auron)
23
Tabel VII. Penafsiran spektrum ultraviolet flavonoida dengan penambahan AlCl3 serta AlCl3 dan HCl (Markham, 1988)
Pergeseran yang tampak Jenis flavonoida
5-OH dengan oksigenasi pada 6
Mungkin 5-OH dengan gugus prenil pada 6
+ 50 sampai 60 nm
Mungkin 3-OH (dengan atau tanpa 5-OH)
Pergeseran AlCl3/HCl
tambah 30 sampai 40 nm
o-diOH pada cincin B Flavanon dan (Tambahan pada pergeseran o-di OH pada cincin B)
o-diOH pada cincin A (6,7 dan 7,8)
Isoflavon, flavanon, dan dihidroflavonol (AlCl3 dan HCl)
Dihidroflavonol tanpa 5-OH (tambahan pada sembarang pergeseran o-di OH)
+48 sampai 64
2’-OH (Khalkon dengan oksigenasi pada 3’
4-OH (Auron)
Mungkin o-diOH pada cincin A
Antosianin (AlCl3)
Pergeseran lebih besar
H. Keterangan Empiris
Dari ekstrak metanol herba pegagan embun dapat diidentifikasi jenis
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian non eksperimental yang dilakukan di
laboratorium Farmakognosi Fitokimia, Universitas Sanata Dharma, Yogyakarta.
B. Definisi Operasional
1. Herba pegagan embun adalah seluruh bagian tanaman pegagan embun yang
berada di atas tanah.
2. Ekstrak metanol-air adalah ekstrak yang diperoleh dari penyarian herba
pegagan embun secara maserasi dengan metanol-air (9:1 dan 1:1).
3. Struktur parsial merupakan kerangka dasar dari segi struktur senyawa dengan
gugus-gugus tersubstitusi pada bagian struktur tersebut.
C. Bahan Penelitian
Bahan-bahan kimia yang digunakan adalah bahan kimia yang berderajat pro
analisis (p.a), kecuali dinyatakan lain.
1. Bahan tanaman : herba segar dari pegagan embun (yang telah dikeringkan dan
diserbuk).
2. Bahan kimia untuk penyari : bahan yang digunakan adalah metanol dan
aquadest (lokal).
3. Bahan untuk kromatografi : kromatografi lapis tipis (KLT) dengan fase diam
selulosa, n-butanol, aquadest (lokal), asam asetat, amonia pekat.
4. Bahan pereaksi identifikasi warna flavonoida : serbuk Mg, asam klorida pekat,
asam sulfat pekat, natrium hidroksida (NaOH).
5. Pereaksi diagnostik untuk penentuan struktur flavonoida secara spektroskopi
ultraviolet : natrium hidroksida (NaOH), alumunium klorida (AlCl3), natrium
asetat (CH3COONa), asam borat (H3BO3).
D. Alat Penelitian
1. Alat pengeringan, penyerbukan dan penyarian : oven, blender, ayakan, kertas
saring, alat-alat gelas (pipet tetes, gelas ukur, Beaker glass, corong, pengaduk).
2. Alat kromatografi dan spektroskopi Ultraviolet : seperangkat alat spektroskopi
UV-Vis (Genesys 6), vakum, pipa kapiler, lampu 365 nm, seperangkat alat
kromatografi kolom, alat-alat gelas (corong pisah, Beaker glass, gelas ukur,
pipet), kertas saring.
E. Jalannya Penelitian 1. Determinasi tanaman pegagan embun
Determinasi dilakukan terhadap tanaman pegagan embun di
laboratorium Farmakognosi Fitokimia menurut Backer dan Backhuizen van de
27
2. Pengumpulan bahan
Herba segar dari pegagan embun dikumpulkan pada bulan januari
2006 pada musim penghujan dari daerah Paingan, Yogyakarta. Pencucian
dilakukan terlebih dahulu untuk menghilangkan kotoran yang menempel seperti
debu dan serangga. Bagian herba juga dipisahkan dari bagian tanaman lain yang
terikut saat pengumpulan.
3. Pengeringan herba pegagan embun
Herba pegagan embun dikeringkan tanpa dirajang terlebih dahulu
karena herba yang tipis.Pengeringan dilakukan dalam oven pada suhu 40ºC
selama 5 jam. Dikatakan kering jika herba pegagan embun sudah dapat hancur
ketika diremas dengan tangan.
4. Penyerbukan herba pegagan embun
Herba pegagan embun yang telah dikeringkan kemudian diserbuk
menggunakan blender, lalu diayak.
5. Ekstraksi herba pegagan embun
Penyarian dilakukan dengan memaserasi terlebih dahulu simplisia
yang telah digiling menjadi serbuk dengan campuran pelarut pertama yaitu
metanol : air (9 :1) secukupnya hingga terbentuk bubur cair. Campuran
dibiarkan selama 6 – 12 jam, di tempat yang terlindung cahaya pada suhu
kamar. Untuk pemisahan serbuk dan cairan hasil penyarian, dilakukan
pelarut metanol : air (1:1), dilakukan dengan cara yang sama seperti di atas.
Kedua hasil penyarian dicampur, diuapkan hingga tinggal sepertiga atau
pelarutnya hampir menguap semua (Mursyidi, 1990).
6. Fraksinasi flavonoida dengan kromatografi kolom vakum
Kolom yang digunakan mempunyai diameter 4 cm dan mempunyai
tinggi 20 cm.
a. Cara membuat fase diam
Sejumlah selulosa dimasukkan ke dalam Beaker glass kemudian diaduk
hingga berbentuk bubur (slurry) menggunakan aquadest.
Bubur selulosa dimasukkan ke dalam kolom setinggi 5 cm dengan bantuan
corong dan batang pengaduk.
b. Penempatan sampel
Sebanyak 1,0 gram ekstrak kering diletakkan di atas fase diam.
c. Pemisahan fraksi
Sebanyak 25 ml fase gerak dituang di atas sampel, kemudian divakum sampai
semua fase gerak tersedot keluar. Hal tersebut dilakukan 15 kali sampai fraksi
yang dihasilkan berwarna bening. Masing-masing fraksi lalu dipekatkan.
7. Identifikasi flavonoida dengan KLT
Kandungan flavonoida fraksi dari hasil fraksinasi dengan kromatografi
kolom vakum diperiksa dengan kromatografi lapis tipis. Fraksi ditotolkan pada
lempeng selulosa, kemudian dikembangkan dengan jarak pengembangan 8 cm
29
fase atas) hingga batas yang ditetapkan. Bercak dideteksi menggunakan uap
amonia, dan lampu UV 365 nm.
8. Isolasi flavonoida dengan KLT preparatif
Dilakukan isolasi KLT preparatif dalam fase diam selulosa dan fase
gerak BAW (4:1:5 v/v, fase atas). Isolat ditotolkan berupa garis yang
selanjutnya dikembangkan, dan didapatkan pemisahan bercak. Hasil kerokan
diekstraksi dengan metanol kemudian disaring dengan kertas saring. Maka
diperoleh isolat flavonoida untuk diuji kemurnian, reaksi warna, dan
spektroskopi ultraviolet.
9. Pemeriksaan kemurnian isolat senyawa flavonoida
Kemurnian isolat flavonoida dapat diketahui menggunakan lempeng
kromatrografi dengan menotolkan pada dua lempeng yang masing-masing
dikembangkan menggunakan fase gerak BAW (4:1:5 v/v, fase atas) dan asam
asetat 15 %.
10. Reaksi warna flavonoida
Isolat senyawa flavonoida dianalisis reaksi warna menggunakan
pereaksi-pereaksi warna :
a. Natrium hidroksida 4% (larutan ini dibuat dengan melarutkan 4 g NaOH
dalam air bebas CO2 hingga 100 ml), 3 tetes larutan isolat flavonoida pada
droping plate ditambah dengan 1 tetes larutan natrium hidroksida, warna
b. Logam magnesium dan asam klorida, 3 tetes larutan isolat flavonoida pada
droping plate ditambah sedikit serbuk magnesium dan asam klorida, warna
yang terjadi dicatat.
c. Asam sulfat pekat 98%, 3 tetes larutan isolat flavonoida pada droping plate
ditambah dengan 1 tetes larutan asam sulfat pekat 98%, warna yang
terjadi dicatat.
11. Identifikasi spektra senyawa flavonoida dengan spektroskopi ultra violet Tiap isolat senyawa flavonoida yang telah diperiksa kemurniannya,
diencerkan dengan metanol sampai konsentrasi 0,2% dan kemudian dilakukan
pembacaan absorbansi melalui tahapan sebagai berikut :
a. isolat flavonoida dimasukkan dalam kuvet sampel dan ke dalam kuvet
pembanding diisikan metanol. Pembacaan absorbansi dilakukan pada
panjang gelombang 200 – 500 nm.
b. Penambahan pereaksi geser NaOH, pembacaan absorbansi pada panjang
gelombang 200 – 500 nm dilakukan segera setelah penambahan 3 tetes
NaOH 2 N. Untuk memeriksa apakah ada penguraian pergeseran panjang
gelombang diperiksa lagi setelah 5 menit, kemudian cuplikan dibuang dan
kuvet yang telah dicuci diisi dengan larutan isolat persediaan.
c. Penambahan pereaksi geser AlCl3, pembacaan absorbansi pada panjang
gelombang 200 – 500 nm dilakukan setelah penambahan larutan AlCl3
pada isolat flavonoida. Selanjutnya dibaca lagi absorbansi setelah
31
d. Penambahan pereaksi geser natrium asetat, pembacaan pada panjang
gelombang 200 – 500 nm dilakukan dengan cara serbuk natrium asetat
dimasukkan dalam kuvet berisi 2 -3 ml isolat flavonoida lalu digojog,
sedemikian rupa sehingga terdapat kira-kira 2 mm lapisan natrium asetat
pada dasar kuvet. Pembacaan dilakukan setelah 2 menit penambahan
natrium asetat.
e. Penambahan pereaksi geser natrium asetat / H3BO3, pembacaan absorbansi
pada panjang gelombang 200 – 500 nm dilakukan dengan cara serbuk
H3BO3 dimasukkan ke kuvet berisi 2 ml isolat flavonoida, larutan
dijenuhkan secepatnya dengan serbuk kasar natrium asetat lalu dibaca
absorbansinya. Pembacaan absorbansi dilakukan pada kecepatan 50 nm
per menit.
12. Pembuatan pereaksi geser (Markham, 1988) a. Natrium hidroksida (NaOH)
Pereaksi NaOH menggunakan larutan NaOH 2 M dalam air.
b. Natrium asetat (NaOAc)
Digunakan serbuk NaOAc anhidrat.
c. Alumunium klorida (AlCl3)
Sebanyak 5 g AlCl3 ditambahkan ke dalam 100 ml metanol.
d. Asam hidroklorida (HCl)
Sejumlah 50 ml HCl pekat ditambahkan ke dalam 100 ml aquadest.
e. Asam borat (H3BO3)
F. Tata Cara Analisis Hasil
Analisis hasil dilakukan terhadap data yang diperoleh dari
kromatografi lapis tipis, reaksi warna ,dan spektroskopi ultraviolet
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Determinasi Tanaman
Determinasi tanaman pegagan embun dilakukan dengan tujuan untuk
mengetahui kebenaran identitas nama ilmiah tanaman pegagan embun.
Determinasi pada penelitian ini dilakukan dengan cara mencocokkan keadaan
tanaman dengan ciri-ciri yang terdapat pada pustaka acuan (Backer dan
Backhuizen van de Brink, 1963).
Tanaman yang digunakan dalam penelitian adalah tanaman pegagan
embun yang dideterminasi sampai tingkat spesies menurut Backer dan
Backhuizen van de Brink (1963) (Lampiran 1). Berdasarkan determinasi hingga
kategori spesies tersebut, maka tanaman yang digunakan dalam penelitian ini
adalah benar pegagan embun dengan nama ilmiah Hydrocotyle sibthorpioides
Lmk.
B. Ekstraksi Herba Pegagan Embun
Herba pegagan embun yang telah diambil kemudian dicuci dan
dibersihkan dengan air untuk memisahkan kotoran , tanah dan mikroba yang
melekat pada herba. Setelah itu, herba dikeringkan dalam oven pada suhu 40˚ C
selama 5 jam. Pengeringan dimaksudkan untuk menghentikan reaksi enzimatik
yang dapat menguraikan senyawa aktif dan mencegah tumbuhnya mikroba.
Setelah kering, yang ditandai dengan herba mudah hancur ketika diremas dengan
tangan maka herba tersebut diserbuk. Penyerbukan dilakukan untuk memperbesar
luas permukaan sehingga pada waktu penyarian hasilnya akan optimal.
Flavonoida merupakan polifenol yang memiliki sifat kimia fenol. Adanya
gula yang terikat pada aglikon akan meningkatkan polaritas, maka flavonoida
cukup larut dalam pelarut polar yaitu metanol. Adanya gula yang terikat pada
flavonoida cenderung menyebabkan flavonoida lebih mudah larut dalam air dan
dengan demikian campuran metanol-air merupakan pelarut yang baik untuk
melarutkan flavonoida. Maka penyarian yang dilakukan secara maserasi dengan
prinsip perendaman dan penggojogan sudah dapat membuat flavonoida tersari ke
dalam cairan penyari. Selain itu, maserasi dapat dikerjakan tanpa alat yang khusus
dan cara kerjanya sederhana.
Cairan penyari menembus membran dan masuk ke dalam rongga sel
herba sehingga zat aktif herba terlarut karena terjadi perpindahan dari konsentrasi
yang lebih besar ke konsentrasi yang lebih kecil dari dalam sel ke cairan penyari.
Penyarian dengan maserasi dapat mencapai titik jenuh, maka penggojogan
dilakukan untuk menjaga perbedaan konsentrasi di dalam sel dan di luar sel
sehingga tetap terjadi perpindahan senyawa aktif dari sel tersebut.
C. Isolasi dengan Kromatografi Kolom Vakum
Fraksi metanol dipisahkan dengan kromatografi kolom vakum
menggunakan fase diam selulosa dan fase gerak BAW. Digunakan fase diam
selulosa karena selulosa ideal untuk memisahkan glikosida yang satu dari
35
kurang polar (Markham,1988). Sedangkan dipilih fase gerak BAW karena BAW
sesuai untuk memisahkan glikosida, aglikon, dan gula (Markham,1988). Selulosa
bersifat non polar dan BAW bersifat polar sehingga sesuai untuk memisahkan
flavonoida dimana flavonoida akan lebih terikat dalam fase gerak Penggunaan
vakum dimaksudkan untuk mempercepat proses keluarnya fraksi dari kolom.
Jika fraksi yang dihasilkan sudah bening dan jika dilihat di bawah lampu
UV sudah tampak tidak ada bercak warna, maka proses pemisahan dapat
dihentikan. Pemisahan komponen-komponen fraksi metanol dengan kromatografi
kolom vakum menghasilkan 15 fraksi.
D. Identifikasi Flavonoida dengan Kromatografi Lapis Tipis (KLT) Pemeriksaan selanjutnya dilakukan dengan kromatografi lapis tipis.
Kromatografi lapis tipis merupakan metode yang umum dan cocok untuk
memeriksa senyawa polar seperti flavonoida yang umumnya mempunyai
kelarutan polar (struktur flavonoida banyak mengandung gugus hidroksi).
Jumlah ekstrak yang ditotolkan menentukan kualitas pola flavonoida yang
terjadi. Jika ekstrak yang ditotolkan terlalu sedikit, bercak flavonoida yang
terbentuk setelah pengembangan akan sulit untuk dideteksi. Jika terlalu banyak,
maka setelah dilakukan pengembangan akan terjadi pengekoran (tailing) yang
akan mengganggu hasil analisis karena menurut Sastrohamidjojo (2005), ekor
akan menaikkan kelebaran pita sehingga cenderung menimbulkan penindihan pita
Fraksi-fraksi dari hasil kromatografi kolom vakum diperiksa dengan KLT dengan
fase diam selulosa dan fase gerak BAW (4:1:5, fase atas). Hasil pemisahan fraksi
3 - 12 dengan KLT menghasilkan dua bercak pemisahan yang dideteksi di bawah
lampu UV 365 nm, yaitu bercak A yang berwarna ungu gelap dengan harga Rf
0,86 dan bercak B yang berwarna biru dengan harga Rf 0,76 (Lampiran 2). Reaksi
antara flavonoida dengan amonia akan memperpanjang ikatan rangkap
terkonjugasi sehingga intensitas warna kuning menjadi jelas (Gambar 5). Dari
hasil penelitian, setelah diuapi dengan amonia maka intensitas warna kuning
menjadi jelas jika dilihat secara visible. Fraksi 3 – 12 menunjukkan kromatogram
yang sama, oleh karena itu fraksi-fraksi tersebut disatukan dan dipekatkan untuk
kemudian dipisahkan dengan kromatografi lapis tipis preparatif.
Berdasarkan data tersebut yang didapat dari warna bercak dan nilai Rf pada
kromatografi lapis tipis dan dibandingkan dengan pustaka ada indikasi bahwa
fraksi BAW ekstrak metanol herba pegagan embun kemungkinan mengandung
flavonoida (Harborne, 1984; Markham, 1988) (Tabel VIII).
O
37
Tabel VIII. Data kromatogram dari bercak fraksi herba pegagan embun menggunakan fase diam selulosa dan fase gerak BAW (4:1:5 v/v, fase atas)
deteksi dengan sinar UV 365 nm sebelum dan sesudah diuapi amonia (Markham,
1988)
E. Isolasi flavonoida dengan Kromatografi Lapis Tipis Preparatif Penggunaan kromatografi lapis tipis preparatif (KLTP) lebih ditekankan
untuk mendapatkan isolat dengan menggunakan pelarut seminimal mungkin.
Keuntungan lain yang didapat yaitu penghematan waktu dan biaya yang
diperlukan.
Pada kromatografi lapis tipis preparatif fraksi BAW (4:1:5 v/v, fase atas)
ekstrak metanol-air ditotolkan berupa garis / pita 10 cm pada lempeng
kromatografi dengan fase diam selulosa dan fase gerak BAW (4:1:5 v/v, fase
atas). Penotolan diulang beberapa kali agar bercak yang diperoleh lebih jelas.
Pengembangan dilakukan dengan jarak pengembangan 10 cm dari totolan awal.
Bercak pita dengan harga Rf dan warna yang sama dengan bercak yang dipilih
pada pemeriksaan sebelumnya, dikerok kemudian dikumpulkan dan diekstraksi
Pada penelitian, dipilih bercak yang berwarna ungu dengan harga Rf 0,86.
Pemilihan bercak dilakukan karena pertimbangan bercak yang lebih dominan.
Hasil pengerokan dari kromatografi lapis tipis preparatif dari bercak tersebut
selanjutnya disebut isolat flavonoida.
F. Pemeriksaan Kemurnian Isolat Flavonoida
Kemurnian isolat flavonoida diperiksa secara KLT multi eluen dengan
menggunakan dua macam fase gerak yang mempunyai kepolaran yang berbeda
yaitu BAW dan asam asetat, dimana asam asetat 15% bersifat lebih polar daripada
BAW.
Hasil pengembangan KLT multi eluen diperoleh bercak tunggal berwarna
ungu yang mengindikasikan bahwa isolat flavonoida sudah murni dan dapat
diperiksa secara spektroskopi UV. Bercak tersebut dilihat di bawah sinar UV 365
nm sebelum dan sesudah diuapi amonia. Diperoleh harga Rf 0,55 untuk
pengembangan dengan fase gerak BAW (Gambar 7) dan Rf 0,93 untuk
39
A
B
Gambar 6. Kromatogram isolasi flavonoida dengan KLTP Keterangan :
Sampel : Fraksi BAW (4:1:5 v/v, fase atas) ekstrak metanol-air herba pegagan embun
Fase diam : Selulosa
Gambar 7 . Kromatogram pemeriksaan kemurnian isolat flavonoida Keterangan :
Sampel : Pita bercak (Rf 0,69) dari Fraksi BAW (4:1:5 v/v, fase atas) ekstrak metanol-air herba pegagan embun
Fase diam : Selulosa
Fase gerak : BAW (4:1:5 v/v, fase atas) Bercak pada pengembangan : Rf 0,93
41
Gambar 8. Kromatogram pemeriksaan kemurnian isolat flavonoida Keterangan :
Sampel : Pita bercak (Rf 0,69) dari Fraksi BAW (4:1:5 v/v, fase atas) ekstrak metanol-air herba pegagan embun
Fase diam : Selulosa
Fase gerak : Asam asetat 15 % Bercak pada pengembangan : Rf 0,55
G. Identifikasi Flavonoida dengan Reaksi Warna
Reaksi warna flavonoida merupakan uji pendahuluan untuk menentukan
golongan senyawa flavonoida. Uji ini memberi informasi berupa gambaran umum
golongan senyawa flavonoida pada hidroksilasi dan substitusinya.
Penambahan NaOH yang bersifat basa menyebabkan flavonoida menjadi
kuning. Warna ini timbul disebabkan oleh pembentukan garam dan terbentuknya
struktur kuinoid pada cincin B pada flavonoida (Venkataraman, 1962).
Adanya gugus fenol pada flavonoida akan memberikan reaksi positif
antara flavonoida dengan pereaksi untuk fenol, seperti H2SO4 pekat. Reaksi ini
tidak spesifik dan harus diikuti dengan reaksi warna yang lain (Venkataraman,
1962; Harborne, 1987).
Flavonoida akan mengalami reduksi jika direaksikan dengan serbuk
magnesium dalam asam klorida dan menghasilkan warna kuning sampai merah
untuk golongan flavon (Venkataraman, 1962).
Berdasarkan data dari reaksi warna yang diperoleh (Tabel IX), maka dapat
disimpulkan bahwa isolat flavonoida mengarah pada golongan flavon
(Venkataraman, 1962).
Tabel IX. Reaksi warna isolat flavonoida herba pegagan embun
Uji Warna NaOH H2SO4 p Mg-HCl p
Isolat flavonoida
Kuning Kuning Kuning
Flavon (Venkataraman,
1962)
43
H. Identifikasi Spektrum Isolat Flavonoida dengan Spektroskopi Ultraviolet Analisis selanjutnya dilakukan pada data spektroskopi ultraviolet untuk
memastikan golongan flavonoida dan struktur parsialnya. Isolat flavonoida dalam
metanol yang diukur menghasilkan dua puncak serapan karena pada struktur
flavonoida terdapat dua komponen penyerap, yaitu komponen penyerap benzoil
dan komponen penyerap sinamoil.
Komponen penyerap sinamoil merupakan puncak serapan untuk pita I,
sedangkan komponen penyerap benzoil merupakan puncak serapan untuk pita II.
Pita I mempunyai panjang gelombang yang lebih besar karena ikatan rangkap
terkonjugasinya lebih banyak dibanding pita II. Penambahan ikatan rangkap
terkonjugasi ini menyebabkan makin kecil energi yang diperlukan untuk
tereksitasi sehingga akan menyerap sinar UV pada panjang gelombang yang lebih
TabelX. Data spektrum dan pergeseran yang terjadi setelah diberi pereaksi – (Mabry dkk, 1970)
Isolat
ortodihidroksi di B
Isolat adanya 3-hidroksi di cincin B (jika
dibandingkan dengan AlCl3)
JIka dibandingkan dengan metanol pada pita I. maka tidak menampakkan
Posisi orto dihidroksi di cincin B (3’ dan 4’ atau 4’ dan 5’) Tidak adanya posisi orto dihidroksi pada cincin A
Ket: * : dibandingkan dengan serapan isolat metanol
45
Hasil pengukuran isolat flavonoida dalam metanol memperoleh puncak
dengan serapan 345 nm pada pita I dan 260 nm pada pita II. Hal ini menunjukkan
bahwa isolat flavonoida hasil isolasi mengarah pada golongan flavon dan flavonol
dengan 3-OH tersubstitusi (Markham, 1988)(Tabel X).
260 270 345 395
MeOH
MeOH + NaOH
Gambar 10. Spektrum UV Hiperin dalam MeOH dan NaOMe (Mabry,dkk. 1970) Tabel XI. Perbandingan data spektrum isolat Flavonoida dengan Hiperin dalam MeOH dan NaOMe
Senyawa Pita I Pita II
Isolat Flavonoida 395 270
Hiperin (Mabry,dkk. 1970) 409 272
Pada penambahan NaOH dalam larutan ini didapat puncak serapan 395 nm
pada pita I dan 270 nm pada pita II. Pada pergeseran ini tidak terjadi dekomposisi,
47
Gambar 11. Reaksi antara Flavon dengan NaOH
AlCl3 dan AlCl3/HCl menyebabkan pembentukan kompleks tahan asam
antara gugus hidroksil dan keton yang bertetangga dan membentuk kompleks tak
tahan asam dengan gugus o-dihidroksil, pereaksi ini dapat digunakan untuk
mendeteksi kedua gugus tersebut. Pada penambahan AlCl3 ke dalam isolat
flavonoida dalam metanol didapatkan puncak serapan 360 nm pada pita I dan 265
nm pada pita II. Pergeseran ini mengindikasikan adanya ortodihidroksi pada
260 265 345 360
MeOH
MeOH + AlCl3
49
265 350 360
AlCl3
AlCl3 + HCl
Gambar 14. Spektrum UV Hiperin dalam MeOH dan AlCl3/ HCl
(Mabry,dkk. 1970)
Tabel XII. Perbandingan data spektrum isolat Flavonoida dengan Hiperin dalam MeOH dan AlCl3/ HCl
Senyawa Pita I Pita II
Isolat Flavonoida 350 265
Hiperin (Mabry,dkk. 1970) 405 268
Adanya gugus 5-OH dan 3-OH dalam spektrum akan memperlihatkan
51
AlCl3/HCl. Dari analisis yang diperoleh tidak mengindikasikan adanya 5-OH dan
3-OH (Tabel X).
Gambar 15. Reaksi antara Flavon dengan AlCl3/HCl (Mabry dkk, 1970)
Penambahan pereaksi NaOAc bertujuan untuk mendeteksi adanya 7-OH
bebas dari golongan flavon dan flavonol. Keberadaan 7-OH bebas akan
menyebabkan pergeseran batokromik sebesar 5 – 20 nm pada pita II (Mabry dkk,
1970). Pada penambahan NaOAc ke dalam isolat flavonoida dalam metanol
diperoleh pergeseran batokromik sebesar 5 nm pada pita II. Hal ini
mengindikasikan adanya: 7-OH pada golongan flavon atau 7-OH pada golongan
260 265 345 385
MeOH
MeOH+ NaOAc
Gambar 16. Spektrum UV isolat flavonoida dalam MeOH dan NaOAc
O OH
O
+
O -O
O
OH OH
OH
CH3- C
O
ONa - Na+
- CH3COOH
OH
O
OH
OH
O
-O
53
Penambahan pereaksi NaOAc/ H3BO3 untuk mendeteksi adanya gugus
ortodihidroksi pada cincin B dan gugus ortodihidroksi pada cincin A dari
golongan flavon dan flavonol. Adanya gugus ortodihidroksi pada cincin B
ditunjukkan dengan pergeseran batokromik sebesar 12 – 30 nm pada pita I,
sedangkan adanya gugus ortodihiroksi pada cincin A ditunjukkan dengan
pergeseran batokromik kira-kira sebesar 5 – 10 nm pada pita I (Mabry dkk, 1970).
Pada penambahan NaOAc/ H3BO3 ke dalam isolat flavonoida dalam metanol
diperoleh pergeseran batokromik sebesar 20 nm pada pita I. Hal ini memberikan
kemungkinan adanya gugus ortodihidroksi pada cincin B dan tidak menunjukkan
adanya gugus ortodihidroksi pada cincin A (Tabel X).
260 345 365
MeOH
MeOH+ NaOAc/ H3BO3
Gambar 19. Spektrum UV Hiperin dalam MeOH dan NaOAc/ H3BO3
(Mabry,dkk. 1970)
Tabel XIII. Perbandingan data spektrum isolat Flavonoida dengan Hiperin dalam MeOH dan NaOAc/ H3BO3
Senyawa Pita I Pita II
Isolat Flavonoida 365 260
55
Gambar 20. Reaksi antara Flavon dengan NaOAc/ H3BO3
Berdasarkan analisis warna bercak dan Rf (Tabel VIII), analisis reaksi
warna (Tabel IX), dan analisis spektroskopi ultraviolet (Tabel X) maka isolat
flavonoida tersebut kemungkinan golongan flavon dengan kemungkinan struktur
parsial 7,3’,4’ trihidroksi flavon atau 7, 4’,5’ trihidroksi flavon.
O
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Penelitian yang dilakukan yaitu isolasi dan prakiraan struktur
parsial herba pegagan embun (Hydrocotyle sibthorpioides Lmk.) secara
kromatografi, reaksi warna, dan spektroskopi ultraviolet maka isolat A diduga
memiliki golongan flavon, dengan kemungkinan struktur parsial 7,3’,4’
trihidroksi flavon atau 7, 4’,5’ trihidroksi flavon.
O
O
OH OH
HO O
O
OH
OH HO
7,3’,4’ trihidroksi flavon 7,4’,5’ trihidroksi flavon
B. Saran
Perlu dilakukan penentuan golongan flavonoida dan prakiraan struktur
parsial terhadap bercak biru yang nampak pada KLT.
57
DAFTAR PUSTAKA
Anonim, 1985, Cara Pembuatan Simplisia, 4-6, Departemen Kesehatan RI, Jakarta.
Anonim, 2004, Calincing untuk darah tinggi, http://www.suaramerdeka.com%20-%20semata-mata%20fakta!htm, diakses, 27 April 2006.
Anonim,2005, Semanggi Gunung,
http://www.iptek.net.id/ind/pd_tanobat/view.php?id=58-15k. diakses, 26 April 2006.
Anonim, 2007, Noble rhubarb,
http://en.wikipedia.org/wiki/Noble_rhubarb, diakses 2 Mei 2007.
Anonim,1986a, Sediaan Galenik, 1-5, 0-16, 25-28, Departemen Kesehatan RI, Jakarta.
Backer, C.A. dan Backhuizen Van de Brink Jr., R.C., 1963, Flora of Java,
Volume I, 3-9, 25-26, N.V.P. Noordhoff, Groningen, The Nederlands.
Backer, C.A. dan Backhuizen Van de Brink Jr., R.C., 1963, Flora of Java,
Volume II, 171-172, N.V.P. Noordhoff, Groningen, The Nederlands.
Bruneton, J., 1999, Pharmacognosy Phytochemistry Medicinal Plants, Edisi II, 310-326, Intercept. Ltd, New York.
Creswell, C. J., Runquist, O.A., Campbell, M.M., 1982, Spectrum Analysis of Organic Compound, diterjemahkan oleh Kosasih Padmawinata dan Iwang Soediro, Edisi III, 46-59, Penerbit ITB, Bandung.
Harborne, J.B., 1987, Phytochemical Methods, diterjemahkan oleh Kosasih Padmawinata dan Iwang Soediro, Edisi II, 2-28, 34-37, 47-49,69-103, Penerbit ITB, Bandung.
Hostettmann, K., Hostettmann, M., Marston, A., 1995, Cara Kromatografi Preparatif, diterjemahkan oleh Kosasih Padmawinata, 33-36, Penerbit ITB, Bandung.
Mabry, T.J., Markham, K.R., Thomas, M.B., 1970, The Systematical Identification of Flavonoida Compound, 35 – 55, Springer Verlag, New York – Heidelberg – Berlin.
Markham K.R., 1988, Techniques of Flavonoida Identification, diterjemahkan oleh Kosasih Padmawinata, 15-27, 32-53, Penerbit ITB, Bandung.
Mulya, M., 1995, Analisis Instrumental, Penerbit Airlangga University Press, Surabaya.
Mursyidi A., 1990, Analisis Metabolit Sekunder, Cetakan I, 171-187, Penerbit PAU Bioteknologi UGM, Yogyakarta.
Pelletier, S. W., Chokshi, H. P., Desai, H. K., 1986, Journal of Natural Products,
Volume 49, 892, 897, The University of Georgia Athens, Georgia.
Robinson, T., 1995, The Constituen of Higher Plants, diterjemahkan oleh Kosasih Padmawinata, Edisi 6, 191-213, Penerbit ITB, Bandung.
Sastrohamidjojo, H., 1991, Spektroskopi, Cetakan II, 22-23, Penerbit Liberty, Yogyakarta.
Sastrohamidjojo, H. , 2005, Kromatografi, Cetakan III, 4, Penerbit Liberty, Yogyakarta.
Silverstein, R.M., Basser,C.G., Morril, I.C.,1974, Spectrometric Identification of Organic Compounds, Edisi IV, 305-308, Penerbit Erlangga, Jakarta.
Stahl, E., 1985, Drug Analysis by Chromatography and Microscopy,
diterjemahkan oleh Kosasih Padmawinata, edisi VII, 3-6, Penerbit ITB, Bandung.