KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
HERBA KELAKAI (Stenochlaena palustris (Burm.f.) Bedd.)
SKRIPSI
OLEH:
CLARA STEPHANIE
NIM 121524099
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
HERBA KELAKAI (Stenochlaena palustris (Burm.f.) Bedd.)
SKRIPSI
Diajukan Sebagai salah satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
CLARA STEPHANIE
NIM 121524099
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan
karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi
yang berjudul Karakterisasi Simplisia dan Skrining Fitokimia serta Uji Aktivitas
Antioksidan Ekstrak Ekstrak Etanol Herba Kelakai (Stenochlaena palustris
(Burm.f.) Bedd.). Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh
gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., dan Prof. Dr. Julia Reveny, M.Si., Apt., selaku Dekan dan
Wakil Dekan I Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis
selama perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terima kasih
kepada Bapak Drs. Suryadi Achmad, M.Sc., Apt. dan Bapak Drs. Awaluddin
Saragih, M.Si., Apt. yang telah meluangkan waktu dan tenaga dalam
membimbing penulis dengan penuh kesabaran dan tanggung jawab, memberikan
petunjuk dan saran-saran selama penelitian hingga selesainya skripsi ini. Ucapan
terima kasih juga penulis sampaikan kepada Ibu Dr. Marline Nainggolan, M.S.,
Apt., selaku ketua penguji, Ibu Dra. Suwarti Aris, M.Si., Apt Apt., dan Ibu Dra.
Aswita Hanif Lubis, M.Si., Apt., selaku anggota penguji yang telah memberikan
saran untuk menyempurnakan skripsi ini, dan Ibu Dra. Siti Nurbaya, Apt., selaku
dosen pembimbing akademik serta Bapak dan Ibu staf pengajar Fakultas Farmasi
USU yang telah banyak membimbing penulis selama masa perkuliahan hingga
Penulis juga mempersembahkan rasa terima kasih yang tak terhingga
kepada keluarga tercinta, Ayahanda A. Simanjuntak dan Ibunda Helena Setiawati,
abang David Simanjuntak dan kakak Reny Simanjuntak atas limpahan kasih
sayang, memberikan doa, dukungan serta pengorbanan baik moril maupun
material selama menempuh pendidikan Sarjana Farmasi.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum
sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang
membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Juli 2015 Penulis,
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
HERBA KELAKAI (Stenochlaena palustris (Burm.f.) Bedd.)
ABSTRAK
Tumbuhan kelakai (Stenochlaena palustris (Burm.f.) Bedd.) berasal dari suku Blechnaceae merupakan salah satu tumbuhan jenis paku-pakuan yang banyak tumbuh di Kalimantan Tengah. Daun dan batang kelakai muda dipercaya masyarakat suku Dayak memiliki banyak manfaat, diantaranya sebagai suplemen untuk penambah darah, obat awet muda, penambah ASI untuk ibu yang sedang menyusui, obat tekanan darah tinggi, pereda demam dan mengobati sakit kulit. Tujuan penelitian ini adalah untuk menentukan karakteristik simplisia, skrining fitokimia dan aktivitas antioksidan dari ekstrak etanolherba kelakai.
Tahapan penelitian meliputi pengumpulan bahan tumbuhan, identifikasi tumbuhan, pengolahan tumbuhan, karakterisasi simplisia dengan metode azeotropi dan gravimetri, skrining fitokimia menggunakan metode kualitatif, pembuatan ekstrak etanol dilakukan dengan cara perkolasi serta pengujian aktivitas antioksidan dengan menggunakan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) diukur pada panjang gelombang 516 nm setelah 60 menit pada suhu kamar. Kemampuan antioksidan diukur sebagai penurunan absorbansi larutan DPPH setelah penambahan ekstrak.
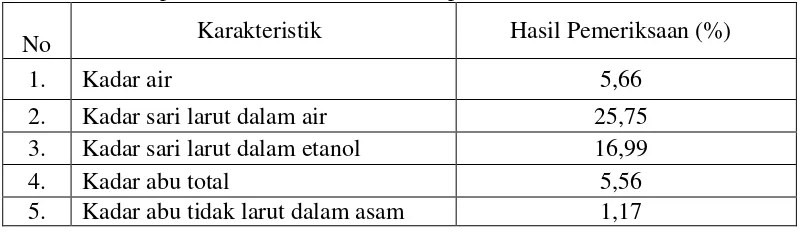
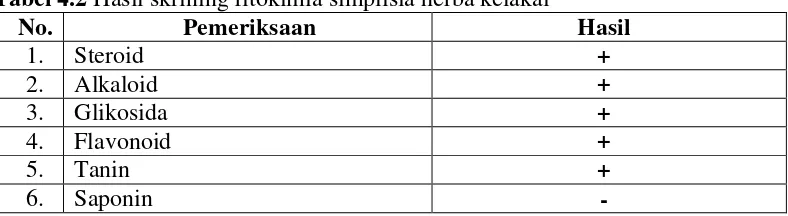
Hasil pemeriksaan karakteristik simplisia diperoleh kadar air 5,66%, kadar sari larut air 25,75%, kadar sari larut etanol 16,99%, kadar abu total 5,56%, kadar abu yang tidak larut dalam asam 1,17%. Hasil skrining fitokimia menunjukkan serbuk simplisia herba kelakai mengandung senyawa steroid, alkaloid, glikosida, flavonoid dan tanin. Hasil uji aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) menunjukkan bahwa ekstrak etanol herba kelakai termasuk dalam kategori antioksidan kuat dengan nilai Inhibitory Concentration (IC50) sebesar 80,43 ppm.
SIMPLEX CHARACTERIZATIONAND PHYTOCHEMICAL SCREENING AND ANTIOXIDANT ACTIVITY ASSAY
OF ETHANOL EXTRACT FROM KELAKAI HERBS (Stenochlaena palustris (Burm.f.) Bedd)
ABSTRACT
Kelakai (Stenochlaena palustris (Burm.f.) Bedd) is a member of Blechnaceae family and a kind of Pteridophyta plants that popularly grown at Middle Kalimantan. The leaves and stems of kelakai have so many functions, such as supplement for increasing blood, anti-aging materials, increasing breast milk in feeding mothers, anti-hypertensi, anti-pyretic, and curing the skin illness. The purpose of this study was to determine the characteristics of the simplex, phytochemycal screening and the antioxidant activity of ethanol extract of kelakai herbs.
Stages of research involves collecting plant material, plant identification, processing plants, bulbs characterization azeotropi and gravimetric method, phytochemical screening using qualitative methods, the manufacture of ethanol extract conducted by percolation method and test the antioxidant activity using DPPH free radical trapping methods (1, 1-diphenyl - 2 - picrylhydrazil ) measured at a wavelength of 516 nm after 60 minutes at room temperature. The ability of antioxidants measured as a decrease in absorbance of DPPH solution after the addition of the extract .
The result obtained from simplex characterization of kelakai’s herb are water content 5.66%, water-soluble extract content 25.75%, ethanol-soluble extract content 16.99%, total ash content 5.56%, and acid-insoluble ash content 1.17%. The result of phytochemical screening shows that kelakai’s simplex contained steroid, alkaloid and flavonoid. The result of antioxidant activity in scavenging DPPH free radical shows that ethanol extract of kelakai’s herb has antioxidant ativity in strong category with Inhibitory Concentration (IC50) value 80,432 ppm. Ethanol extract kelakai’s herb of showed strong category of antioxidant activity with Inhibitory Concentration (IC50) value 80,432 ppm.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan Paku ... 6
2.2 Tumbuhan Kelakai ... 7
2.2.1 Morfologi tumbuhan ... 7
2.2.3 Sistematika tumbuhan ... 8
2.2.4 Khasiat dan manfaat ... 8
2.2.5 Kandungan kimia ... 9
2.3 Simplisia dan Ekstrak ... 12
2.3.1 Simplisia ... 12
2.3.2 Ekstrak ... 12
2.4 Radikal Bebas ... 14
2.5 Antioksidan ... 15
2.5.1 Vitamin C ... 17
2.5.2 Karotenoid ... 17
2.5.3 Flavonoid ... 18
2.5.4 Tokoferol ... 19
2.5.5 Polifenol ... 20
2.6 Spektrofotometri UV-Visible ... 20
2.7 Penentuan Aktivitas Antioksidan dengan Metode DPPH ... 21
2.7.1 Pelarut ... 22
2.7.2 Pengukuran absorbsi panjang gelombang ... 23
2.7.3 Waktu pengukuran ... 23
BAB III METODE PENELITIAN ... 24
3.1 Alat ... 24
3.2 Bahan ... 24
3.3 Penyiapan Bahan Tumbuhan ... 25
3.3.1 Pengumpulan bahan tumbuhan ... 25
3.3.3 Pengolahan bahan ... 25
3.4 Pembuatan Pereaksi ... 26
3.4.1 Pereaksi besi (III) klorida 1% ... 26
3.4.2 Pereaksi timbal (II) asetat 0,4 M ... 26
3.4.3 Pereaksi natrium hidroksida 2 N ... 26
3.4.4 Pereaksi asam sulfat 2 N ... 26
3.4.5 Pereaksi kloralhidrat ... 26
3.4.6 Pereaksi Mayer ... 26
3.4.7 Pereaksi Molisch ... 27
3.4.8 Pereaksi Dragendorff ... 27
3.4.9 Pereaksi Bouchardat ... 27
3.4.10 Pereaksi Liebermann-Burchard ... 27
3.5 Karakterisasi Simplisia ... 27
3.5.1 Pemeriksaan makroskopik ... 27
3.5.2 Pemeriksaan mikroskopik ... 27
3.5.3 Penetapan kadar air ... 28
3.5.4 Penetapan kadar sari yang larut dalam air ... 28
3.5.5 Penetapan kadar sari yang larut dalam etanol ... 29
3.5.6 Penetapan kadar abu total ... 29
3.5.7 Penetapan kadar abu yang tidak larut dalam asam ... 29
3.6 Skrining Fitokimia ... 30
3.6.1 Pemeriksaan steroida/triterpenoida ... 30
3.6.2 Pemeriksaan alkaloida ... 30
3.6.4 Pemeriksaan flavonoid ... 31
3.6.5 Pemeriksaan tanin ... 31
3.6.6 Pemeriksaan saponin ... 32
3.7 Pembuatan Ekstrak ... 32
3.8 Pengujian Aktivitas Antioksidan ... 33
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH .. 33
3.8.2 Pembuatan larutan ... 33
3.8.3 Penentuan panjang gelombang serapan maksimum .... 33
3.8.4 Penentuan operating time larutan DPPH ... 34
3.8.5 Pembuatan larutan uji ... 34
3.8.6 Analisis persen pemerangkapan DPPH oleh sampel uji ... 34
3.8.7 Analisis nilai IC50 ... 35
BAB IV HASIL DAN PEMBAHASAN ... 36
4.1 Hasil Identifikasi Tumbuhan ... 36
4.2 Hasil Karakterisasi Simplisia ... 36
4.2.1 Hasil pemeriksaan makroskopik ... 36
4.2.2 Hasil pemeriksaan mikroskopik ... 36
4.2.3 Hasil pemeriksaan karakteristik ... 37
4.3 Hasil Skrining Fitokimia ... 38
4.4 Hasil Pengujian Aktivitas Antioksidan ... 39
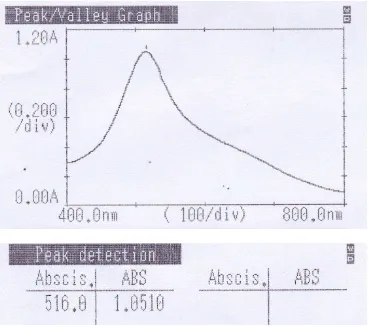
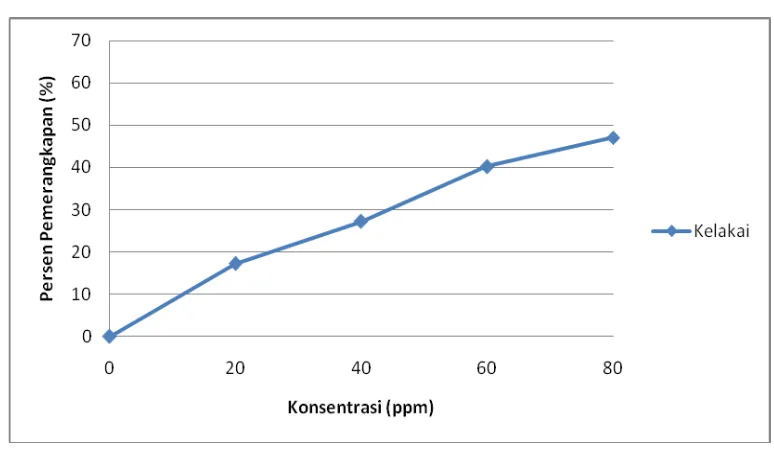
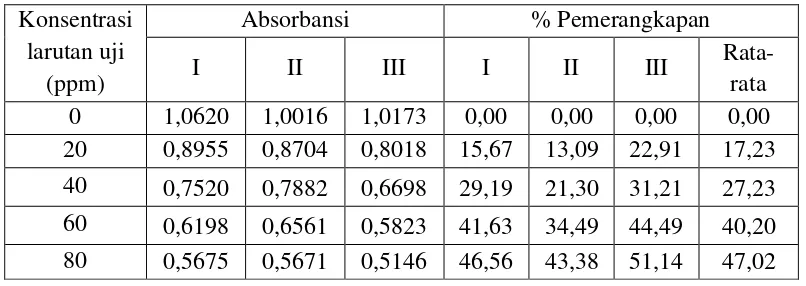
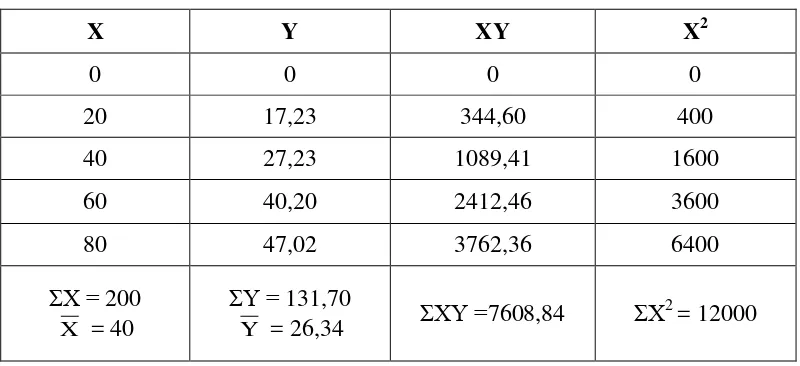
4.4.1 Hasil penentuan panjang gelombang serapan maksimum ... 39
4.4.3 Hasil analisis persen pemerangkapan DPPH oleh
sampel uji ... 41
4.4.4 Hasil analisis nilai IC50 ... 43
BAB V KESIMPULAN DAN SARAN ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Tabel Halaman
4.1 Hasil pemeriksaan karakteristik simplisia herba kelakai ... 37
4.2 Hasil skrining fitokimia simplisia herba kelakai ... 38
DAFTAR GAMBAR
Gambar Halaman
1.1 Skema kerangka pikir penelitian ... 5
2.1 Rumus bangun vitamin C... 17
2.2 Rumus bangun β-karoten ... 18
2.3 Rumus bangun flavonoid ... 19
2.4 Rumus bangun tokoferol ... 20
2.4 Rumus bangun DPPH ... 22
4.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam Metanol menggunakan spektrofotometer UV-Visibel ... 40
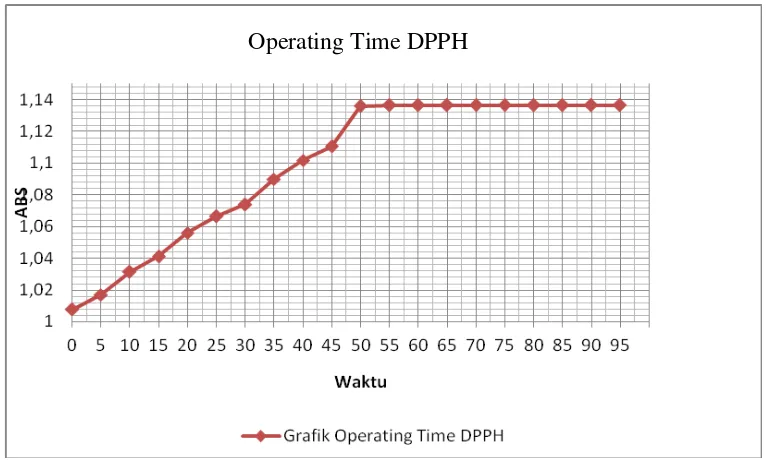
4.2 Kurva absorbansi operating time larutan DPPH ... 41
DAFTAR LAMPIRAN
Lampiran Halaman
1 Surat hasil identifikasi tumbuhan ... 48
2 Bagan kerja penelitian ... 50
3 Gambar tumbuhan dan simplisia herba kelakai ... 51
4 Gambar pemeriksaan mikroskopik serbuk simplisia herba ... 53
5 Gambar spektrofotometer (UVmini-1240 Shimadzu) ... 54
6 Data hasil penentuan operating time larutan DPPH ... 55
7 Perhitungan pemeriksaan karakteristik serbuk simplisia herba kelakai ... 56
8 Hasil analisis persen pemerangkapan DPPH oleh sampel uji ... 59
9 Hasil analisis nilai IC50 ... 61
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL
HERBA KELAKAI (Stenochlaena palustris (Burm.f.) Bedd.)
ABSTRAK
Tumbuhan kelakai (Stenochlaena palustris (Burm.f.) Bedd.) berasal dari suku Blechnaceae merupakan salah satu tumbuhan jenis paku-pakuan yang banyak tumbuh di Kalimantan Tengah. Daun dan batang kelakai muda dipercaya masyarakat suku Dayak memiliki banyak manfaat, diantaranya sebagai suplemen untuk penambah darah, obat awet muda, penambah ASI untuk ibu yang sedang menyusui, obat tekanan darah tinggi, pereda demam dan mengobati sakit kulit. Tujuan penelitian ini adalah untuk menentukan karakteristik simplisia, skrining fitokimia dan aktivitas antioksidan dari ekstrak etanolherba kelakai.
Tahapan penelitian meliputi pengumpulan bahan tumbuhan, identifikasi tumbuhan, pengolahan tumbuhan, karakterisasi simplisia dengan metode azeotropi dan gravimetri, skrining fitokimia menggunakan metode kualitatif, pembuatan ekstrak etanol dilakukan dengan cara perkolasi serta pengujian aktivitas antioksidan dengan menggunakan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) diukur pada panjang gelombang 516 nm setelah 60 menit pada suhu kamar. Kemampuan antioksidan diukur sebagai penurunan absorbansi larutan DPPH setelah penambahan ekstrak.
Hasil pemeriksaan karakteristik simplisia diperoleh kadar air 5,66%, kadar sari larut air 25,75%, kadar sari larut etanol 16,99%, kadar abu total 5,56%, kadar abu yang tidak larut dalam asam 1,17%. Hasil skrining fitokimia menunjukkan serbuk simplisia herba kelakai mengandung senyawa steroid, alkaloid, glikosida, flavonoid dan tanin. Hasil uji aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazil) menunjukkan bahwa ekstrak etanol herba kelakai termasuk dalam kategori antioksidan kuat dengan nilai Inhibitory Concentration (IC50) sebesar 80,43 ppm.
SIMPLEX CHARACTERIZATIONAND PHYTOCHEMICAL SCREENING AND ANTIOXIDANT ACTIVITY ASSAY
OF ETHANOL EXTRACT FROM KELAKAI HERBS (Stenochlaena palustris (Burm.f.) Bedd)
ABSTRACT
Kelakai (Stenochlaena palustris (Burm.f.) Bedd) is a member of Blechnaceae family and a kind of Pteridophyta plants that popularly grown at Middle Kalimantan. The leaves and stems of kelakai have so many functions, such as supplement for increasing blood, anti-aging materials, increasing breast milk in feeding mothers, anti-hypertensi, anti-pyretic, and curing the skin illness. The purpose of this study was to determine the characteristics of the simplex, phytochemycal screening and the antioxidant activity of ethanol extract of kelakai herbs.
Stages of research involves collecting plant material, plant identification, processing plants, bulbs characterization azeotropi and gravimetric method, phytochemical screening using qualitative methods, the manufacture of ethanol extract conducted by percolation method and test the antioxidant activity using DPPH free radical trapping methods (1, 1-diphenyl - 2 - picrylhydrazil ) measured at a wavelength of 516 nm after 60 minutes at room temperature. The ability of antioxidants measured as a decrease in absorbance of DPPH solution after the addition of the extract .
The result obtained from simplex characterization of kelakai’s herb are water content 5.66%, water-soluble extract content 25.75%, ethanol-soluble extract content 16.99%, total ash content 5.56%, and acid-insoluble ash content 1.17%. The result of phytochemical screening shows that kelakai’s simplex contained steroid, alkaloid and flavonoid. The result of antioxidant activity in scavenging DPPH free radical shows that ethanol extract of kelakai’s herb has antioxidant ativity in strong category with Inhibitory Concentration (IC50) value 80,432 ppm. Ethanol extract kelakai’s herb of showed strong category of antioxidant activity with Inhibitory Concentration (IC50) value 80,432 ppm.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Penggunaan senyawa antioksidan semakin berkembang baik untuk
makanan maupun pengobatan seiring dengan bertambahnya pengetahuan tentang
radikal bebas. Proses penuaan dan penyakit degeneratif seperti kanker,
kardiovaskuler, penyumbatan pembuluh darah yang meliputi hiperlipidemik,
aterosklerosis, stroke, dan tekanan darah tinggi serta terganggunya sistem imun
tubuh dapat disebabkan oleh stress oksidatif. Stress oksidatif merupakan keadaan
yang tidak seimbang antara jumlah molekul radikal bebas dan antioksidan dalam
tubuh (Trilaksani, 2003).
Sumber radikal bebas banyak ditemukan dalam kehidupan sehari-hari,
beberapa diantaranya yaitu asap rokok, asap kendaran bermotor, asap pabrik, air
yang tercemar logam berat, makanan berlemak serta paparan sinar matahari
berlebih (Kumalingsih, 2006). Untuk menetralisir kerja radikal bebas dibutuhkan
antioksidan. Antioksidan merupakan senyawa yang dapat menghambat reaksi
oksidasi, dengan mengikat radikal bebas dan molekul yang sangat reaktif,
akibatnya kerusakan sel dapat dihambat (Winarsi, 2007). Antioksidan alami
banyak ditemukan pada tanaman seperti biji-bijian, buah, dan sayur-sayuran yang
mempunyai manfaat bagi kesehatan. Antioksidan alami antara lain turunan fenol,
koumarin, hidroksi sinamat, tokoferol, difenol, flavonoid, dihidroflavon, katekhin,
asam askorbat (Prakash, 2001). Tumbuhan kelakai salah satu tumbuhan yang di
sebagai antioksidan karena mengandung flavonoid yang tinggi (Suhartono, dkk.,
2012)
Menurut penelitian mahasiswa Universitas Lambung Mangkurat
mendapatkan bahwa herba kelakai mengandung zat metabolit sekunder seperti
flavonoid, alkaloid dan steroid. Flavonoid merupakan zat yang berfungsi sebagai
antioksidan dari tumbuhan yang berwarna cerah. Warna-warna merah, biru, ungu
pada bagian-bagian tanaman disebabkan oleh warna pigmen antosianin, yang
merupakan bagian dari senyawa flavonoid (Maharani, 2005).
Kalimantan merupakan daerah yang mempunyai sebaran lahan rawa (rawa
air tawar dan rawa gambut) yang banyak ditumbuhi oleh berbagai macam jenis
paku-pakuan dan salah satunya tumbuhan kelakai (Ceri, dkk., 2014). Tumbuhan
kelakai (Stenochlaena palustris (Burm.f.) Bedd.) adalah jenis paku-pakuan yang
berasal dari suku Blechnaceae. Tumbuh hingga pada ketinggian 900 meter dpl dan
merambat pada hutan-hutan bekas penebangan kayu terutama dekat air tawar, air
payau, hutan bakau, khususnya disepanjang tepi sungai dan sumber air. Umumnya
ditemukan di dataran rendah, di tempat terbuka, hutan sekunder dan wilayah
rawa-rawa termasuk rawa gambut (MacKinnon, 2000). Daun-daunnya yang muda
bewarna kemerahan seperti warna udang yang di masak, oleh karena itu dinamai
juga paku merah atau paku udang (Hartini, 2011). Tumbuhan kelakai sebenarnya
tidak hanya tumbuh di Kalimantan tetapi tumbuh juga di daerah Sumatera dan
daerah lain yang kondisi tanahnya masih tanah gambut, namun penggunaan
kelakai sebagai penganan masih dominan dilakukan oleh masyarakat Kalimantan,
kelakai biasa dimasak dengan cara dioseng-oseng, sayur bening atau direbus
dipergunakan oleh masyarakat suku dayak sebagai suplemen penambah darah,
obat awet muda, penambah ASI untuk ibu yang sedang menyusui, obat tekanan
darah tinggi, pereda demam dan mengobati sakit kulit (Maharani dkk, 2005).
Berdasarkan uraian di atas, peneliti melakukan karakterisasi simplisia,
skrinning fitokimia serta uji aktivitas antioksidan ekstrak etanol herba kelakai.
Pengujian antioksidan dilakukan dengan menggunakan metode DPPH
(1,1-diphenyl-2-picrylhydrazil).
1.2 Perumusan Masalah
Berdasarkan latar belakang diatas, maka perumusan masalah dalam
penelitian ini adalah sebagai berikut:
a. apakah karakteristik simplisia herba kelakai dapat ditentukan?
b. apakah golongan senyawa kimia yang terkandung dalam herba kelakai?
c. apakah nilai IC50 antioksidan ekstrak etanol herba kelakai termasuk dalam
rentang kategori antioksidan kuat?
1.3 Hipotesis
Berdasarkan perumusan diatas, maka hipotesis penelitin ini adalah sebagai
berikut:
a. Karakteristik simplisia herba kelakai dapat ditentuka.
b. golongan senyawa kimia yang terkandung dalam herba kelakai adalah
golongan steroid, alkaloid, glikosida, flavonoid dan tanin.
c. nilai IC50 ekstrak etanol herba kelakai <100 termasuk ke dalam kategori
1.4 Tujuan
Berdasarkan hipotesis diatas, maka tujuan penelitian ini adalah sebagai
berikut:
a. untuk mengetahui karakteristik dari simplisia herba kelakai.
b. untuk mengetahui kandungan golongan senyawa kimia yang terdapat pada
herba kelakai.
c. untuk mengetahui nilai IC50 serta kategori kekuatan antioksidan dari ekstrak
etanol herba kelakai.
1.5 Manfaat
Dapat memberikan informasi mengenai golongan senyawa kimia yang
terkandung dalam herba kelakai serta khasiat ekstrak etanol herba kelakai sebagai
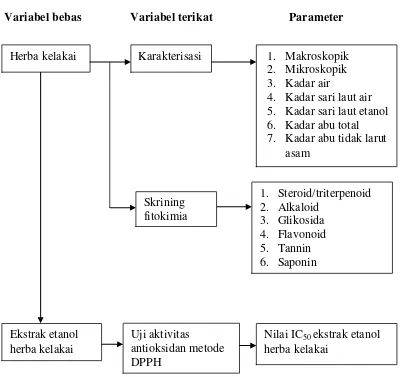
1.6 Kerangka Pikir Penelitian
Variabel bebas Variabel terikat Parameter
Herba kelakai Karakterisasi 1. Makroskopik 2. Mikroskopik 3. Kadar air
4. Kadar sari laut air 5. Kadar sari laut etanol 6. Kadar abu total 7. Kadar abu tidak larut
asam
Ekstrak etanol herba kelakai
Uji aktivitas
antioksidan metode DPPH
Nilai IC50 ekstrak etanol herba kelakai
Gambar 1.1 Skema kerangka pikir penelitian Skrining
fitokimia
1. Steroid/triterpenoid 2. Alkaloid
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan Paku (Pteridophyta)
Tumbuhan paku merupakan suatu divisi yang warganya telah jelas
mempunyai kormus, artinya tubuhnya dengan nyata dapat dibedakan dalam tiga
bagian pokoknya, yaitu akar, batang dan daun. Namun demikian, pada tumbuhan
paku belum dihasilkan biji. Alat perkembang-biakan tumbuhan paku yang utama
adalah spora (Tjitrosoepomo, 1994).
Tumbuhan paku dapat dibedakan menjadi dua bagian utama yaitu organ
vegetatif yang terdiri dari akar, batang, rimpang, dan daun. Sedangkan organ
generatif terdiri atas spora, sporangium, anteridium, dan arkegonium. Sporangium
tumbuhan paku umumnya berada di bagian bawah daun serta membentuk gugusan
berwarna hitam atau coklat. Gugusan sporangium ini dikenal sebagai sorus. Letak
sorus terhadap tulang daun merupakan sifat yang sangat penting dalam klasifikasi
tumbuhan paku. Menurut Tjitrosoepomo (1994) divisi Pteridophyta dapat
dikelompokkan kedalam empat kelas yaitu Psilophytinae (paku purba),
Lycopodiinae (paku kawat), Equisetinae (paku ekor kuda) dan Filiciane (paku
sejati); dan menurut Steennis (1988), tumbuhan paku-pakuan dapat dibagi ke
dalam 11 famili yaitu Salviniceae, Marsileaceae, Equicetaceae, Selagillaceae,
Lycopodiaceae, Ophiglossaceae, Schizaeaceae, Gleicheniaceae, Cyatheaceae,
Ceratopteridaceae dan Polypodiaceae.
Tumbuhan paku-pakuan yang tergolong dalam kelas Filiciane (paku sejati)
paku sejati sebagian besar di darat pada daerah tropis dan subtropis. Paku sejati
diperkirakan berjumlah 12.000 jenis dari kelas Filicinae. Filicinae memiliki akar,
batang, dan daun sejati. Batang dapat berupa batang dalam (rizom) atau batang di
atas permukaan tanah. Daun Filicinae umumnya berukuran besar dan memiliki
tulang daun bercabang. Daun mudanya memiliki ciri khas yaitu tumbuh
menggulung (circinnatus) (Tjitrosoepomo, 1994).
2.2 Tumbuhan Kelakai
2.2.1 Morfologi tumbuhan
Tumbuhan kelakai merupakan jenis tumbuhan paku yang memiliki
panjang 5 – 10 m. Akar rimpang yang memenjat tinggi, kuat, pipih persegi.
Tangkai daun 10 – 20 cm, kuat. Daun menyirip tunggal 1,5 – 4 cm, mengkilap,
daun mudanya berwarna merah muda, merah kerap kali keungu-unguan,
bertekstur lembut dan tipis, semakin dewasa daunnya mengalami perubahan
warna menjadi kecoklatan dan pada akhirnya menjadi hijau tua dan keras. Daun
berbentuk lanset, ujungnya meruncing, tepinya bergerigi dan pangkalnya
membulat (Steenis, 2003).
2.2.2 Daerah tumbuh
Tumbuhan kelakai tumbuh hingga pada ketinggian 900 meter dibawah
permukaan laut dan merambat pada hutan-hutan bekas penebangan kayu terutama
dekat air tawar, air payau, hutan bakau, di tanah pasir, khususnya disepanjang tepi
sungai dan sumber air. Paku ini didapati di mana-mana seperti di dataran rendah,
di tempat terbuka, hutan sekunder dan umum ditemukan di wilayah rawa-rawa
2.2.3 Sistematika tumbuhan
Sistematika tumbuhan kelakai hasil identifikasi Herbarium Medanense
adalah sebagai berikut:
Kingdom : Plantae
Divisi : Pteridophyta
Kelas : Filicopsida
Ordo : Filicales
Suku : Blechnaceae
Genus : Stenochlaena
Spesies : Stenochlaena palustris (Burm. f.) Bedd.
Sinonim :Polypodium palustris Burm. f., Onoclea scandens Sw.,
Lomaria scandens (Sw) Willd (Anonimb, 2012)
Nama asing : Miding, melat, akar pakis (Malaysia) (Anonima, 2013).
Nama daerah : Kelakai atau kalakai (Kalimantan Tengah/Kalimantan Selatan),
Lemiding, miding (Pontianak), paku bang (Jawa), maja-majang,
wewesu, bampesu (Sulawesi), lemidi (Sumatera) (Anonima,
2013).
2.2.4 Khasiat dan manfaat
Bagi masyarakat Dayak Kalimantan Tengah kelakai merupakan makanan
favorit, kelakai dimasak dengan cara dioseng-oseng, sayur bening atau direbus
untuk lalapan. Berdasarkan studi empiris daun dan batang kelakai muda
dipergunakan oleh masyarakat suku Dayak sebagai suplemen penambah darah,
obat awet muda, penambah ASI pada ibu yang sedang menyusui, obat tekanan
2.2.5 Kandungan kimia
2.2.5.1 Steroida/triterpenoida
Steroid merupakan senyawa kimia yang memiliki kerangka dasar
siklopentanafenantren. Pada umumnya, gugus metil berada pada C10 dan C13.
Rantai samping alkil dapat juga berada pada C17. Sterol adalah steroid yang
memiliki gugus hidroksi pada C3.
Triterpenoid merupakan senyawa yang mempunyai kerangka karbonnya
berasal dari enam satuan isopren, dimana kerangka karbonnya dibangun oleh dua
atau lebih satuan C5 tersebut. Senyawa terpenoid terdapat bebas dalam jaringan
tanaman, tetapi banyak diantaranya yang terdapat sebagai alkohol, aldehid
(Harbone,1987), glikosida dan ester asam aromatik (Sastrohamidjojo, 1996).
Pembagian triterpenoid berdasarkan jumlah cincin yang terdapat pada struktur
molekulnya (Robinson, 1995), antara lain triterpenoid asiklik, triterpenoid
trisiklik, triterpenoid tetrasiklik dan triterpenoid pentasiklik.
2.2.5.2 Alkaloid
Alkaloid merupakan golongan zat/senyawa tumbuhan sekunder yang
terbesar. Umumnya alkaloid mencakup senyawa yang bersifat basa yang
mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan, sebagai
bagian dalam sistem siklik. Alkaoid sering kali beracun bagi manusia dan banyak
mempunyai kegiatan fisiologi yang menonjol, jadi digunakan luas dalam bidang
pengobatan (Harbone, 1987).
2.2.5.3 Glikosida
Glikosida merupakan senyawa yang mengandung komponen gula dan
gula dikenal sebagai aglikon. Dari segi biologi, glikosida memiliki peranan
penting di dalam kehidupan tumbuhan dan terlibat di dalam pertumbuhan dan
perlindungan tumbuhan tersebut. Beberapa glikosida mengandung lebih dari satu
jenis gula dalam bentuk disakarida atau trisakarida (Gunawan dan Mulyani,
2004).
Semua glikosida alam dapat terhidrolisis menjadi gula dan bukan gula
dengan cara mendidihkannya bersama asam mineral. Biasanya, glikosida juga
dapat terhidrolisis dengan mudah oleh enzim yang terdapat dalam jaringan
tumbuhan yang sama. Pengelompokan glikosida berdasarkan struktur bukan gula
terbagi atas : glikosida jantung, glikosida antrakinon, glikosida saponin, glikosida
sianogenik, glikosida isotiosianat, glikosida flavonol, glikosida alkohol, glikosida
alkohol, glikosida aldehida, glikosida lakton, glikosida fenol dan tanin (Tyler,
1988).
Menurut Farnsworth (1966), pembagian glikosida berdasarkan ikatan yang
menghubungkan bagian gula dan bukan gula adalah:
a. C-glikosida yaitu senyawa glikosida yang ikatan antara glikon dan aglikonnya
dihubungkan oleh atom C. Contoh: Barbaloin.
b. O-glikosida yaitu senyawa glikosida yang ikatan antara glikon dan aglikonnya
dihubungkan oleh atom O. Contoh: Salisin.
c. N-glikosida yaitu senyawa glikosida yang ikatan antara glikon dan aglikonnya
dihubungkan oleh atom N. Contoh: Krotonosid.
d. S-glikosida yaitu senyawa glikosida yang ikatan antar glikon dan aglikonnya
2.2.5.4 Flavonoid
Flavonoid merupakan sekelompok besar senyawa polifenol tanaman yang
tersebar luas dalam berbagai bahan makanan dan dalam berbagai konsentrasi.
Flavonoid memiliki kerangka dasar karbon yang terdiri atas 15 atom karbon,
dimana dua cincin benzen (C6) terikat pada suatu rantai propan (C3) sehingga
membentuk susunan C6-C3-C6 (Lenny, 2006).
Flavonoida berfungsi dalam menarik burung dan serangga yang berperan
untuk proses penyerbukan bunga. Beberapa fungsi lainnya adalah untuk mengatur
fotosintesis, kerja antimikroba dan antivirus serta memiliki kemampuan dalam
mengusir serangga (Robinson, 1995).
Peranan beberapa senyawa fenol sudah diketahui misalnya antosianin
sebagai pigmen bunga yang menghasilkan hampir semua warna merah jambu,
merah marak, merah, merah senduduk, ungu dan biru. Antosianin hampir terdapat
umum dalam tumbuhan berpembuluh seperti dalam beberapa lumut dan daun
muda paku (Harbone, 1987).
2.2.5.5 Tanin
Tanin adalah senyawa fenol dengan berat molekul yang cukup tinggi,
mengandung gugus hidroksil dan kelompok lain yang cocok (seperti karboksil)
untuk membentuk kompleks yang efektif dengan protein dan makro molekul yang
lain dibawah kondisi lingkungan tertentu yang telah dipelajari. Tanin merupakan
bentuk komplek dari protein, pati, selulosa dan mineral (Horvath, 1981).
Tanin dibagi menjadi dua kelompok yaitu tanin yang terhidrolisis dan
tanin yang terkondensasi. Tanin yang terhidrolisis merupakan polimer gallic atau
terkondensasi merupakan polimer senyawa flavonoid dengan ikatan
karbon-karbon (Westendarp, 2006).
Tanin terbagi dalam dua golongan, yaitu berasal dari turunan pyrogallol
memiliki 3 gugus hidroksil pada inti aromatis dan berasal dari turunan
pyrocatechol yang memiliki 2 gugus hidroksil pada inti aromatis. Pyrogallol dan
catechol merupakan hasil peruraian glikosida tanin yangdapat digunakan sebagai
anti bakteri dan anti fungi dengan adanya gugus –OH. Tanin merupakan senyawa
yang tidak dapat dikristalkan (Tyler, 1988).
2.3 Simplisia dan Ekstrak
2.3.1 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang
belum mengalami pengolahan apapun juga dan kecuali dikatakan lain, berupa
bahan yang telah dikeringkan. Simplisia dibedakan simplisia nabati, simplisia
hewani dan simplisia pelikan (mineral). Simplisia nabati adalah simplisia yang
berupa tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan
(Ditjen POM, 2000).
2.3.2 Ekstrak
Ekstrak yaitu sediaan kental atau cair yang diperoleh dengan
mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan
pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan
(Depkes RI, 1995).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
Simplisia yang diekstraksi mengandung senyawa aktif yang dapat larut dan
senyawa yang tidak dapat larut (Ditjen POM, 2000).
Menurut Ditjen POM (2000), ada beberapa metode ekstraksi yang sering
digunakan dalam berbagai penelitian antara lain yaitu:
a. Cara dingin
1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar.
Maserai yang dilakukan dengan cara pengadukan dan pengulangan penambahan
pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya
disebut remaserasi.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu
baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada
temperature kamar.
b. Cara panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang
relatif konstan dengan adanya pendingin balik.
2. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum
3. Soxhletasi
Soxhletasi adalah proses penyarianatau ekstraksi dengan menggunakan
pelarut yang selalu baru, dilakukan dengan menggunakan alat soklet sehingga
menjadi ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin
balik.
4. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 30 menit.
2.4 Radikal Bebas
Radikal bebas adalah atom atau gugus atom yang memiliki satu atau lebih
elektron tidak berpasangan, sehingga senyawa tersebut sangat reaktif mencari
pasangan (Fessenden dan Fessenden, 1986). Senyawa ini terbentuk di dalam
tubuh dapat dipicu oleh berbagai faktor, misalnya ketika komponen makanan
diubah menjadi bentuk energi melalui proses metabolisme. Dalam kondisi
demikian mudah terbentuk radikal bebas, seperti anion superoksida, hidroksil dan
lain-lain. Radikal bebas juga dapat terbentuk dari senyawa lain yang sebenarnya
bukan radikal bebas, tetapi mudah berubah menjadi radikal bebas (Winarsi, 2007).
Radikal bebas cenderung menangkap elektron dari molekul lain dan
kemudian membuat senyawa baru yang tidak normal yang akan menyebabkan
tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit seperti
kanker, jantung koroner, katarak, serta penyakit degeneratif lainnya (Muchtadi,
2013).
Mekanisme reaksi radikal bebas terbentuk melalui 3 tahapan reaksi, yaitu:
(1) permulaan (inisiasi, initiation) suatu radikal bebas, (2) perambatan (propagasi,
propagation) reaksi radikal bebas; (3) pengakhiran (terminasi, termination) reaksi
radikal bebas (Fessenden dan Fessenden, 1986).
Tahap inisiasi adalah tahap awal terbentuknya radikl bebas. tahap
propagasi adalah tahap perpanjangan radikal berantai, dimana terjadi reaksi antara
sutau radikal dengan senyawa lain dan menghasilkan radikal baru. Tahap
terminasi adalah tahap akhir, terjadi pengikatan suatu radikal bebas dengan radikal
bebas yang lain sehingga membentuk senyawa non radikal yang biasanya kurang
reaktif dari radikal induknya (Kumalaningsih, 2006).
Sifat radikal bebas yang tidak stabil menyebabkan reaksi menerima atau
memberikan elektron dengan molekul sekitarnya. Kebanyakan molekul ini bukan
radikal bebas melainkan makromolekul biologi seperti lipid, protein, asam nukleat
dan karbohidrat. Dengan reaksi ini timbulah reaksi radikal bebas beruntun yaitu
terbentuknya radikal bebas baru yang bereaksi lagi dengan makromolekul lain
(Kosasih, dkk., 2004).
2.5 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang
dapat memberikan elektronnya kepada molekul radikal bebas dan dapat memutus
reduktor berfungsi untuk mencegah terjadinya reaksi oksidasi atau menetralkan
senyawa yang telah teroksidasi dengan cara menyumbangkan hidrogen dan atau
elektron (Silalahi, 2006).
Menurut Kumalaningsih (2006), antioksidan tubuh dikelompokkan
menjadi 3 yakni:
1. Antioksidan primer yang berfungsi untuk mencegah pembentuk senyawa
radikal baru karena dapat merubah radikal bebas yang ada menjadi molekul
yang berkurang dampak negatifnya, sebelum radikal bebas ini sempat bereaksi.
Contohnya adalah enzim superoksida dismutase (SOD) yang berfungsi sebagai
pelindung hancurnya sel-sel dalam tubuh karena radikal bebas.
2. Antioksidan sekunder merupakan senyawa yang berfungsi menangkap
senyawa serta mencegah terjadinya reaksi berantai. Contohnya adalah vitamin
E, vitamin C dan betakaroten yang dapat diperoleh dari buah-buahan.
3. Antioksidan tersier merupakan senyawa yang memperbaiki kerusakan sel-sel
dan jaringan yang disebabkan radikal bebas. Contohnya enzim metionin
sulfoksidan reduktase untuk memperbaiki DNA pada inti sel.
Khasiat antioksidan untuk mencegah berbagai penyakit akibat pengaruh
oksidatif akan lebih efektif jika kita mengkonsumsi sayur-sayuran dan
buah-buahan yang kaya akan antioksidan dan berbagai jenis daripada menggunakan
antioksidan tungggal. Hal ini mungkin dikarenakan oleh adanya komponen lain
dan interaksinya dalam sayur-sayuran dan buah-buahan yang berperan secara
positif (Silalahi, 2006).
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik
asam-asam organik. Senyawa polifenolik dapat bereaksi sebagai pereduksi,
penangkap radikal bebas. Antioksidan alami yaitu antioksidan yang dapat
diperoleh dari tanaman atau hewan berupa tokoferol, vitamin C, betakaroten,
flavonoid dan senyawa fenolik (Kumalaningsih, 2006).
2.5.1 Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan
rumus bangun C6H8O6, dengan titik lebur 190 - 192°C. Asam askorbat
mengandung tidak kurang dari 99,0% C6H8O6. Pemerian: serbuk atau hablur
putih atau agak kuning, tidak berbau, rasa asam, oleh pengaruh cahaya lambat
laun menjadi gelap, dalam larutan cepat teroksidasi. Penyimpanan dalam wadah
tertutup rapat, terlindung dari cahaya. Vitamin C mengandung khasiat sebagai
antiskorbut (Ditjen POM, 1979).
Gambar 2.1. Rumus bangun vitamin C (Silalahi, 2006)
Vitamin C berperan dalam pencegahan penyakit jantung koroner,
mencegah kanker, meningkatkan sistem kekebalan tubuh terhadap infeksi virus
dan bakteri (Kosasih, dkk., 2004).
2.5.2 Karotenoid
tidak larut dalam air. Salah satu senyawa karotenoid adalah β-karoten, yaitu
senyawa yang akan dikonversikan menjadi vitamin A oleh tubuh sehingga sering
juga disebut sebagai pro-vitamin A (Kumalaningsih, 2006).
β-karoten mempunyai berat molekul 536,9 dengan rumus molekul C40H56.
Karakteristik β-karoten adalah hablur atau serbuk berwarna coklat-merah atau
merah kecoklatan, praktis tidak larut dalam air, sedikit larut dalam sikloheksana,
kurang larut dalam etanol. β-karoten peka terhadap udara, panas dan cahaya,
terutama ketika dalam bentuk larutan. Rumus bangun β-karoten dapat dilihat
pada gambar 2.2 berikut:
Gambar 2.2Rumus bangun β-karoten
Sebagai antioksidan, β-karoten memperlambat fase inisiasi radikal bebas
sehingga dapat melindungi tubuh terhadap berbagai penyakit, yaitu menghambat
pertumbuhan sel kanker, mencegah serangan jantung, mencegah katarak, serta
meningkatkan fungsi sistem kekebalan tubuh (Silalahi, 2006).
2.5.3 Flavonoid
Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3
-C6. Kelompok terbesar flavonoid memiliki ciri adanya cincin piran yang
(Robinson, 1995). Flavonoid pada tumbuhan berfungsi sebagai pelindung
terhadap serangan jamur ataupun radiasi sinar UV yang dapat merusak tumbuhan,
selain itu flavonoid juga terlibat dalam proses fotosintesis, transfer energi dan
respirasi pada tumbuhan. Struktur umum untuk turunan flavonoid dapat dilihat
pada gambar berikut:
Gambar 2.3 Rumus bangun flavonoid (Silalahi 2006)
Senyawa ini adalah senyawa pereduksi yang dapat menghambat reaksi
oksidasi sehingga dapat dijadikan sebagai antioksidan (Robinson, 1995). Senyawa
ini berperan sebagai penangkap radikal bebas karena mengandung gugus hidroksil
(Silalahi, 2006).
2.5.4 Tokoferol
Tokoferol merupakan salah satu antioksidan yang terdapat dalam
tumbuhan. Struktur α-tokoferol dapat dilihat pada gambar berikut:
Gambar 2.4 Rumus bangun α- tokoferol (Yoshida, dkk., 2007)
Beberapa tokoferol ada yang terdapat di alam, salah satunya α-tokoferol
yang merupakan senyawa paling aktif secara biologis (Silalahi, 2006). Aktivitas
anti aging dan sedang dilakukan penelitian lebih lanjut mengenai efektivitasnya
dalam pengobatan Alzheimer (Yoshida, dkk., 2007).
2.5.5 Polifenol
Polifenol adalah kelompok zat kimia yang ditemukan pada tumbuhan. Zat
ini memiliki tanda khas yakni memiliki banyak gugus fenol dalam molekulnya.
Polifenol memiliki spektrum luas dengan sifat kelarutan pada suatu pelarut yang
berbeda-beda, hal ini disebabkan oleh gugus hidroksil pada senyawa tersebut yang
dimiliki berbeda jumlah dan posisinya (Hattenschwiler, 2000).
Turunan polifenol sebagai antioksidan dapat menstabilkan radikal bebas
dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas.
Polifenol merupakan komponen yang bertanggung jawab terhadap aktivitas
antioksidan dalam buah dan sayur (Hattenschwiler, 2000).
2.6 Spektrofotometri UV-Visible
Prinsip kerja spektrofotometer UV-Vis adalah sinar/cahaya dilewatkan
melewati sebuah wadah (kuvet) yang berisi larutan, dimana akan menghasilkan
spektrum. Sebagian dari cahaya tersebut akan diserap dan sisanya akan
dilewatkan. Nilai absorbansi dari cahaya yang dilewatkan akan sebanding dengan
konsentrasi larutan didalam kuvet. Alat ini menggunakan hukum Lambert Beer
sebagai acuan (Ewing, 1985).
Ahli kimia telah lama menggunakan warna sebagai bantuan dalam
mengenali zat-zat kimia. Spektrofotometri dapat dianggap sebagai perluasan suatu
pemeriksaan visual, yaitu dengan menggunakan alat untuk mengukur absorpsi
pengukuran kualitatif dari suatu zat dengan ketelitian yang lebih besar (Day,
1994).
Spektrofotometer UV/Visibel pada dasarnya terdiri atas sumber sinar
monokromator, tempat sel untuk zat yang diperiksa, detektor, penguat arus dan
alat ukur atau pencatatt. Panjang gelombang untuk sinar ultraviolet antara 200 -
400 nm sedangkan panjang gelombang untuk sinar tampak/visible antara 400 -
750 nm (Rohman, 2007).
2.7 Penentuan Aktivitas Antioksidan Dengan Metode DPPH
Metode untuk menentukan aktivitas antioksidan ada beberapa cara, yaitu:
(1). BCB Method (β-Carotene Bleaching Method) atau Metode Pemutihan β
-karoten, (2). DPPH (1,1-difenil-2- picrylhydrazil) Radical Scavenging Method
(Metode Pemerangkapan Radikal Bebas DPPH), (3). Thiobarbituric
Acid-Reactive Substance (TBARS) Assay, (4). ORAC Assay (Oxygen-Radical
Absorbance Capacity), (5). CUPRAC Assay (Cupric Reducing Antioxidant
Capacity), (6). FRAP Assay (Ferric Reducing Antioxidant Power), (7).
Determination of Conjugated Dienes, (8). Determination of Lipid Hydroperoxides
(De la Rosa, 2010).
Pada tahun 1922, Goldschmidt dan Renn menemukan senyawa berwarna
ungu radikal bebas stabil DPPH. DPPH berwarna sangat ungu seperti KMnO4 dan
tidak larut dalam air (Ionita, 2005).
Metode DPPH merupakan suatu metode yang cepat, sederhana dan murah
yang dapat digunakan untuk menguji kemampuan antioksidan yang terkandung
dalam makanan. Metode DPPH dapat digunakan untuk sampel yang padat dan
juga dalam bentuk larutan. Prinsipnya dimana elektron ganjil pada molekul DPPH
memberikan serapan maksimum pada panjang gelombang 517 nm yang berwarna
ungu. Warna ini akan berubah dari ungu menjadi kuning lemah apabila elektron
ganjil tersebut berpasangan dengan atom hidrogen yang disumbangkan senyawa
antioksidan. Perubahan warna ini berdasarkan reaksi kesetimbangan kimia
(Prakash, 2001).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah
harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibition
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan % penghambatan 50%. Zat yang mempunyai
aktivitas antioksidan tinggi, akan mempunyai harga EC50 atau IC50 yang rendah
(Molyneux, 2004).
2.7.1 Pelarut
Pelarut yang digunakan dalam metode DPPH akan bekerja dengan baik
bila menggunakan pelarut metanol atau etanol dan kedua pelarut ini tidak akan
mempengaruhi dalam reaksi antara sampel uji sebagai antioksidan dengan DPPH
2.7.2 Pengukuran absorbansi panjang gelombang
Panjang gelombang maksimum (λ maks) yang digunakan dalam
pengukuran uji sampel uji sangat bervariasi. Menurut beberapa literatur panjang
gelombang maksimum untuk DPPH antara lain 515-520 nm, bagaimanapun dalam
praktiknya hasil pengukuran yang memberikan peak maksimum itulah panjang
gelombangnya yaitu sekitar panjang gelombang yang disebutkan diatas. Nilai
absorbansi yang mutlak tidaklah penting, karena panjang gelombang dapat diatur
untuk memberikan absorbansi maksimum sesuai dengan alat yang digunakan
(Molyneux, 2004).
2.7.3 Waktu pengukuran
Lamanya pengukuran menurut literatur bervariasi yakni 1 menit, 5 menit,
10 menit, 20 menit, 30 menit, 60 menit, 90 menit, 120 menit sampai 240 menit.
Waktu pengukuran yang direkomendasikan adalah 20 menit dan 30 menit.
Kecepatan reaksi dipengaruhi oleh sifat dari aktivitas antioksidan yang terdapat di
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental. Metodologi
penelitian meliputi pengumpulan dan pengolahan bahan tumbuhan, identifikasi
bahan tumbuhan, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak
etanol serta uji aktivitas antioksidan dengan metode DPPH (
1,1-diphenyl-2-picrylhydrazyl sebagai sumber radikal bebas dan absorbansi DPPH diukur
menggunakan alat spektrofotometer visibel pada panjang gelombang 516 nm.
3.1 Alat
Alat-alat yang digunakan terdiri dari alat-alat gelas laboratorium
(corong, corong pisah, erlenmeyer, gelas arloji, gelas beaker, gelas ukur, labu
bersumbat, labu tentukur, matt pipet, tabung reaksi, pipet tetes), aluminium foil,
blender (National), cawan berdasar rata, desikator, kaca objek, kaca penutup,
kertas saring, krus porselin, lemari pengering, mikroskop (Olympus), neraca
analitis (Vibra), neraca kasar (O’haus), oven listrik (Stork), penangas air
(Yenaco), rotary evaporator (Stuart), spektofotometer UV/Vis (Shimadzu) dan
tanur (Gallenkamp).
3.2Bahan
Bahan yang digunakan adalah herba dari tumbuhan kelakai. Bahan-bahan
kimia berkualitas pro analisis poduksi Sigma: 1,1-diphenyl-2-picrylhydrazyl
pekat, asam nitrat pekat, asam sulfat pekat, benzen, besi (III) klorida, bismuth (III)
nitrat, isopropanol, kloroform, metanol, n-heksan, raksa (II) klorida, serbuk
magnesium (Mg), timbal (II) asetat, kloralhidrat, toluen, kalium iodida, α-naftol.
Bahan kimia berkualitas teknis: etanol 70% dan air suling.
3.3 Penyiapan Bahan Tumbuhan
3.3.1 Pengumpulan bahan tumbuhan
Pengumpulan bahan tumbuhan dilakukan secara purposive yaitu tanpa
membandingkan dengan bahan tumbuhan yang sama dari daerah lain. Bahan
tumbuhan yang digunakan adalah herba dari tumbuhan kelakai (Stenochlaena
palustris (Burm.f.) Bedd.), diambil dari Jl.G.Obos, Kecamatan Jekan Raya Kota
Palangkaraya, Provinsi Kalimantan Tengah.
3.3.2Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Laboratorium Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi-LIPI Bogor dan di Herbarium Medanense
Universitas Sumatera Utara-Medan.
3.3.3 Pengolahan bahan tumbuhan
Bahan yang digunakan adalah herba dari tumbuhan kelakai yang masih
muda. Herba kelakai yang telah terkumpul dibersihkan dari kotoran, dicuci,
ditiriskan kemudian ditimbang sebagai berat basah.
Herba kelakai selanjutnya dikeringkan dalam lemari pengering pada
temperatur ± 40°C sampai kering (ditandai bila diremas rapuh), kemudian
ditimbang sebagai berat kering. Simplisia yang telah kering diblender menjadi
dan pengotoran lain. Bagan kerja penelitian dapat dilihat pada lampiran 2,
halaman 50.
3.4Pembuatan Pereaksi
3.4.1 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
secukupnya hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.2Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbon dioksida sebanyak 100 ml (Depkes RI, 1995).
3.4.3 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga
diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.4 Pereaksi asam sulfat 2 N
Sebanyak 5,5 ml larutan asam sulfat pekat ditambahkan air suling sampai
100 ml (Depkes RI, 1995).
3.4.5Pereaksi kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml
air suling (Depkes RI, 1995).
3.4.6 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml
pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10
ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga
3.4.7 Pereaksi Molisch
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Depkes RI,1995).
3.4.8 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam
nitrat pekat, lalu ditimbang sebanyak 27,2 g kalium iodide dalam 50 ml air suling.
Kedua larutan dicampurkan dan didiamkan sampai memisah sempurna, larutan
jernih diencerkan dalam air suling hingga volume 100 ml (Depkes RI, 1995).
3.4.9 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling
secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling
hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.10 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50
bagian volume etanol 95% ditambahkan dengan hati-hati 5 bagian volume asam
asetat anhidrida ke dalam campuran tersebut dan dinginkan (Depkes RI, 1995).
3.5Karakterisasi Simplisia
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari
herba kelakai segar dan simplisia herba kelakai.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia herba
larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati di bawah
mikroskop.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Alat terdiri dari labu alas bulat 500 ml, pendingin, tabung penyambung, tabung
penerima 5 ml berskala 0,05 ml, alat penampung dan pemanas listrik.
a. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan kedalam labu alas
bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Sebanyak 5 gram serbuk simplisia yang telah ditimbang seksama
dimasukkan ke dalam labu yang berisi toluen yang telah dijenuhkan, kemudian
labu dipanaskan selama 15 menit, setelah toluen mendidih, kecepatan tetesan
diatur 2 tetes/detik sampai sebagian besar air terdestilasi, kemudian kecepatan
destilasi dinaikkan sampai 4 tetes/detik, setelah semua air terdestilasi, bagian
dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit,
kemudian tabung penerima dibiarkan mendingin pada suhu kamar, setelah air dan
toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Kadar air
dihitung dalam persen (WHO, 1992).
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dengan
didalam labu bersumbat, dikocok sesekali selama 6 jam pertama, kemudian
dibiarkan selama 18 jam, kemudian disaring. Sejumlah 20 ml filtrat diuapkan
sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan
dan ditara. Sisa dipanaskan pada suhu 105º C sampai bobot tetap. Kadar dalam
persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan
(Depkes RI, 1995).
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama,
kemudian dibiarkan selama 18 jam, kemudian disaring cepat untuk menghindari
penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan
penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan
pada suhu 105 ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam
etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.6 Penetapan kadar abu total
Sebanyak 2 gram serbuk ditimbang seksama dimasukkan dalam krus
porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar
perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600 ºC selama 3 jam
kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu
dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25
ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
lalu dipijar sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu
yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan
(Depkes RI, 1995).
3.6 Skrining Fitokimia
3.6.1 Pemeriksaan steroida/triterpenoida
Serbuk simplisia ditimbang sebanyak 1 g serbuk simplisia dimaserasi
dengan 20 ml n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan
penguap. Pada sisa ditambahkan beberapa tetes pereaksi Liebermann-Burchard.
Timbulnya warna biru atau biru hijau menunjukkan adanya steroida, sedangkan
warna merah, merah muda atau ungu meunjukkan adanya triterpenoida (Harborne,
1987).
3.6.2 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g, ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit,
kemudian didinginkan dan disaring, filtrat lalu dipakai untuk uji alkaloida.
Diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan
0,5 ml filtrat.
Pada tabung I : ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan
menggumpal berwarna putih atau kuning.
Pada tabung II : ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk
endapan berwarna coklat atau jingga kecoklatan.
Pada tabung III : ditambahkan 2 tetes pereaksi Bourchardat, akan terbentuk
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau
tiga dari percobaan di atas (Depkes RI, 1995).
3.6.3Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml
campuran 7 bagian volume etanol 96% dan 3 bagian volum air suling ditambah
dengan 10 ml asam klorida 2 N. Direfluks selama 30 menit, didinginkan dan
disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan 25 ml timbal (II)
asetat 0,4 M lalu dikocok selama 5 menit dan disaring. Filtrat disari dengan 20 ml
campuran 3 bagian kloroform dan 2 isopropanol dilakukan berulang sebanyak tiga
kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC. Sisanya
dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut,
yaitu 0,1 ml larutan percobaan dimasukkan ke dalam tabung reaksi, diuapkan di
penangas air. Sisa dilarutkan dalam 2 ml air suling dan 5 tetes pereaksi Molish
kemudian secara perlahan ditambahkan 2 ml asam sulfat pekat. Glikosida positif
jika terbentuk cincin ungu (Depkes, 1995).
3.6.4 Pemeriksaan flavonoid
Serbuk simplisia ditimbang sebanyak 10 g, ditambahkan 10 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml
filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml
amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna
merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.5 Pemeriksaan tanin
Serbuk simplisia ditimbang sebanyak 0,5 g, disari dengan 10 ml air suling
diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%.
Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin
(Farnsworth, 1966).
3.6.6 Pemeriksaan saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam
tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok
kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1 sampai 10 cm yang
stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes
asam klorida 2 N menunjukkan adanya saponin (Depkes RI, 1995).
3.7Pembuatan Ekstrak
Pembuatan ekstrak etanol herba kelakai dilakukan dengan cara perkolasi.
Prosedur pembuatan ekstrak sebanyak 230 g serbuk simplisia dibasahi dengan
etanol 70% dan dibiarkan selama 3 jam., Kemudian dimasukkan ke dalam alat
perkolator, lalu dituang cairan penyari etanol sampai semua simplisia terendam
dan terdapat selapis cairan penyari diatasnya, mulut tabung perkolator ditutup
dengan alumunium foil dan dibiarkan selama 24 jam, kemudian kran dibuka dan
dibiarkan tetesan ekstrak mengalir dengan kecepatan 1 ml/menit, perkolat
ditampung.
Cairan penyari ditambahkan berulang-ulang secukupnya sehingga selalu
terdapat cairan penyari di atas simplisia. Perkolasi dihentikan jika cairan perkolat
terakhir yang keluar tidak berwarna lagi. Biarkan dalam bejana tertutup 2 hari
ditempat sejuk dan terlindung dari cahaya. Saring lalu dipekatkan dengan alat
3.8Pengujian Aktivitas Antioksidan
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi radikal bebas
DPPH (1,1 diphenyl-2-picryl-hidrazyl) dalam larutan metanol (sehingga terjadi
perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50 (konsentrasi
sampel uji yang mampu meredam radikal bebas 50%) digunakan sebagai
parameter menentukan aktivitas antioksidan sampel uji (Molyneux, 2004).
3.8.2 Pembuatan larutan
a. Larutan blanko DPPH
Sebanyak 10 mg DPPH ditimbang, kemudian dimasukkan ke dalam labu
tentukur 50 ml, dicukupkan volumenya dengan pelarut metanol sampai garis
tanda, maka diperoleh larutan DPPH 0,5 mM (konsentrasi = 200 ppm).
Dipipet larutan DPPH 0,5 mM (konsentrasi = 200 ppm) sebanyak 5 ml
dimasukkan ke dalam labu tentukur 25 ml, dicukupkan volumenya dengan
metanol sampai garis tanda, maka diperoleh larutan blanko DPPH (konsentrasi =
40 ppm).
b. Larutan sampel induk (ekstrak etanol herba kelakai)
Sebanyak 25 mg sampel ditimbang, kemudian dilarutkan dalam labu
tentukur 25 ml dengan methanol, lalu volumenya dicukupkan dengan metanol
sampai garis tanda, maka diperoleh larutan induk baku sampel (konsentrasi =
1000 ppm).
3.8.3Penentuan panjang gelombang serapan maksimum
Larutan DPPH dengan konsentrasi 40 ppm dihomogenkan dengan pelarut
seperangkat alat spektrofotometer uv-visibel (UVmini-1240 Shimadzu) dapat
dilihat pada Lampiran 5, halaman 34.
3.8.4 Penentuan operating time larutan DPPH
Lama waktu pengukuran metode DPPH bermacam-macam dan menurut
beberapa literatur yang direkomendasikan adalah selama 60 menit, tetapi dalam
beberapa penelitian waktu yang digunakan sangat bervariasi yaitu dari 1 menit
hingga 240 menit (Rosidah, dkk., 2008; Molyneux, 2004; Marinova dan
Batchvarov, 2011).
3.8.5 Pembuatan larutan uji
Konsentrasi larutan uji ditetapkan setelah dilakukan beberapa kali uji
orientasi pada sampel. Larutan induk dipipet sebanyak 0,2 ml; 0,4 ml; 0,6 ml; 0,8
ml ke dalam masing-masing labu tentukur 10 ml untuk mendapatkan konsentrasi
larutan uji 20 ppm, 40 ppm, 60 ppm, 80 ppm, kemudian ditambahkan 2 ml larutan
DPPH 0,5 mM (konsentrasi 200 = ppm) lalu volumenya dicukupkan dengan
metanol sampai garis tanda, diamkan larutan di tempat gelap selama 60 menit,
lalu diukur serapannya menggunakan spektrofotometer uv-visibel pada panjang
gelombang 516 nm.
3.8.6 Analisis persen pemerangkapan DPPH oleh sampel uji
Penentuan persen pemerangkapan radikal bebas terhadap sampel uji
dihitung dengan rumus sebagai berikut:
Aktivitas pemerangkapan radikal bebas (%) = x 100% kontrol
3.8.7 Analisis nilai IC50
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan
radikal bebas adalah nilai IC50 (Inhibitory Concentration), nilai tersebut
menggambarkan besarnya konsentrasi senyawa uji yang dapat memerangkap
radikal bebas sebesar 50% (Molyneux, 2004). Hasil perhitungan dimasukkan ke
dalam persamaan regresi dengan konsentrasi sampel (µg/ml) sebagai absis (sumbu
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi-LIPI Bogor dan di Herbarium Medanense
Universitas Sumatera Utara-Medan menunjukkan bahwa sampel yang digunakan
dalam penelitian ini adalah tumbuhan kelakai (Stenochlaena palustris (Burm.f.)
Bedd.), dapat dilihat pada Lampiran 1, halaman 48.
4.2Hasil Karakterisasi Simplisia
4.2.1 Hasil pemeriksaan makroskopik
Hasil pemeriksaan makroskopik herba kelakai yaitu memiliki batang yang
panjang 10 – 30 cm, beruas, bewarna hijau dan memiliki daun berwarna merah
atau keunguan dengan lebar daun 1,5 – 4 cm dengan permukaan yang licin
mengkilap, bentuk memanjang, sisi-sisinya bergerigi serta memiliki rasa dan bau
yang khas. Gambar dapat dilihat pada Lampiran 3, halaman 51.
Hasil pemeriksaan makroskopik simplisia herba kelakai yang diperoleh
yaitu berwarna coklat kehitaman, daun berbentuk mengkerut dan agak bergulung,
batang keras serta memiliki bau yang khas. Gambar simplisia herba kelakai dapat
dilihat pada Lampiran 3, halaman 52.
4.2.2 Hasil pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik pada serbuk simplisia diperoleh adanya