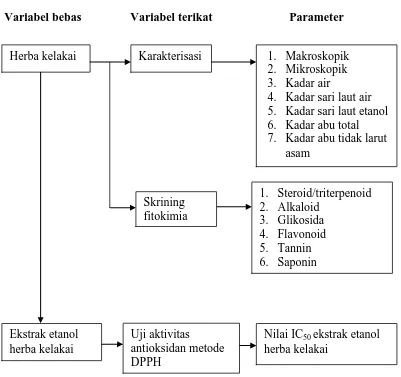
Lampiran 2. Bagan kerjapenelitian
Serbuk simplisia Herba kelakai
Simplisia
Dicuci, ditiriskan, dipotong menjadi bagian kecil dan ditimbang sebagai berat basah
Karakterisasi simplisia Skrining Fitokimia Ekstraksi
Lampiran 3.Gambar tumbuhandan simplisiaherba kelakai
Lampiran 3.(lanjutan)
Simplisia herba kelakai
Lampiran 4.Gambar mikroskopik serbuk simplisia herbakelakai
Keterangan:
1. Rambut penutup
2. Stoma tipe parasitik
3. Berkas pengangkut penebalan
bentuk spiral
4. Serabut sklerenkim
1
2
3
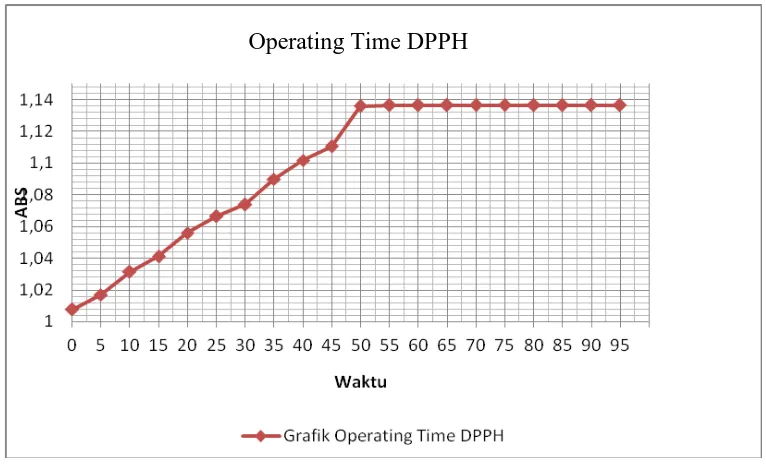
Lampiran 6.Data hasil penentuan operating timelarutan DPPH
No ABS K*ABS
1 1.0076 1.0076
2 1.0168 1.0168
3 1.0314 1.0314
4 1.0411 1.0411
5 1.0560 1.0560
6 1.0664 1.0664
7 1.0739 1.0739
8 1.0898 1.0898
9 1.1018 1.1018
10 1.1359 1.1359
11 1.1366 1.1366
12 1.1366 1.1366
13 1.1366 1.1366
14 1.1366 1.1366
15 1.1366 1.1366
16 1.1366 1.1366
17 1.1366 1.1366
18 1.1366 1.1366
19 1.1366 1.1366
Lampiran 7.Perhitungan pemeriksaan karakteristik serbuk simplisia herba
kelakai
1. Perhitungan kadar air serbuk simplisia herba kelakai
% Kadar air simplisia =
x
100%
(g)
2.Perhitungan kadar sari larut dalam air
% Kadar sari larut dalam air = 100%
Lampiran 7. (Lanjutan)
3.Perhitungan kadar sari simplisia larut dalam etanol
% Kadar sari larut dalam etanol = x 100%
4. Perhitungan kadar abu total simplisia
Lampiran 7. (Lanjutan)
% Rata-rata kadar abu total = = 5,56%
5. Perhitungan kadar abu simplisia tidak larut dalam asam
% Kadar abu tidak larut dalam asam = x 100%
(g) simplisia Berat
(g) abu Berat
No. Berat sampel (g) Berat abu (g)
1. 2,008 0,019
2. 2,010 0,021
3. 2,011 0,027
1. Kadar abu tidak larut dalam asam = = 0,94%
2. Kadar abu tidak larut dalam asam = = 1,23%
3. Kadar abu tidak larut dalam asam = = 1,34%
Lampiran 8. Hasil analisis persen pemerangkapan DPPH oleh sampel uji
Tabel data absorbansi ekstrak etanol herba kelakai Konsentrasi
Aktivitas pemerangkapan (%) = x 100% kontrol
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Lampiran 9. Hasil analisis nilai IC50
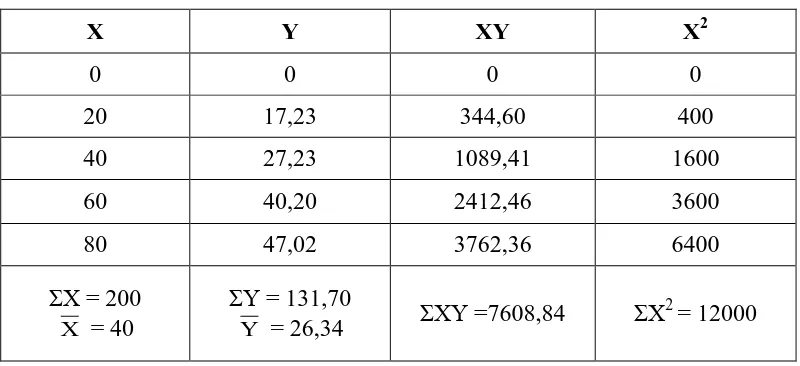
Tabel perhitungan nilai IC50 dari ekstrak etanol herba kelakai
X Y XY X2
Keterangan: X = Konsentrasi (ppm)
Y = % Pemerangkapan
Jadi, persamaan garis regresi Y = 0,5851 X + 2,9365
Nilai IC50 = Y = 0,5851 X + 2,9365
50 = 0,5851 X + 2,9365
X = 80,43 ppm
DAFTAR PUSTAKA
Anonima. (2012). Stenochlaena palustris (Burm. f.) Bedd-The Plant List. http://www.theplantlist.org/tpl/record/tro-26610182. Tanggal akses 09 Maret 2015.
Anonimb. (2013). Lemidi. http://id.wikipedia.org/wiki/Lemidi. Tanggal akses 09 Maret 2015.
BPOM RI. (2005). Penyiapan Simplisia Untuk Sediaan Herbal. Jakarta: Badan Pengawas Obat dan Makanan Republik Indonesia. Halaman 1.
Ceri, Bunia., Lovadi, Irwan., dan Linda Riza. (2014). Keanekaragaman Jenis Paku-Pakuan (Pteridophyta) di Mangrove Muara Sungai Peniti Kecamatan Segedong Kabupaten Pontianak. Jurnal Protobiont. 3(2): 240 – 246.
Day, R.A., dan Underwood, A.L. (1968). Analisis Kimia Kualitatif. Edisi Ke Enam. Penerjemah Iis Sopyan. Jakarta: Penerbit Erlangga. Halaman 382.
De la Rosa, L., Emilio, A., dan Gustavo, A. (2010). Fruit and Vegetable
Phytochemicals: Chemistry, Nutitional Value and Stability. New York:
Wiley-Blackwell Publishing. Halaman 271 – 292.
Departemen Kesehatan RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Halaman 297-326, 333 – 340.
Ditjen POM. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Halaman 9, 33.
Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Halaman 10-11.
Ewing, G.W. (1975). Instrumental Methods of Chemical Analysis. Edisi Empat. Tokyo: McGraw-Hill Kogakusha. Halaman 34 – 40.
Farnsworth, N. R. (1966). Biological and Phytochemical Screening of Plants.
Journal of Pharmaceutical Sciences. 55(3): 263 - 264.
Fessenden, R.J. dan J.S. Fessenden. (1986). Kimia Organik. Diterjemahkan oleh A.H. Pudjaaymaka. Jakarta: Penerbit Erlangga. Halaman 223 - 226.
Harborne, J.B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisa
Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Soediro.
Terbitan Kedua. Bandung: Penerbit ITB. Halaman 76, 78, 147-148, 234. Hartini, S. (2011). Tumbuhan Paku di Beberapa Kawasan Hutan di Taman
Nasional Kepulauan Togean dan Upaya Konservasinya di Kebun Raya Bogor. Berk, Penelitian Hayati Edisi Khusus. 7A: 35 – 40.
Hattenschwiller, S., dan Vitousek, P.M. (2000). The Role of Polyphenols in Terestrial Ecosystem Nutrient Cycling. Riview of Polyphenols
PII:S0169-5347(00)01861-9 TREE. 15(6): 144.
Horvath, P. J. (1981). The Nutrional and Eculogical Significance of Acer Tanins
and Related Polyphenols. Thesis. New York: Cornell University.
Ionita, P. (2005). Is DPPH Stable Free Radikal a Good Scavenger for Oxygen Active Spesies. Journal of Chemical Paper. 59(1): 11 – 16.
Kosasih, E.N., Tony, S., dan Hendro, H. (2004). Peran Antioksidan Pada Lanjut
Usia. Jakarta: Pusat kajian Nasional Masalah Lanjut Usia. Halaman 56 –
57.
Kumalaningsih, S. (2006). Antioksidan Alami. Surabaya: Trubus Agrisarana. Halaman 3, 39,53.
MacKinnon. (2000). Ekologi Kalimantan Edisi III. Jakarta. Halaman 35 – 40.
Maharani, D.M., Haidah, S.N., dan Haiyinah. (2005). Studi Potensi Kelakai (Stenochlaena palustris (Burm.f.) Bedd) Sebagai Pangan Fungsional. Jurusan Budidaya Pertanian Universitas Lambung Mangkurat. Banjarbaru: Program Kreativitas Mahasiswa Penelitian. 13(1): 1 – 13.
Marinova, G. dan Batchvarov, V. (2011). Evaluation of the Methods for Determination of the Free Radical Scavenging Activity by DPPH. Bulg.
J. Agric. Sci. 17: 13 – 14.
Marx, J. L. (1985). “Oxygen Free Radicals Linked to Many Disease”. Dalam:
Science . Halaman 235, 529 – 531.
Molyneux, P. (2004). The Use of the Stable Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin J. Sci.
Technol. 26(2): 211 – 219.
Muchtadi, D. (2013). Antioksidan dan Kiat Sehat di Usia Produktif. Bandung: Alfabeta. Halaman 1
Prakash, A. (2001). Antioxidant Activity. Medallion Laboratories-Analytical
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Penerjemah: Kosasih Padmawinata. Edisi Ke-enam. Bandung: Penerbit ITB. Halaman 71, 191 – 192, 195 – 197, 203.
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Halaman 222.
Roizen, M.F., dan Mehmet, C.O. (2009). Staying Young: Jurus Menyiasati Kerja
Gen Agar Muda Sepanjang Hidup. Bandung: Qanita. Halaman 84.
Rosidah, Yam, M.F., Sadikun, A., dan Asmawi, M.Z. (2008). Antioxidant Potential of Gynura procumbens. Pharmaceutical Biology. 46(9): 616 – 625.
Sastrohamidjojo, H. (1985). Kromatografi. Edisi I. Yogyakarta. Penerbit Liberty. Hal. 1-5, 13-25
Silalahi, J. (2006). Makanan Fungsional. Yogyakarta: Penerbit Kanisius. Halaman 40, 47 – 48.
Suhartono, E., Viani E., Ramadhan M.A., Gultom S.I., Rakhman M.F., dan Indrawardhana D. (2012). Screening of Medical Plant for Total Flavonoid and Antioxidant Activity in South Kalimantan of Indonesian.
International Journal of Chemical Engineering and Applications. 4(3):
297 – 299.
Stennis, CGGJ. (2003). Flora. Jakarta: PT. Pradnya Paramita. Halaman 53.
Trease, G.E. dan Evans, W.C. (1983). Pharmacognosy. Edisi Keduabelas. London: Bailliere Tindal. Halaman 132.
Trilaksani, W. (2003). Antioksidan: Jenis, Sumber, Mekanisme Kerja dan Peran
Terhadap Kesehatan. Bogor: Institut Pertanian Bogor. Halaman 1 – 12. Tyler, V.E. (1988). Pharmacognosy. Ninth Edition. Lea and Febiger.
Philadelphia. Pages. 57 – 59, 67, 77 – 78, 186 – 187 .
Westerndarp, H. (2006). Effect of Tanins in Animal Nutrition. Dutsch: Tieraztl Wochenschr. 113 (2): 264-266.
Winarsi, H. (2007). Antioksidan Alami dan Radikal. Yogyakarta: Penerbit Kanisius. Halaman 12, 128, 274, 275.
World Health Organization.(1992). Quality Control Methods for Medicinal Plant
Materials.WHO/PHARM/ 92.559. Switzerland: Geneva. Halaman 25-28.
World Health Organization. (2011). Quality Control Methods For Herbal
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental. Metodologi
penelitian meliputi pengumpulan dan pengolahan bahan tumbuhan, identifikasi
bahan tumbuhan, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak
etanol serta uji aktivitas antioksidan dengan metode DPPH
(1,1-diphenyl-2-picrylhydrazyl sebagai sumber radikal bebas dan absorbansi DPPH diukur
menggunakan alat spektrofotometer visibel pada panjang gelombang 516 nm.
3.1 Alat
Alat-alat yang digunakan terdiri dari alat-alat gelas laboratorium
(corong, corong pisah, erlenmeyer, gelas arloji, gelas beaker, gelas ukur, labu
bersumbat, labu tentukur, matt pipet, tabung reaksi, pipet tetes), aluminium foil,
blender (National), cawan berdasar rata, desikator, kaca objek, kaca penutup,
kertas saring, krus porselin, lemari pengering, mikroskop (Olympus), neraca
analitis (Vibra), neraca kasar (O’haus), oven listrik (Stork), penangas air
(Yenaco), rotary evaporator (Stuart), spektofotometer UV/Vis (Shimadzu) dan
tanur (Gallenkamp).
3.2 Bahan
Bahan yang digunakan adalah herba dari tumbuhan kelakai. Bahan-bahan
kimia berkualitas pro analisis poduksi Sigma: 1,1-diphenyl-2-picrylhydrazyl
pekat, asam nitrat pekat, asam sulfat pekat, benzen, besi (III) klorida, bismuth (III)
nitrat, isopropanol, kloroform, metanol, n-heksan, raksa (II) klorida, serbuk
magnesium (Mg), timbal (II) asetat, kloralhidrat, toluen, kalium iodida, α-naftol.
Bahan kimia berkualitas teknis: etanol 70% dan air suling.
3.3 Penyiapan Bahan Tumbuhan 3.3.1 Pengumpulan bahan tumbuhan
Pengumpulan bahan tumbuhan dilakukan secara purposive yaitu tanpa
membandingkan dengan bahan tumbuhan yang sama dari daerah lain. Bahan
tumbuhan yang digunakan adalah herba dari tumbuhan kelakai (Stenochlaena
palustris (Burm.f.) Bedd.), diambil dari Jl.G.Obos, Kecamatan Jekan Raya Kota
Palangkaraya, Provinsi Kalimantan Tengah.
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Laboratorium Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi-LIPI Bogor dan di Herbarium Medanense
Universitas Sumatera Utara-Medan.
3.3.3 Pengolahan bahan tumbuhan
Bahan yang digunakan adalah herba dari tumbuhan kelakai yang masih
muda. Herba kelakai yang telah terkumpul dibersihkan dari kotoran, dicuci,
ditiriskan kemudian ditimbang sebagai berat basah.
Herba kelakai selanjutnya dikeringkan dalam lemari pengering pada
temperatur ± 40°C sampai kering (ditandai bila diremas rapuh), kemudian
ditimbang sebagai berat kering. Simplisia yang telah kering diblender menjadi
dan pengotoran lain. Bagan kerja penelitian dapat dilihat pada lampiran 2,
halaman 50.
3.4Pembuatan Pereaksi
3.4.1 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air
secukupnya hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.2 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air suling bebas karbon dioksida sebanyak 100 ml (Depkes RI, 1995).
3.4.3 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga
diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.4 Pereaksi asam sulfat 2 N
Sebanyak 5,5 ml larutan asam sulfat pekat ditambahkan air suling sampai
100 ml (Depkes RI, 1995).
3.4.5 Pereaksi kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml
air suling (Depkes RI, 1995).
3.4.6 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml
pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10
ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga
3.4.7 Pereaksi Molisch
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Depkes RI,1995).
3.4.8 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) nitrat ditimbang, dilarutkan dalam 20 ml asam
nitrat pekat, lalu ditimbang sebanyak 27,2 g kalium iodide dalam 50 ml air suling.
Kedua larutan dicampurkan dan didiamkan sampai memisah sempurna, larutan
jernih diencerkan dalam air suling hingga volume 100 ml (Depkes RI, 1995).
3.4.9 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling
secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling
hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.10 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50
bagian volume etanol 95% ditambahkan dengan hati-hati 5 bagian volume asam
asetat anhidrida ke dalam campuran tersebut dan dinginkan (Depkes RI, 1995).
3.5 Karakterisasi Simplisia 3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari
herba kelakai segar dan simplisia herba kelakai.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia herba
larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati di bawah
mikroskop.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Alat terdiri dari labu alas bulat 500 ml, pendingin, tabung penyambung, tabung
penerima 5 ml berskala 0,05 ml, alat penampung dan pemanas listrik.
a. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan kedalam labu alas
bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume
air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Sebanyak 5 gram serbuk simplisia yang telah ditimbang seksama
dimasukkan ke dalam labu yang berisi toluen yang telah dijenuhkan, kemudian
labu dipanaskan selama 15 menit, setelah toluen mendidih, kecepatan tetesan
diatur 2 tetes/detik sampai sebagian besar air terdestilasi, kemudian kecepatan
destilasi dinaikkan sampai 4 tetes/detik, setelah semua air terdestilasi, bagian
dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit,
kemudian tabung penerima dibiarkan mendingin pada suhu kamar, setelah air dan
toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Kadar air
dihitung dalam persen (WHO, 1992).
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dengan
didalam labu bersumbat, dikocok sesekali selama 6 jam pertama, kemudian
dibiarkan selama 18 jam, kemudian disaring. Sejumlah 20 ml filtrat diuapkan
sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan
dan ditara. Sisa dipanaskan pada suhu 105º C sampai bobot tetap. Kadar dalam
persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan
(Depkes RI, 1995).
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 gram serbuk simplisia dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama,
kemudian dibiarkan selama 18 jam, kemudian disaring cepat untuk menghindari
penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan
penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan
pada suhu 105 ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam
etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.6 Penetapan kadar abu total
Sebanyak 2 gram serbuk ditimbang seksama dimasukkan dalam krus
porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar
perlahan-lahan sampai arang habis, pijaran dilakukan pada suhu 600 ºC selama 3 jam
kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu
dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5.7 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25
ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
lalu dipijar sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu
yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan
(Depkes RI, 1995).
3.6 Skrining Fitokimia
3.6.1 Pemeriksaan steroida/triterpenoida
Serbuk simplisia ditimbang sebanyak 1 g serbuk simplisia dimaserasi
dengan 20 ml n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan
penguap. Pada sisa ditambahkan beberapa tetes pereaksi Liebermann-Burchard.
Timbulnya warna biru atau biru hijau menunjukkan adanya steroida, sedangkan
warna merah, merah muda atau ungu meunjukkan adanya triterpenoida (Harborne,
1987).
3.6.2 Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g, ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit,
kemudian didinginkan dan disaring, filtrat lalu dipakai untuk uji alkaloida.
Diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan
0,5 ml filtrat.
Pada tabung I : ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan
menggumpal berwarna putih atau kuning.
Pada tabung II : ditambahkan 2 tetes pereaksi Dragendorff, akan terbentuk
endapan berwarna coklat atau jingga kecoklatan.
Pada tabung III : ditambahkan 2 tetes pereaksi Bourchardat, akan terbentuk
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau
tiga dari percobaan di atas (Depkes RI, 1995).
3.6.3 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml
campuran 7 bagian volume etanol 96% dan 3 bagian volum air suling ditambah
dengan 10 ml asam klorida 2 N. Direfluks selama 30 menit, didinginkan dan
disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan 25 ml timbal (II)
asetat 0,4 M lalu dikocok selama 5 menit dan disaring. Filtrat disari dengan 20 ml
campuran 3 bagian kloroform dan 2 isopropanol dilakukan berulang sebanyak tiga
kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC. Sisanya
dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut,
yaitu 0,1 ml larutan percobaan dimasukkan ke dalam tabung reaksi, diuapkan di
penangas air. Sisa dilarutkan dalam 2 ml air suling dan 5 tetes pereaksi Molish
kemudian secara perlahan ditambahkan 2 ml asam sulfat pekat. Glikosida positif
jika terbentuk cincin ungu (Depkes, 1995).
3.6.4 Pemeriksaan flavonoid
Serbuk simplisia ditimbang sebanyak 10 g, ditambahkan 10 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml
filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml
amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna
merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.5 Pemeriksaan tanin
Serbuk simplisia ditimbang sebanyak 0,5 g, disari dengan 10 ml air suling
diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%.
Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin
(Farnsworth, 1966).
3.6.6 Pemeriksaan saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam
tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok
kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1 sampai 10 cm yang
stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes
asam klorida 2 N menunjukkan adanya saponin (Depkes RI, 1995).
3.7Pembuatan Ekstrak
Pembuatan ekstrak etanol herba kelakai dilakukan dengan cara perkolasi.
Prosedur pembuatan ekstrak sebanyak 230 g serbuk simplisia dibasahi dengan
etanol 70% dan dibiarkan selama 3 jam., Kemudian dimasukkan ke dalam alat
perkolator, lalu dituang cairan penyari etanol sampai semua simplisia terendam
dan terdapat selapis cairan penyari diatasnya, mulut tabung perkolator ditutup
dengan alumunium foil dan dibiarkan selama 24 jam, kemudian kran dibuka dan
dibiarkan tetesan ekstrak mengalir dengan kecepatan 1 ml/menit, perkolat
ditampung.
Cairan penyari ditambahkan berulang-ulang secukupnya sehingga selalu
terdapat cairan penyari di atas simplisia. Perkolasi dihentikan jika cairan perkolat
terakhir yang keluar tidak berwarna lagi. Biarkan dalam bejana tertutup 2 hari
ditempat sejuk dan terlindung dari cahaya. Saring lalu dipekatkan dengan alat
3.8Pengujian Aktivitas Antioksidan
3.8.1 Prinsip metode pemerangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi radikal bebas
DPPH (1,1 diphenyl-2-picryl-hidrazyl) dalam larutan metanol (sehingga terjadi
perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50 (konsentrasi
sampel uji yang mampu meredam radikal bebas 50%) digunakan sebagai
parameter menentukan aktivitas antioksidan sampel uji (Molyneux, 2004).
3.8.2 Pembuatan larutan
a. Larutan blanko DPPH
Sebanyak 10 mg DPPH ditimbang, kemudian dimasukkan ke dalam labu
tentukur 50 ml, dicukupkan volumenya dengan pelarut metanol sampai garis
tanda, maka diperoleh larutan DPPH 0,5 mM (konsentrasi = 200 ppm).
Dipipet larutan DPPH 0,5 mM (konsentrasi = 200 ppm) sebanyak 5 ml
dimasukkan ke dalam labu tentukur 25 ml, dicukupkan volumenya dengan
metanol sampai garis tanda, maka diperoleh larutan blanko DPPH (konsentrasi =
40 ppm).
b. Larutan sampel induk (ekstrak etanol herba kelakai)
Sebanyak 25 mg sampel ditimbang, kemudian dilarutkan dalam labu
tentukur 25 ml dengan methanol, lalu volumenya dicukupkan dengan metanol
sampai garis tanda, maka diperoleh larutan induk baku sampel (konsentrasi =
1000 ppm).
3.8.3 Penentuan panjang gelombang serapan maksimum
Larutan DPPH dengan konsentrasi 40 ppm dihomogenkan dengan pelarut
seperangkat alat spektrofotometer uv-visibel (UVmini-1240 Shimadzu) dapat
dilihat pada Lampiran 5, halaman 34.
3.8.4 Penentuan operating time larutan DPPH
Lama waktu pengukuran metode DPPH bermacam-macam dan menurut
beberapa literatur yang direkomendasikan adalah selama 60 menit, tetapi dalam
beberapa penelitian waktu yang digunakan sangat bervariasi yaitu dari 1 menit
hingga 240 menit (Rosidah, dkk., 2008; Molyneux, 2004; Marinova dan
Batchvarov, 2011).
3.8.5 Pembuatan larutan uji
Konsentrasi larutan uji ditetapkan setelah dilakukan beberapa kali uji
orientasi pada sampel. Larutan induk dipipet sebanyak 0,2 ml; 0,4 ml; 0,6 ml; 0,8
ml ke dalam masing-masing labu tentukur 10 ml untuk mendapatkan konsentrasi
larutan uji 20 ppm, 40 ppm, 60 ppm, 80 ppm, kemudian ditambahkan 2 ml larutan
DPPH 0,5 mM (konsentrasi 200 = ppm) lalu volumenya dicukupkan dengan
metanol sampai garis tanda, diamkan larutan di tempat gelap selama 60 menit,
lalu diukur serapannya menggunakan spektrofotometer uv-visibel pada panjang
gelombang 516 nm.
3.8.6 Analisis persen pemerangkapan DPPH oleh sampel uji
Penentuan persen pemerangkapan radikal bebas terhadap sampel uji
dihitung dengan rumus sebagai berikut:
Aktivitas pemerangkapan radikal bebas (%) = x 100% kontrol
Akontrol = Absorbansi tidak mengandung sampel
3.8.7 Analisis nilai IC50
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan
radikal bebas adalah nilai IC50 (Inhibitory Concentration), nilai tersebut
menggambarkan besarnya konsentrasi senyawa uji yang dapat memerangkap
radikal bebas sebesar 50% (Molyneux, 2004). Hasil perhitungan dimasukkan ke
dalam persamaan regresi dengan konsentrasi sampel (µg/ml) sebagai absis (sumbu
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense,
Bidang Botani Pusat Penelitian Biologi-LIPI Bogor dan di Herbarium Medanense
Universitas Sumatera Utara-Medan menunjukkan bahwa sampel yang digunakan
dalam penelitian ini adalah tumbuhan kelakai (Stenochlaena palustris (Burm.f.)
Bedd.), dapat dilihat pada Lampiran 1, halaman 48.
4.2 Hasil Karakterisasi Simplisia 4.2.1 Hasil pemeriksaan makroskopik
Hasil pemeriksaan makroskopik herba kelakai yaitu memiliki batang yang
panjang 10 – 30 cm, beruas, bewarna hijau dan memiliki daun berwarna merah
atau keunguan dengan lebar daun 1,5 – 4 cm dengan permukaan yang licin
mengkilap, bentuk memanjang, sisi-sisinya bergerigi serta memiliki rasa dan bau
yang khas. Gambar dapat dilihat pada Lampiran 3, halaman 51.
Hasil pemeriksaan makroskopik simplisia herba kelakai yang diperoleh
yaitu berwarna coklat kehitaman, daun berbentuk mengkerut dan agak bergulung,
batang keras serta memiliki bau yang khas. Gambar simplisia herba kelakai dapat
dilihat pada Lampiran 3, halaman 52.
4.2.2 Hasil pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik pada serbuk simplisia diperoleh adanya
dan serabut sklerenkim. Gambar hasil mikroskopik serbuk simplisia dapat dilihat
pada Lampiran 4, halaman 53.
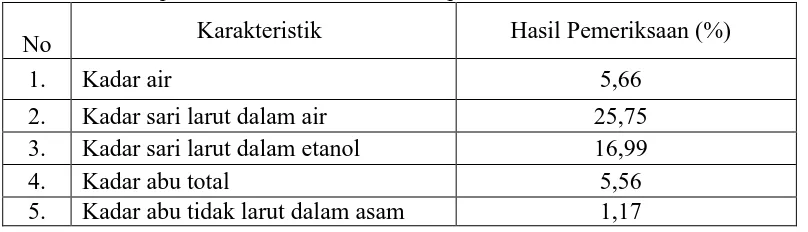
4.2.3 Hasil pemeriksaan karakteristik
Hasil pemeriksaan karakteristik simplisia dapat diliat pada Tabel 4.1 dan
perhitungan dapat dilihat pada Lampiran 7, halaman 56 – 58. Monografi simplisia
dari kelakai tidak terdapat dalam buku Materia Medika Indonesia (MMI),
sehingga tidak ada acuan untuk menentukan parameter simplisia tersebut.
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia herba kelakai
No Karakteristik Hasil Pemeriksaan (%)
1. Kadar air 5,66
2. Kadar sari larut dalam air 25,75
3. Kadar sari larut dalam etanol 16,99
4. Kadar abu total 5,56
5. Kadar abu tidak larut dalam asam 1,17
Kadar air simplisia menunjukkan jumlah air yang terkandung dalam
simplisia, dari tabel 4.1 menunjukkan kadar air simplisia herba kelakai sebesar
5,56% dan memenuhi persyaratan umum yaitu di bawah 10%. Pengeringan
simplisia dilakukan untuk mendaptkan simplisia yang tidak kudah rusak oleh
mikroba seperti jamur. Kadar air yang melebihi persyaratan memungkinkan
terjadinya pertumbuhan jamur (BPOM RI, 2005); Trease dan Evans, 1983).
Penetapan kadar sari dilakukan terhadap dua pengujian yaitu kadar sari
larut dalam air dan kadar sari larut dalam etanol. Penetapan kadar sari larut air dan
etanol untuk mengetahui jumlah senyawa yang dapat tersari dalam air dan etanol
dari simplisia.
Senyawa yang bersifat polar atau larut dalam air pada simplisia herba
yang tidak larut dalam air atau larut dalam etanol akan tersari oleh etanol dengan
hasil 16,99%.
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral
internal yang terdapat di dalam simplisia serta senyawa organik setelah
pembakaran. Abu total terbagi dua, yang pertama abu fisiologis adalah abu yang
berasal dari jaringan tumbuhan itu sendiri dan abu non fisiologis adalah sisa yang
berasal dari benda asing yang terdapat pada permukaan simplisia. Kadar abu tidak
larut asam untuk menentukan jumlah silika, khususnya pasir yang ada pada
simplisia dengan cara melarutkan abu total dalam asam klorida (WHO, 2011).
4.3 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap serbuk simplisia, diketahui bahwa herba
kelakai mengandung golongan senyawa-senyawa kimia seperti yang terlihat pada
tabel berikut ini:
Tabel 4.2 Hasil skrining fitokimia simplisia herba kelakai
No. Pemeriksaan Hasil
1. Steroid +
Keterangan: (+) Positif : mengandung golongan senyawa () Negatif : tidak mengandung golongan senyawa
Berdasarkan hasil pemeriksaan skrining fitokimia menunjukkan bahwa
serbuk simplisia herba kelakai mengandung golongan senyawa kimia yaitu
steroid, alkaloid, glikosida, flavonoid dan tanin. Hasil diatas menunjukkan bahwa
senyawa-senyawa yang mempunyai potensi sebagai antioksidan umumnya
merupakan senyawa flavonoida (Kumalaningsih, 2006).
Bagian dari senyawa flavonoid yang mempunyai potensi antioksidan
tersebut ialah antosianin yang merupakan pigmen berwarna kuat yang
memberikan warna merah marak, merah, merah senduduk, ungu pada daun
kelakai yang masih muda (Harbone, 1987). Antosianin bertindak sebagai
penangkap radikal bebas karena gugus hidroksil yang dikandungnya
mendonorkan hidrogen kepada radikal bebas. Senyawa tersebut mampu
menetralisir radikal bebas dengan memberikan elektron kepadanya sehingga atom
dengan elektron yang tidak berpasangan mendapat pasangan elektron dan tidak
lagi menjadi radikal (Silalahi, 2006).
4.4 Hasil Pengujian Aktivitas Antioksidan
Aktivitas antioksidan ekstrak etanol herba kelakai diperoleh dari hasil
pengukuran absorbansi DPPH (1,1-diphenyl-2-picrylhidrazyl) dengan adanya
penambahan larutan uji.
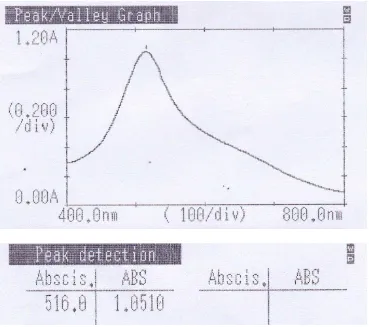
4.4.1 Hasil penentuan panjang gelombang serapan maksimum
Pengukuran serapan maksimum larutan DPPH 40 ppm dalam metanol
dengan menggunakan spektrofotometer UV-Visibel. Hasil pengukuran
menunjukkan bahwa larutan DPPH dalam metanol menghasilkan serapan
maksimum pada panjang gelombang 516 nm. Panjang gelombang 516 nm,
termasuk dalam kisaran panjang gelombang sinar tampak (400-750 nm) (Rohman,
2007). Data hasil pengukuran panjang gelombang maksimum dapat dilihat pada
Gambar 4.1 Kurva serapan maksimum larutan DPPH 40 ppm dalam methanol menggunakan spektrofotometer UV-Visibel
4.4.2 Hasil penentuan operating time larutan DPPH
Penentuan operating time bertujuan untuk mengetahui waktu pengukuran
yang stabil. Waktu operasional ditentukan dengan mengukur hubungan antara
waktu pengukuran dengan absorbansi larutan. Penentun operating time larutan
DPPH 40 ppm dalam metanol dilakukan dengan waktu preparasi selama 5 menit
dan diperoleh waktu kerja pada menit ke-55 sampai menit ke-100. Hasil
penentuan operating time diperoleh waktu kerja terbaik adalah pada menit ke 60
setelah penambahan pelarut metanol. Data absorbansi dapat dilihat pada Lampiran
6, halaman 55 dan Kurva serapan untuk operating time larutan DPPH dalam
Gambar 4.2 Kurva absorbansi operating time larutan DPPH
4.4.3 Hasil analisis persen pemerangkapan DPPH oleh sampel uji
Aktivitas antioksidan ekstrak etanol herba kelakai diperoleh dari hasil
pengukuran absorbansi DPPH pada menit ke-60 dengan adanya penambahan
larutan uji dengan konsentrasi 20 ppm, 40 ppm, 60 ppm dan 80 ppm yang
dibandingkan dengan kontrol DPPH (tanpa penambahan larutan uji). Pada hasil
analisis aktivitas antioksidan dapat dilihat adanya penurunan nilai absorbansi
DPPH yang diberi larutan uji ekstrak etanol herba kelakai.
Penurunan nilai absorbansi ini terjadi dikarenakan larutan uji
memerangkap DPPH dan pemerangkapan terjadi karena adanya transfer elektron
atom hidrogen antioksidan kepada DPPH. Interaksi ini akan menetralkan radikal
bebas DPPH. Semua elektron pada radikal bebas DPPH menjadi berpasangan
ditandai dengan terjadinya warna larutan yang berubah dari ungu tua menjadi
kuning terang dan absorbansi pada panjang gelombang maksimumnya akan hilang
Lampiran 8, halaman 59 – 60 dan nilai IC50 dapat dilihat pada Lampiran 9,
halaman 61.
Penurunan nilai absorbansi DPPH dan persen pemerangkapan dengan
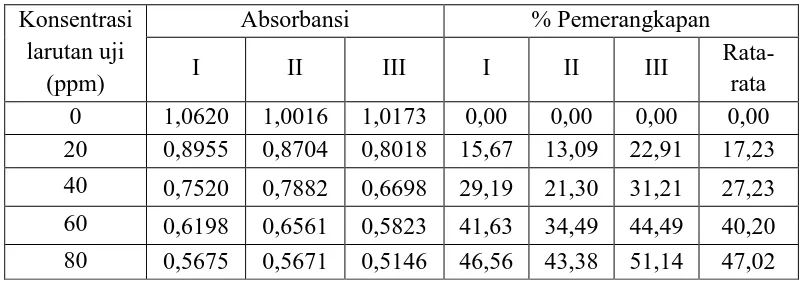
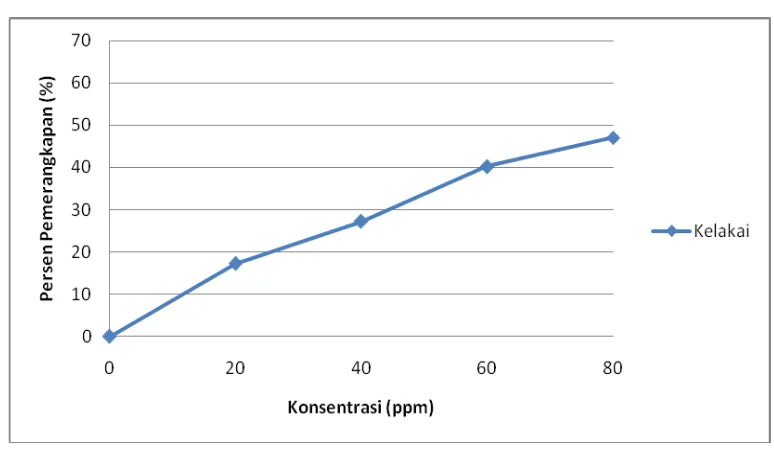
penambahan ekstrak etanol herba kelakai dapat dilihat pada tabel berikut ini:
Tabel 4.3 Penurunan absorbansi dan persen pemerangkapan DPPH oleh sampel
uji Konsentrasi
larutan uji (ppm)
Absorbansi % Pemerangkapan
I II III I II III Rata-rata
0 1,0620 1,0016 1,0173 0,00 0,00 0,00 0,00 20 0,8955 0,8704 0,8018 15,67 13,09 22,91 17,23
40 0,7520 0,7882 0,6698 29,19 21,30 31,21 27,23
60 0,6198 0,6561 0,5823 41,63 34,49 44,49 40,20
80 0,5675 0,5671 0,5146 46,56 43,38 51,14 47,02
Pada tabel 4.3 diatas dapat dilihat bahwa ekstrak etanol herba kelakai
menunjukkan nilai penurunan absorbansi DPPH. Penurunan nilai absorbansi
menunjukkan aktivitas antioksidan yang semakin besar.
Hubungan antara konsentrasi larutan uji dan persen pemerangkapan radikal
bebas DPPH oleh ekstrak etanol herba kelakai dapat dilihat pada Gambar 4.3
4.4.4 Hasil analisis nilai IC50
Nilai IC50 diperoleh berdasarkan perhitungan persamaan regresi linier yang
diperoleh dengan cara memplot konsentrasi larutan uji dan persen pemerangkapan
DPPH sebagai parameter aktivitas antioksidan, dimana konsentrasi sampel (ppm)
sebagai absis (sumbu X) dan nilai % pemerangkapan sebagai koordinat (sumbu
Y). Nilai IC50 (konsentrasi sampel uji yang mampu memerangkap radikal bebas
sebesar 50%) digunakan sebagai parameter untuk menentukan aktivitas
antioksidan sampel uji (Prakash, 2001).
Hasil persamaan regresi linier yang diperoleh dari ekstrak etanol herba
kelakai adalah Y = 0,5815X + 2,93654 dan hasil analisis IC50 adalah 80,43 ppm.
Kemampuan sampel uji dalam meredam DPPH sebagai radial bebas dalam larutan
metanol dengan nilai IC50 (konsentrasi sampel uji yang mampu meredam radikal
bebas sebesar 50%) digunakan sebgai parameter untuk menentukan aktivitas
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan:
a. Hasil karakterisasi simplisia herba kelakai secara berturut-turut diperoleh kadar
air 5,66%, kadar sari larut air 25,75%, kadar sari larut etanol 16,99%, kadar
abu total 5,56% dan kadar abu tidak larut asam 1,17%.
b. Hasil skrining fitokimia simplisia herba kelakai menunjukkan adanya senyawa
kimia golongan steroid, alkaloid, glikosida, flavonoid dan tanin.
c. Nilai IC50 dari ekstrak etanol herba kelakai sebesar 80,43 ppm dan termasuk
dalam kategori antioksidan kuat.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan isolasi terhadap
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan Paku (Pteridophyta)
Tumbuhan paku merupakan suatu divisi yang warganya telah jelas
mempunyai kormus, artinya tubuhnya dengan nyata dapat dibedakan dalam tiga
bagian pokoknya, yaitu akar, batang dan daun. Namun demikian, pada tumbuhan
paku belum dihasilkan biji. Alat perkembang-biakan tumbuhan paku yang utama
adalah spora (Tjitrosoepomo, 1994).
Tumbuhan paku dapat dibedakan menjadi dua bagian utama yaitu organ
vegetatif yang terdiri dari akar, batang, rimpang, dan daun. Sedangkan organ
generatif terdiri atas spora, sporangium, anteridium, dan arkegonium. Sporangium
tumbuhan paku umumnya berada di bagian bawah daun serta membentuk gugusan
berwarna hitam atau coklat. Gugusan sporangium ini dikenal sebagai sorus. Letak
sorus terhadap tulang daun merupakan sifat yang sangat penting dalam klasifikasi
tumbuhan paku. Menurut Tjitrosoepomo (1994) divisi Pteridophyta dapat
dikelompokkan kedalam empat kelas yaitu Psilophytinae (paku purba),
Lycopodiinae (paku kawat), Equisetinae (paku ekor kuda) dan Filiciane (paku
sejati); dan menurut Steennis (1988), tumbuhan paku-pakuan dapat dibagi ke
dalam 11 famili yaitu Salviniceae, Marsileaceae, Equicetaceae, Selagillaceae,
Lycopodiaceae, Ophiglossaceae, Schizaeaceae, Gleicheniaceae, Cyatheaceae,
Ceratopteridaceae dan Polypodiaceae.
Tumbuhan paku-pakuan yang tergolong dalam kelas Filiciane (paku sejati)
paku sejati sebagian besar di darat pada daerah tropis dan subtropis. Paku sejati
diperkirakan berjumlah 12.000 jenis dari kelas Filicinae. Filicinae memiliki akar,
batang, dan daun sejati. Batang dapat berupa batang dalam (rizom) atau batang di
atas permukaan tanah. Daun Filicinae umumnya berukuran besar dan memiliki
tulang daun bercabang. Daun mudanya memiliki ciri khas yaitu tumbuh
menggulung (circinnatus) (Tjitrosoepomo, 1994).
2.2 Tumbuhan Kelakai 2.2.1 Morfologi tumbuhan
Tumbuhan kelakai merupakan jenis tumbuhan paku yang memiliki
panjang 5 – 10 m. Akar rimpang yang memenjat tinggi, kuat, pipih persegi.
Tangkai daun 10 – 20 cm, kuat. Daun menyirip tunggal 1,5 – 4 cm, mengkilap,
daun mudanya berwarna merah muda, merah kerap kali keungu-unguan,
bertekstur lembut dan tipis, semakin dewasa daunnya mengalami perubahan
warna menjadi kecoklatan dan pada akhirnya menjadi hijau tua dan keras. Daun
berbentuk lanset, ujungnya meruncing, tepinya bergerigi dan pangkalnya
membulat (Steenis, 2003).
2.2.2 Daerah tumbuh
Tumbuhan kelakai tumbuh hingga pada ketinggian 900 meter dibawah
permukaan laut dan merambat pada hutan-hutan bekas penebangan kayu terutama
dekat air tawar, air payau, hutan bakau, di tanah pasir, khususnya disepanjang tepi
sungai dan sumber air. Paku ini didapati di mana-mana seperti di dataran rendah,
di tempat terbuka, hutan sekunder dan umum ditemukan di wilayah rawa-rawa
2.2.3 Sistematika tumbuhan
Sistematika tumbuhan kelakai hasil identifikasi Herbarium Medanense
adalah sebagai berikut:
Kingdom : Plantae
Divisi : Pteridophyta
Kelas : Filicopsida
Ordo : Filicales
Suku : Blechnaceae
Genus : Stenochlaena
Spesies : Stenochlaena palustris (Burm. f.) Bedd.
Sinonim : Polypodium palustris Burm. f., Onoclea scandens Sw.,
Lomaria scandens (Sw) Willd (Anonimb, 2012)
Nama asing : Miding, melat, akar pakis (Malaysia) (Anonima, 2013).
Nama daerah : Kelakai atau kalakai (Kalimantan Tengah/Kalimantan Selatan),
Lemiding, miding (Pontianak), paku bang (Jawa), maja-majang,
wewesu, bampesu (Sulawesi), lemidi (Sumatera) (Anonima,
2013).
2.2.4 Khasiat dan manfaat
Bagi masyarakat Dayak Kalimantan Tengah kelakai merupakan makanan
favorit, kelakai dimasak dengan cara dioseng-oseng, sayur bening atau direbus
untuk lalapan. Berdasarkan studi empiris daun dan batang kelakai muda
dipergunakan oleh masyarakat suku Dayak sebagai suplemen penambah darah,
obat awet muda, penambah ASI pada ibu yang sedang menyusui, obat tekanan
2.2.5 Kandungan kimia 2.2.5.1 Steroida/triterpenoida
Steroid merupakan senyawa kimia yang memiliki kerangka dasar
siklopentanafenantren. Pada umumnya, gugus metil berada pada C10 dan C13.
Rantai samping alkil dapat juga berada pada C17. Sterol adalah steroid yang
memiliki gugus hidroksi pada C3.
Triterpenoid merupakan senyawa yang mempunyai kerangka karbonnya
berasal dari enam satuan isopren, dimana kerangka karbonnya dibangun oleh dua
atau lebih satuan C5 tersebut. Senyawa terpenoid terdapat bebas dalam jaringan
tanaman, tetapi banyak diantaranya yang terdapat sebagai alkohol, aldehid
(Harbone,1987), glikosida dan ester asam aromatik (Sastrohamidjojo, 1996).
Pembagian triterpenoid berdasarkan jumlah cincin yang terdapat pada struktur
molekulnya (Robinson, 1995), antara lain triterpenoid asiklik, triterpenoid
trisiklik, triterpenoid tetrasiklik dan triterpenoid pentasiklik.
2.2.5.2 Alkaloid
Alkaloid merupakan golongan zat/senyawa tumbuhan sekunder yang
terbesar. Umumnya alkaloid mencakup senyawa yang bersifat basa yang
mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan, sebagai
bagian dalam sistem siklik. Alkaoid sering kali beracun bagi manusia dan banyak
mempunyai kegiatan fisiologi yang menonjol, jadi digunakan luas dalam bidang
pengobatan (Harbone, 1987).
2.2.5.3 Glikosida
Glikosida merupakan senyawa yang mengandung komponen gula dan
gula dikenal sebagai aglikon. Dari segi biologi, glikosida memiliki peranan
penting di dalam kehidupan tumbuhan dan terlibat di dalam pertumbuhan dan
perlindungan tumbuhan tersebut. Beberapa glikosida mengandung lebih dari satu
jenis gula dalam bentuk disakarida atau trisakarida (Gunawan dan Mulyani,
2004).
Semua glikosida alam dapat terhidrolisis menjadi gula dan bukan gula
dengan cara mendidihkannya bersama asam mineral. Biasanya, glikosida juga
dapat terhidrolisis dengan mudah oleh enzim yang terdapat dalam jaringan
tumbuhan yang sama. Pengelompokan glikosida berdasarkan struktur bukan gula
terbagi atas : glikosida jantung, glikosida antrakinon, glikosida saponin, glikosida
sianogenik, glikosida isotiosianat, glikosida flavonol, glikosida alkohol, glikosida
alkohol, glikosida aldehida, glikosida lakton, glikosida fenol dan tanin (Tyler,
1988).
Menurut Farnsworth (1966), pembagian glikosida berdasarkan ikatan yang
menghubungkan bagian gula dan bukan gula adalah:
a. C-glikosida yaitu senyawa glikosida yang ikatan antara glikon dan aglikonnya
dihubungkan oleh atom C. Contoh: Barbaloin.
b. O-glikosida yaitu senyawa glikosida yang ikatan antara glikon dan aglikonnya
dihubungkan oleh atom O. Contoh: Salisin.
c. N-glikosida yaitu senyawa glikosida yang ikatan antara glikon dan aglikonnya
dihubungkan oleh atom N. Contoh: Krotonosid.
d. S-glikosida yaitu senyawa glikosida yang ikatan antar glikon dan aglikonnya
2.2.5.4 Flavonoid
Flavonoid merupakan sekelompok besar senyawa polifenol tanaman yang
tersebar luas dalam berbagai bahan makanan dan dalam berbagai konsentrasi.
Flavonoid memiliki kerangka dasar karbon yang terdiri atas 15 atom karbon,
dimana dua cincin benzen (C6) terikat pada suatu rantai propan (C3) sehingga
membentuk susunan C6-C3-C6 (Lenny, 2006).
Flavonoida berfungsi dalam menarik burung dan serangga yang berperan
untuk proses penyerbukan bunga. Beberapa fungsi lainnya adalah untuk mengatur
fotosintesis, kerja antimikroba dan antivirus serta memiliki kemampuan dalam
mengusir serangga (Robinson, 1995).
Peranan beberapa senyawa fenol sudah diketahui misalnya antosianin
sebagai pigmen bunga yang menghasilkan hampir semua warna merah jambu,
merah marak, merah, merah senduduk, ungu dan biru. Antosianin hampir terdapat
umum dalam tumbuhan berpembuluh seperti dalam beberapa lumut dan daun
muda paku (Harbone, 1987).
2.2.5.5 Tanin
Tanin adalah senyawa fenol dengan berat molekul yang cukup tinggi,
mengandung gugus hidroksil dan kelompok lain yang cocok (seperti karboksil)
untuk membentuk kompleks yang efektif dengan protein dan makro molekul yang
lain dibawah kondisi lingkungan tertentu yang telah dipelajari. Tanin merupakan
bentuk komplek dari protein, pati, selulosa dan mineral (Horvath, 1981).
Tanin dibagi menjadi dua kelompok yaitu tanin yang terhidrolisis dan
tanin yang terkondensasi. Tanin yang terhidrolisis merupakan polimer gallic atau
terkondensasi merupakan polimer senyawa flavonoid dengan ikatan
karbon-karbon (Westendarp, 2006).
Tanin terbagi dalam dua golongan, yaitu berasal dari turunan pyrogallol
memiliki 3 gugus hidroksil pada inti aromatis dan berasal dari turunan
pyrocatechol yang memiliki 2 gugus hidroksil pada inti aromatis. Pyrogallol dan catechol merupakan hasil peruraian glikosida tanin yangdapat digunakan sebagai
anti bakteri dan anti fungi dengan adanya gugus –OH. Tanin merupakan senyawa
yang tidak dapat dikristalkan (Tyler, 1988).
2.3 Simplisia dan Ekstrak 2.3.1 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang
belum mengalami pengolahan apapun juga dan kecuali dikatakan lain, berupa
bahan yang telah dikeringkan. Simplisia dibedakan simplisia nabati, simplisia
hewani dan simplisia pelikan (mineral). Simplisia nabati adalah simplisia yang
berupa tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan
(Ditjen POM, 2000).
2.3.2 Ekstrak
Ekstrak yaitu sediaan kental atau cair yang diperoleh dengan
mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan
pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan
(Depkes RI, 1995).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
Simplisia yang diekstraksi mengandung senyawa aktif yang dapat larut dan
senyawa yang tidak dapat larut (Ditjen POM, 2000).
Menurut Ditjen POM (2000), ada beberapa metode ekstraksi yang sering
digunakan dalam berbagai penelitian antara lain yaitu:
a. Cara dingin
1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar.
Maserai yang dilakukan dengan cara pengadukan dan pengulangan penambahan
pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya
disebut remaserasi.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu
baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada
temperature kamar.
b. Cara panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang
relatif konstan dengan adanya pendingin balik.
2. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum
3. Soxhletasi
Soxhletasi adalah proses penyarianatau ekstraksi dengan menggunakan
pelarut yang selalu baru, dilakukan dengan menggunakan alat soklet sehingga
menjadi ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin
balik.
4. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 30 menit.
2.4 Radikal Bebas
Radikal bebas adalah atom atau gugus atom yang memiliki satu atau lebih
elektron tidak berpasangan, sehingga senyawa tersebut sangat reaktif mencari
pasangan (Fessenden dan Fessenden, 1986). Senyawa ini terbentuk di dalam
tubuh dapat dipicu oleh berbagai faktor, misalnya ketika komponen makanan
diubah menjadi bentuk energi melalui proses metabolisme. Dalam kondisi
demikian mudah terbentuk radikal bebas, seperti anion superoksida, hidroksil dan
lain-lain. Radikal bebas juga dapat terbentuk dari senyawa lain yang sebenarnya
bukan radikal bebas, tetapi mudah berubah menjadi radikal bebas (Winarsi, 2007).
Radikal bebas cenderung menangkap elektron dari molekul lain dan
kemudian membuat senyawa baru yang tidak normal yang akan menyebabkan
tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit seperti
kanker, jantung koroner, katarak, serta penyakit degeneratif lainnya (Muchtadi,
2013).
Mekanisme reaksi radikal bebas terbentuk melalui 3 tahapan reaksi, yaitu:
(1) permulaan (inisiasi, initiation) suatu radikal bebas, (2) perambatan (propagasi,
propagation) reaksi radikal bebas; (3) pengakhiran (terminasi, termination) reaksi
radikal bebas (Fessenden dan Fessenden, 1986).
Tahap inisiasi adalah tahap awal terbentuknya radikl bebas. tahap
propagasi adalah tahap perpanjangan radikal berantai, dimana terjadi reaksi antara
sutau radikal dengan senyawa lain dan menghasilkan radikal baru. Tahap
terminasi adalah tahap akhir, terjadi pengikatan suatu radikal bebas dengan radikal
bebas yang lain sehingga membentuk senyawa non radikal yang biasanya kurang
reaktif dari radikal induknya (Kumalaningsih, 2006).
Sifat radikal bebas yang tidak stabil menyebabkan reaksi menerima atau
memberikan elektron dengan molekul sekitarnya. Kebanyakan molekul ini bukan
radikal bebas melainkan makromolekul biologi seperti lipid, protein, asam nukleat
dan karbohidrat. Dengan reaksi ini timbulah reaksi radikal bebas beruntun yaitu
terbentuknya radikal bebas baru yang bereaksi lagi dengan makromolekul lain
(Kosasih, dkk., 2004).
2.5 Antioksidan
Antioksidan adalah senyawa yang mempunyai struktur molekul yang
dapat memberikan elektronnya kepada molekul radikal bebas dan dapat memutus
reduktor berfungsi untuk mencegah terjadinya reaksi oksidasi atau menetralkan
senyawa yang telah teroksidasi dengan cara menyumbangkan hidrogen dan atau
elektron (Silalahi, 2006).
Menurut Kumalaningsih (2006), antioksidan tubuh dikelompokkan
menjadi 3 yakni:
1. Antioksidan primer yang berfungsi untuk mencegah pembentuk senyawa
radikal baru karena dapat merubah radikal bebas yang ada menjadi molekul
yang berkurang dampak negatifnya, sebelum radikal bebas ini sempat bereaksi.
Contohnya adalah enzim superoksida dismutase (SOD) yang berfungsi sebagai
pelindung hancurnya sel-sel dalam tubuh karena radikal bebas.
2. Antioksidan sekunder merupakan senyawa yang berfungsi menangkap
senyawa serta mencegah terjadinya reaksi berantai. Contohnya adalah vitamin
E, vitamin C dan betakaroten yang dapat diperoleh dari buah-buahan.
3. Antioksidan tersier merupakan senyawa yang memperbaiki kerusakan sel-sel
dan jaringan yang disebabkan radikal bebas. Contohnya enzim metionin
sulfoksidan reduktase untuk memperbaiki DNA pada inti sel.
Khasiat antioksidan untuk mencegah berbagai penyakit akibat pengaruh
oksidatif akan lebih efektif jika kita mengkonsumsi sayur-sayuran dan
buah-buahan yang kaya akan antioksidan dan berbagai jenis daripada menggunakan
antioksidan tungggal. Hal ini mungkin dikarenakan oleh adanya komponen lain
dan interaksinya dalam sayur-sayuran dan buah-buahan yang berperan secara
positif (Silalahi, 2006).
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik
asam-asam organik. Senyawa polifenolik dapat bereaksi sebagai pereduksi,
penangkap radikal bebas. Antioksidan alami yaitu antioksidan yang dapat
diperoleh dari tanaman atau hewan berupa tokoferol, vitamin C, betakaroten,
flavonoid dan senyawa fenolik (Kumalaningsih, 2006).
2.5.1 Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan
rumus bangun C6H8O6, dengan titik lebur 190 - 192°C. Asam askorbat
mengandung tidak kurang dari 99,0% C6H8O6. Pemerian: serbuk atau hablur
putih atau agak kuning, tidak berbau, rasa asam, oleh pengaruh cahaya lambat
laun menjadi gelap, dalam larutan cepat teroksidasi. Penyimpanan dalam wadah
tertutup rapat, terlindung dari cahaya. Vitamin C mengandung khasiat sebagai
antiskorbut (Ditjen POM, 1979).
Gambar 2.1. Rumus bangun vitamin C (Silalahi, 2006)
Vitamin C berperan dalam pencegahan penyakit jantung koroner,
mencegah kanker, meningkatkan sistem kekebalan tubuh terhadap infeksi virus
dan bakteri (Kosasih, dkk., 2004).
2.5.2 Karotenoid
tidak larut dalam air. Salah satu senyawa karotenoid adalah β-karoten, yaitu
senyawa yang akan dikonversikan menjadi vitamin A oleh tubuh sehingga sering
juga disebut sebagai pro-vitamin A (Kumalaningsih, 2006).
β-karoten mempunyai berat molekul 536,9 dengan rumus molekul C40H56.
Karakteristik β-karoten adalah hablur atau serbuk berwarna coklat-merah atau
merah kecoklatan, praktis tidak larut dalam air, sedikit larut dalam sikloheksana,
kurang larut dalam etanol. β-karoten peka terhadap udara, panas dan cahaya,
terutama ketika dalam bentuk larutan. Rumus bangun β-karoten dapat dilihat
pada gambar 2.2 berikut:
Gambar 2.2 Rumus bangun β-karoten
Sebagai antioksidan, β-karoten memperlambat fase inisiasi radikal bebas
sehingga dapat melindungi tubuh terhadap berbagai penyakit, yaitu menghambat
pertumbuhan sel kanker, mencegah serangan jantung, mencegah katarak, serta
meningkatkan fungsi sistem kekebalan tubuh (Silalahi, 2006).
2.5.3 Flavonoid
Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3
-C6. Kelompok terbesar flavonoid memiliki ciri adanya cincin piran yang
(Robinson, 1995). Flavonoid pada tumbuhan berfungsi sebagai pelindung
terhadap serangan jamur ataupun radiasi sinar UV yang dapat merusak tumbuhan,
selain itu flavonoid juga terlibat dalam proses fotosintesis, transfer energi dan
respirasi pada tumbuhan. Struktur umum untuk turunan flavonoid dapat dilihat
pada gambar berikut:
Gambar 2.3 Rumus bangun flavonoid (Silalahi 2006)
Senyawa ini adalah senyawa pereduksi yang dapat menghambat reaksi
oksidasi sehingga dapat dijadikan sebagai antioksidan (Robinson, 1995). Senyawa
ini berperan sebagai penangkap radikal bebas karena mengandung gugus hidroksil
(Silalahi, 2006).
2.5.4 Tokoferol
Tokoferol merupakan salah satu antioksidan yang terdapat dalam
tumbuhan. Struktur α-tokoferol dapat dilihat pada gambar berikut:
Gambar 2.4 Rumus bangun α- tokoferol (Yoshida, dkk., 2007)
Beberapa tokoferol ada yang terdapat di alam, salah satunya α-tokoferol
yang merupakan senyawa paling aktif secara biologis (Silalahi, 2006). Aktivitas
anti aging dan sedang dilakukan penelitian lebih lanjut mengenai efektivitasnya
dalam pengobatan Alzheimer (Yoshida, dkk., 2007).
2.5.5 Polifenol
Polifenol adalah kelompok zat kimia yang ditemukan pada tumbuhan. Zat
ini memiliki tanda khas yakni memiliki banyak gugus fenol dalam molekulnya.
Polifenol memiliki spektrum luas dengan sifat kelarutan pada suatu pelarut yang
berbeda-beda, hal ini disebabkan oleh gugus hidroksil pada senyawa tersebut yang
dimiliki berbeda jumlah dan posisinya (Hattenschwiler, 2000).
Turunan polifenol sebagai antioksidan dapat menstabilkan radikal bebas
dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas.
Polifenol merupakan komponen yang bertanggung jawab terhadap aktivitas
antioksidan dalam buah dan sayur (Hattenschwiler, 2000).
2.6 Spektrofotometri UV-Visible
Prinsip kerja spektrofotometer UV-Vis adalah sinar/cahaya dilewatkan
melewati sebuah wadah (kuvet) yang berisi larutan, dimana akan menghasilkan
spektrum. Sebagian dari cahaya tersebut akan diserap dan sisanya akan
dilewatkan. Nilai absorbansi dari cahaya yang dilewatkan akan sebanding dengan
konsentrasi larutan didalam kuvet. Alat ini menggunakan hukum Lambert Beer
sebagai acuan (Ewing, 1985).
Ahli kimia telah lama menggunakan warna sebagai bantuan dalam
mengenali zat-zat kimia. Spektrofotometri dapat dianggap sebagai perluasan suatu
pemeriksaan visual, yaitu dengan menggunakan alat untuk mengukur absorpsi
pengukuran kualitatif dari suatu zat dengan ketelitian yang lebih besar (Day,
1994).
Spektrofotometer UV/Visibel pada dasarnya terdiri atas sumber sinar
monokromator, tempat sel untuk zat yang diperiksa, detektor, penguat arus dan
alat ukur atau pencatatt. Panjang gelombang untuk sinar ultraviolet antara 200 -
400 nm sedangkan panjang gelombang untuk sinar tampak/visible antara 400 -
750 nm (Rohman, 2007).
2.7 Penentuan Aktivitas Antioksidan Dengan Metode DPPH
Metode untuk menentukan aktivitas antioksidan ada beberapa cara, yaitu:
(1). BCB Method (β-Carotene Bleaching Method) atau Metode Pemutihan β
-karoten, (2). DPPH (1,1-difenil-2- picrylhydrazil) Radical Scavenging Method
(Metode Pemerangkapan Radikal Bebas DPPH), (3). Thiobarbituric
Acid-Reactive Substance (TBARS) Assay, (4). ORAC Assay (Oxygen-Radical
Absorbance Capacity), (5). CUPRAC Assay (Cupric Reducing Antioxidant
Capacity), (6). FRAP Assay (Ferric Reducing Antioxidant Power), (7).
Determination of Conjugated Dienes, (8). Determination of Lipid Hydroperoxides
(De la Rosa, 2010).
Pada tahun 1922, Goldschmidt dan Renn menemukan senyawa berwarna
ungu radikal bebas stabil DPPH. DPPH berwarna sangat ungu seperti KMnO4 dan
tidak larut dalam air (Ionita, 2005).
Metode DPPH merupakan suatu metode yang cepat, sederhana dan murah
yang dapat digunakan untuk menguji kemampuan antioksidan yang terkandung
dalam makanan. Metode DPPH dapat digunakan untuk sampel yang padat dan
juga dalam bentuk larutan. Prinsipnya dimana elektron ganjil pada molekul DPPH
memberikan serapan maksimum pada panjang gelombang 517 nm yang berwarna
ungu. Warna ini akan berubah dari ungu menjadi kuning lemah apabila elektron
ganjil tersebut berpasangan dengan atom hidrogen yang disumbangkan senyawa
antioksidan. Perubahan warna ini berdasarkan reaksi kesetimbangan kimia
(Prakash, 2001).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah
harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibition
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan % penghambatan 50%. Zat yang mempunyai
aktivitas antioksidan tinggi, akan mempunyai harga EC50 atau IC50 yang rendah
(Molyneux, 2004).
2.7.1 Pelarut
Pelarut yang digunakan dalam metode DPPH akan bekerja dengan baik
bila menggunakan pelarut metanol atau etanol dan kedua pelarut ini tidak akan
mempengaruhi dalam reaksi antara sampel uji sebagai antioksidan dengan DPPH
2.7.2 Pengukuran absorbansi panjang gelombang
Panjang gelombang maksimum (λ maks) yang digunakan dalam
pengukuran uji sampel uji sangat bervariasi. Menurut beberapa literatur panjang
gelombang maksimum untuk DPPH antara lain 515-520 nm, bagaimanapun dalam
praktiknya hasil pengukuran yang memberikan peak maksimum itulah panjang
gelombangnya yaitu sekitar panjang gelombang yang disebutkan diatas. Nilai
absorbansi yang mutlak tidaklah penting, karena panjang gelombang dapat diatur
untuk memberikan absorbansi maksimum sesuai dengan alat yang digunakan
(Molyneux, 2004).
2.7.3 Waktu pengukuran
Lamanya pengukuran menurut literatur bervariasi yakni 1 menit, 5 menit,
10 menit, 20 menit, 30 menit, 60 menit, 90 menit, 120 menit sampai 240 menit.
Waktu pengukuran yang direkomendasikan adalah 20 menit dan 30 menit.
Kecepatan reaksi dipengaruhi oleh sifat dari aktivitas antioksidan yang terdapat di
BAB I PENDAHULUAN
1.1 Latar Belakang
Penggunaan senyawa antioksidan semakin berkembang baik untuk
makanan maupun pengobatan seiring dengan bertambahnya pengetahuan tentang
radikal bebas. Proses penuaan dan penyakit degeneratif seperti kanker,
kardiovaskuler, penyumbatan pembuluh darah yang meliputi hiperlipidemik,
aterosklerosis, stroke, dan tekanan darah tinggi serta terganggunya sistem imun
tubuh dapat disebabkan oleh stress oksidatif. Stress oksidatif merupakan keadaan
yang tidak seimbang antara jumlah molekul radikal bebas dan antioksidan dalam
tubuh (Trilaksani, 2003).
Sumber radikal bebas banyak ditemukan dalam kehidupan sehari-hari,
beberapa diantaranya yaitu asap rokok, asap kendaran bermotor, asap pabrik, air
yang tercemar logam berat, makanan berlemak serta paparan sinar matahari
berlebih (Kumalingsih, 2006). Untuk menetralisir kerja radikal bebas dibutuhkan
antioksidan. Antioksidan merupakan senyawa yang dapat menghambat reaksi
oksidasi, dengan mengikat radikal bebas dan molekul yang sangat reaktif,
akibatnya kerusakan sel dapat dihambat (Winarsi, 2007). Antioksidan alami
banyak ditemukan pada tanaman seperti biji-bijian, buah, dan sayur-sayuran yang
mempunyai manfaat bagi kesehatan. Antioksidan alami antara lain turunan fenol,
koumarin, hidroksi sinamat, tokoferol, difenol, flavonoid, dihidroflavon, katekhin,
asam askorbat (Prakash, 2001). Tumbuhan kelakai salah satu tumbuhan yang di
sebagai antioksidan karena mengandung flavonoid yang tinggi (Suhartono, dkk.,
2012)
Menurut penelitian mahasiswa Universitas Lambung Mangkurat
mendapatkan bahwa herba kelakai mengandung zat metabolit sekunder seperti
flavonoid, alkaloid dan steroid. Flavonoid merupakan zat yang berfungsi sebagai
antioksidan dari tumbuhan yang berwarna cerah. Warna-warna merah, biru, ungu
pada bagian-bagian tanaman disebabkan oleh warna pigmen antosianin, yang
merupakan bagian dari senyawa flavonoid (Maharani, 2005).
Kalimantan merupakan daerah yang mempunyai sebaran lahan rawa (rawa
air tawar dan rawa gambut) yang banyak ditumbuhi oleh berbagai macam jenis
paku-pakuan dan salah satunya tumbuhan kelakai (Ceri, dkk., 2014). Tumbuhan
kelakai (Stenochlaena palustris (Burm.f.) Bedd.) adalah jenis paku-pakuan yang
berasal dari suku Blechnaceae. Tumbuh hingga pada ketinggian 900 meter dpl dan
merambat pada hutan-hutan bekas penebangan kayu terutama dekat air tawar, air
payau, hutan bakau, khususnya disepanjang tepi sungai dan sumber air. Umumnya
ditemukan di dataran rendah, di tempat terbuka, hutan sekunder dan wilayah
rawa-rawa termasuk rawa gambut (MacKinnon, 2000). Daun-daunnya yang muda
bewarna kemerahan seperti warna udang yang di masak, oleh karena itu dinamai
juga paku merah atau paku udang (Hartini, 2011). Tumbuhan kelakai sebenarnya
tidak hanya tumbuh di Kalimantan tetapi tumbuh juga di daerah Sumatera dan
daerah lain yang kondisi tanahnya masih tanah gambut, namun penggunaan
kelakai sebagai penganan masih dominan dilakukan oleh masyarakat Kalimantan,
kelakai biasa dimasak dengan cara dioseng-oseng, sayur bening atau direbus
dipergunakan oleh masyarakat suku dayak sebagai suplemen penambah darah,
obat awet muda, penambah ASI untuk ibu yang sedang menyusui, obat tekanan
darah tinggi, pereda demam dan mengobati sakit kulit (Maharani dkk, 2005).
Berdasarkan uraian di atas, peneliti melakukan karakterisasi simplisia,
skrinning fitokimia serta uji aktivitas antioksidan ekstrak etanol herba kelakai.
Pengujian antioksidan dilakukan dengan menggunakan metode DPPH
(1,1-diphenyl-2-picrylhydrazil).
1.2 Perumusan Masalah
Berdasarkan latar belakang diatas, maka perumusan masalah dalam
penelitian ini adalah sebagai berikut:
a. apakah karakteristik simplisia herba kelakai dapat ditentukan?
b. apakah golongan senyawa kimia yang terkandung dalam herba kelakai?
c. apakah nilai IC50 antioksidan ekstrak etanol herba kelakai termasuk dalam
rentang kategori antioksidan kuat?
1.3 Hipotesis
Berdasarkan perumusan diatas, maka hipotesis penelitin ini adalah sebagai
berikut:
a. Karakteristik simplisia herba kelakai dapat ditentuka.
b. golongan senyawa kimia yang terkandung dalam herba kelakai adalah
golongan steroid, alkaloid, glikosida, flavonoid dan tanin.
c. nilai IC50 ekstrak etanol herba kelakai <100 termasuk ke dalam kategori