KAJIAN RUMPUT LAUT EUCHEMA COTONII
SEBAGAI SUMBER SERAT ALTERNATIF
MINUMAN CENDOL INSTAN
UBAEDILLAH
s
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul : “Kajian Rumput Laut Euchema cotonii Sebagai Sumber Serat Alternatif Minuman Cendol Instan” adalah karya saya sendiri dengan pengarahan dari komisi pembimbing dan belum pernah dipublikasikan kepada perguruan tinggi manapun. Sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini. Hasil penelitian atau gambar boleh dikutip untuk kepentingan non komersial dengan menyebutkan sumbernya.
Bogor, Februari 2008
RINGKASAN
UBAEDILLAH. Kajian Rumput Laut Euchema cotonii Sebagai Sumber Serat Alternatif Minuman Cendol Instan. Dibimbing oleh USMAN AHMAD dan SANTOSO.
Serat pangan (Dietary fiber) seringkali identik dengan produk sayuran yang segar. Manfaat serat dapat diperoleh juga melalui produk olahan yang mengandung bahan dasar rumput laut. Dalam produk makanan, rumput laut seringkali digunakan sebagai alternatif bahan yang menguntungkan dan dapat meningkatkan nilai gizi. Penambahan rumput laut sebagai sumber serat akan mampu meningkatkan nilai jual es cendol yang telah dikenal masyarakat dari sisi cita rasa dan pada kandungan seratnya juga sehingga dapat dimanfaatkan sebagai sumber serat pangan (dietary fiber) alternatif.
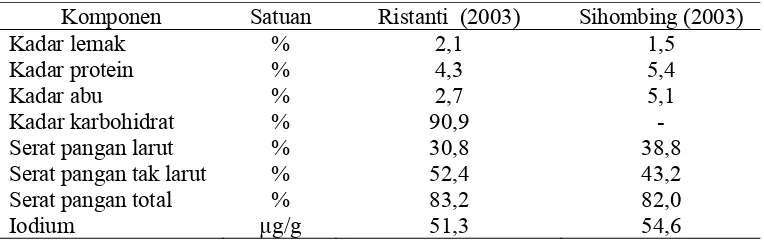
Rumput laut Euchemacotonii yang digunakan dalam penelitian ini memiliki komposisi kimia; kadar air 96,12%, kadar lemak 1,55%, protein 20,10%, abu 6,96%, karbohidrat 71,39%, serat pangan larut 15,46%, serat pangan tak larut 38,96%, serat pangan total 54,38%, dan iodium 55,46 µg/g. Dengan demikian, rumput laut Euchema cotonii dapat digunakan sebagai sumber serat dalam cendol instan. Selain sebagai sumber serat, Euchema cotonii dapat juga digunakan sebagai sumber iodium.
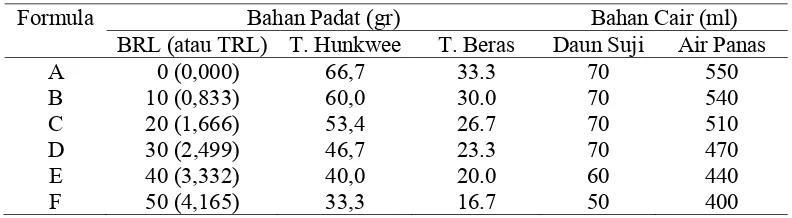
Komposisi rumput laut Euchema cotonii dalam cendol paling disukai pada taraf 20% (formula C). Komposisi formula C dalam 100 gram bahan cendol yaitu rumput laut 20 gram, tepung hunkwee 53,4 gram, tepung beras 26,7 gram, dan larutan daun suji 70 ml. Berdasarkan uji kesukaan, komposisi tersebut paling disukai oleh panelis sehingga diharapkan sesuai juga dengan selera konsumen.
Kadar serat pangan total cendol formula B yaitu 17,40%, sedangkan serat pangan total formula C yaitu 18,68%. Jika dalam satu takaran saji cendol instan adalah sebanyak 20 gram maka jumlah serat yang dikonsumsi untuk cendol formula B adalah 3,48 gram dan untuk formula C adalah 3,74 gram. Apabila dalam satu hari diasumsikan diminum sebanyak tiga kali maka jumlah asupan serat pangannya adalah 10,44 gram per hari untuk formula B dan 11,22 gram per hari untuk formula C. Dengan mengkonsumsi cendol instan setiap hari diharapkan dapat memenuhi sebagian kebutuhan serat pangan setiap hari.
Kandungan iodium cendol rumput laut formula B cukup tinggi yaitu 9,01 µg/g dan untuk formula C yaitu 9,31 µg/g. Untuk anak-anak usia 4-6 tahun membutuhkan iodium 100 µg perhari, dianjurkan untuk mengkonsumsi cendol rumput laut formula B sebanyak 11 gram per hari atau 10 gram untuk cendol formula C. Untuk orang dewasa (10-<60 tahun) dengan kebutuhan iodium 150 µg per hari, dianjurkan untuk mengkonsumsi sebanyak 17 gram cendol rumput laut formula B atau 16 gram formula C. Selain sebagai sumber serat, cendol instan ini dapat dijadikan sebagai sumber iodium untuk mencegah GAKI.
ABSTRACT
UBAEDILLAH. Study on Seaweed Euchema cotonii as Alternatif Sources of Dietary Fiber on Instant Cendol. Under the Supervision of USMAN AHMAD and SANTOSO.
Dietary fiber have fungsional effect to human health, for example it can be used to decrease cholesteroleomic, to prevent constipation and diverticulosis,as well as to prevent degeneratif desease. Dietary fiber from seaweed (Euchema cotonii) are usually consumed as food product (processed), for instant seaweed tangkue, noodles, putu ayu, donut, and other products with seaweed added. The objectives of this research were to study the advantage of seaweed as sources of dietary fiber, to obtain the optimum composition for instant cendol, and to observe the product instant cendol. This researh was began with blending of seaweed, formulation of cendol (A, B, C, D, E, and F with 0%, 10%, 20%, 30%, 40%, and 50% seaweed respectively), freeze drying, analyze for chemical and physical characterictic of instant cendol, organoleptic analyze (hedonic and pairs). The result showed that porridge of seaweed have total dietary fiber 54,38% (db), iodium 55,46 µg/g (db). Organoleptic score significantly different for formula B on colour 7,7 and for formula C 6,65 on texture. Formula C seaweed cendol has a total dietary fiber higher than formula B and control. Total dietary fiber for formula C was 18,68%, for formula B 17,40%, and for control 15,04%. If compared with comercial cendol,colour of instant cendol showed better result than commercial one, but odour, taste, and texture were inferior than commercial one.
KAJIAN RUMPUT LAUT EUCHEMA COTONII
SEBAGAI SUMBER SERAT ALTERNATIF
MINUMAN CENDOL INSTAN
UBAEDILLAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi teknologi Pascapanen
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Rumput Laut Euchema cotonii Sebagai Sumber Serat Alternatif Minuman Cendol Instan
Nama : Ubaedillah
NRP : F051050031
Disetujui Komisi Pembimbing
Dr. Ir. Usman Ahmad, MAgr. Ir. Santoso, MPhill. Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Pascapanen
Dr. Ir. Wayan Budiastra, MAgr. Prof. Dr. Ir. Khairil Anwar Notodiputro, MS.
PRAKATA
Puji sukur penulis panjatkan kepada Allah SWT atas limpahan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan kuliah dan karya ilimiah ini. Karya ilmiah ini merupakan sebagian kecil dari nikmat dan kasih sayang-Nya yang diberikan kepada penulis. Judul yang dipilih karya ilimiah ini adalah “Kajian Rumput Laut Euchema cotonii Sebagai Sumber Serat Alternatif Minuman Cendol Instan”.
Terima kasih penulis sampaikan kepada Ayahanda Abdul Muttholib, Ibunda Daro’ah, Kang Toni, Aisyah, Munji, Imah yang selalu memberikan kasih sayang, dukungan, dan do’a. Ade Iis, Himah, Alif, dan Inu membuat penulis ter-support untuk menyelesaikan kuliah dan karya ilmiah ini dengan sebaik-baiknya.
Terima kasih penulis sampaikan kepada Dr. Ir. Usman Ahmad, MAgr dan Ir. Santoso, Mphill yang telah bersedia memberikan bimbingan dan arahan yang sangat bermanfaat untuk pengembangan wawasan penulis Dr. Ir. Rohani Hasbullah, Msi selaku dosen penguji yang telah memberikan masukan demi kesempurnaan tesis ini. Terima kasih juga penulis sampaikan kepada Bu Rina dan Balai Pengembangan dan Pengendalian Hasil Perikanan (BP2HP) Jakarta atas proyek penelitian yang diberikan. Mba Yulia yang selalu memberi dukungan dari awal studi dan pendapatnya yang berarti, Pa Yaden yang selalu sabar, Pa Joko, Bu Pia, rekan-rekan seperjuangan di Teknologi Pascapanen; Tika, Eci, Nuni, Faidah, mba Dewi, Bayu, Adnan, Kemala, Eni, Deva (klito), Venty, dan Etha. Tak lupa juga penulis menghargai semua dukungan dari Dias Marchi dan rekan-rekan pengajar di SMAIPB-Soedirman, Cijantung, Neng Ima, Dul Majid, dan Dol Cebannya sebagai jalan rezeki.
Dengan kerendahan hati, semoga karya ilmiah ini memberi manfaat bagi yang membutuhkan.
Bogor, Februari 2008
RIWAYAT HIDUP
Penulis dilahirkan di Indramayu pada Tanggal 16 Agustus 1982. Anak ke lima dari sembilan bersudara dari ayahanda Abdul muttholib dan ibunda Daro’ah. Penulis merupakan anak kelima dari sembilan bersaudara.
DAFTAR ISI
halaman
Ringkasan ... iii
Abstract ... iv
Kata Pengantar ... vii
Prakata ... vii
Daftara Isi ... ix
Daftar Tabel ... xi
Daftar Gambar ... xii
Daftar Lampiran ... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
TINJAUAN PUSTAKA ... 4
Cendol ... 4
Rumput Laut ... 5
Komposisi Kimia Euchema cotonii ... 7
Serat Pangan (Dietary fiber) ... 8
Tepung Beras ... 11
Tepung Hunkwee ... 12
Pengeringan Beku (Freeze Drying) ... 14
METODE PENELITIAN ... 17
Waktu Penelitian ... 17
Bahan dan Alat ... 17
Metode Penelitian ... 18
Analisis Data ... 20
Analisis Daya Serap Air ... 23
Total Mikroba ... 29
Uji Organoleptik ... 30
Analisis Ekonomi ... 31
HASIL DAN PEMBAHASAN ... 34
Pembuatan Bubur Rumput Laut ... 34
Formulasi Cendol Rumput Laut ... 37
Pengeringan Beku (Freeze drying) Cendol Rumput Laut ... 46
Pembekuan Cendol rumput Laut ... 47
Pengeringan Cendol rumput Laut ... 49
Analisis Cendol Rumput Laut Instan ... 50
Analisis Proksimat ... 52
Serat Pangan (dietary fiber) ... 57
Iodium ... 59
Analisis Daya Serap Air ... 62
Analisis Mikrobiologi (Total Plate Count) ... 64
Uji Organoleptik (Perbandingan Pasangan) ... 65
Analisis Ekonomi ... 70
SIMPULAN DAN SARAN ... 72
Simpulan ... 72
Saran ... 73
DAFTAR PUSTAKA ... 74
DAFTAR TABEL
No halaman
1. Produksi rumput laut di Indonesia Tahun 2000-2004 ... 1
2. Komposisi kimia Euchema cotonii ... 8
3. Komposisi kimia tepung beras ... 11
4. Kandungan gizi dan kecambah kacang hijau ... 13
5. Komposisi tepung hunkwee ... 13
6. Perbedaan metode dan mutu produk antara pengeringan beku dan pengeringan konvensional ... 16
7. Kriteria Uji Kesukaan ... 30
8. Kriteria Uji Perbandingan Pasangan ... 31
9. Komposisi kimia Bubur Rumput Laut Euchema cotonii ... 36
10. Komposisi Kimia Rumput Laut Euchema cotonii Segar ... 37
11. Komposisi Formulasi Cendol Rumput Laut ... 39
12. Komposisi Gizi Cendol Rumput Laut Kering (bk) ... 52
13. Kebutuhan Iodium Menurut Kelompok Umur ... 61
DAFTAR GAMBAR
No halaman
1. Klasifikasi Rumput Laut dan Hasil Produksinya ... 5
2. Keterkaitan Antara Dinding Sel Tanaman dan Serat Pangan ... 8
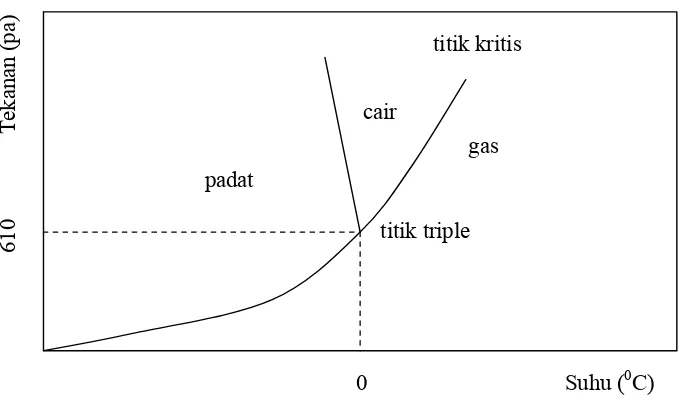
3. Diagram Fase Air ... 16
4. Freeze Dryer Skala Laboratorium ... 17
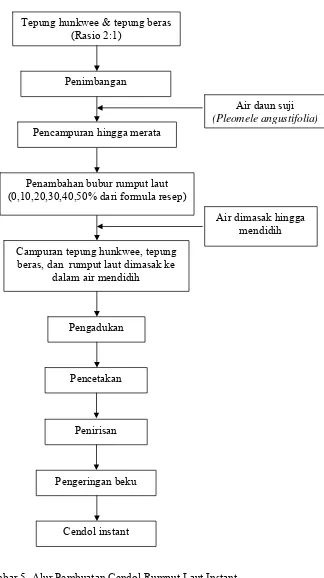
5. Alur Pembuatan Cendol Instant ... 21
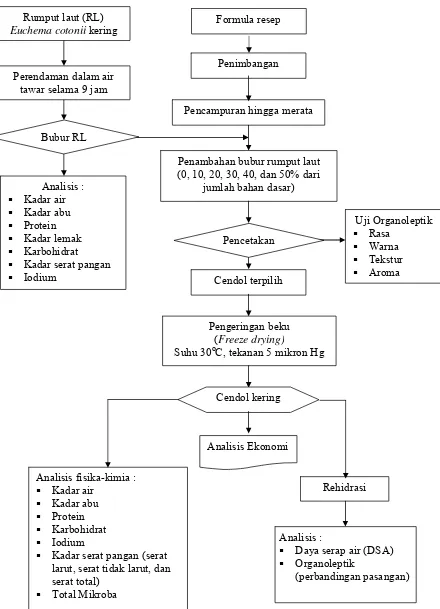
6. Diagram Alir Penelitian ... 22
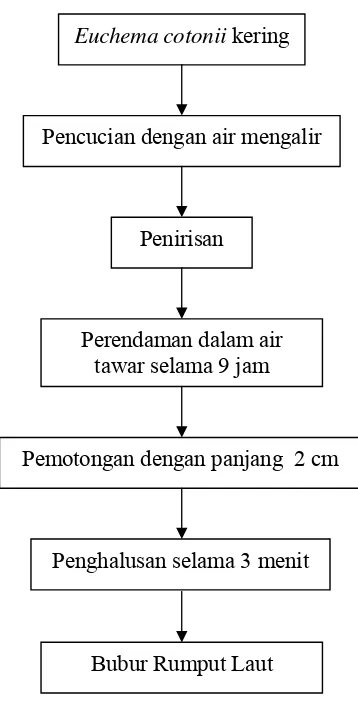
7. Alur Penghilangan Bau Amis dan Pembuatan Bubur Rumput Laut ... 23
8. Rumput Laut Euchema cotonii Kering ... 34
9. Bubur Rumput Laut Euchemaa cotonii ... 36
10. Pencetakan Cendol Rumput Laut ... 38
11. Penampilan Enam Jenis Formulasi Cendol Rumput Laut ... 40
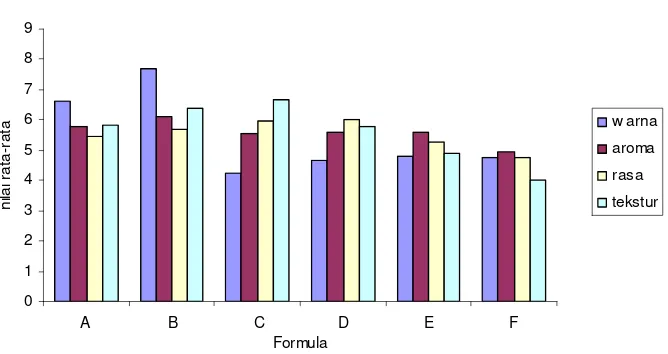
12. Histogram Nilai Organoleptik Cendol Rumput Laut ... 40
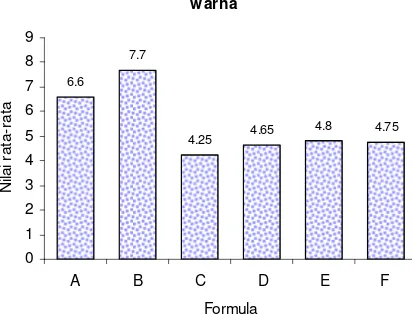
13. Histogram Hasil Uji Warna Formula Cendol Rumput Laut ... 41
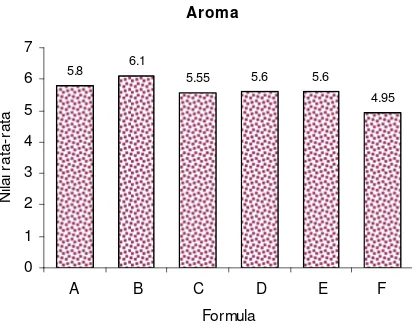
14. Histogram Hasil Uji Aroma Formula Cendol Rumput Laut ... 43
15. Hasil Uji Rasa Formula Cendol Rumput Laut ... 44
16. Hasil Uji Tekstur Formula Cendol Rumput Laut ... 45
17. Cendol Rumput Laut Beku ... 48
18. Grafik Pergerakan Fraksi Air Pengeringan Beku Buah Durian ... 50
19. Penampakan Cendol Rumput Laut Setelah Freeze Dry ... 51
20. Kadar Air Cendol Rumput Laut Formula B, Formula C, dan Kontrol. .. 53
21. Kadar Protein (bk) Cendol Rumput Laut Formula B, Formula C, dan Kontrol ... 54
22. Kadar Lemak (bk) Cendol Rumput Laut Formula B, Formula C, dan Kontrol ... 55
23. Kadar Abu (bk) Cendol Rumput Laut Formula B, Formula C, dan Kontrol ... 55
24. Kadar Karbohidrat (bk) Cendol Rumput Laut Formula B, Formula C, dan Kontrol ... 57
25. Kadar Serat Pangan (bk) Cendol Rumput Laut Formula B, Formula C, dan Kontrol ... 58
27. Penampakan Rongga-Rongga Cendol Rumput Laut Kering ... 64 28. Cendol Rumput Laut Formula B (kiri), Cendol Komersil (tengah),
DAFTAR LAMPIRAN
No halaman
1. Score Sheet Cendol Rumput Laut Euchema cotonii ... 79
2. Lembar Isian Uji Perbandingan Pasangan ... 81
3. Analisis Ragam dan Uji Lanjut Warna Cendol Rumput Laut ... 82
4. Analisis Ragam dan Uji Lanjut Aroma Cendol Rumput Laut ... 82
5. Analisis Ragam dan Uji Lanjut Rasa Cendol Rumput Laut ... 83
6. Analisis Ragam dan Uji Lanjut Tekstur Cendol Rumput Laut ... 83
7. Analisis Ragam dan Uji Lanjut Kadar Air Cendol Rumput Laut ... 84
8. Analisis Ragam dan Uji Lanjut Lemak Cendol Rumput Laut ... 84
9. Analisis Ragam Protein Cendol Rumput Laut ... 84
10. Analisis Ragam Abu Cendol Rumput Laut ... 84
11. Analisis Ragam Karbohidrat Cendol Rumput Laut ... 85
12. Analisis Ragam dan Uji Lanjut Serat Pangan Larut Cendol Rumput Laut ... 85
13. Analisis Ragam dan Uji Lanjut Serat Pangan tak Larut Cendol Rumput Laut ... 85
14. Analisis Ragam dan Uji Lanjut Serat Pangan Total Cendol Rumput Laut ... 86
15. Analisis Ragam dan Uji Lanjut Iodium Cendol Rumput Laut ... 86
16. Asumsi Dasar Analisis Ekonomi Usaha Cendol Instan ... 87
17. Biaya Variabel Usaha Cendol Instan ... 88
18. Uraian Pemakaian Biaya Listrik ... 88
19. Biaya Tetap Usaha Cendol Instan ... 89
20. Cash Flow Usaha Cendol Instan ... 90
I. PENDAHULUAN 1.1. Latar Belakang
Di Indonesia, rumput laut secara luas dimanfaatkan dalam industri kembang
gula, kosmetik, es krim, media cita rasa, roti, saus, sutera, pengalengan ikan dan
daging, obat-obatan dan lainnya (Winarno, 1990). Komposisi utama rumput laut
yang dapat digunakan sebagai bahan pangan adalah karbohidrat, abu, serat pangan,
dan sebagian kecil lemak dan protein. Hasil penelitian Chaidir (2007) menunjukkan
kadar karbohidrat pada rumput laut Euchema cotonii yang direndam dalam air tawar
selama 9 jam adalah 75,36% bk, abu 18% bk, lemak 3,39% bk, protein 0,43% bk dan
serat pangan total 9,62% bb. Serat pangan (dietary fiber) adalah suatau karbohidrat
kompleks di dalam bahan pangan yang tidak dapat dicerna oleh enzim-enzim
pencernaan manusia. Dietary fiber merupakan komponen dari jaringan tanaman
tahan terhadap proses hidrolisis oleh enzim dalam lambung dan usus kecil. Serat
tersebut banyak berasal dari dinding sel sayuran dan buah-buahan. Secara kimia
dinding sel tersebut tersusun dari beberapa karbohidrat, seperti selulosa,
hemiselulosa, pektin, dan nonkarbohidrat seperti polimer lignin, beberapa gumi, dan
mucilage (Astawan et al., 2004).
Tabel 1. Produksi Rumput Laut di Indonesia Tahun 1999-2004
Tahun Volume (ton) Sumber : Biro Pusat Statistik, 2005.
Serat pangan (dietary fiber) memiliki efek fungsional yang menguntungkan
bagi kesehatan manusia, diantaranya dapat menurunkan kolesterol darah,
memperbaiki fungsi-fungsi pencernaan, dan mencegah berbagai penyakit degeneratif
(Astawan et al., 2004). Selain serat, rumput laut juga mengandung iodium yang merupakan elemen penting dalam pencegahan penyakit gondok. Di Jepang, satu dari
satu juta penduduk yang terkena penyakit gondok, sedangkan di Indonesia sebanyak
kasus gondok di Jepang mungkin disebabkan oleh kegemaran masyarakat Jepang
mengkonsumsi rumput laut, terutama kombu (Laminaria aparuca) dan L. religosa.
Penelitian Hunninghake et al., (1994), pasien yang menderita
hiperkolesterolemia setelah diberi serat sebanyak 20 gram/hari, total kolesterol, LDL,
serta rasio LDL-HDL plasmanya menunjukkan penurunan masing-masing 6%, 8%,
dan 8%. Komponen LDL merupakan kolesterol yang berpotensi menimbulkan
penyakit jantung koroner.
Serat pangan (dietary fiber) memberikan efek fisiologis dan metabolis karena
sifatnya mampu larut dalam air, kemampuan mengikat air (water holding capacity),
viskositas, kemampuan mengikat molekul organik dan inorganik, dan daya cerna
atau daya fermentasinya oleh bakteri (Groff dan Gropper, 1999). Karena sifat-sifat
tersebut serat pangan dapat memperlambat penurunan makanan dalam pencernaan,
mengurangi pencampuran nutrisi makanan dengan enzim pencernaan dan
menurunkan aktifitas enzim dalam mencerna makanan.
Dietary fiber seringkali identik dengan produk sayuran yang segar. Manfaat serat dapat diperoleh juga melalui produk olahan yang mengandung bahan dasar
rumput laut. Dalam produk makanan, rumput laut seringkali digunakan sebagai
alternatif bahan yang menguntungkan dan dapat meningkatkan nilai gizi. Penelitian
Astawan et al., (2004) menunjukkan bahwa penambahan 30% rumput laut pada kue putu ayu, 30% pada kue centik manis, 30% pada kue lumpur, dan 40% pada kue
donat masih dapat diterima oleh panelis, baik dari rasa, tekstur, warna, dan aroma.
Selain serat, kandungan iodium dalam rumput laut terbukti dapat meningkatkan
jumlah sel neuron otak kiri anak sehingga dapat meningkatkan kemampuan belajar
(kecerdasan).
Selain dalam bentuk makanan, serat pangan banyak dijumpai juga dalam
bentuk cair (minuman) yang banyak dijual dalam berbagai merk dengan sumber serat
yang bermacam-macam. Chaidir (2007) telah melakukan penelitian terhadap
minuman berserat dengan sumber serat berasal dari rumput laut. Penambahan tepung
rumput laut Euchema cotonii 48,7% dalam bahan minuman berserat, dapat
meningkatkan kadar serat pangan (total dietary fiber) menjadi 41,8% yang terdiri
dari serat pangan larut 36,1% dan serat pangan tidak larut 5,7%, yang berarti bahwa
Kesadaran masyarakat akan pentingnya mengkonsumsi serat memacu industri
makanan dan minuman untuk melakukan diversifikasi produk dengan produk intinya
berupa serat pangan (dietary fiber) dalam bentuk instan. Produk instan merupakan
tuntutan konsumen masa kini yang dituntut serba cepat dan tidak merepotkan. Salah
satu upaya yang dapat dilakukan untuk diversifikasi produk minuman berserat adalah
melalui produk cendol instant. Cendol rumput laut merupakan minuman yang
disajikan dengan komposisi tertentu rumput laut sebagai sumber serat (dietary fiber)
dilengkapi cairan pati dan gula merah.
Cendol yang ada saat ini umumnya berbahan dasar dari tepung beras, tepung
hunkwee, atau tepung sagu. Produk ini hampir selalu ada di seluruh Wilayah
Indonesia, bahkan di Malaysia karena rasanya yang enak dan teksturnya yang lembut
sehingga disukai oleh berbagai lapisan masyarakat. Penambahan rumput laut sebagai
sumber serat diharapkan akan mampu meningkatkan nilai jual cendol yang dikenal
masyarakat dari sisi cita rasa dan pada kandungan seratnya sehingga dapat
dimanfaatkan sebagai sumber serat pangan (dietary fiber) alternatif.
1.2. Tujuan
Penelitian ini bertujuan untuk mengkaji penggunaan rumput laut sebagai
sumber serat pada minuman cendol instan.
Secara khusus penelitian ini bertujuan untuk menemukan komposisi optimum
rumput laut Euchema cotonii dan bahan-bahan lainnya dalam pembuatan minuman
berserat cendol instan dan mengkaji minuman berserat yang dihasilkan.
II. TINJAUAN PUSTAKA 2.1. Cendol
Cendol merupakan salah satu makanan tradisional dengan bahan baku berasal
dari sumber lokal, diolah menurut resep setempat dan sesuai dengan selera
masyarakat. Menurut Rungkat et al., (2001), pengertian pangan tradisional meliputi
bahan baku dan produk pangan serta minuman yang dibuat dari bahan yang tersedia
di Indonesia dan sudah dikenal dan digunakan semenjak dahulu. Berbagai jenis
pangan tradisional diketahui secara empiris mempunyai khasiat terhadap kesehatan
baik sebagai pencegah penyakit maupun sebagai penyembuh atau sebagai pangan
fungsional. Potensi makanan tradisional digunakan sebagai pangan fungsional cukup
besar karena berbagai hasil penelitian mulai menghasilkan data ilmiah mengenai
khasiat makanan tradisonal, baik khasiat bahan-bahan baku maupun produk-produk
jadi. Bahan-bahan baku yang telah diteliti khasitanya meliputi rempah-rempah,
sayuran, buah-buahan, rumput laut, kacang-kacangan, dan sebagainya.
Menurut Candraningsih (1997), cendol merupakan salah satu jenis makanan
tradisonal Indonesia yang bahan baku utamanya berupa padi-padian dan
kacang-kacangan, yang sudah dikenal dan digemari secara luas di Indonesia. Cendol
memiliki tekstur yang kenyal dan umumnya berwarna hijau. Cendol terbentuk
sebagai akibat dari proses gelatinisasi pati. Dalam 100 gram cendol yang terbuat dari
dari campuran tepung beras dan tepung tapioka mengandung energi 95,08 Kkal,
karbohidrat 8,25 gr, protein 1,21 gr, dan lemak 6,44 gr (Anonymousa, 2001).
Menurut Santoso (2000), dalam proses pembuatan cendol, tepung hunkwe atau
tepung beras ditambah dengan pewarna hijau dan air, dimasak sampai kekentalan
tertentu kemudian dicetak dengan cetakan cendol.
Terdapat dua jenis cendol siap pakai yang ada dipasaran yaitu cendol tepung
hunkwee dan cendol tepung beras. Cendol tepung hunkwee berwarna hijau terang
dan kenyal, sedangkan cendol tepung beras berwarna hijau gelap dan empuk. Cendol
siap pakai dijual dalam kemasan plastik dan direndam dalam air agar setiap butiran
tidak lengket satu sama lainnya. Cendol pada umumnya memiliki aroma segar yang
2.2. Rumput Laut
Rumput laut merupakan tanaman tingkat rendah yang tidak memiliki
perbedaaan susunan kerangka akar, batang, dan daun. Meskipun wujudnya tampak
seperti ada perbedaan, bentuk yang sesungguhnya hanya berupa thalus. Rumput laut
termasuk ke dalam jenis alga. Secara umum, alga dikelompokkan dalam empat kelas
yaitu alga hijau (Chlorophyceae), alga hijau-biru (Cyanophyceae), alga coklat
(Phaecophyceae), dan alga merah (Rhodophyceae). Alga coklat dan alga merah
memiliki habitat di laut dan lebih banyak dikenal sebagai rumput laut atau seaweed.
Klasisfikasi rumput laut dan hasil produksinya dapat dilihat pada Gambar 1
(Winarno, 1990).
Gambar 1. Klasifikasi Rumput Laut dan Hasil Produksinya (Winarno, 1985 dalam Winarno 1990).
Rumput laut
Gracilaria Gelidium
Ascophyllum laminaria Macrocystis
Rhodophyceae (Alga merah)
Phaecophyceae (Alga coklat) Cyanophyceae (Alga hijau-biru) Chlorophyceae
(Alga hijau) Kelas :
Genus :
Chondrus Euchema Gigartina
Furcellaria
Rumput laut tumbuh dengan menempel baik pada karang mati, atau cangkang
moluska agar dapat tahan terhadap terpaan ombak. Selain memerlukan tempat
menempel, rumput laut juga memerlukan sinar matahari untuk proses fotosintesis.
Sinar matahari yang masuk dan diserap tergantung kejernihan air laut. Jenis
Chlorophyceae umumnya tumbuh lebih dekat dengan pantai, lebih ke tengah lagi
Phaecophyceae, dan jenis Rhodophyceae hidup di laut yang lebih dalam (Indriani
dan Sumiarsih, 1991).
Proses fotosintesis rumput laut tidak hanya dibantu oleh sinar matahari, tetapi
juga dipengaruhi oleh ketersediaan zat hara dalam air sekelilingnya. Zat hara yang
ada di laut masih mencukupi untuk kehidupan rumput laut karena adanya sirkulasi
yang baik, run-off dari darat, dan gerakan air. Namun demikian, hal yang perlu
diperhatikan dalam budidaya rumput laut adalah kondisi cemaran air laut. Rumput
laut dapat meneyerap logam berat seperti Pb dan Hg yang berbahaya bagi kesehatan
manusia. Zat hara yang tersedia diserap melalui seluruh bagian tanaman. Selain
menyediakan zat hara, gerakan air laut juga membantu memudahkan rumput laut
membersihkan kotoran yang menempel, dan melangsungkan proses pertukaran CO2
dengan O2, sehingga kebutuhan oksigen dapat terpenuhi. Arus yang baik untuk
pertumbuhan rumput laut adalah antara 20-40 cm/detik atau jika bergelombang
tingginya tidak lebih dari 30 cm (Indriani dan Sumiarsih, 1991).
Selain faktor zat hara dan sinar matahari, pertumbuhan rumput laut juga
dipengaruhi oleh salinitas (kadar garam) dan temperatur. Berdasarkan salinitasnya,
terdapat dua golongan rumput laut yaitu stenohalin yang dapat tumbuh dan
berkembang biak pada perairan dengan kisaran salinitas yang sempit, dan euryhalin
yang dapat tumbuh dan berkembang biak di perairan dengan kisaran salinitas yang
luas. Temperatur yang baik untuk pertumbuhan rumput laut berkisar antara 20-28oC.
Walaupun demikian, ada beberapa jenis rumput laut yang dapat hidup di luar kisaran
tersebut, seperti Phorphyra, Furcellaran, Chondrus, dan Laminaria (Indriani dan Sumiarsih, 1991).
Terdapat dua kelompok rumput laut yang telah menjadi komoditas budidaya
bernilai ekonomi, yaitu Gracilaria spp. dan Eucheuma spp. Kedua rumpun ini telah
berhasil dibudidayakan dan telah diperdagangkan secara luas karena dibutuhkan
beberapa jenis rumput laut di Indonesia yang memiliki nilai ekonomis sesuai dengan
hasil ekstraksinya, antara lain Gracilaria Sp, Gelidium, Gelidiopsis, dan Hypnea
yang merupakan rumput laut penghasil agar-agar (agarophyte), Euchema spinosum,
E. cotonii, dan E. striatum merupakan rumput laut penghasil karagenan (Carragenophyt), Sargassum, Marcocystis, dan Lessonia merupakan rumput laut
penghasil algin.
Rumput laut jenis Euchema cotonii yang merupakan bagian dari ganggang
merah, merupakan jenis rumput laut yang banyak dibudidayakan di Indonesia.
Euchema cotonii tumbuh di berbagai wilayah, antara lain Teluk Banten, Kepulauan Seribu, perairan Sulawesi, perairan Nusa Penida, Bali, dan perairan Pelabuhan Ratu
(Atmaja et al., 1995). Atmaja et al., (1995) menambahkan, rumput laut jenis ini umumnya lebih dikenal dan biasa dipakai dalam dunia perdagangan nasional maupun
internasional, sebagai komoditas ekspor dan bahan baku industri penghasil
karagenan. Karagenan yang dihasilkan adalah tipe kappa karagenan. Oleh karena itu
jenis ini secara taknsonomi diubah namanya dari Euchema alvarezii menjadi
Kappaphycus alvarezii.
2.3. Komposisi Kimia Euchema cotonii
Kandungan rumput laut umumnya adalah mineral esensial (besi, iodin,
aluminum, mangan, calsium, nitrogen dapat larut, phosphor, sulfur, chlor. silicon, rubidium, strontium, barium, titanium, cobalt, boron, copper, kalium, dan unsur-unsur lainnya yang dapat dilacak), protein, tepung, gula dan vitamin A, B, C, D.
Persentase kandungan zat-zat tersebut bervariasi tergantung dari jenisnya
(Departemen Kelautan dan Perikanan Republik Indonesia, 2003).
Hasil penelitian Chaidir (2007) menunjukkan bahwa air merupakan
komponen yang dominan pada Euchema cotonii segar yaitu 93,1%, diikuti oleh
kandungan karbohidrat 75,36% bk. Komposisi lengkap Euchema cotonii disajikan
pada Tabel 2 dan disajikan pula komposisi kimia Euchema cotonii menurut Astawan
Tabel 2. Komposisi Kimia Euchema cotonii
Komponen Satuan Astawan et al., (2004) Chaidir (2007) Kadar abu
Kadar lemak Kadar protein Karbohidrat Serat pangan larut Serat pangan tak larut Serat pangan total
2.4. Serat Pangan (dietary fiber)
Menurut Trowell (1976), serat pangan dalam arti fisiologi yaitu polisakarida
tumbuhan dan lignin yang tahan terhadap hidrolisis enzim pencernaan manusia.
Sedangkan secara kimia serat pangan diartikan sebagai polisakarida bukan pati (non
starch polysaccharides/NSP) dari tumbuhan dan lignin (Gallaher dan Schneeman, 1996). Definisi serat pangan berasal dari sel tanaman. Sel tanaman mengandung
lebih dari 95% komponen serat pangan, yaitu selulose, hemiselulose, lignin, pektin,
dan juga termasuk polisakarida bukan pati (Groff dan Gropper, 1999). Keterkaitan
antara dinding sel tanaman dan serat pangan dapat diuraikan pada Gambar 2.
Gambar 2. Keterkaitan Antara Dinding Sel Tanaman dan Serat Pangan (Groff dan Gropper, 1999).
Serat pangan secara prinsip berbeda dengan serat kasar. Serat kasar adalah
bagian tanaman pangan yang tersisa atau tidak dapat dihidrolisis kembali oleh larutan Komponen dinding
sel tanaman
Gum Mucilages
Algal polysaccharides Suberin
Komponen inorganik Lignin
asam sulfat (H2SO4) atau larutan natrium hidroksida (NaOH) dalam analisis
proksimat bahan pangan. Kandungan tersebut belum menunjukkan kandungan serat
total dalam makanan. Oleh karena larutan asam sulfat dan natrium hidroksida
berkadar 1,25% masih mampu menghidrolisis komponen-komponen makanan dalam
jumlah yang lebih besar. Berbeda dengan kemampuan enzim-enzim pencernaan yang
dihasilkan tubuh. Bila dibandingkan dengan serat pangan, nilai serat kasar lebih kecil
1/3 – 1/2 dari nilai serat pangan (Soelistijani, 2002).
Dihubungkan dengan sifat kolesterolemik, terdapat tiga komponen penting
yang dikandung oleh rumput laut yaitu agar, karagenan, dan asam alginat. Menurut
Hallgren (1981) pengaruh fisiologis pemberian serat adalah meningkatkan berat dan
volume feses, menurunkan transit time, mengikat asam empedu, menurunkan
kolesterol darah dan penyerapan mineral.
Studi tentang kemampuan agar, alginat, dan karagenan telah banyak
dilakukan oleh para peneliti di bidang pangan dan medis. Penelitian yang dilakukan
oleh Alan et al., (1976) terhadap tikus percobaan menunjukkan bahwa penambahan
agar sebanyak 7% dalam ransum menurunkan kadar kolesterol dalam serum. Pada
tikus kontrol (ransum tanpa penambahan serat) kadar kolesterol serum 78 mg/100
ml, sedangkan yang diberi agar 7% adalah 72 mg/100 ml. Demikian juga yang
dilaporkan oleh Kelley dan Tsai (1978) pada tikus yang ditambahkan agar 5% dalam
ransum, kandungan kolesterol dalam serumnya menurun. Serum tikus yang berperan
sebagai kontrol mengandung kolesterol 110 mg/dl, sedangkan yang diberi perlakuan
agar 5% kolesterol serumnya 108 mg/dl.
Penelitian pada manusia juga telah dilakukan oleh Hunninghake et al., (1994)
yang menunjukkan bahwa terjadi penurunan kolesterol plasma akibat pengaruh serat
pangan. Pasien yang menderita hiperkolesterolemia setelah diberi serat sebanyak 20
gram/hari ternyata total kolesterol, LDL, serta rasio LDL-HDL plasmanya
mengalami penurunan masing-masing 6%, 8%, dan 8%. Mereka menyimpulkan
bahwa kandungan serat dalam makanan merupakan terapi konvensional bagi
penderita hiperkolesterolemia.
Berdasarkan kelarutannya, serat pangan dapat dikelompokkan menjadi serat
pangan larut dan tidak larut. Adapun serat larut adalah serat yang dapat terdispersi di
serat yang tidak dapat terdispersi di dalam air (Gallaher dan Schneeman, 1996). Sifat
kelarutan ini berpengaruh pada fisiologis serat pada proses-proses di dalam
pencernaan dan metabolisme zat gizi. Serat larut air terdiri dari pektin, musilase, dan
gum, sedangkan serat yang tidak larut air terdiri dari selulosa, hemiselulosa, dan
lignin (Soelistijani, 2002).
Serat yang bersifat larut dalam air (soulble dietary fiber) memiliki peranan
fisiologis penting dalam menurunkan kadar kolesterol dan glukosa serum, serta
mencegah penyakit jantung dan hipertensi (Astawan, 1998 dalam Astawan, 1999).
Fungsi serat pangan dalam hal ini melibatkan asam empedu (bile acid). Pasien
dengan konsumsi serat yang tinggi dapat mengekskresikan asam empedu, sterol, dan
lemak lebih banyak melalui feses. Serat-serat tersebut mencegah terjadinya
penyerapan kembali asam empedu, kolesterol, dan lemak.
Serat tidak larut (insoluble dietary fiber) merupakan bulking agent yang dapat
berperan dalam pencegahan penyakit kanker usus besar, divertikulosis, konstipasi,
dan hemmorhoid (Astawan, 2004). Menurut Winarno (1997), penyakit divertikulosis
merupakan panyakit yang disebabkan oleh terjadinya pembengkakan keluar pada
usus besar, terutama pada bagian depan (bagian ascending dan menyilang). Bagian
usus besar tersebut dapat menggembung dan pecah sehingga terjadi infeksi. Hasil
penelitian secara klinis diperoleh bahwa serat pangan khususnya dari serealia sangat
efektif dalam menanggulangi penyakit divertikulosis. Dengan konsumsi serat yang
tinggi maka feses lebih mudah menyerap air, menjadi lebih empuk, halus, dan mudah
didorong keluar sehingga mengurangi kesakitan penderita penyakit ini.
Menurut Soelistijani (2002), konstipasi merupakan kesulitan dalam
pengeluaran sisa pencernaan karena volume feces terlalu kecil, sehingga penderita
jarang buang air besar. Gangguan ini dapat dihindari dengan mengkonsumsi
makanan berserat tinggi yang tidak larut air, misal selulosa dan hemiselulosa.
Serat-serat tersebut di dalam kolon mampu berikatan menyerap air. Keadaan ini akan
menyebabkan volume feses menjadi besar dan lunak. Untuk mencegah diare,
sebaiknya secara teratur mengkonsumsi serat larut air. Serat ini mudah membentuk
gel sehingga memperlambat waktu transit zat-zat makanan di dalam usus.
untuk menghindari kelebihan lemak jenuh, kolesterol, gula, natrium, serta membantu
mengontrol berat badan. American Dietetic Association (ADA), National Center Institute, dan American Cancer Society merekomendasikan konsumsi serat antara 25 hingga 35 gram setiap hari atau 10 hingga 13 gram serat per 1000 Kcal setiap harinya
untuk orang dewasa dan manula. Untuk anak-anak dan remaja (umur 2 hingga 20
tahun), ADA merekomendasikan konsumsi serat sama dengan umur (dalam tahun)
ditambah 5 gram setiap hari. Sebagai contoh, anak berusia 5 tahun, maka kebutuhan
seratnya adalah 10 gram per hari, sedangkan pada usia 20 tahun kebutuhan seratnya
adalah 25 gram per hari (Anonymousb, 2007).
2.5. Tepung Beras
Beras terdiri dari bagian kariopsis dan struktur pembungkus yaitu sekam.
Bagian sekam terdiri dari 18-20% berat gabah. Kariopsis merupakan biji tunggal
yang dilapisi dengan dinding ovari matang atau perikarp membentuk biji (Juliano,
1972). Tepung beras dibuat melalui tahapan seperti pembersihan bahan, pengeringan
sampai kadar air 14% dan kemudian digiling kasar untuk memisahkan lembaga dan
endospermnya. Hasil gilingan itu dikeringkan kembali hingga mencapai kadar air
12-14%, kemudian dilakukan penggilingan halus dengan alat penggilas. Hasil gilingan
tersebut selanjutnya diayak dengan pengayak bertingkat untuk mendapatkan berbagai
tingkatan hasil giling, misal < 10 mesh (butir kasar), < 40 mesh (tepung kasar atau
bubuk), 65-80 mesh (tepung agak halus), dan > 100 mesh (tepung halus) (Hubeis,
1984). Komposisi kimia tepung beras dapat dilihat pada Tabel 3.
Tabel 3. Komposisi Kimia Tepung Beras per 100 Gram
Komponen Satuan Nilai
Kandungan amilosa dan amilopektin banyak menentukan tekstur pada
makanan yang banyak mengandung pati. Menurut Graham (1977), kandungan
amilosa pada beras sebanyak 16-17% dari berat total dan kandungan amilopektin
beras menurut Winarno (1992) sebanyak 4-5% dari berat total. Amilosa
menyebabkan terbentuknya gel yang keras dan berwarna keruh setelah dimasak
sedangkan amilopektin berperan penting terhadap sifat konsistensi gel dan viskositas
gel sehingga menyebabkan makanan menjadi lengket (Cagampang et al., 1973).
Pati tidak larut dalam air dingin, tetapi bila pati dipanaskan dalam air maka
akan terjadi perubahan yang nyata pada saat mencapai suhu gelatinisasi, dimana
butir-butir pati akan mengembang (Kulp, 1975). Suhu gelatinisasi adalah suhu pada
saat granula pati mengembang dan tidak kembali lagi ke bentuk semula
(irreversible). Menurut Winarno (1980) bila pemanasan diteruskan, pengembangan
akan mencapai titik maksimum dan granula pati akan pecah sehingga kekentalan dari
suspensi akan naik.
2.6. Tepung Hunkwee
Bahan baku yang digunakan dalam pembuatan tepung hunkwee adalah biji
kacang haijau. Biji kacang hiaju secara umum terbagi dalam dua bagian yaitu kulit
biji, endosperm, dan lembaga. Kulit biji berfungsi untuk melindungi biji dari
kekeringan, kerusakan fisik, mekanik, serangan kapang dan serangga. Endosperm
merupakan biji yang mengandung cadangan makanan untuk pertumbuhan lembaga.
Lembaga ini akan membesar selama pertumbuhan biji tersebut (Soeprapto dan
Sutarman, 1990)
Kacang hijau merupakan salah satu tanaman Leguminosae yang cukup
penting karena kacang ini banyak mengandung protein, vitamin, dan mineral. Setiap
100 gram biji kacang hijau mengandung 150-400 IU (International Unit) vitamin A,
dan beberapa jenis vitamin lainnya. Bila biji kacang hijau dikecambahkan, maka
kecambah yang tumbuh menjadi kaya akan vitamin E (Soeprapto, 1998). Nilai gizi
kacang hijau dan taoge dapat dilihat pada Tabel 4.
Kadar vitamin kacang hijau tergantung pada bentuk olahannya. Dalam bentuk
bersisa bila dalam bentuk tepung. Hal ini disebabkan karena vitamin yang
terkandung mudah larut dalam air, terutama vitamin B1 sehingga vitamin banyak
yang terbawa bersama air (Soeprapto, 1998).
Tabel 4. Kandungan Gizi Biji dan Kecambah Kacang Hijau per 100 Gram (Soeprapto, 1998)
Komposisi Satuan Biji Kecambah (Taoge)
Kalori Kkal 345,0 23,0
Salah satu pemanfaatan kacang hijau dalam industri pangan di Indonesia
yang porsinya cukup besar adalah sebagai bahan baku pabrik tepung hunkwee.
Tepung hunkwee adalah pati kacang hijau yang diekstrak dengan air. Kandungan
utama tepung hunkwee adalah karbohidrat (83,5%), sedangkan protein 4,5%.
Komposisi kimia tepung hunkwee disajikan pada Tabel 5 (Direktorat Gizi,
Departemen Kesehatan RI, 1979).
Tabel 5. Komposisi Tepung Hunkwee (100 gram)
Komposisi Satuan Nilai
Kalori Kal 364,0
Protein gr 4,5
Lemak gr 1,0
Karbohidrat gr 83,5
Kalsium mg 50,0
Dari kacang hijau dapat diperoleh 15,20% tepung hunkwee. Proses
pembuatan tepung hunkwee secara tradisional adalah dengan cara menggiling pecah
biji kacang hijau menjadi dua bagian. Bagian pertama berupa kulit luar dan bagian
kedua berupa kulit halus dan dedak. Bagian kulit halus dan dedak kemudian
direndam selama 3-4 jam dan dicuci dengan air. Kulit halus dan dedak digiling
dalam kondisi basah, kemudian dilakukan penyaringan untuk mendapatkan larutan
patinya. Larutan pati diendapkan, dicuci, dan diendapkan kembali selama 3 jam
sebanyak 3 kali. Endapan berupa tepung halus digiling dan dikeringkan selama 1-2
hari, kemudian ditambah dengan vanili dan zat pewarna (Departemen Pertanian,
Balai Informasi Pertanian Daerah Istimewa Aceh, 1987).
2.7. Pengeringan Beku (Freeze Drying)
Pengeringan secara umum bertujuan untuk menghilangkan air atau hilangnya
pelarut organik. Hilangnya air menjamin stabilitas dan pengawetan yang efektif
(Voight, 1994). Dengan pengeringan beku produk akhir diharapkan memiliki
karakteristik tidak keriput (bentuk tetap), bau, warna, dan cita rasa tidak berubah
serta proses rehidrasi lebih cepat.
Proses pengeringan pada pengeringan beku berlangsung pada saat bahan
dalam kondisi beku, sehingga proses yang terjadi adalah sublimasi. Proses sublimasi
terjadi pada suhu dan tekanan rendah, di bawah titik triple air. Mula-mula bahan
dalam keadaan beku dimasukkan ke dalam ruang pengering yang hampa udara,
panas sublimasi akan diberikan dengan menempatkan lempeng pemanas di dalam
ruang pengering, dan panas akan diradiasikan dari lempeng pemanas ke permukaan
(Rachdiani, 2001).
Menurut Liapis dan Bruttini (1995) proses pengeringan beku berlangsung
dalam tiga tahap, yaitu a) tahap pembekuan, dimana seluruh bahan didinginkan
hingga menjadi beku; b) tahap pengeringan primer, dimana air dan pelarut
dikeluarkan dalam keadaan beku secara sublimasi; c) tahap pengeringan sekunder,
mencakup pengeluaran uap air terikat yang ada di lapisan kering. Tahap pengeringan
sekunder dimulai setelah tahap pengeringan primer berakhir.
Menurut Desrosier (1988) bahan pangan dengan kandungan air yang tinggi
pembekuan, suhu bahan tersebut relatif tetap sampai sebagian besar dari bahan
pangan tersebut membeku, dan setelah beberapa waktu, suhu akan mendekati
medium pembeku. Pembekuan cepat didefinisikan sebagai proses di mana suhu
bahan pangan tersebut melampaui zona pembekuan kristal maksimum dalam waktu
kurang dari 30 menit.
Menurut teori kerusakan kristal, pertumbuhan kristal es pada umumnya
merusakkan kualitas bahan pangan. Pembekuan lambat memberi kesempatan
pertumbuhan kristal es yang besar. Sel-sel daging unggas, ikan, kerang,
buah-buahan, dan sayuran semuanya mengandung protoplasma yang menyerupai selai.
Maka untuk membuat massa yang tetap menyerupai selai, besarnya kecepatan
pembekuan harus sedemikian rupa sehingga terbentuk kristal kecil yang seragam ke
seluruh jaringan. Jaringan yang dibekukan dengan cepat jika dicairkan kembali maka
air akan diserap kembali ke dalam jaringan ketika kristal-kristal es tersebut mencair,
sedangkan pada pembekuan lambat atau kondisi suhu pembekuan yang berfluktuasi
akan terbentuk kristal es yang besar sehingga sel-sel menjadi rusak dan jaringan yang
dicairkan tidak dapat kembali seperti pada keadaan awal selai. Sebagian cairan yang
dihasilkan dari pencairan tidak dapat diserap kembali dan nampak seperti air bebas
(Desrosier, 1988).
Untuk merubah fase es pada bahan menjadi fase uap diperlukan panas sebesar
panas laten sublimasi, yaitu sebesar 666 kalori/gram es. Panas ini dapat diperoleh
dari suhu lingkungan atau dari sumber panas yang ada di luar bahan. Secara
komersial, panas untuk sublimasi pengeringan beku diperoleh dengan menempatkan
lempeng pemanas di dalam ruang pengering dan uap air yang terbentuk ditarik
dengan pompa vakum yang dilengkapi dengan kondensor untuk menangkap uap air
proses sublimasi (Harper et al., 1962).
Pergerakan fraksi air selama proses pengeringan beku akan semakin
menurun. Pada tahap awal pergerakan fraksi air menurun dengan tajam dan
menjelang akhir proses pengeringan gradien pergerakan fraksi air mulai melandai.
Melandainya gradien pergerakan fraksi air, menunjukkan semakin sedikitnya
kandungan air dalam bahan yang harus diuapkan sehingga tidak terjadi lagi
Gambar 3. Diagram Fase Air (Karel, 1975 dalam Wenur, 1997).
Selama proses pengeringan beku, kandungan air bahan tidak dalam fase cair
sehingga dapat mencegah terjadinya perpindahan zat-zat yang larut dalam air dan
memperkecil terjadinya reaksi degradasi (King, 1971). Keunggulan lain proses
pengeringan beku dibandingkan dengan pengeringan konvensional dapat dilihat pada
Tabel 6.
Tabel 6. Perbedaan Metode dan Mutu Produk antara Pengeringan Beku dan Pengeringan konvensional (Tischer dan Brockman dalam Desrosier, 1988)
Variabel Pengeringan Konvensional Pengeringan Beku Suhu proses
III. METODE PENELITIAN 3.1. Waktu Penelitian
Penelitian dilakukan pada Bulan April sampai September 2007 di
Laboratorium Pengolahan Balai Besar Pengembangan dan Pengendalian Hasil
Perikanan, Jakarta. Analisis laboratorium dilakukan di Laboratorium Kimia,
Laboratorium Mikrobiologi, Laboratorium Organoleptik Balai Besar Pengembangan
dan Pengendalian Hasil Perikanan, Jakarta, Laboratorium Pascapanen Pertanian,
Bogor, Laboratorium Pusat Antar Universitas, IPB, Bogor, dan Laboratorium
Anatomi, Fakultas Kedokteran Hewan, IPB, Bogor.
3.2. Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah rumput laut kering jenis
Euchema cotonii, tepung beras, tepung hunkwee, air, daun suji (Pleomele angustifolia), dan bahan-bahan kimia yang diperlukan untuk analisis di laboratorium. Alat yang digunakan yaitu cetakan cendol, saringan, freeze dryer skala
laboratorium Merk Labconco Freeze Dry system, mikroskop, kamera digital Merk
Canon, blender, mixer, jangka sorong, wadah, peralatan gelas, serta peralatan
laboratorium untuk pengujian kimia dan organoleptik sesuai dengan parameter yang
sudah ditentukan.
3.3. Metode Penelitian
Penelitian ini melalui beberapa tahapan yang sistematis, yaitu pembuatan
bubur rumput laut termasuk didalamnya proses perendaman rumput laut yang
bertujuan untuk menghilangkan bau amisnya, formulasi cendol rumput laut,
pengeringan beku (freeze drying), uji organoleptik (uji kesukaan dan perbandingan
pasangan), dan analisis ekonomi cendol rumput laut instant. Alur pembuatan cendol
instan dapat dilihat pada Gambar 5 dan alur penelitian dapat dilihat pada Gambar 6.
a. Pembuatan bubur rumput laut Euchema cotonii
Sebelum rumput laut Euchema cotonii dibuat bubur, rumput laut tersebut
lebih dahulu dilakukan perendaman untuk menghilangkan bau amisnya.
Penghilangan bau amis pada rumput laut segar dapat dilakukan dengan merendam
rumput laut selama empat hari dengan perbandingan air dan rumput laut 1 : 0.5, air
perendam diganti setiap 24 jam (Astawan et al., 2004). Sedangkan untuk rumput laut
kering, penghilangan bau amis dapat dilakukan dengan perendaman dalam air tawar
selama 9 jam (Chaidir, 2007). Selain untuk menghilangkan bau amis, perendaman
juga bertujuan untuk mendapatkan rumput laut dengan kenampakan (warna) putih
dan tekstur yang tidak lembek.
Rumput laut yang telah direndam selanjutnya dipotong-potong sehingga
menghasilkan ukuran yang lebih kecil. Pemotongan rumput laut bertujuan untuk
memudahkan dalam proses peghancuran (diblender) dan proses blender menjadi
lebih singkat. Rumput laut tersebut diblender selama 3 menit.
Bubur rumput laut yang telah dibuat selanjutnya dilakukan analisis proksimat
(kadar air, abu, protein, dan karbohidrat), kadar serat pangan (serat pangan larut,
serat pangan tidak larut, dan serat pangan total), dan Iodium. Diagram alir pembuatan
bubur rumput laut dapat dilihat pada Gambar 7.
b. Formulasi Cendol Rumput Laut
Formulasi cendol rumput laut bertujuan untuk mendapatkan komposisi
cendol yang paling baik. Cendol rumput laut dibuat dengan menambahkan bubur
rumput laut ke dalam adonan formula resep, dengan konsentrasi 0% (formula A),
10% (formula B), 20% (formula C), 30% (formula D), 40% (formula E), dan 50%
gram dan jumlah rumput laut yang akan ditambahkan adalah 20% maka bubur
rumput laut yang akan ditambahkan adalah 20 gram dalam 100 gram bahan adonan.
Bahan pewarna dalam cendol penelitian ini digunakan pewarna alami, yaitu
daun suji (Pleomele angustifolia). Larutan daun suji dibuat dengan cara
mencampurkan air ke dalam daun suji yang telah diblender dengan perbandingan
daun suji dan air 1:5 (Anggraeni, 2002). Misalkan daun suji yang digunakan adalah
100 gram, maka air yang ditambahkan adalah 500 ml. Daun suji dan air tersebut
diblender selama 3 menit, dan disaring. Hasil saringan tersebut siap digunakan
sebagai bahan pewarna cendol rumput laut.
c. Pengeringan Beku Cendol Rumput Laut
Cendol rumput laut dari formula terpilih selanjutnya dilakukan pengeringan.
Pengeringan secara umum bertujuan untuk menghilangkan air atau hilangnya pelarut
organik. Hilangnya air menjamin stabilitas dan pengawetan yang efektif (Voight,
1994). Dengan pengeringan beku produk akhir diharapkan memiliki karakteristik
tidak keriput (bentuk tetap), bau, warna, dan cita rasa tidak berubah serta proses
rehidrasi lebih cepat.
Proses pengeringan pada pengeringan beku berlangsung pada saat bahan
dalam kondisi beku, sehingga proses yang terjadi adalah sublimasi. Proses sublimasi
terjadi pada suhu dan tekanan rendah, di bawah titik triple air. Mula-mula bahan
dalam keadaan beku dimasukkan ke dalam ruang pengering yang hampa udara,
panas sublimasi akan diberikan dengan menempatkan lempeng pemanas di dalam
ruang pengering, dan panas akan diradiasikan dari lempeng pemanas ke permukaan
(Rachdiani, 2001).
Menurut Liapis dan Bruttini (1995) proses pengeringan beku berlangsung
dalam tiga tahap, yaitu a) tahap pembekuan, dimana seluruh bahan didinginkan
hingga menjadi beku; b) tahap pengeringan primer, dimana air dan pelarut
dikeluarkan dalam keadaan beku secara sublimasi; c) tahap pengeringan sekunder,
mencakup pengeluaran uap air terikat yang ada di lapisan kering. Tahap pengeringan
Tahap pengeringan beku cendol rumput laut dapat dibagi menjadi dua proses
utama yaitu pembekuan dan pengeringan. Prosedur yang dilakukan pada proses
pembekuan adalah ;
a. Cendol rumput laut yang telah terpilih dimasukkan ke dalam wadah contoh.
b. Cendol rumput laut dan wadah contoh dibekukan pada plat pembeku yang
terdapat pada alat pengering beku pada suhu -30 0C selama 8 jam.
c. Proses pembekuan dihentikan sampai suhu bahan hampir seragam.
Prosedur pengeringan dalam pengeringan beku yaitu ;
a. Cendol rumput laut yang telah beku selanjutnya dikeringkan menggunakan
freeze drier padasuhu 30 0C dengan lama pengeringan 36 jam.
b. Proses pengeringan dihentikan setelah kekeringan akhir bahan hampir
seragam.
3.4. Analisis Data
Penelitian uji penambahan rumput laut dan uji pengeringan beku dilakukan
dengan menggunakan Rancangan Acak Lengkap (RAL). Faktor yang berpengaruh
pada formulasi cendol rumput laut adalah komposisi (persentase) rumput laut yang
ditambahkan pada bahan cendol (0, 10, 20, 30, 40, dan 50%). Data yang didapat
selanjutnya dianalisis dengan analisis sidik ragam (ANOVA) untuk mengetahui
pengaruh dari perlakuan. Bila ada perbedaan dilanjutkan dengan uji Less Significant
Difference (LSD). Model yang digunakan adalah :
Yij = µ + αi + εij
Dimana :
Yij : Nilai pengamatan dari perlakuan ke-i, pada ulangan ke-j
µ : Nilai rata-rata tengah umum
αi : Pengaruh perlakuan ke-i
Gambar 5. Alur Pembuatan Cendol Rumput Laut Instant.
Air daun suji (Pleomele angustifolia)
Penambahan bubur rumput laut (0,10,20,30,40,50% dari formula resep)
Campuran tepung hunkwee, tepung beras, dan rumput laut dimasak ke
dalam air mendidih
Air dimasak hingga mendidih
Pengadukan
Pengeringan beku
Cendol instant Pencetakan
Penirisan
Tepung hunkwee & tepung beras (Rasio 2:1)
Penimbangan
Gambar 6. Diagram Alir Penelitian.
Pencampuran hingga merata
Penambahan bubur rumput laut (0, 10, 20, 30, 40, dan 50% dari tawar selama 9 jam
Analisis :
Gambar 7. Alur Penghilangan Bau Amis dan Pembuatan Bubur Rumput Laut.
3.5. Analisis Daya Serap Air (DSA) (Rasper dan J.M de Man, 1980)
Sebanyak 10 gram cendol direndam dalam air 100 ml. Setelah mencapai
waktu optimum (seluruh bagian cendol sudah mengembang), cendol ditiriskan
selama 5 menit. Cendol kemudian ditimbang dan dikeringkan pada suhu 105 0C
sampai bobotnya konstan kemudian ditimbang kembali.
DSA = 100%
A = Berat cendol setelah direhidrasi
B = Berat cendol awal sebelum direhidrasi Euchema cotonii kering
Pencucian dengan air mengalir
Penirisan
Perendaman dalam air tawar selama 9 jam
Pemotongan dengan panjang 2 cm
Penghalusan selama 3 menit
3.6. Sifat Kimia Cendol Rumput Laut Euchema cotonii a. Kadar air (Apriyantono et al., 1989)
Kadar air diukur dengan metode oven. Sebanyak 5 gram contoh dikeringkan
dalam oven pada suhu 105 0C selama 16-24 jam sehingga diperoleh bobot yang
konstan.
B = bobot wadah setelah dikeringkan (gr)
C = bobot bahan
b. Kadar abu (Apriyantono et al., 1989) Cara penentuan kadar abu yaitu ;
- cawan pengabuan dibakar dalam tanur
- didinginkan dalam desikator dan ditimbang beratnya
- sampel ditimbang 3-5 gram dalam cawan
- sampel pangabuan didinginkan dan ditimbang
Kadar abu (%) = 100%
c. Kadar lemak (Apriyantono et al., 1989)
Penentuan kadar lemak dengan metode soxhlet. Labu lemak dikeringkan
dalam oven, didinginkan dalam desikator. Sejumlah kecil (3-5 gram) sampel
dibungkus dengan kertas saring dan diletakkan dalam alat ekstraksi soxhlet,
kemudian kondensor diletakkan diatasnya dan labu lemak di bawahnya. Setelah
pelarut dietil eter atau petroluem eter dituangkan dalam labu lemak, maka dilakukan
refluks selama minimal 5 jam sampai pelarut yang turun ke labuh lemak kembali
berwarna jernih. Selanjutnya labu lemak yang berisi lemak hasil ekstraksi dipisahkan
dalam dalam oven pada suhu 105 0C. Setelah dikeringkan sampai berat konstan dan
Kadar lemak (%) = 100%
d. Kadar protein (Apriyantono et al., 1989)
Analisis kadar protein pada penelitian ini menggunakan metode
mikrokjeldahl. Prinsip kerjanya adalah sejumlah sampel ditimbang, lalu dimasukkan
ke dalam tabung kjeldahl 30 ml. Kedalammnya ditambahakan 1,9 gram K2SO4, 40
mg HgO dan 20 ml H2SO4. Jika sampel lebih dari 15 mg kemudian di tambahkan 0,1
ml H2SO4 untuk setip 10 mg bahan organik. Selanjutnya sampel di didihkan selama
1-1,5 jam sampai cairan jernih dan di dinginkan.
Isi labu kjeldahl di pindah kan dalam alat destilasi.labu di cuci dan dibilas 1-5
kali dengan 1-2 ml air.Air cucian di masukan dalam alat destilasi kemudian di
tambahkan 8-10 ml larutan NaOH-Na2S2O3. Erlemeyer 125 ml yang berisi 5 ml
H3BO3 dan 2-4 tetes indikator di letakan di bawah kondensor. Ujung tabung
kodensor harus terendam di bawah larutan H3BO3.setelah itu di lakukan destasi
sampai di peroleh kira kira 15 ml destilasi dalam erlenmeyer.
Tabung kondensor dibilas air dan bilasanya di tampung dalam erlenmeyer
yang sama. Isi erlenmeyer di encerkan sampai 50 ml kemudian dititrasi dengan HCI
0,02 N sampai terjadi perubahan warna menjadi abu-abu. Hal ini di lakukan terhadap
blanko.
A : Volume (ml) HCl untuk mentitirasi larutan dalam contoh
B : Volume (ml) HCl larutan blanko
N : Normalitas HCl standar yang digunakan
14,007 : Berat atom Nitrogen
e. Kadar karbohidrat (by different)
Kadar karbohidrat dihitung setelah nilai kadar protein, kadar lemak, kadar
abu, dan kadar air diperoleh. Kadar karbohidrat dihitung dengan menggunakan
rumus sebagai berikut :
Kadar karbohidrat (%) = 100% - (kadar air + kadar protein + kadar lemak + kadarabu)
f. Kadar serat pangan (Asp et al., 1983)
Contoh kering homogen diekstraksi lemaknya dengan petroleum eter selama
15 menit pada suhu kamar. Kemudian diambil 1 gram dan dimasukkan ke dalam labu
erlenmeyer dan ditambahkan 25 ml 0,1 M buffer Natrium fosfat pH 6,0 dan
dicampur secara merata. Setelah itu ditambahkan 0,1 ml alfa amilase (termamyl 120
L) dan labu ditutup dengan aluminium foil, kemudian diinkubasi selama 15 menit
dalam penangas air panas bergoyang pada suhu 80 0C. Selanjutnya didinginkan lalu
ditambahkan 20 ml air destilata, pH diatur menjadi 1,5 dengan HCl 0,1 N dan
elektroda dibersihkan dengan air. Kemudian ditambahakan pepsin 0,1 gram, ditutup
dengan aluminium foil dan diinkubasi dalam penangas air bergoyang pada suhu 40
0C selama 1 jam. lalu ditambahkan 20 ml air destilata dan pH diatur menjadi 6,8
dengan NaOH, elektroda dibersihkan dengan 5 ml air. Selanjutnya ditambahkan 0,1
gram pankreatin, kemudian labu ditutup dengan alumunium foil dan didinkubasi
dalam penangas air bergoyang pada suhu 40 0C selama 1 jam, pH diatur menjadi 4,5
dengan HCl 0,1 N. Kemudian disaring dengan crucible, dicuci dengan 2 x 10 ml air
destilata.
Serat pangan tidak larut (Residu / insoluble dietary fiber)
Residu dalam crucible dicuci dengan 2 x 10 ml etanol 90% dan 2 x 10 ml
aseton. Crucible dikeringkan pada suhu 105 0C sampai bobot tetap dan ditimbang
setelah didinginkan dalam desikator (D1). Kemudian diabukan pada suhu 550 0C
selama kurang lebih 5 jam, serta ditimbang setelah pendinginan dalam desikator (I1).
Serat pangan larut (Filtrat/soluble dietary fiber)
Volume filtrat diatur dan dicuci dengan air sampai 100 ml kemudian
60 menit. Lalu disaring dengan crucible kering (porositas 2) yang menngandung 0,5
gram celite, selanjutnya dicuci berturut dengan 2 x 10 ml etanol 78%, 2 x 10 ml
aseton. Setelah itu filter gelas dikeringkan dalam oven suhu 105 0C sampai beratnya
konstan dan ditimbang setelah didinginkan dalam desikator (D2), dan diabukan pada
suhu 550 0C selama kurang lebih 5 jam serta ditimbang setelah pendinginan dalam
desikator (I2).
Dilakukan juga perhitungan serat blanko dengan mengunakan prosedur
seperti di atas, tetapi tidak digunakan sampel. Nilai blanko ini harus diperiksa secara
berkala dan bila enzim yang digunakan berasal dari batch baru.
Perhitungan :
D = berat setelah peneringan (gram)
I = berat setelah pengabuan (gram)
B = blanko bebas serat (gram)
g. Kadar Iodium
Salah satu cara penetapan kuantitatif untuk menetapkan kadar iodium dalam
bahan makanan adalah berdasarkan reduksi katalis ion Ce4+ (kuning) menjadi Ce3+
(tidak berwarna). Metode ini terdiri dari 4 bagian, yaitu pembuatan larutan pereaksi,
pembuatan kurva standar, persiapan contoh, dan perhitungan kadar iodium.
Pembuatan larutan pereaksi
1. Asam arsenit 0,02 N : sebanyak 0,986 gram arsen trioksida (As2O3)
dilarutkan dalam 10 ml NaOH 0,5 N dalam sebuah gelas piala dan dipanaskan.
Selanjutnya dimasukkan secara kuantitatif ke dalam labu takar 1 liter,
diencerkan dengan 850 air suling dan ditambahkan 20 ml asam klorida pekat
dan 20,6 ml asam sulfat pekat, kemudian ditepatkan dengan air suling
2. seri ammonium sulfat 0,03 N : 48,6 ml asam sulfat pekat ditambahkan ke
dalam air suling dalam labu takar 1 liter. Kemudian tambahkan 20 gram seri
ammonium sulfat dan dilarutkan, volume ditepatkan hingga 1 liter.
3. larutan pengabuan : sebanyak 212 gram natrium karbonat anhydrous dan 20
gram kalium hipoklorida dilarutkan dalam 1 liter air suling.
4. larutan standar indul iodium 4 µg/ml dibuat dengan melarutkan standar kalium
iodide ke dlam air suling
5. standar kerja ioduim : larutan standar iodium dipipet ke dalam tabung takar
100 ml masing-masing 1, 2, 3, dan 4 ml dan ditepatkan hingga tanda garis.
Larutan ini mengandung 0,04; 0,08; 0,12; dan 0,16 µg iodium/ml.
Pembuatan kurva standar
Sebanyak 5 ml masing-masing larutan standar kerja iodium 0; 0,04; 0,08;
0,12; dan 0,16 µg iodium/ml dipipet ke dalam tabung pereaksi atau kuvet dan
direndam dalam penangas air bersuhu 37 0C. Setelah suhu 37 0C tercapai,
ditambahkan dengan 0,1 ml larutan seri ammonium sulfat ke dalam tabung. Setelah
20 menit, reduksi seri ammonium kepada sero diukur dengan spektrofotometer
dengan panjang gelombang 420 nm. Dilakukan juga blanko tanpa sampel atau
standar. Selanjutnya dibuat kurva hubungan konsentrasi (µg iodium/ml) versus
serapan masing-masing larutan standar.
Persiapan contoh
Sebanyak 5 gram contoh (mengandung 0,04-0,08 µg iodium) ditimbang ke
dalam tabung pyrex 22 x 220 mm (15 x 125 mm) dan ditambahkan larutan pembantu
pengabuan 0,5 ml. Kemudian campuran tersbut dikeringkan dalam oven pada suhu
105-110 0C selama ± 2 jam. Selanjutnya tabung dipindahkan ke dalam tanur lalu
suhu dinaikkan perlahan-lahan dan contoh diabukan pada suhu 500 0C selama 4 – 6
jam. Tabung didinginkan, kemudian abu dikestrak dengan menambahkan 10 ml
larutan asam arsenit dan didiamkan selama ± 15 menit. Campuran diputarkan pada
200 rpm selama 20 menit dan sebanyak 5 ml supernatan dipipet ke dalam tabung
reaksi atau kuvet dan direndam dalam penangas air bersuhu 37 0C. Setelah suhu 37
0
tabung tepat setelah 20 menit, reduksi seri kepada sero diukur dengan
spektrofotometer pada panjang gelombang 420 nm.
Perhitungan :
Iodium (µg/100 gram) =
B x V x
C 100
Keterangan :
C = konsentrasi larutan sampel yang terbaca dari kurva standar
(µg iodium/ml).
V = volume ekstrak sampel dalam ml (10 ml)
B = berat sampel (gram)
3.7. Total Mikroba (Fardiaz, 1989)
Sebanyak 10 g sampel dimasukkan ke dalam plastik tahan panas yang telah
disterilkan yang berisi 90 ml larutan pengencer steril. Sampel tersebut kemudian
dihancurkan dengan menggunakan alat stomacher selama 60 detik, dan dihasilkan
sampel dengan pengenceran 1:10. Campuran dikocok, diambil 1 ml kemudian
dimasukkan ke dalam tabung reaksi 9 ml larutan pengencer steril (10-2). Dengan cara
yang sama diperoleh pengenceran 10-3,10-4, dan seterusnya.
Dari tiap-tiap pengenceran, dipipet secara aseptis 1 ml suspensi sampel dan
dimasukkan ke dalam cawan petri steril. Selanjutnya ditambahkan 15-20 ml medium
PCA steril pada suhu 47-50oC (duplo). Setelah medium membeku, cawan petri
diinkubasi dengan posisi terbalik pada inkubator suhu 37oC selama 2-3 hari.
Perhitungan total mikroba menggunakan metode Standar Plate Count (SPC), dengan
rumus;
Faktor pengenceran = pengenceran awal x pengenceran selanjutnya x Σ yang ditumbuhkan
Koloni per ml/gr = Σ koloni x
n pengencera faktor
3.8. Uji Organoleptik
Uji organoleptik dilakukan terhadap cendol rumput laut yang masih basah
(belum dilakukan proses pengeringan beku) dan cendol kering yang telah direhidrasi.
Untuk cendol yang basah dilakukan uji kesukaan (hedonik), sedangkan untuk cendol
kering dilakukan uji perbandingan berpasangan dengan produk cendol komersial.
a. Uji kesukaan (hedonik)
Uji kesukaan (hedonik) meliputi parameter warna, aroma, rasa, dan tekstur.
Uji kesukaan dilakukan oleh 20 orang panelis dengan menggunakan score sheet
dengan skala 1-9 yang mendeskripsikan sampel cendol yang diujikan. Dalam uji ini,
cendol yang disajikan dalam bentuk segar dan tidak dicampur dengan larutan gula
kelapa dan larutan santan kelapa. Uji hedonik menggunakan angka 9 untuk nilai
tertinggi (amat sangat suka) dan angka 1 untuk nilai terendah (amat sangat tidak
suka). Kriteria penilaian uji kesukaan seperti pada Tabel 7 dan score sheet kriteria uji
kesukaan dapat dilihat pada Lampiran 1.
Tabel 7. Kriteria Uji Kesukaan
Skala hedonik Nilai
Sangat suka 9
Suka 7
Agak suka 6
Netral 5
Agak tidak suka 4
Tidak suka 3
Sangat tidak suka 1
b. Uji perbandingan pasangan (Rahayu, 2001)
Formula terpilih selanjutnya dilakukan uji perbandingan pasangan dengan
produk komersial. Pada uji perbandingan pasangan, cendol yang diuji disajikan
dalam kondisi siap saji sebagaimana cendol komersil disajikan, yaitu dengan
penambahan larutan gula kelapa 40 ml dan larutan santan kelapa 30 ml. Menurut
Anggraeni (2002), dalam pembuatan larutan gula kelapa, perbandingan antara gula
kelapa dan air yang paling baik adalah 1 : 2,5, sedangkan untuk larutan santan
kelapa perbandingan yang paling baik antara santan kelapa dan air adalah 2 : 5.
Panelis melakukan penilaian berdasarkan formulir isian (Lampiran 2) dengan
Angka 3 untuk penilaian sangat lebih baik, sedangkan angka -3 untuk penilaian
sangat lebih buruk. Kriteria uji perbandingan berpasangan seperti pada Tabel 8.
Tabel 8. Kriteria Uji Perbandingan Pasangan
Skala perbandingan Nilai
Sangat lebih baik 3
Lebih baik 2
Agak lebih baik 1
Tidak berbeda 0
Agak lebih buruk -1
Lebih buruk -2
Sangat lebih buruk -3
3.9. Analisis Ekonomi
Analisis ekonomi dilakukan untuk menilai kelayakan suatu usaha
berdasarkan biaya-biaya yang dikkeluarkan selama proses produksi dengan jangka
waktu tertentu. Dalam penelitian ini, penilaian kelayakan dititik beratkan pada
kelayakan usaha cendol instan yang dikeringkan dengan mesin pengering beku
(Freeze dryer) yang notabene menggunakan energi yang tinggi terutama energi listrik
dalam prosesnya.
Hal pertama yang harus dilakukan dalam analisis kelayakan usaha cendol
instan ini adalah menggolongkan biaya-biaya yang dikeluarkan selama proses
produksi. Berdasarkana perilakunya terhadap perubahan volume produksi, biaya
dalam usaha cendol instan dapat digolongkan menjadi biaya tetap (fixed cost) dan
biaya variabel (variable cost) (Garrison, 1997). Biaya tetap adalah jenis-jenis biaya
yang selama periode kerja pengoperasian usaha tetap dan tidak tergantung pada
jumlah produk yang dihasilkan, sedangkan biaya variabel adalah biaya yang berubah
sesuai dengan pertambahan jumlah produksi.
a. Keuntungan usaha (profit)
Keuntungan usaha digunakan untuk melihat keuntungan dari suatu usaha
berdasarkan perhitungan finansial. Perhitungan besarnya keuntungan diperoleh
dengan persamaan :
Dimana : TR = Total Revenue (Penerimaan total) TC = Total Cost (Biaya total)
Kriteria : TR > TC = usaha menguntungkan TR < TC = usaha rugi
TR = TC = impas
b. Benefit/cost ratio (B/C Ratio)
Analisis ini digunakan untuk mengetahui sejauh mana hasil yang diperoleh
dari usaha tertentu cukup menguntungkan dengan membandingkan antara
penerimaan dengan biaya. Perhitungan B/C Ratio dihitung dengan persamaan :
B/C = Cj Pj
Dimana : Pj = NPV dari aliran uang tunai proyek mulai pada periode t=0 Cj = NPV dari biaya yang dikeluarkan mulai pada periode t= 1 Kriteria : B/C > 1 = usaha menguntungkan
B/C < 1 = usaha rugi B/C = 1 = usaha impas
c. Net Present Value (NPV)
NPV adalah selisih harga sekarang antara penerimaan dan pengeluaran pada
tingkat suku bunga tertentu. NPV merupakan salah satu metode menghitung selisih
nilai sekarang investasi dengan penerimaan kas di masa yang akan datang. NPV
dirumuskan dalam persamaan berikut :
NPV =
∑
NPV < 0 = usaha tidak layak dilaksanakand. Internal Rate of Return (IRR)
Usaha cendol instan layak dilaksanakan jika dioperasikan pada tingkat suku
tingkat suku bunga yang berlaku. Untuk mendapatkan nilai IRRdirumuskan dengan NPV’’ = NPV dari ulangan ii’ yang bernilai negatif
i’ = tingkat suku bunga yang memberikan NPV positif i’’ = tingkat suku bunga yang memberikan NPV negatif
e. Break even Point (BEP)
Break even point atau titik impas merupakan titik dimana usaha yang
dijalankan tidak memperoleh keuntungan maupun kerugian. Titik impas bisa dalam
satuan jumlah produk atau dalam jumlah nilai penjualan. Titik impas dirumuskan
dengan persamaan (Riyanto, 1996) :
BEP (Q) =
Pay back periode atau waktu pengembalian investasi adalah waktu yang
dibutuhkan untuk mengembalikan seluruh investasi selama periode operasi.
Pengembalian investasi dilakukan dengan pembayaran laba bersih ditambah dengan
penyusutan (Madani, 2002). PBP dirumuskan sebagai berikut :
IV. HASIL DAN PEMBAHASAN
4.1. Pembuatan Bubur Rumput Laut
Bahan baku yang digunakan dalam penelitian ini adalah rumput laut kering
tawar jenis Euchema cotonii yang diperoleh dari petani rumput laut di Kepulauan
Seribu. Rumput laut ini sebelumnya sudah mengalami perlakuan sehingga didapat
rumput laut Euchema cotonii kering tawar dengan warna kuning pucat. Rumput laut
ini mendapat perlakuan khusus setelah dipanen, yaitu direndam dalam air tawar
selama 2-3 hari dalam bak tertutup atau air mengalir. Rumput laut dijemur di bawah
sinar matahari selama 2-3 hari hingga kering. Rumput laut kering memiliki
karakteristik warna kuning pucat, aroma sedikit amis, dan thallus agak keras.
Rumput laut Euchema cotonii kering dapat dilihat pada Gambar 8.
Gambar 8. Rumput Laut Euchema cotonii Kering.
Bubur rumput laut (BRL) merupakan hasil olahan dari rumput laut yang telah
dihaluskan secara mekanis dengan menggunakan mesin penghalus blender sehingga
memudahkan dalam proses pembuatan adonan cendol rumput laut. Bubur rumput
laut memiliki beberapa keunggulan antara lain volume lebih kecil sehingga tidak
membutuhkan ruang yang luas dan lebih efektif aplikasinya dalam pembuatan
adonan karena ukurannya yang sudah halus dan tidak memerlukan biaya tinggi untuk
pembuatannya. Selain itu, proses pembuatan bubur yang tidak menggunakan suhu
tinggi diharapkan dapat mempertahankan kandungan gizinya terutama iodium yang
sensitif terhadap panas. Berbeda dengan pembuatan tepung rumput laut yang
berpotensi mengalami penurunan nilai gizi rumput laut tersebut sebagai akibat dari