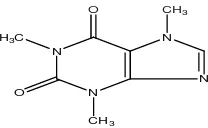
i
PENETAPAN KADAR TEOBROMIN DAN KAFEIN DALAM EKSTRAK SERBUK COKELAT MERK “X” MENGGUNAKAN METODE KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Oleh: Melisa Darmawan NIM : 088114162
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2012
iv
HALAMAN PERSEMBAHAN
Kupersembahkan karyaku ini untuk:
Tuhan Yesus Kristus yang sangat luar biasa
Kedua orang tuaku tersayang
Kakak-kakakku tercinta
Sahabat dan teman-temanku
vii
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas segala limpahan berkat dan kasih-Nya sehingga penelitian dan penyusunan skripsi yang berjudul “Penetapan Kadar Teobromin dan Kafein dalam Ekstrak Serbuk Cokelat Merk “X” Menggunakan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik” dapat diselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk meraih gelar Sarjana Farmasi (S. Farm) di Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Dalam pelaksanaan penelitian hingga selesainya penyusunan skripsi ini, penulis mendapat banyak dukungan dan bantuan dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Ipang Djunarko, M. Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Prof. Dr. Sudibyo Martono, M. S., Apt. selaku dosen pembimbing yang dengan sabar memberikan pengarahan, masukan, kritik dan saran baik selama penelitian maupun penyusunan skripsi ini.
3. Jeffry Julianus, M. Si. selaku dosen penguji yang telah memberikan saran dan kritik yang membangun dalam penyusunan skripsi dan dosen pembimbing akademik atas bimbingan dan semangat yang telah diberikan.
viii
5. Rini Dwiastuti, M. Sc, Apt. selaku Kepala Laboratorium Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
6. Seluruh Dosen Fakultas Farmasi Universitas Sanata Dharma yang telah memberikan ilmu demi kemajuan mahasiswa dalam bidang farmasi.
7. Seluruh staf laboratorium kimia Fakultas Farmasi Universitas Sanata Dharma: Mas Bimo, Mas Parlan, Mas Kunto, Mas Otok, dan Pak Ketul yang telah banyak membantu selama penelitian di laboratorium.
8. Perpustakaan Universitas Sanata Dharma atas koleksi buku-buku dan fasilitas internet sehingga mempermudah penulis dalam memperoleh bahan-bahan yang dibutuhkan dalam penulisan skripsi ini.
9. Keluargaku tercinta, Papa Iwan Darmawan, Mama Maria Ningrum D, Mam Christiana, Tante Lian, Ci Fen2, Oh Rudy, Ci Cen2, yang tidak pernah berhenti memberikan semangat dan doa sampai terselesaikannya skripsi ini. 10.Eka Riusinta Wati dan Monica Satya R. Y, teman seperjuangan, tempat
berbagi keluh kesah dan kegembiraan selama penelitian dan penyusunan skripsi.
ix
Imoliana, dan Meiske Munda. Terima kasih untuk diskusi dan kebersamaannya selama penelitian di laboratorium.
13.Kelompok praktikum C2, Dian, Yuni, Elisa, Seco, Uchan, Satya, Vica, Asti,
dan Tika yang telah memberikan pengalaman berharga, keceriaan, kebersamaan, suka duka selama praktikum serta telah memberikan semangat dalam penyusunan dan ujian skripsi.
14.Sari Tambunan, Elya, Rika, Dina, Amel, Wiwik, There, Citra, Nona yang telah berbagi pengalaman, informasi, masukan, serta telah memberikan semangat dan dukungan secara moril.
15.Teman-teman FST A dan B atas kebersamaan, tawa, canda, cerita dan kekompakan yang begitu indah dan tak terlupakan.
16.Keluarga besar kost “Sari Ayu I”, Ibu Anti, Opung Devi, Morin, Novie, Marjan, Inang, Monik, Kak Yanti, Nina, Rotua, Yoestenia, Iness, Kak Ade, Vina, Ika Lestari, dan Jolina atas semangat yang diberikan kepada penulis dalam penyusunan dan ujian skripsi.
17.Semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu penulis dalam mewujudkan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan skripsi ini, sehingga segala kritik dan saran yang membangun sangat penulis harapkan. Semoga skripsi ini membantu dan bermanfaat bagi pembaca pada khususnya dan ilmu pengetahuan pada umumnya.
x
DAFTAR ISI
Halaman
HALAMAN JUDUL ……… i
HALAMAN PERSETUJUAN PEMBIMBING ……….……. ii
HALAMAN PENGESAHAN ……….…… iii
HALAMAN PERSEMBAHAN ……….……. iv
PERNYATAAN KEASLIAN KARYA ………. v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ….. vi
PRAKATA ………..………. vii
DAFTAR ISI ………..……….. x
DAFTAR TABEL ………..………….. xiv
DAFTAR GAMBAR ………..……….. xv
DAFTAR LAMPIRAN ………..………….. xvii
INTISARI ………..………... xviii
ABSTRACT ………..………. xix
BAB I. PENGANTAR ………..………... 1
A. Latar Belakang ………..…….. 1
1. Permasalahan ………..…….. 5
2. Keaslian Penelitian ………..……. 5
3. Manfaat Penelitian ………..….. 6
B. Tujuan Penelitian ………..…….. 6
xi
A. Cokelat (Theobroma cocoa) …...……… 8
B. Penyarian ……… 9
1. Ekstrak ……….. 10
2. Cairan Penyari ………...………... 10
3. Metode Ekstraksi secara Soxhletasi ………. 11
C. Teobromin ……….. 13
D. Kafein ………...….. 14
E. Kromatografi Cair Kinerja Tinggi ……….. 16
1. Definisi dan Instrumentasi ……… 16
2. Pembagian Jenis Kromatografi ………. 17
3. Kromatografi Partisi ………. 18
4. Pemisahan Puncak dalam Kromatografi ……...………... 23
5. Analisis Kualitatif dan Kuantitatif ……… 25
F. Keterangan Empiris ……… 26
BAB III. METODE PENELITIAN ………. 28
A. Jenis dan Rancangan Penelitian ……….. 28
B. Variabel Penelitian ………. 28
C. Definisi Operasional ………... 29
D. Bahan Penelitian ………. 29
E. Alat Penelitian ……… 30
F. Tata Cara Penelitian ………... 30
1. Pemilihan Sampel ………. 30
xii
3. Pembuatan Larutan Stok Teobromin dan Kafein ………. 31
4. Pembuatan Larutan Intermediet Teobromin dan Kafein ………….. 31
5. Pembuatan Seri Larutan Baku Campuran Teobromin dan Kafein ... 32
6. Penetapan Panjang Gelombang Maksimum Teobromin dan Kafein dengan Spektrofotometer UV ……….. 32
7. Pembuatan Kurva Baku Teobromin dan Kafein ……….. 33
8. Pembuatan Larutan NaOH 0,1 M ………. 33
9. Penetapan Jumlah Sirkulasi Ekstraksi dengan Metode Soxhletasi yang Menghasilkan Kadar Teobromin dan Kafein Maksimum …... 33
10.Preparasi Sampel ……….. 34
11.Penetapan Kadar Teobromin dan Kafein dalam Sampel dengan Penambahan Larutan Baku Campuran Teobromin dan Kafein……. 35
12.Penetapan Kadar Campuran Teobromin dan Kafein dalam Sampel. 36 G. Analisis Hasil ……….. 37
BAB IV. HASIL DAN PEMBAHASAN ……… 38
A. Pemilihan Sampel ………... 38
B. Pembuatan Fase Gerak ………... 40
C. Pembuatan Larutan Baku Teobromin dan Kafein ……….. 42
D. Penentuan Panjang Gelombang Maksimum Teobromin dan Kafein dengan Spektrofotometer UV ………. 44
xiii
Cokelat yang Menghasilkan Kadar Maksimum ………. 53
H. Analisis Kuallitatif Berdasarkan Waktu Retensi (tR) Teobromin dan Kafein ………. 57
I. Penetapan Kadar Teobromin dan Kafein dalam Sampel dengan Penambahan Larutan Baku Campuran Teobromin dan Kafein ……….. 61
J. Penetapan Kadar Teobromin dan Kafein dalam Ekstrak Serbuk Cokelat ……… 62
BAB V. KESIMPULAN DAN SARAN ………. 64
A. Kesimpulan ………. 64
B. Saran ………... 64
DAFTAR PUSTAKA ……….. 66
LAMPIRAN ………. 70
xiv
DAFTAR TABEL
Tabel I Indeks polaritas beberapa pelarut ……….. 22 Tabel II Pembuatan larutan campuran teobromin dan kafein ………. 36 Tabel III Persyaratan keseragaman bobot kemasan serbuk cokelat ………. 39 Tabel IV Kadar rata-rata teobromin pada penetapan jumlah sirkulasi
ekstraksi ………. 55
Tabel V Kadar rata-rata kafein pada penetapan jumlah sirkulasi ekstraksi. 56 Tabel VI Perhitungan kadar teobromin dan kafein dalam ekstrak serbuk
xv
DAFTAR GAMBAR
Gambar 1 Cokelat (Theobroma Cacao) ………... 8
Gambar 2 Diagram Soxhlet extractor ………... 11
Gambar 3 Struktur teobromin ………... 14
Gambar 4 Struktur kafein ………...……... 14
Gambar 5 Peralatan KCKT ………... 17
Gambar 6 Mekanisme pemisahan kromatografi partisi ………... 18
Gambar 7 Reaksi silanasi ………... 20
Gambar 8 Reaksi pembuatan kolom oktadesilsilan ………. 20
Gambar 9 Pemisahan dua senyawa ………... 24
Gambar 10 Struktur trietilamin ………... 42
Gambar 11 Interaksi trietilamin dengan residu silanol dalam kolom C18 .. 42
Gambar 12 Gugus kromofor dan auksokrom teobromin dan kafein …….. 45
Gambar 13 Spektra serapan teobromin dan kafein dalam pelarut akuabides panas (suhu 80oC) dengan λmaks = 275 nm ………. 45
Gambar 14 Kurva hubungan antara jumlah teobromin dengan respon AUC ……… 48
Gambar 15 Kurva hubungan antara jumlah kafein dengan respon AUC ... 48
xvi
teobromin (% b/b) pada penetapan jumlah sirkulasi ekstraksi. 54 Gambar 19 Kurva hubungan antara jumlah sirkulasi ekstraksi vs kadar
kafein (% b/b) pada penetapan jumlah sirkulasi ekstraksi ….. 55 Gambar 20 Kromatogram baku campuran teobromin (60 ppm) dan
kafein (30 ppm) ………... 57 Gambar 21 Kromatogram sampel ekstrak serbuk cokelat ………. 58 Gambar 22 Gugus non polar teobromin dan kafein ………... 59 Gambar 23 Interaksi teobromin dengan fase diam C18 melalui interaksi
van Der Waals ………... 59 Gambar 24 Interaksi kafein dengan fase diam C18 melalui interaksi van
Der Waals ………... 60 Gambar 25 Interaksi teobromin dengan fase gerak metanol :
akuabides/TEA 3% (40 : 60, v/v)melalui interaksi hidrogen . 60 Gambar 26 Interaksi kafein dengan fase gerak metanol : akuabides/TEA
xvii
DAFTAR LAMPIRAN
Lampiran 1 Sertifikat analisis teobromin ……….. 71 Lampiran 2 Sertifikat analisis kafein ……… 72 Lampiran 3 Penimbangan serbuk cokelat tiap kemasan untuk
perhitungan keseragaman bobot sampel serbuk cokelat……. 73 Lampiran 4 Penimbangan sampel serbuk cokelat ………. 74 Lampiran 5 Penimbangan bobot tetap ekstrak cokelat ……….. 76 Lampiran 6 Kromatogram sampel penetapan jumlah sirkulasi ekstraksi .. 78 Lampiran 7 Kromatogram sampel menggunakan 34 kali sirkulasi ……... 86 Lampiran 8 Data kadar teobromin penentuan jumlah sirkulasi ………… 90 Lampiran 9 Data kadar kafein penentuan jumlah sirkulasi ………... 92 Lampiran 10 Data kadar teobromin dan contoh perhitungan kadar
teobromin ………... 94
Lampiran 11 Data kadar kafein dan contoh perhitungan kadar kafein …... 96 Lampiran 12 Perhitungan konversi kadar teobromin dan kafein dalam
kemasan (45 gram) ……… 98
xviii
INTISARI
Teobromin dan kafein merupakan dua komponen yang terdapat dalam serbuk cokelat. Kombinasi teobromin dan kafein dalam suatu sediaan dapat meningkatkan efek farmakologis yang diberikan. Penelitian ini bertujuan untuk mengetahui jumlah sirkulasi ektraksi yang menghasilkan kadar maksimum dan menetapkan kadar teobromin dan kafein dalam ekstrak serbuk cokelat dengan menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT).
Penelitian ini merupakan penelitian eksperimental deskriptif. Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik yang digunakan adalah suatu sistem dengan kondisi optimal dan memenuhi parameter validasi. Sistem KCKT fase terbalik yang optimal menggunakan fase diam Kromasil Oktadesilsilan C-18 (100-5C18) merek KNAUER dimensi 250 mm x 4,6 mm,
ukuran partikel 5 µ m, fase gerak metanol : akuabides/TEA 3% (40 : 60, v/v),
kecepatan alir 0,8 mL/ menit dengan detektor UV pada λ maks 275 nm.
Jumlah sirkulasi ekstraksi yang memberikan kadar teobromin dan kafein yang maksimum adalah sebanyak 37 kali sirkulasi. Kadar teobromin dan kafein dalam serbuk cokelat yang diteliti, yaitu 0,11 % (b/b) dengan nilai CV = 2,10% untuk teobromin dan 0,09 % (b/b) dengan nilai CV = 1,98% untuk kafein.
xix
ABSTRACT
Theobromine and caffeine are two components in chocolate powder. The combination of theobromine and caffeine in a product can increase the pharmacologic effect. This study aims to determine the concentration maximum extraction circulation and determine theobromine and caffeine in cocoa powder extract using High Performance Liquid Chromatography (HPLC).
This study is an experimental descriptive. The reversed phase High Performance Liquid Chromatography (HPLC) which is used is a system with optimum condition and fulfill the validation parameters. The optimal conditions of HPLC system is used stationary phase chromasil octadecylsylane C-18 (100-5C-18) 5 µm merk KNAUER 250 mm x 4.6 mm, mobile phase methanol :
aquabides/TEA 3% (40 : 60, v/v), flow rate 0.8 mL/min with UV detector at wavelength 275 nm.
The extraction circulation amount which provide the maximum concentration of theobromine and caffeine is 37 circulations. The concentration of theobromine and caffeine in chocolate powder are 0.11% (w/w) with the value of CV = 2.10% for theobromine and 0.09% (w/w) with the value of CV = 1.98% for caffeine.
1
BAB I
PENGANTAR
A. Latar Belakang
Cokelat merupakan makanan yang tidak asing lagi di tengah masyarakat sekarang ini, bahkan cokelat merupakan makanan yang digemari segala usia mulai dari anak-anak sampai orang tua. Perkembangan teknologi membuat cokelat tidak hanya dinikmati dalam bentuk buah cokelat saja, namun sekarang ini cokelat dapat diolah menjadi beranekaragam bentuk makanan, diantaranya cokelat batangan, permen cokelat, biskuit cokelat, ice cream, minuman, dan serbuk cokelat (Mutiara, 2011). Serbuk cokelat merupakan salah satu bentuk cokelat yang sering digunakan sebagai campuran dalam pembuatan beranekaragam makanan, antara lain roti cokelat, pudding cokelat, dan susu cokelat.
Banyak masyarakat menggemari berbagai makanan yang terbuat dari cokelat, namun hanya sedikit orang yang mengetahui kandungan dalam cokelat yang sering mereka konsumsi. Cokelat merupakan makanan yang terbuat dari biji buah kakao (cacao) yang dijemur atau dikeringkan selanjutnya digiling dan ditambahkan bahan-bahan lainnya seperti mentega, gula dan susu bubuk, melewati beberapa proses produksi hingga menghasilkan batangan-batangan cokelat (Utami, 2011).
mengandung teobromin dibandingkan kafein. Walau tidak terdapat dasar yang kuat, kebanyakan ilmuwan percaya bahwa efek stimulan kombinasi teobromin dan kafein dalam cokelat adalah dua kali lebih besar dibanding kafein (Weinberg
el al., 2010).
Kafein yang selama ini dikenal oleh masyarakat luas menimbulkan efek negatif, namun pada kenyataanya kafein bersama dengan teobromin mempunyai daya kerja positif sebagai stimulan sistem syaraf pusat, stimulan otot jantung, meningkatkan aliran darah melalui arteri koroner, relaksasi otot polos bronki, dan aktif sebagai diuretika dengan tingkatan yang berbeda. Daya kerja sebagai stimulan sistem syaraf pusat kafein sangat menonjol sehingga umumnya digunakan sebagai stimulan sentral (Qiqi, 2001). Efek rangsangan yang dihasilkan oleh cokelat berasal dari efek kombinasi teobromin dan kafein (Utami, 2011).
Kandungan teobromin dan kafein dalam cokelat, khususnya serbuk cokelat akan menimbulkan dampak positif atau negatif, tergantung dari kadar yang ada dalam serbuk cokelat. Kandungan teobromin dan kafein dalam serbuk cokelat yang belum diketahui oleh masyarakat inilah yang seharusnya diketahui kadarnya secara pasti supaya masyarakat lebih bijak dalam mengkonsumsi serbuk cokelat. Masyarakat tidak hanya menjadikan cokelat sebagai makanan kegemaran, namun cokelat akan menjadi makanan yang memberikan dampak positif bagi tubuh bila digunakan secara tepat.
dapat dipastikan bahwa produk cokelat yang dihasilkan mengandung teobromin dan kafein tidak sekedar menggunakan pewarna cokelat.
Penetapan kadar teobromin dan kafein dalam serbuk cokelat harus melalui beberapa tahap, antara lain dengan mengekstraksi serbuk cokelat supaya didapatkan kandungan teobromin dan kafein yang terpisah dari komponen lain yang tidak dikehendaki. Sistem ekstraksi yang dipilih adalah metode soxhletasi karena lebih praktis, hanya kemungkinan kecil zat yang diekstraksi hilang selama proses ekstraksi (Khopkar, 1990), cairan penyari yang diperlukan lebih sedikit daripada metode ekstraksi lainnya sehingga diperoleh hasil ekstrak yang lebih pekat (Mitra, 2003), dan senyawa teobromin dan kafein merupakan senyawa yang tahan terhadap panas (Anonim, 1986). Proses soxhletasi serbuk cokelat akan menggunakan penyari klorofom karena teobromin dan kafein mempunyai kelarutan yang tinggi dalam klorofom. Metode soxhletasi juga memerlukan penentuan jumlah sirkulasi ekstraksi, karena jumlah sirkulasi merupakan parameter konstan yang dapat diamati, dengan menggunakan kondisi yang sama (suhu, jenis dan jumlah pelarut) pada masing-masing proses ekstraksi. Hal ini dilakukan supaya senyawa teobromin dan kafein dalam sampel serbuk cokelat dapat terambil seluruhnya.
yang bersifat polar. Selain itu, KCKT juga memiliki kelebihan yaitu cepat, sensitif dan memiliki daya pisah yang baik (Jhonson and Stevenson, 1978). Metode KCKT yang digunakan harus tervalidasi sebelumnya untuk memberikan jaminan terhadap hasil penetapan kadar pada sampel sehingga dapat dipercaya kebenarannya.
Penelitian ini mengacu dari penelitian sebelumnya yang telah dilakukan oleh Wati (2012) tentang optimasi komposisi dan flow rate fase gerak pada penentuan kadar teobromin dan kafein dalam serbuk cokelat dengan menggunakan metode Kromatografi Cair Kinerja Tinggi fase terbalik. Hasil optimasi yang didapat pada sistem KCKT yang optimum menggunakan fase gerak campuran metanol : akuabides/TEA 3% dengan komposisi 40 : 60 (v/v), fase diam Kromasil Oktadesilsilan C-18 (100-5C18) merek KNAUER dimensi 250 mm
1. Permasalahan
Berdasarkan latar belakang di atas, maka dapat disusun permasalahan sebagai berikut:
1. Berapakah jumlah sirkulasi ekstraksi serbuk cokelat merk “X” dengan menggunakan metode soxhletasi yang menghasilkan kadar teobromin dan kafein maksimum?
2. Berapakah kadar teobromin dan kafein dalam ekstrak serbuk cokelat merk “X” hasil penetapan menggunakan metode KCKT fase terbalik?
2. Keaslian Penelitian
Sejauh penelusuran pustaka yang penulis lakukan, telah dilakukan penetapan kadar teobromin dan kafein dalam berbagai produk kopi menggunakan metode KCKT fase terbalik dengan fase gerak metanol : akuabides/bufer ammonium asetat pH 7,5 dengan perbandingan 20 : 80 (v/v), fase diam Phenomenex Kinetex 2.6 um XB C-18, kecepatan alir 1,0 mL/menit, detektor UV pada panjang gelombang maksimum 272 nm oleh Czech et al. (2011). Penetapan kandungan metilksantin dan polifenol dalam produk cokelat pernah dilakukan menggunakan metode KCKT, dengan fase gerak metanol : akuabides : asam asetat (20 : 79 : 1, v/v), fase diam µ-Bondapak 10 µ m (30 cm x 4,0 mm), kecepatan alir 1,0 mL/min oleh Ramli et al. (2001).
3. Manfaat Penelitian
Penelitian yang dilakukan oleh penulis, diharapkan dapat bermanfaat sebagai berikut:
a. Manfaat Teoritis. Penelitian ini diharapkan dapat memberikan sumbangan terhadap ilmu pengetahuan tentang penetapan jumlah sirkulasi ekstraksi dengan metode soxhletasi dan tentang metode KCKT sehingga dapat digunakan untuk menetapkan kadar teobromin dan kafein.
b. Manfaat Metodologis. Penelitian ini diharapkan dapat memberikan informasi prosedur penetapan jumlah sirkulasi ekstraksi dengan metode soxhletasi yang menghasilkan kadar maksimum dan penggunaan metode KCKT fase terbalik dalam penetapan kadar teobromin dan kafein dalam ekstrak serbuk cokelat merk “X”.
c. Manfaat Praktis. Penelitian ini diharapkan dapat memberikan informasi mengenai jumlah sirkulasi ektraksi menggunakan metode soxhletasi yang memberikan kadar teobromin dan kafein yang maksimal dalam ekstrak serbuk cokelat merk “X”.
B. Tujuan Penelitian
Berdasarkan latar belakang dan permasalahan yang ada, maka penelitian ini bertujuan sebagai berikut:
8
BAB II
PENELAAHAN PUSTAKA
A. Cokelat (Theobroma cacao)
Gambar 1. Cokelat (Theobroma cacao)
Cokelat dihasilkan melalui serangkaian proses dari biji kakao. Biji kakao ini berasal dari tanaman kakao, Theobroma cacao, yang tumbuh hanya di daerah tropis. Istilah cokelat itu sendiri berasal dari xocolatl (bahasa suku Aztec) yang berarti minuman pahit (Alexander et al., 2008).
Secara garis besar, cokelat mengandung lemak 31%, karbohidrat 14%, dan protein 9%. Protein cokelat kaya akan asam amino triptofan, fenilalanin, dan tirosin. Meski cokelat mengandung lemak tinggi namun relatif tidak mudah tengik karena cokelat mengandung 6% polifenol, yang berfungsi sebagai antioksidan pencegah tengik. Cokelat mengandung berbagai macam gula, pati, protein sayuran, kalium, magnesium, kalsium, natrium, zat besi, krom, berbagai macam vitamin (A, B1 tiamin, B2 riboflavin, D dan E), kafein dan feniletilamin (Mutiara,
B. Penyarian
Penyarian atau ekstraksi adalah kegiatan penarikan kandungan kimia yang terlarut supaya terpisah dari bahan yang tidak larut dengan pelarut cair. Pada proses penyarian terjadi perpindahan masa zat aktif yang semula berada di dalam sel akan ditarik oleh cairan penyari. Proses penyarian dapat dibagi pada tahapan pembuatan serbuk, penyarian, dan pemekatan. Hasil penyarian akan semakin baik apabila serbuk semakin halus, karena permukaan serbuk simplisia yang bersentuhan dengan penyari akan semakin luas. Akan tetapi pertimbangan ini tidak selalu dapat dilaksanakan karena dengan semakin halus serbuk simplisia juga akan mengganggu proses penyarian. Hal ini dikarenakan serbuk yang terlalu halus tersebut dapat membentuk suspensi sehingga sulit dipisahkan dari hasil penyarian. Faktor yang mempengaruhi kecepatan penyarian adalah kecepatan difusi cairan penyari (Anonim, 1986).
Ekstraksi dilakukan untuk menyari zat-zat berkhasiat atau zat-zat aktif dari bagian tanaman obat, hewan dan beberapa jenis ikan termasuk biota laut. Zat-zat aktif terdapat di dalam sel, namun sel tanaman dan hewan berbeda demikian pula ketebalannya, sehingga diperlukan metode ekstraksi dengan pelarut tertentu dalam mengekstraksinya (Harbone, 1987).
1. Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir pelarut diuapkan menjadi ekstrak kental atau ekstrak kering (Anonim, 1986).
Pembuatan ekstrak yang baik perlu memperhatikan beberapa tahap karena akan mempengaruhi mutu ekstrak seperti keseragaman kandungan kimia, sifat fisiknya, khasiat, dan keamanannya (Sidik dan Mudahar, 2000).
2. Cairan Penyari
Cairan penyari yang digunakan dalam proses pembuatan ekstrak adalah pelarut yang optimal untuk senyawa kandungan yang berkhasiat atau aktif, dengan demikian senyawa tersebut dapat terpisahkan dari bahan dan dari senyawa kandungan lainnya. Diharapkan, ekstrak yang diperoleh hanya mengandung sebagian besar senyawa yang diinginkan. Ekstrak kental diperoleh jika cairan pelarut yang digunakan dapat melarutkan hampir semua metabolit sekunder yang terkandung (Anonim, 2000).
Pemilihan cairan penyari harus mempertimbangkan banyak faktor. Cairan penyari yang baik harus memenuhi kriteria berikut ini:
a. murah dan mudah diperoleh b. stabil secara fisika dan kimia c. bereaksi netral
d. mudah menguap dan tidak mudah terbakar
f. tidak mudah mempengaruhi zat berkhasiat
g. diperbolehkan oleh peraturan dengan pertimbangan keamanan/toksisitas (Anonim, 1986).
Pelarut yang digunakan dalam ekstraksi harus dipilih berdasarkan kemampuannya dalam melarutkan kandungan zat aktif yang maksimal dan seminimal mungkin bagi unsur yang tidak diinginkan (Ansel, 1985).
3. Metode Ekstraksi secara Soxhletasi
Alat Soxhlet adalah suatu alat terbuat dari gelas yang bekerja secara kontinyu dalam menyari. Pada proses ini sampel yang disari dimasukkan pada alat Soxhlet, lalu dielusi dengan pelarut yang cocok sedemikian rupa sehingga akan terjadi dua kali sirkulasi dalam waktu 30 menit (Harbone, 1987).
Gambar 2. Diagram soxhlet extractor (Mitra, 2003)
sirkulasi ini berlangsung terus-menerus sehingga zat aktif yang hendak diekstraksi harus tahan terhadap pemanasan (Anonim, 1986). Ekstraksi sempurna ditandai bila cairan sifon tidak berwarna atau sirkulasi ekstraksi telah mencapai 20-25 kali (Utami, 2011).
Bahan yang akan diekstraksi diletakkan dalam sebuah kantong ekstrak dalam sebuah alat ekstraksi dari gelas yang bekerja kontinyu. Wadah gelas yang berisi sampel diletakkan diantara labu penampung dan suatu pendingin aliran balik. Labu tersebut berisi bahan pelarut yang mudah menguap mencapai ke pendingin aliran balik melalui pipa samping, berkondensasi di dalamnya, menetes ke atas bahan yang akan diekstraksi dan membawa keluar bahan yang diekstraksi. Larutan yang terkumpul di dalam wadah gelas dan setelah mencapai tinggi maksimal secara otomatis dipindahkan ke dalam labu, dengan demikian zat yang akan terektraksi terakumulasi melalui penguapan bahan pelarut murni berikutnya. Pada cara ini cairan pengekstrak terus diperbaharui, artinya bahan pelarut bebas bahan aktif akan menyari pada sirkulasi berikutnya (Voigt, 1971).
Kelebihan metode soxhletasi:
a. Uap panas tidak melalui serbuk simplisia tetapi melalui pipa samping. b. Cairan penyari yang diperlukan lebih sedikit dibanding metode ekstraksi
lainnya dan menghasilkan ekstrak yang lebih pekat.
c. Serbuk simplisia disari dengan cairan penyari yang murni sehingga dapat menyari zat aktif lebih banyak.
d. Penyarian dapat diteruskan sesuai keperluan tanpa menambah volume cairan penyari. Hal ini sangat menguntungkan karena selain ekonomis, akan diperoleh ekstrak yang lebih kental.
Kekurangan metode soxhletasi:
a. Larutan dipanaskan terus-menerus sehingga kurang cocok untuk zat aktif yang tidak tahan pemanasan. Hal ini dapat diperbaiki dengan menambah peralatan yang dapat mengurangi tekanan udara.
b. Cairan penyari dididihkan terus-menerus sehingga penyari yang baik harus murni atau campuran azeotrop (Anonim, 1986).
C. Teobromin
Teobromin atau 3,7-dimetilksantin merupakan turunan ksantin yang termasuk dalam golongan alkaloid, terdapat dalam biji Theobroma cacao. Berupa serbuk kristal putih dengan rumus molekul C7H8N4O2 dan bobot molekul 180,2
dari 101,0% dari 3,7-dimetilksantin (Anonim, 2011). Serbuk cokelat kakao mengandung teobromin antara 18-38 g/kg (Alexander et al., 2008).
Teobromin (gambar 3) memiliki kelarutan: 1 dalam 2000 air, 1 dalam 150 air panas, 1 dalam 2500 etanol, dan 1 dalam 6000 kloroform. Teobromin tidak
Metode analisis yang paling sering digunakan untuk menganalisis kandungan teobromin dalam makanan adalah Kromatografi Cair Kinerja Tinggi (KCKT). Banyak metode lain yang dapat digunakan untuk menganalisis teobromin, antara lain kromatografi gas-spektrofotometer massa atau Spektrofotometer UV/Vis. Penyarian kandungan teobromin dalam makanan dapat dilakukan menggunakan metode maserasi dengan pemanasan (Cezch et al., 2011).
D. Kafein
Kafein memiliki sinonim 1,3,7-trimetilksantin dengan rumus molekul C8H10N4O2 dan bobot molekul 194,2 g/mol (Clarke, 1986); bersifat basa dengan
pKa 10,4 (Nadendla, 2005). Rumus bangun kafein dapat dilihat pada gambar 4.
Kafein berbentuk anhidrat atau hidrat yang mengandung satu molekul air. Mengandung tidak kurang dari 98,5% dan tidak lebih dari 101,0% C8H10N4O2,
dihitung terhadap zat anhidrat. Pemerian berupa sebuk putih atau berbentuk jarum mengkilat putih; biasanya menggumpal; tidak berbau; rasa pahit (Anonim, 1995). Serbuk cokelat kakao mengandung kafein sebanyak 9,9 g/kg (Alexander et al., 2008).
Sebanyak 1 gram kafein larut dalam: 46 mL air; 5,5 mL air (80oC); 1,5 mL air mendidih; 66 mL alkohol; 22 mL alkohol (60oC); 50 mL aseton; 5,5 mL kloroform; 530 mL eter; 100 mL benzene; 22 mL benzen mendidih; dan larut dalam etil asetat (Anonim, 1989).
Kafein secara alami di dalam tanaman terdapat dalam bentuk garam. Kafein bebas dalam bentuk basa tidak dapat larut dalam air, tetapi kafein dalam bentuk garam yang dihasilkan dari reaksi dengan asam dapat larut dalam air. Kafein bebas dalam bentuk basa larut dalam eter, kloroform atau pelarut organik lain, tetapi garam kafein tidak larut (Robbers, 1996). Menurut Polp (1990), kafein dapat larut dalam etanol dan klorofom.
Kafein berkhasiat sebagai stimulan susunan saraf pusat dengan efek menghilangkan rasa letih, lapar, rasa kantuk, meningkatkan daya konsentrasi, kecepatan reaksi, dan memperbaiki suasana jiwa (Tjay dan Raharja, 2002). Kafein mempunyai efek paling besar dalam menstimulasi pusat respirasi dan meningkatkan kemampuan kerja otot dibandingkan dengan turunan ksantin lainnya. Dosis letal kafein pada orang dewasa antara 5-10 g, namun reaksi yang tidak diinginkan terlihat pada penggunaan 1 g (15 mg/kg/BB) (Wilmana, 1995). Pada orang yang lelah, kafein dapat menghilangkan gejala kelelahan dan meningkatkan kemampuan psikis (Mutschler and Ernst, 1986).
Kafein memiliki titik lebur yang tinggi antara 235-237°C dan titik sublimasinya 178°C. Kafein mempunyai spektrum absorbansi pada UV. Kafein dalam etanol mempunyai serapan maksimum pada panjang gelombang 273 nm dengan % = 519. Kafein dalam HCl 0,1 N mempunyai serapan maksimum pada panjang gelombang 272 nm dengan % = 470 (Clarke, 1986).
E. Kromatografi Cair Kinerja Tinggi
1. Definisi dan Instrumentasi
memisahkan komponen dari matriks sampel dan tetap dibiarkan dalam fase diam kemudian ditentukan untuk analisis (Mulja dan Suharman, 1995).
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan salah satu metode kromatografi cair yang fase geraknya dialirkan secara tepat dengan bantuan tekanan dan hasil yang diperoleh dideteksi dengan instrumen (Williard et al., 1988). Secara skematis, KCKT terlihat pada gambar 5. KCKT memiliki sistem pompa tekanan tinggi dan detektor yang sensitif telah menyebabkan perubahan kromatografi kolom cair menjadi suatu sistem pemisahan dengan kecepatan dan efisiensi yang tinggi (Anonim, 1995).
Gambar 5. Peralatan KCKT
2. Pembagian Jenis Kromatografi
Secara umum kromatografi dapat dibagi menjadi lima jenis, yaitu: a. Kromatografi cair-cair atau kromatografi partisi
Pada kromatografi partisi, fase diam bersifat polar atau non polar. Bila fase diam bersifat polar dan fase gerak non polar disebut kromatografi partisi fase normal, sedangkan bila fase diam bersifat non polar dan fase gerak polar dinamakan kromatografi partisi fase terbalik (Munson, 1984). b. Kromatografi adsorpsi
c. Kromatografi pertukaran ion
Anion atau kation diikatkan secara kovalen pada fase diam padat, biasanya resin. Ion-ion solut dengan muatan berlawanan menyerang fase diam dengan kekuatan elektrostatik. Fase geraknya cair (Harris, 1999). d. Kromatografi eksklusi
Pada kromatografi ini tidak ada interaksi tarik menarik antara fase diam dan solut. Fase gerak cair atau gas melalui gel berpori. Ukuran pori cukup kecil untuk mengeluarkan molekul solut yang besar. Molekul solut yang kecil akan masuk ke dalam pori gel, sedangkan molekul yang besar akan mengalir tanpa memasuki pori gel (Harris, 1999).
e. Kromatografi afinitas
Digunakan untuk interaksi spesifik antara satu jenis molekul solut dan sebuah molekul lain yang secara kovalen terikat pada fase diam. Misalnya pemisahan komponen protein (Harris, 1999).
3. Kromatografi Partisi
Prinsip kromatografi partisi analit diantara 2 fase yang tidak saling campur, karena adanya perbedaan koefisien distribusi dari masing-masing senyawa (Johnson and Stevenson, 1978). Mekanisme pemisahan pada kromatografi partisi dapat digambarkan sebagai berikut (gambar 6):
Kecepatan migrasi analit fase diam ditentukan oleh perbandingan distribusinya (K) yang tergantung pada afinitas analit pada fase gerak. Di dalam kromatografi, K didefinisikan sebagai perbandingan konsentrasi analit dalam fase diam (Cs) dan konsentrasi analit dalam fase gerak (Cm) (Rohman dan Gandjar, 2007).
K =
Cm Cs
Hal-hal yang harus diperhatikan dalam pemilihan metode kromatografi partisi fase terbalik yaitu kolom, fase gerak, dan detektor.
a. Kolom
Fase diam pada KCKT berupa kolom kromatografi yang merupakan bagian penting karena pemisahan komponen-komponen sampel terjadi di dalam kolom. Keberhasilan pemisahan komponen-komponen sampel sangat bergantung pada keadaan kolom sehingga pemilihan kolom yang tepat sangatlah penting (Mulja dan Suharman, 1995).
Kebanyakan fase diam pada KCKT berupa silika yang dimodifikasi secara kimia, silika yang tidak dimodifikasi, atau polimer-polimer stiren dan divinil benzen. Permukaan silika adalah polar dan sedikit asam karena adanya residu gugus silanol (Si-OH). Oktadesilsilan (ODS atau C18) merupakan fase diam yang paling banyak digunakan
Kolom yang digunakan dalam kromatografi partisi fase terbalik adalah kolom dengan kemasan fase terikat yang memiliki sifat stabil karena fase diamnya terikat secara kimia pada penyangga, sehingga tidak mudah terbawa oleh fase gerak. Penyangga pada kemasan fase terikat biasanya terbuat dari silika yang sudah diseragamkan, berpori, dan umumnya partikel mempunyai diameter 3,5 atau 10 µ m (Skoog et al., 1998).
Pada KCKT partisi fase terbalik biasanya mengandung bahan organik yang terikat secara kimia dengan gugus silanol pada silika. Bagian organik tersebut umumnya hidrokarbon rantai panjang, sehingga fase gerak umumnya polar. Gugus silanol permukaan dapat direaksikan dengan berbagai cara menempelkan berbagai jenis gugus organik. Kemasan fase terikat dengan tipe ikatan siloksan (Si-O-Si-O) dibuat dengan mereaksikan organoklorosilan dengan gugus silanol pada permukaan silika gel. Reaksi silanasi (gambar 7) sebagai berikut:
Gambar 7. Reaksi silanasi
Reaksi tersebut digunakan untuk membuat isian kolom oktadesilsilan (ODS) gugus silanol dan oktadesiklorosilan (gambar 8) sebagai berikut:
Gugus yang ditempelkan pada silanol pada umumnya adalah hidrokarbon rantai panjang. Tertambatnya senyawa pada fase diam dipengaruhi panjang pendeknya rantai karbon (Skoog et al., 1998).
b. Fase gerak
Kemampuan KCKT untuk memisahkan banyak senyawa terutama tergantung pada keanekaragaman fase gerak yang sangat berpengaruh terhadap tambatan dan pemisahan senyawa (Munson, 1984).
Fase gerak untuk analisis secara KCKT harus murni untuk mencegah adanya peak pengganggu yang dapat tumpang tindih dengan
peak analit, tidak bereaksi atau mempengaruhi kolom, dapat melarutkan analit, memiliki titik didih 20-50°C di atas temperatur kolom, viskositasnya rendah (Skoog et al., 1998).
Fase gerak KCKT juga harus bebas dari gas terlarut karena dapat mempengaruhi respon detektor sehingga memunculkan sinyal palsu dan akan mempengaruhi kolom (Gritter dkk., 1985), maka fase gerak perlu
didegassing untuk menghilangkan gas terlarut (Dean, 1995).
Pada fase terbalik kandungan utama fase geraknya adalah air. Pelarut yang dapat campur dengan air seperti metanol, etanol, asetonitril, dan tetrahidrofuran ditambahkan untuk mengatur kepolaran fase gerak. Kepolaran dinyatakan dalam indeks polaritas (P') yang dapat dihitung dengan persamaan berikut:
P' = Φa P'a + Φb P'b
Indeks polaritas (P') beberapa pelarut yang sering digunakan dalam KCKT disajikan dalam tabel I:
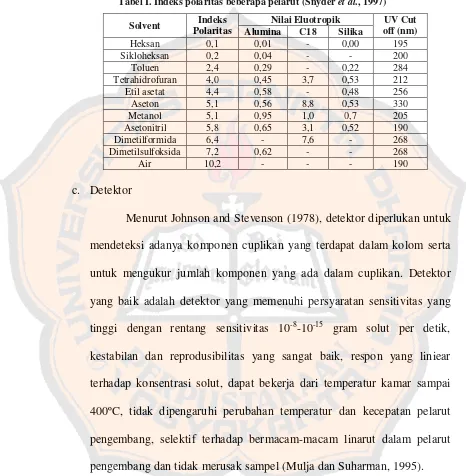
Tabel I. Indeks polaritas beberapa pelarut (Snyder et al., 1997)
Solvent Indeks Polaritas
Nilai Eluotropik UV Cut off (nm)
Menurut Johnson and Stevenson (1978), detektor diperlukan untuk mendeteksi adanya komponen cuplikan yang terdapat dalam kolom serta untuk mengukur jumlah komponen yang ada dalam cuplikan. Detektor yang baik adalah detektor yang memenuhi persyaratan sensitivitas yang tinggi dengan rentang sensitivitas 10-8-10-15 gram solut per detik, kestabilan dan reprodusibilitas yang sangat baik, respon yang liniear terhadap konsentrasi solut, dapat bekerja dari temperatur kamar sampai 400ºC, tidak dipengaruhi perubahan temperatur dan kecepatan pelarut pengembang, selektif terhadap bermacam-macam linarut dalam pelarut pengembang dan tidak merusak sampel (Mulja dan Suharman, 1995). Detektor pada KCKT dikelompokkan menjadi 2 golongan yaitu:
b. Detektor spesifik yang hanya akan mendeteksi analit secara spesifik dan selektif, seperti detektor UV-Vis, detektor fluoresensi, dan elektrokimia (Rohman, 2009).
Idealnya, suatu detektor harus mempunyai karakteristik sebagai berikut: a. Mempunyai respon terhadap solut yang cepat dan reprodusibel
b. Mempunyai sensitivitas yang tinggi, yakni mampu mendeteksi solut pada kadar yang sangat kecil
c. Stabil dalam pengoperasiannya
d. Mempunyai sel volume yang kecil sehingga mampu meminimalkan pelebaran pita
e. Signal yang dihasilkan berbanding lurus dengan konsentrasi solut pada kisaran yang luas (kisaran dinamis dan linier)
f. Tidak peka terhadap perubahan temperatur dan kecepatan aliran fase gerak (Rohman, 2009).
4. Pemisahan Puncak dalam Kromatografi
Keberhasilan atau kegagalan analisis tergantung pada pemilihan kolom dan kondisi kerja yang tepat. Ukuran kinerja kolom dapat dilihat dari kemampuan kolom dalam memisahkan senyawa. Kolom yang efisien mencegah pelebaran puncak atau menghasilkan puncak yang sangat sempit (Johnson and Stevenson, 1978).
Resolusi (R) adalah ukuran pemisahan dua puncak berdekatan yang dapat diukur dengan persamaan:
R =
( ) = Δ
Nilai tR1 dan tR2 merupakan waktu retensi senyawa yang diukur pada titik
maksimum puncak, nilai w1 dan w2 merupakan lebar alas puncak (Johnson
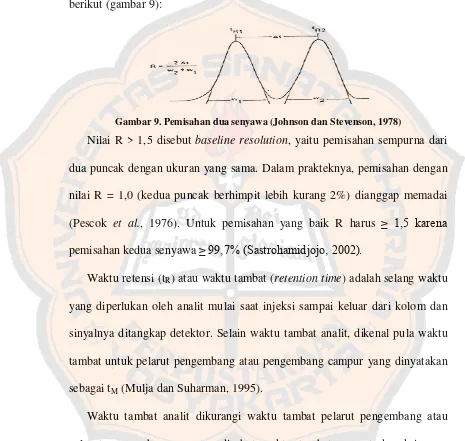
and Stevenson, 1978). Pemisahan dua senyawa dapat digambarkan sebagai berikut (gambar 9):
Gambar 9. Pemisahan dua senyawa (Johnson dan Stevenson, 1978)
Nilai R > 1,5 disebut baseline resolution, yaitu pemisahan sempurna dari dua puncak dengan ukuran yang sama. Dalam prakteknya, pemisahan dengan nilai R = 1,0 (kedua puncak berhimpit lebih kurang 2%) dianggap memadai (Pescok et al., 1976). Untuk pemisahan yang baik R harus ≥ 1,5 karena pemisahan kedua senyawa ≥ 99,7% (Sastrohamidjojo, 2002).
Waktu retensi (tR) atau waktu tambat (retention time) adalah selang waktu
yang diperlukan oleh analit mulai saat injeksi sampai keluar dari kolom dan sinyalnya ditangkap detektor. Selain waktu tambat analit, dikenal pula waktu tambat untuk pelarut pengembang atau pengembang campur yang dinyatakan sebagai tM (Mulja dan Suharman, 1995).
Waktu tambat analit dikurangi waktu tambat pelarut pengembang atau pelarut pengembang campur disebut waktu tambat yang terkoreksi yang dinyatakan sebagai tR' (Mulja dan Suharman, 1995). Jika nilai K
gerak atau (Cm > Cs) yang berarti analit akan lebih lama tinggal di dalam fase gerak dan memiliki waktu retensi lebih cepat (Mulja dan Suharman, 1995).
5. Analisis Kualitatif dan Kuantitatif
KCKT digunakan untuk analisis kuantitatif suatu sampel atau cuplikan. Hasil pemisahan adalah kromatogram. Informasi yang diperoleh dari kromatogram yaitu mengenai waktu retensi suatu senyawa (Noegrohati, 1994).
Waktu retensi menunjukkan identitas suatu senyawa dan merupakan selang waktu yang diperlukan oleh senyawa mulai pada saat injeksi sampai keluar dari kolom dan sinyalnya ditangkap oleh detektor (Gritter et al., 1985). Masing-masing senyawa memiliki waktu retensi yang spesifik pada kondisi tertentu seperti kolom, suhu, dan laju sehingga dapat digunakan sebagai salah satu dasar uji kualitatif (Noegrohati, 1994). Analisis kualitatif dilakukan dengan cara membandingkan waktu retensi senyawa murni dengan waktu retensi senyawa yang dimaksud dalam sampel (Gritter et al., 1985).
F. Keterangan Empiris
Cokelat mengandung dua komponen yang dapat menjadi suplemen, yaitu: teobromin dan kafein. Efek farmakologis teobromin serupa dengan kafein, tetapi dalam jumlah yang sama efek teobromin lebih kecil dibanding kafein. Cokelat lebih banyak mengandung teobromin dibanding kafein.
Komposisi penyusun serbuk cokelat secara umum adalah lemak, karbohidrat, protein, alkaloid (teobromin dan kafein), gula, dan polifenol. Pada produk makanan, produsen tidak mencantumkan pada label kemasan berapa kadar teobromin dan kafein yang digunakan. Pengambilan senyawa teobromin dan kafein dalam serbuk cokelat memerlukan suatu metode soxhletasi yang maksimum supaya teobromin dan kafein dalam serbuk cokelat dapat terambil semaksimal mungkin.
Teobromin dan kafein memiliki panjang gelombang pada daerah spektrofotometri UV. Teobromin dan kafein memiliki kromofor, ausokrom, dan perbedaan interaksi terhadap fase diam dan fase gerak yang digunakan sehingga metode yang dapat digunakan untuk pemisahan campuran dan menganalisis secara kuantitatif yaitu metode KCKT fase terbalik menggunakan detektor UV. Kelebihan metode ini yaitu memiliki sensitivitas dan selektivitas yang tinggi dalam memisahkan campuran senyawa yang memiliki kepolaran yang hampir sama.
dan fase gerak yang bersifat polar. Perbedaan interaksi antara teobromin dan kafein dengan fase diam dan fase gerak pada sistem KCKT menyebabkan teobromin dan kafein akan terpisah dan dapat dihitung kadarnya dengan metode KCKT fase terbalik.
28
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang dilakukan mengikuti jenis penelitian eksperimental karena pada penelitian ini ada perbedaan perlakuan terhadap subyek uji dalam hal perbedaan jumlah sikulasi ekstraksi.
B. Variabel Penelitian
1. Variabel bebas
Variabel bebas dalam penelitian ini adalah sediaan dan ekstrak serbuk cokelat merk “X” yang mengandung teobromin dan kafein.
2. Variabel tergantung
Variabel tergantung dalam penelitian ini adalah kadar teobromin dan kafein dalam ekstrak serbuk cokelat merk “X”.
3. Variabel pengacau terkendali
Variabel pengacau terkendali dalam penelitian ini adalah:
a. Kemurnian pelarut yang digunakan, untuk mengatasinya digunakan pelarut yang memiliki kemurnian tinggi yaitu pelarut pro analysis.
C. Definisi Operasional
1. Serbuk cokelat merk “X” merupakan sedian cokelat dalam bentuk serbuk yang memiliki nomor kode produksi yang sama.
2. Kadar teobromin dan kafein maksimum adalah kondisi dimana seluruh kandungan teobromin dan kafein dalam serbuk cokelat merk “X” sudah terektraksi seluruhnya.
3. Sistem Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik yang digunakan adalah seperangkat alat KCKT dengan fase diam Kromasil Oktadesilsilan C-18 (100-5C18) merek KNAUER dimensi 250 mm x 4,6 mm,
ukuran partikel 5 µ m, fase gerak metanol : akuabides/TEA 3% dengan perbandingan komposisi 40 : 60 (v/v), kecepatan alir 0,8 mL/menit, dan panjang gelombang pada detektor UV yaitu 275 nm.
4. Kadar campuran teobromin dan kafein dalam serbuk cokelat merk “X” ditetapkan dalam jumlah % (b/b).
D. Bahan Penelitian
Bahan yang digunakan adalah baku teobromin kualitas Non-compendial
primary reference standard dengan Certificate of Analysis dari Sigma-Aldrich,
baku kafein kualitas working standard dengan Certificate of Analysis dari Brataco, metanol (p.a., E. Merck), Akuabides (Laboratorium Kimia Analisis Instrumental Fakultas Farmasi Universitas Sanata Dharma Yogyakarta), trietilamin (p.a., E. Merck), organic dan anorganic solvent membrane filter
40-60oC) (p.a., E. Merck), kloroform teknis, Natrium hidroksida, dan serbuk cokelat merk “X”.
E. Alat Penelitian
Alat yang digunakan adalah penyaring Milipore, indikator pH, mikropipet Socorex, neraca analitik (Ohaus PAJ1003), ultrasonikator (Retsch tipe T460 no V935922013 Ey), vacuum (Gaast model DOA-P104-BN), spektrofotometer UV/Vis (Optima SP 3000), sistem KCKT (isokratik, model LC-2010C HT, CAT No.228-46703-38, SERIAL No. C21254706757 LP, Shimadzu Corporation), kolom Kromasil Oktadesilsilan C-18 (100-5C18) merek KNAUER
dimensi 250 mm x 4,6 mm, ukuran partikel 5 µm, seperangkat computer (merk
Dell B6RDZ1S Connexant System RD01-D850 A03-0382 JP France S.A.S, printer HP Deskjet D2566 HP-024-000 625 730), satu set alat Soxhlet, batu didih, penangas air, hot-plate, dan alat-alat gelas yang umum digunakan laboratorium analisis (Pyrex).
F. Tata Cara Penelitian
1. Pemilihan Sampel
2. Pembuatan Fase Gerak
Fase gerak yang digunakan dalam penelitian ini terdiri atas campuran metanol : akuabides/TEA 3% dengan perbandingan 40 : 60 (v/v). Masing-masing fase gerak disaring menggunakan organic solvent membrane filter
(Whatman) untuk metanol, dan anorganic solvent membrane filter (Whatman)
untuk akuabides TEA 3% dengan bantuan pompa vakum. Fase gerak tersebut lalu didegassing selama 15 menit menggunakan ultrasonicator.
3. Pembuatan Larutan Stok Teobromin dan Kafein
a. Larutan stok teobromin 1000 ppm. Lebih kurang 25,0 mg baku teobromin ditimbang seksama, kemudian dilarutkan menggunakan akuabides panas (80oC) dalam labu takar 25 mL hingga tanda batas.
b. Larutan stok kafein 1000 ppm. Lebih kurang 25,0 mg baku kafein ditimbang seksama, kemudian dilarutkan menggunakan akuabides panas (80oC) dalam labu takar 25 mL hingga tanda batas.
4. Pembuatan Larutan Intermediet Teobromin dan Kafein
a. Larutan Intermediet teobromin 500 ppm. Larutan stok teobromin dipipet seksama sebanyak 12,5 mL kemudian diencerkan dengan akuabides panas (80oC) dalam labu takar 25 mL hingga tanda batas.
5. Pembuatan Seri Larutan Baku Campuran Teobromin dan Kafein
Larutan intermediet teobromin dipipet sebanyak 0,4; 0,8; 1,2; 1,6; 2,0; dan 2,4 mL kemudian dimasukkan dalam labu takar 10 mL. Larutan intermediet kafein dipipet sebanyak 0,2; 0,4; 0,6; 0,8; 1,0; dan 1,2 mL kemudian masing-masing dimasukkan ke dalam labu takar yang telah berisi larutan intermediet teobromin yang telah diambil sebelumnya. Masing-masing labu takar diencerkan dengan akuabides sampai tanda batas sehingga didapat seri konsentrasi 20; 40; 60; 80; 100; dan 120 ppm teobromin serta 10; 20; 30; 40; 50; dan 60 ppm kafein.
6. Penetapan λ Maksimum Teobromin dan Kafein dengan
Spektrofotometer UV
7. Pembuatan Kurva Baku Teobromin dan Kafein
Masing-masing larutan seri baku campuran teobromin dan kafein disaring menggunakan millipore kemudian didegassing menggunakan ultrasonikator selama 15 menit. Sejumlah 10 L masing-masing seri larutan baku tersebut diinjeksikan ke sistem KCKT dengan fase diam Kromasil Oktadesilsilan C-18 (100-5C18) merek KNAUER dimensi 250 mm x 4,6 mm,
ukuran partikel 5 µ m, menggunakan fase gerak metanol : akuabides/TEA 3% dengan perbandingan 40 : 60 (v/v) dengan kecepatan alir fase gerak 0,8 mL/menit dan dideteksi pada λ 275 nm. Replikasi dilakukan 3 kali dan dipilih persamaan kurva baku teobromin dan kafein yang paling baik dilihat dari nilai koefisisen korelasinya (r 0,999), intersep paling kecil, dan slope paling besar.
8. Pembuatan Larutan NaOH 0,1 M
Natrium hidroksida (NaOH) ditimbang sebanyak 4 g dan dimasukkan dalam labu takar 1000,0 mL larutkan dan encerkan dengan akuabides hingga tanda batas.
9. Penetapan Jumlah Sirkulasi Ekstraksi dengan Metode Soxhletasi yang
Menghasilkan Kadar Teobromin dan Kafein Maksimum
Masing-masing serbuk cokelat diekstraksi dengan alat Soxhlet menggunakan 100 mL petroleum eter (40-60oC) selama 4 jam untuk penghilangan lemak yang terdapat dalam sampel serbuk cokelat. Kantong ekstraksi kemudian direndam menggunakan larutan NaOH 0,1 M selama 5 menit. Proses ekstraksi dilanjutkan menggunakan pelarut klorofom teknis sampai didapatkan 25; 28; 31; 34; dan 37 kali sirkulasi. Masing-masing tahapan sirkulasi dilakukan sebanyak 3 replikasi. Larutan hasil ekstraksi dimasukkan ke dalam cawan porselin yang sudah ditimbang terlebih dahulu. Klorofom teknis diuapkan sehingga didapatkan ekstrak cokelat dengan bobot tetap (Anonim, 1979). Masing-masing ekstrak cokelat diambil 25 mg dan dilarutkan dengan metanol
p.a. Ekstrak cokelat yang didapatkan disaring menggunakan kertas saring. Larutan dimasukkan ke dalam labu takar 10 mL dan diencerkan dengan metanol p.a hingga tanda batas. Larutan sampel disaring menggunakan
milipore dan didegassing selama 15 menit. Larutan sampel masing-masing
diinjeksikan ke sistem KCKT adalah 10 µL dengan fase diam Kromasil Oktadesilsilan C-18 (100-5C18) merek KNAUER dimensi 250 mm x 4,6 mm,
ukuran partikel 5 µ m, fase gerak dengan komposisi metanol : akuabides/TEA 3% dan kecepatan alir 0,8 mL/menit, dideteksi dengan UV-275 nm. Respon kadar teobromin dan kafein dipilih yang paling maksimal.
10.Preparasi Sampel
dimasukkan ke dalam kantong ekstraksi. Serbuk cokelat diekstraksi dengan alat Soxhlet menggunakan 100 mL petroleum eter (titik didih 40-60oC) untuk penghilangan lemak yang terdapat dalam sampel serbuk cokelat selama 4 jam. Kantong ekstraksi kemudian direndam menggunakan larutan NaOH 0,1 M selama 5 menit. Proses ekstraksi dilanjutkan menggunakan pelarut klorofom teknis sebanyak 37 kali sirkulasi, yang memberikan kadar maksimum. Larutan hasil ektraksi dimasukkan ke dalam cawan porselin yang sudah ditimbang terlebih dahulu. Klorofom teknis diuapkan sehingga didapatkan ekstrak cokelat dengan bobot tetap, kemudian ekstrak cokelat diambil 25 mg dan dilarutkan dengan metanol p.a. Ekstrak cokelat yang didapatkan disaring menggunakan kertas saring. Larutan dimasukkan ke dalam labu takar 10 mL dan diencerkan dengan metanol p.a hingga tanda batas. Larutan sampel disaring menggunakan milipore dan didegassing selama 15 menit. Replikasi dilakukan 6 kali.
11.Penetapan Kadar Teobromin dan Kafein dalam Sampel dengan
Penambahan Larutan Baku Campuran Teobromin dan Kafein
Sebanyak 10 mg ekstrak cokelat kental yang telah diperoleh kemudian
dispike dengan seri larutan baku campuran teobromin dan kafein pada 3 level
konsentrasi (lihat tabel II). Replikasi dilakukan sebanyak 3 kali untuk masing-masing level konsentrasi. Masing-masing-masing larutan sampel yang telah dispike
Oktadesilsilan C-18 (100-5C18) merek KNAUER dimensi 250 mm x 4,6 mm,
ukuran partikel 5 µ m menggunakan fase gerak metanol : akuabides/TEA 3% (40 : 60, v/v) dengan kecepatan alir fase gerak 0,8 mL/menit. Nilai AUC sampel yang diperoleh dimasukkan ke persamaan kurva baku teobromin dan kafein, maka akan didapatkan kadar teobromin dan kafein dalam sampel. Data disajikan dengan satuan % b/b.
Tabel II. Pembuatan larutan campuran teobromin dan kafein
Konsentrasi
12.Penetapan Kadar Campuran Teobromin dan Kafein dalam Sampel
Larutan sampel diinjeksikan dalam sistem KCKT dengan fase diam Kromasil Oktadesilsilan C-18 (100-5C18) merek KNAUER dimensi 250 mm x
4,6 mm, ukuran partikel 5 µ m, fase gerak dengan komposisi metanol : akuabides/TEA 3% 40 : 60 (v/v) dan kecepatan alir 0,8 mL/menit. Injeksikan
10 µL dan detektor diatur pada λ 275 nm. Amati kromatogram masing-masing
G. Analisis Hasil
Analisis kualitatif dilakukan dengan membandingkan waktu retensi (tR)
38
BAB IV
HASIL DAN PEMBAHASAN
Penetapan kadar teobromin dan kafein dalam ekstrak kental serbuk cokelat dapat dianalisis menggunakan metode kromatografi cair kinerja tinggi (KCKT) fase terbalik yang telah dioptimasi dan divalidasi (Wati dan Yunita, 2012).
Pada tahap optimasi diperoleh kondisi optimum yaitu kolom fase diam Kromasil Oktadesilsilan C-18 (100-5C18) merek KNAUER dimensi 250 mm x 4,6
mm, ukuran partikel 5 µ m dan fase gerak metanol : akuabides/TEA 3% dengan perbandingan 40 : 60 (v/v), kecepatan alir 0,8 mL/menit, detektor UV pada panjang gelombang maksimum 275 nm dengan nilai resolusi 2,942; tailing factor
1,67; jumlah lempeng teoritis 690,6 (teobromin); 1752,3 (kafein); dan nilai HETP 0,04 (teobromin); 0,01 (kafein) (Wati, 2012).
Pada tahap validasi metode diperoleh bahwa metode KCKT fase terbalik memenuhi parameter validasi meliputi selektivitas dengan nilai resolusi (Rs) 2,06, linearitas dengan nilai koefisien korelasi (r) = 0,9998 untuk baku teobromin dan r = 0,9999 untuk baku kafein. Metode KCKT fase terbalik ini memenuhi kriteria validasi metode pada rentang konsentrasi 20-120 ppm teobromin dan 10-60 ppm kafein (Yunita, 2012).
A. Pemilihan Sampel
nomor batch yang sama. Pengambilan sampel dari nomor batch yang sama untuk mendapatkan kriteria homogenitas karena diasumsikan bahwa sampel dengan nomor batch sama mengalami satu proses produksi yang sama. Selain itu, serbuk cokelat yang dianalisis memiliki ukuran partikel yang kecil sehingga memiliki homogenitas yang tinggi. Kriteria lainnya yang harus dipenuhi yaitu representatif, yakni sampel yang dianalisis benar-benar mencerminkan populasi yang diwakilinya, dengan 20 kemasan dan dilakukan replikasi 6 kali diharapkan telah memenuhi persyaratan tersebut. Kriteria representatif pengambilan sampel dikendalikan dengan pengadukan sampel hingga homogen dan pengambilan sampel dari berbagai sisi wadah sampel.
Tabel III. Keseragaman bobot kemasan serbuk cokelat
Bobot sampel serbuk cokelat terukur (g)
48,227 47,286 45,395 46,301
48,094 45,345 48,418 48,165
45,386 48,137 47,335 45,262
46,321 46,219 49,341 47,384
49,458 46,325 45,480 46,278
Bobot rata-rata sampel = 47,008 g
Penyimpangan 10% 47,008 ± 4,700785
Penyimpangan 15% 47,008 ± 7,051178
secara khusus terhadap keseragaman bobot serbuk makanan. Data uji keseragaman bobot yang diperoleh tidak ada satu kemasan pun yang menyimpang dari persyaratan keseragaman bobot. Hal ini menunjukkan, dari 20 kemasan serbuk cokelat memiliki keseragaman bobot yang baik.
B. Pembuatan Fase Gerak
Metode KCKT yang digunakan dalam penelitian ini adalah metode KCKT dengan fase terbalik, sehingga fase diam yang digunakan lebih non polar dibandingkan dengan fase geraknya. Metode KCKT fase terbalik dipilih karena senyawa yang dianalisis (teobromin dan kafein), memiliki bobot molekul kurang dari 2000 g/mol yaitu bobot molekul teobromin = 180,2 g/mol dan kafein = 194,19 g/mol (Clarke, 1986).Kedua senyawa tersebut juga cenderung lebih larut dalam pelarut organik karena sifatnya yang cenderung kurang polar dan juga memiliki sifat basa.
Fase diam yang digunakan adalah Kromasil Oktadesilsilan C-18 (100-5C18) merek KNAUER dimensi 250 mm x 4,6 mm, ukuran partikel 5 µ m yang
bersifat non polar dan fase geraknya adalah campuran metanol : akuabides/TEA 3% dengan perbandingan 40 : 60 (v/v) yang bersifat lebih polar dibandingkan fase diamnya. Sistem yang digunakan adalah sistem isokratik dimana pencampuran kedua kompisisi fase gerak dilakukan di dalam alat KCKT.
umum dan sering digunakan pada sistem KCKT fase terbalik karena viskositasnya lebih rendah dibanding alkohol yang lain.
Sistem KCKT pada penelitian ini menggunakan metanol sebagai pelarut dan fase gerak dikarenakan viskositas metanol lebih kecil dibanding viskositas etanol. Viskositas yang terlalu besar dapat meningkatkan tekanan pompa pada KCKT dan mempengaruhi keawetan kolom yang digunakan. Selain itu, juga digunakan akuabides untuk mendapatkan indeks polaritas yang sesuai, sehingga dihasilkan profil kromatogram yang diinginkan dan memenuhi syarat yang ditetapkan. Pencampuran masing-masing komponen fase gerak dilakukan dalam instrumen KCKT (sistem isokratik). Pencampuran fase gerak menggunakan sistem isokratik karena dapat meningkatkan efisiensi waktu dalam proses analisis dan didukung oleh kemampuan instrumen KCKT yang memadai.
Fase gerak yang sudah dibuat terlebih dahulu disaring menggunakan penyaring Whatman untuk menyaring partikel yang dapat menyumbat kolom. Gelembung udaranya yang terdapat dalam fase gerak juga harus dihilangkan dengan menggunakan ultrasonicator, karena adanya gelembung udara dapat mengganggu tekanan pompa instrumen KCKT, akibatnya tekanan pompa menjadi tidak stabil dan dapat mengganggu proses pembacaan sinyal dalam instrumen KCKT.
Penggunaan TEA 3% yang bersifat basa dalam campuran fase gerak berfungsi untuk menutup residu silanol (bersifat asam) yang terdapat dalam kolom
C18. Covering menggunakan TEA ini diperlukan karena teobromin dan kafein
silanol pada kolom C18 sehingga kromatogram yang dihasilkan akan mengalami
tailing. TEA dipilih sebagai campuran fase gerak karena merupakan amina tersier
sehingga memiliki halangan sterik yang cukup besar untuk menghalangi senyawa teobromin dan kafein yang akan berinteraksi dengan residu silanol.
Trietilamin (TEA) digunakan sebagai campuran dalam fase gerak untuk dapat menurunkan tailing factor yang dialami oleh senyawa-senyawa yang bersifat basa (Choo et al., 1996). Penambahan TEA 3% (gambar 10) pada fase gerak berperan sebagai kompetitor senyawa basa yang dapat menurunkan kemampuan interaksi antara residu silanol pada kolom C18 dengan senyawa analit
melalui mekanisme covering (gambar 11), sehingga dapat menurunkan tailing
yang terjadi. Efisiensi dari kolom juga akan meningkat dengan semakin kecilnya
tailing yang terjadi (Long et al., 2007).
Gambar 11. Interaksi Trietilamin dengan Residu Silanol dalam Kolom C18
C. Pembuatan Larutan Baku Campuran Teobromin dan Kafein
baku kafein yang digunakan memiliki kualitas farmasetis, tingkat kemurniannya 99,58% dengan COA untuk menjamin kemurniannya. Pembuatan larutan baku ini digunakan sebagai pembanding atau reference standard untuk memastikan bahwa dalam sampel benar-benar terdapat analit yang dimaksud.
Larutan baku teobromin dan kafein dibuat dalam konsentrasi tertentu dengan menggunakan pelarut akuabides panas dengan suhu 80oC karena kedua senyawa tersebut larut dalam akuabides panas. Selain itu, digunakan akuabides sebagai pelarut dikarenakan akuabides merupakan komponen terbesar fase gerak sehingga senyawa teobromin dan kafein mudah terelusi dengan fase gerak. Pemilihan pelarut sangat penting karena bertujuan untuk melarutkan analit yang akan dianalisis, yang merupakan syarat utama dari pelarut. Selain itu, pelarut harus murni, inert, dan dapat bercampur dengan fase gerak (Johnson and Stevenson, 1978).
dapat mengganggu tekanan pompa instrumen KCKT, akibatnya tekanan pompa menjadi tidak stabil sehingga dapat mempengaruhi detektor dan menghasilkan sinyal palsu (Gritter et al., 1985). Selain itu, gelembung gas juga dapat meningkatkan tekanan kolom sehingga dapar mengurangi efisiensi kolom.
D. Penentuan Panjang Gelombang Maksimum Teobromin dan kafein
dengan Spektrofotometer UV
Penentuan panjang gelombang pengamatan dilakukan dengan mengukur panjang gelombang kedua analit terlebih dahulu secara terpisah. Pengukuran panjang gelombang maksimum ini dilakukan dengan menggunakan spektrofotometer UV karena secara teoritis, kedua senyawa ini memiliki panjang gelombang maksimum antara 200-300 nm. Masing-masing spektra panjang gelombang zat analit, selanjutnya dilakukan overlapping untuk mengetahui panjang gelombang dimana teobromin dan kafein memberikan serapan secara bersamaan dan optimal pada detektor KCKT yaitu detektor ultraviolet.
Senyawa dapat dianalisis menggunakan spektorfotometer ultraviolet harus memiliki gugus kromofor dan auksokrom. Teobromin dan kafein memiliki gugus kromofor dan auksokrom sehingga dapat memberikan serapan pada panjang gelombang ultraviolet. Gugus kromofor pada suatu senyawa bertanggung jawab pada penyerapan cahaya ultraviolet, sedangkan gugus auksokrom bertanggung jawab pada pergeseran panjang gelombang dan intensitas serapan maksimum teobromin dan kafein. Berikut adalah gambar gugus kromofor dan auksokrom teobromin dan kafein:
(a) (b)
Gambar 12. Gugus kromofor dan auksokrom pada teobromin (a) dan kafein (b)
Keterangan : = kromofor
= auksokrom
Hasil pengukuran panjang gelombang maksimum di ketiga tingkat konsentrasi teobromin dan kafein dapat dilihat pada gambar spektra berikut:
A
Teobromin
Gambar 13. Spektra serapan teobromin dan kafein dalam pelarut akuabides panas (suhu 80oC) dengan maks= 275 nm
Keterangan : A = Konsentrasi 5 ppm (konsentrasi rendah); B = Konsentrasi 10 ppm (konsentrasi tengah); C = Konsentrasi 15 ppm (konsentrasi tinggi)
Berdasarkan gambar 13, dapat dilihat bahwa ketiga seri kadar teobromin dan kafein dalam pelarut akuabides panas (80oC) memiliki serapan maksimum pada 275 nm. Teobromin dan kafein dalam pelarut metanol memiliki serapan maksimum pada panjang gelombang 273 nm (Clarke, 1969). Adanya perbedaan penggunaan panjang gelombang maksimum teobromin dan kafein karena pelarut yang digunakan berbeda. Pada pengamatan panjang gelombang maksimum lebih digunakan pelarut akuabides panas (80oC) dibanding pelarut metanol karena kelarutan teobromin dan kafein lebih tinggi dalam akuabides panas (80oC).
Panjang gelombang pengamatan untuk campuran senyawa teobromin dan kafein menggunakan panjang gelombang overlapping. Namun, karena pada kedua senyawa analit teobromin dan kafein memiliki spektra yang hampir sama dan
B
C
Teobromin
Kafein
panjang gelombang maksimumnya sama yaitu 275 nm, maka digunakan panjang gelombang pengamatan pada 275 nm. Pada panjang gelombang pengamatan ini, baik teobromin dan kafein memiliki serapan yang optimum pada detektor UV yang digunakan dalam sistem KCKT. Teobromin dan kafein memiliki spektra yang hampir mirip, karena keduanya memiliki gugus kromofor yang sama. Namun memiliki gugus auksokrom yang berbeda sehingga yang membedakan adalah intensitas penyerapannya.
E. Pembuatan Kurva Baku Teobromin dan Kafein
Pembuatan kurva baku bertujuan untuk memperoleh persamaan regresi linear yang selanjutnya akan digunakan untuk menghitung kadar teobromin dan kafein dalam sampel serbuk cokelat. Persamaan regresi linier yang diperoleh menyatakan hubungan linier antara konsentrasi (jumlah) analit pada beberapa seri baku dengan respon Area Under Curve (AUC). Parameter yang dilihat untuk menentukan linearitas adalah keofisien korelasi (r) yang menyatakan korelasi antara jumlah analit dengan AUC yang dihasilkan. Pemilihan kurva baku yang nantinya akan digunakan untuk perhitungan kadar dari teobromin dan kafein didasarkan pada nilai koefisien korelasi (r) > 0,999; terutama untuk analisis komponen utama dalam sampel (Snyder et al., 1997), dan juga nilai slope serta intersep.
untuk menetapkan kadar kafein digunakan persamaan y = 1,0180x + 1,4254 yang memiliki nilai r = 0,99989 (Yunita, 2012).
Gambar 14. Kurva hubungan antara jumlah teobromin dengan respon AUC
Gambar 15. Kurva hubungan antara jumlah kafein dengan respon AUC
Berdasarkan kurva baku teobromin dan kafein di atas menunjukkan hubungan linear antara jumlah analit dengan respon AUC. Kurva tersebut menggambarkan terjadinya peningkatan respon AUC proporsional dengan meningkatnya jumlah analit di dalam sampel.
F. Preparasi Sampel Serbuk Cokelat dengan Ekstraksi secara Soxhletasi
ditimbang sebanyak 30 gram dan dimasukkan ke dalam kantong Soxhlet lalu dilakukan proses soxhletasi.
Metode ekstraksi yang digunakan adalah soxhletasi. Metode soxhletasi ini menggunakan pemanasan yang dilakukan terus menerus, teobromin dan kafein termasuk senyawa yang tahan terhadap pemanasan, titik didih teobromin dan kafein cukup tinggi, yakni 290°C dan 235-237°C (Clarke, 1986) sehingga metode soxhletasi dapat digunakan untuk ekstraksi teobromin dan kafein. Alasan lain dalam pemilihan metode soxhletasi karena pengerjaannya mudah dan cairan penyari yang digunakan lebih sedikit dibandingkan metode ekstraksi lainnya (Anonim, 1986).
Prinsip kerja adalah ekstraksi secara kontinyu dengan pemanasan dan pendinginan berulang (refluks). Pemanasan menyebabkan pelarut menguap. Uap yang terbentuk akan segera mencair kembali akibat adanya pendinginan. Serbuk cokelat yang dibungkus dengan kertas saring dimasukkan ke dalam tabung, cairan penyari dipanaskan hingga mendidih. Uap cairan penyari naik ke atas melalui pipa samping, kemudian diembunkan kembali melalui pendinginan tegak. Cairan turun ke labu melalui tabung yang berisi serbuk cokelat.