MODUL PRAKTIKUM BIOLOGI MEDIK II
PROGRAM STUDI TEKNOLOGI LABORATORIUM MEDIK
INSTITUT KESEHATAN MEDISTRA LUBUK PAKAM
VISI dan MISI
INSTITUT KESEHATAN MEDISTRA LUBUK PAKAM
Visi
Menjadi Institut yang unggul dan profesional dalam bidang kesehatan di tingkat Nasional dan Asia tahun 2028.
Misi
1. Menyelenggarakan pendidikan dan pengajaran yang unggul, berkarakter, dan kompeten yang adaptif terhadap perkembangan ilmu pengetahuan, teknologi, seni dan globalisasi;
2. Menyelenggarakan penelitian yang inovatif, produktif dan responsif terhadap ilmu pengetahuan, teknologi dan kebutuhan masyarakat;
3. Menyelenggarakan kegiatan pengabdian kepada masyarakat berlandaskan nilai dan tanggung jawab sosial; dan
4. Menjalin kerjasama yang baik dengan stakeholder mulai dari pemerintah, dunia usaha dan masyarakat sebagai pengguna lulusan.
VISI dan MISI FAKULTAS FARMASI
Visi
Menghasilkan lulusan yang unggul dan professional dalam mutu pendidikan di bidang Farmasi Klinis dan Komunitas serta Mikrobiologi Molekuler Klinis yang Mampu Bersaing di tingkat Nasional dan Asia Tahun 2022.
Misi
1) Menyelenggarakan proses belajar mengajar yang kondusif dengan sistem yang mendukung pada FF sehingga pembelajaran tersebut menghasilkan prodi yang dapat menghasilkan alumni berkarakter unggul, kompeten, dan excellent service;
2) Menyelenggarakan proses praktik laboratorium yang kondusif dan handal di berbagai fasilitas pelayanan kesehatan masyarakat;
3) Mengoptimalkan dan mengimplementasikan penelitian bidang Farmasi Klinis dan Komunitas dan Mikrobiologi Molekuler Klinis dengan menggunakan pendekatan riset dalam bidang Farmasi dan Teknologi Laboratorium Medik;
4) Mengimplementasikan program pengabdian kepada masyarakat berbasis riset untuk menyelesaikan berbagai permasalahan di bidang Farmasi dan Teknologi Laboratorium Medik; dan
5) Mengembangkan kerjasama dengan institusi pendidikan, pelayanan, organisasi, dan stakeholders baik dalam maupun luar negeri.
VISI dan MISI
PROGRAM STUDI TEKNOLOGI LABORATORIUM MEDIK
Visi
Menjadi program studi yang unggul dan professional dalam bidang Mikrobiologi Molekuler Klinis Tahun 2022
Misi
1. Menyelenggarakan pendidikan Teknologi Laboratorium Medik yang unggul dan excelent service dalam bidang Mikrobiologi Molekuler Klinis;
2. Menyelenggarakan proses praktik laboratorium yang kondusif diberbagai fasilitas pelayanan kesehatan masyarakat;
3. Mengoptimalkan dan mengimplementasikan penelitian di bidang Mikrobiologi Molekuler Klinis dengan menggunakan pendekatan riset dalam bidang Teknologi Laboratorium Medik;
4. Mengimplementasikan program pengabdian kepada masyarakat berbasis riset untuk menyelesaikan berbagai permasalahan di bidang Mikrobiologi Molekuler Klinis; dan
5. Mengembangkan kerjasama dengan institusi pendidikan, pelayanan, organisasi, dan stakeholders baik dalam maupun luar negeri.
KATA PENGANTAR
Puji syukur kami Panjatkan kehadirat Tuhan Yang Maha Kuasa atas Karunia dan izin-Nya, sehingga Kami dapat menyelesaikan Modul “Praktikum Biologi Medik II. Pada kesempatan ini pula, kami mengucapkan terima kasih kepada pihak- pihak yang mendukung dan mengarahkan kami sehingga Modul ini dapat diselesaikan dengan baik dan bermanfaat dalam pembelajaran, Kami menyadari bahwa dalam penyusunan modul ini, masih banyak kekurangan yang ditemui. Untuk itu, kami mengharapkan adannya saran dan kritik yang sifatnya membangun demi kesempurnaan Modul ini. Akhir kata, semoga Modul ini dapat memberikan manfaat bagi kita semua terutama bagi para pembaca dan pelajar dibidang ilmu Praktikum biologi medik.
Lubuk Pakam,
DAFTAR ISI DAFTAR ISI
Cover ... i
Visi Dan Misi Institut Kesehatan Medistra Lubuk pakam ... ii
Visi dan Misi Fakultas Farmasi ... iii
Visi dan Misi Program Studi Teknologi Laboratorium Medik ... iv
Kata Pengantar ... v
Daftar Isi ... vi
BAB I METABOLISME TUBUH ... 1
A. Pengertian Metabolisme ... 1
B. Molekul-Molekul Yang Terkait Dengan Proses Metabolisme ... 1
BAB II METABOLISME KARBOHIDRAT ... 18
A. Latar Belakang ... 18
B. Fungsi Karbohidrat ... 20
C. Klasifikasi dan Nomenklator Karbohidrat ... 20
BAB III METABOLISME KARBOHIDRAT LANJUTAN ... 26
A. Polisakarida Sebagai Bahan Makanan Cadangan ... 26
B. Analisis Dalam Karbohidrat ... 30
BAB IV METABOLISME PROTEIN ... 35
A. Latar Belakang ... 35
B. Pengertian Protein ... 37
C. Sifat-Sifat Protein ... 38
D. Jenis Protein ... 39
BAB V METABOLISME PROTEIN LANJUTAN ... 57
A. Definisi dan Struktur Asam Amino ... 57
B. Sifat Asam Amino ... 58
BAB VI METABOLISME LIPID ... 61
A.. Pengertian Lipid ... 61
B. Jenis-Jenis Lipid ... 63
BAB VII METABOLISME LIPID LANJUTAN ... 72
A. Pengertian Asam Lemak ... 72
B. Klasifikasi Asam Lemak ... 73
BAB VIII KELAINAN METABOLISME ... 85
A. Gangguan Metabolisme ... 85
B. Penyebab gangguan metabolisme ... 85
BAB IX KELAINAN METABOLISME LANJUTAN ... 90
A.. Kelainan Metabolisme Lipid ... 90
BAB X METABOLISME VITAMIN LARUT DALAM AIR ... 94
A. Pengertian Vitamin ... 94
B. Vitamin Larut Dalam Air ... 94
DAFTAR PUSTAKA ... 132
TATA TERTIB PRAKTIKUM BIOLOGI MEDIK II
1. Para praktikan harus sudah siap di depan ruang praktikum lima menit sebelum waktu praktikum dimulai.
2. Di dalam laboratorium, Praktikan diharuskan memakai APD (Alat Pelindung Diri)
3. Sebelum mulai praktikum alat- alat diperiksa terlebih dahulu, bila ada yang pecah atau kurang harus dilaporkan.
4. Apabila ada alat yang dipecahkan harus dilaporkan pada instruktur dan harus diganti.
5. Setelah selesai bekerja alat – alat harus dalam keadaan bersih dan dikembalikan ketempat semula.
6. Setelah selesai bekerja harus membuat laporan dalam buku ini dan ditunjukkan pada instruktur yang bertugas.
7. Selama kegiatan praktikum tidak boleh makan, minum atau merokok didalam laboratorium.
8. Praktikan hanya diperbolehkan menggunakan laboratorium pada waktu ada jadwal.
9. Bila mahasiswa tidak mengikuti praktikum tanpa alasan yang SAH < 100%
tidak boleh mengikuti ujian praktikum dan dianggap tidak mempunyai nilai ujian tersebut.
PETUNJUK KERJA DI LABORATORIUM
A. Persiapan
1. Mahasiswa memakai APD (alat pelindung diri) seperti: sepatu, jas laboratorium, handscoon, masker.
2. Persiapan alat praktikum disiapkan 1 hari sebelumnya.
3.Reagen yang diperlukan dalam praktikum sudah dipersiapkan sebelumnya.
4.Mahasiswa harus membawa sampel yang dibutuhkan pada waktu praktikum, sesuai petunjuk instruktur.
B. Selama Praktikum
1. Selama mengerjakan praktikum mahasiswa bekerja tenang, hati – hati, tanggap, teliti, akurat, dan dapat bekerjasama dengan temannya.
2. Mendengarkan instruksi yang diberikan oleh instruktur laboratorium.
3. Mengerjakan praktikum sesuai dengan prosedur petunjuk praktikum.
Bertanggungjawab atas hasil praktikum yang sudah dikerjakan.
C. Selesai Praktikum
1.Membersihkan peralatan praktik dan meja yang dipakai selama praktikum dengan desinfektan.
2.Mengumpulkan laporan praktikum kepada instruktur laboratorium.
3.Setelah kegiatan selesai, mahasiswa melakukan berdoa bersama agar apa yang dikerjakan bermanfaat minimal untuk diri sendiri dan bermanfaat untuk umat
MENGIDENTIFIKASI METABOLISME TUBUH
1.1. Pengertian Metabolisme
Metabolisme merupakan totalitas proses kimia di dalam tubuh. Metabolisme meliputi segala aktivitas hidup yang bertujuan agar sel tersebut mampu untuk tetap bertahan hidup, tumbuh, dan melakukan reproduksi. Semua sel penyusun tubuh makhluk hidup memerlukan energi agar proses kehidupan dapat berlangsung. Sel- sel menyimpan energi kimia dalam bentuk makanan kemudian mengubahnya dalam bentuk energi lain pada proses metabolisme. Makhluk hidup dapat memperoleh dan menggunakan energi dengan cepat disebabkan oleh adanya enzim (biokatalisator). Seperti halnya katalis organic, enzim dapat mempercepat reaksi, tetapi tidak mempengaruhi kesetimbangan akhir, untuk transformasi sejumlah besar molekul hanya diperlukan sejumlah kecil enzim.Amilase merupakanenzim yang berfungsi memecah pati dan glikogen. Enzim ini banyak terdapat dalam hasil tanaman dan hewan. Disamping itu amilase juga dapat diisolasi dari mikroorganisme, misalnya Aspergillus oryzae dan Bacillus subtilis.
Enzim amilase dapat dikelompokkan menjadi tiga golongan yaitu: a-amilase, p- amilase dan glukoaminase.
1. 2. Tujuan
untuk Mengidentifikasi mikroorganisme penghasil enzim amilase secara kualitatif dan menguji aktivitas enzimnya.
1.3. Prinsip
enzim hanya menjalankan satu fungsi saja, seperti enzim amilase yang bekerja spesifik di dalam mulut, enzim ini terdapat bersama dengan air liur (saliva), enzim amilase berperan dalam melakukan hidrolisis awal makanan terutama yang mengandung pati. Disamping kerjanya sangat spesifik, kerja enzim juga sangat dipengaruhi oleh factor-faktor lain. Diantaranya adalah konsentrasi substrat pH, suhu, kofaktor. Karena organisme di alam, termasuk manusia dapat BAB
I
mencerna pati, maka enzim a-Amilase secara alamiah banyak ditemukan, seperti dalam air liur manusia dan system sekresi pancreas.
1.4 Persiapan pasien
1. Beritahu pada pasien bahwa Pengambilan sampel lebih nyaman, mudah, dan tanpa rasa sakit karena pasien hanya perlu mengumpulkan air liur dalam tabung steril.
1.5 sampel
1. Solube starch 1 % (b/v) 2. Yeast extract 0,2 % 3. Peptone 0,5 % 4. MgSO4 0,05 % 5. NaCl 0,05 %
1.6 Alat & Reagensia 1. Beaker glass 2. Tabung reaksi 3. Cawan petri 4. Pipet ukur 5. Erlenmeyer 6. Pipet tetes
7. Shaker incubator 8. Spektrofotometer 9. Larutan iodine 10. Kapas
11. Media screening bakteri menghasil enzim amilase 1.7. Prosedur
1. Deteksi produksi enzim amilase oleh bakteri secara kualitatif
Goreskan isolate bakteri pengahsil amilase pada media screening yang telah ditentukan dan diinkubasi pada suhu ruang selama 24 jam
Koloni yang mampu menghasilkan amilase akan membentuk zona bening disekitar biakan dengan penambahan larutan iodine
Amati perubahan warna yang terjadi
2. Uji aktivitas enzim amilase
Aktifitas amilase diukur dengan penentuan Gula reduksi menggunakan metode DNS (asam 3,5 dinitrosalisilat), dimana 1 unit amilase didefinisikan sebagai jumlah enzim yang reaksinya menghasilkan produk setara dengan 1 μmol glukosa per menit pada kondisi tertentu. Preparasi enzim amilase kasar ( crude enzyme ) :
Ambil 1 ose bekteri dan masukkan ke dalam 100 mL media produksi amilase.
Inkubasi pada shaker incubator selama 18 jam pada 300C.
Biomassa dipisahkan dengan sentrifugasi dingin pada suhu 4oC 5000 rpm selama 10 menit. Filtrat yang terpisah merupakan enzim amilase kasar.
3. Uji aktivitas enzim :
Siapkan 4 tabung reaksi dan diberi label.
Pipet 1 ml enzim amilase kasar dan masukkan dalam 3 buah tabung reaksi sedangkan 1 tabung reaksi diisi dengan aquades 1 ml sebagai blanko.
Tambahkan 1 ml larutan substrat ( 1% soluble starch dalam buffer pH 4,6 dan 10 ) dan 1 ml aquades untuk blanko, tutup mulut tabung dengan alumunium foil.
Inkubasi pada suhu 37°C selama 30 menit.
Reaksi dihentikan dengan penambahan 1 ml reagen asam 3,5 dinitrosalisilat (DNS) kemudian dikocok dengan vortex.
Dipanaskan dalam air mendidih selama 15 menit sampai larutan berwarna merah-coklat.
Kemudian ditambahkan 1 mL larutan KNa-Tartrat 40 %. Tabung reaksi didinginkan dan ditambahkan dengan aquades hingga volumenya menjadi 10 mL dan dihomogenkan.
Diukur absorbansinya dengan spektrofotometer pada panjang gelombang 540 nm.
Kurva standar glukosa dibuat pada kisaran konsentrasi glukosa 200 - 1000 ppm dengan selang 2 ppm. (data sudah disediakan).
Jumlah gula reduksi yang dihasilkan dari reaksi enzimatis ditentukan berdasarkan persamaan kurva standar.
Aktivitas enzim amilase kasar dihitung dengan rumus berikut :
Keterangan:
AE = Aktifitas enzim ( Unit/mL) C = Konsentrasi glukosa
BM = Berat Molekul Glukosa = 180 g/mol t = Waktu Inkubasi (menit)
H = Volume total enzim-substrat (mL) E = Volume enzim (mL)
MENGIDENTIFIKASI METABOLISME KARBOHIDRAT 1.1 Pengertian
Karbohidrat merupakan senyawa organik yang paling melimpah di alam. Senyawa ini dapat ditemukan baik pada tubuh manusia, hewan maupun tumbuhan. Karbohidrat pada umumnya dibagi menjadi tiga golongan yaitu monosakarida, disakarida dan polisakarida.
Monosakarida merupakan karbohidrat yang paling sederhana, contohnya adalah glukosa, fruktosa dan galaktosa. Disakarida merupakan senyawa yang tersusun atas dua molekul monosakarida, sedangkan polisakarida adalah senyawa yang tersusun atas banyak molekul monosakarida (glukosa). Aldehida (-CHO) dan keton (=CO) merupakan gugus fungsi yang terdapat pada karbohidrat. Pada umumnya monosakarida bersifat optis aktif, mudah larut dalam air, berupa zat padat putih, bila dipanaskan akan berbau karamel dan mempunyai sifat mereduksi. Contoh dari senyawa monosakarida yaitu glukosa, galaktosa, fruktosa, dan sebagainya. Oligosakarida terdiri dari dua atau lebih monosakarida yang dihubungkan dengan ikatan glikosida. Senyawa tersebut dapat dihidrolisa dalam suasana asam menghasilkan monosakarida. Contoh dari senyawa ini antara lain adalah sukrosa, laktosa, dan maltosa.
Polisakarida merupakan polimer dari monosakarida. Contoh dari monosakarida antara lain amilum, selulosa, dan glikogen. Amilum merupakan zat tepung dalam tumbuhan yang dapat dijumpai pada beras, gandum, maupun umbi-umbian. Amilum terdiri dari amilosa dan amilopektin. Amilosa mengandung 300 unit glukosa dengan ikatan α-1,4 glikosidik, sedangkan amilopektin terdiri dari 1000 unit glukosa yang bergabung membentuk rantai lurus dengan ikatan α-1,6 glikosidik.
1.2 Tujuan
Untuk Mengidentifikasi senyawa-senyawa metabolisme kabohidrat secara kualitatif dan kuantitatif
1.3 Prinsip
Karbohidrat memiliki sifat Sifat-sifat kimia yang berbeda di alam. Sifat-sifat karbohidrat berkaitan dengan gugus fungsional yang terdapat dalam molekul yaitu gugus hidroksi, gugus aldehid, dan gugus keton. Beberapa sifat kimia karbohidrat dapat digunakan untuk mengidentifikasi dan membedakan senyawa karbohidrat yang satu dengan yang lainnya.
BAB II
1.4 Persiapan Pasien
1 .Beritahu pada pasien bahwa ia dipuasakan selama 8 jam sebelum pemeriksaan
2. Beritahu pada pasien bahwa pengukuran kadar glukosa darah sebelum minum larutan glukosa, dan pengukuran 2 jam setelah minum larutan glukosa 75 gram
1.5 Sampel
1. larutan Fehling A 2. Fehling B
3. glukosa 4. sukrosa 4. amilum 5. NaOH 10%
7. indicator phenplphtalein (pp) 8. larutan Iod 0.1N
1.6 Alat & Reagensia 1. Beaker glass
2. Tabung reaksi 3. Labu ukur 4. Pipet ukur 5. Bola hisap 6. Pipet tetes 7. Pemanas air 8. Spektrofotometri 9. Erlenmeyer 10. Corong 11. Kertas saring
12. Larutan gula (1 %) terdiri dari : Glukosa, Laktosa, Sukrosa 13.Larutan polisakarida: Pati
14. Larutan Fehling
Fehling A 3,5 g CuSO4/50 ml Fehling B terdiri dari campuran : Na-K-Tartarat 17,3 g/ 50 ml dan NaOH 6g/50 ml. Fehling A : B = 1:1)
15. Larutan iodin
16. Larutan standar glukosa
1.7 Prosedur
1. Analisa kualitatif Karbohidrat A. Fehling Test
Sebanyak 2 mL larutan sampel (fruktosa, glukosa, sukrosa, maltose, dan amilum) diambil dan dimasukkan kedalam tabung reaksi yang telah diletakkan di rak tabung reaksi. Fehling A dan Fehling B masing-masing 2 mL ditambahkan kedalam tabung reaksi. Setelah itu, larutan NaOH 10% sebanyak 4 tetes ditambahkan kedalam tabung reaksi. Tabung reaksi tersebut dijepit dengan penjepit tabung reaksi lalu dipanaskan di atas Bunsen yang menyala hingga mendidih. Perubahan warna yang terjadi pada larutan diamati. Reaksi positif pada Fehling test adalah adanya endapan merah bata.
B. Moore Test
Sebanyak 5 mL larutan sampel (fruktosa, glukosa, sukrosa, maltose, dan amilum) diambil dan dimasukkan kedalam tabung reaksi yang telah diletakkan di rak tabung reaksi. Larutan NaOH 10% sebanyak 5 mL ditambahkan ke dalam masing-masing sampel. Tabung reaksi tersebut dijepit dengan penjepit tabung reaksi lalu dipanaskan di atas Bunsen yang menyala hingga mendidih. Perubahan warna yang terjadi pada larutan diamati. Reaksi positif pada Moore test adalah warna kuning tak berendapan.
C. Hidrolisa
Sebanyak 5 mL larutan sampel (fruktosa, glukosa, sukrosa, maltose, dan amilum) diambil dan dimasukkan kedalam tabung reaksi yang telah diletakkan di rak tabung reaksi. Larutan H2SO4 10% sebanyak 1 mL ditambahkan ke dalam masing-masing sampel. Tabung reaksi tersebut dijepit dengan penjepit tabung reaksi lalu dipanaskan di atas Bunsen yang menyala hingga mendidih. Kemudian tabung tersebut didinginkan. Setelah dingin, larutan NaOH 10%
sebanyak 2 mL dan indikator PP sebanyak 2 tetes ditambahkan kedalam masing-masing sampel. Setelah itu, Fehling A dan Fehling B masing-masing sebanyak 2 mL ditambahkan ke dalam masing-masing sampel. Tabung reaksi dipanaskan lagi. Perubahan warna yang terjadi
pada larutan diamati. Reaksi positif pada hidrolisa adalah adanya endapan yang berwarna merah bata.
D. Iod Test
Sebanyak 5 mL larutan sampel (fruktosa, glukosa, sukrosa, maltose, dan amilum) diambil dan dimasukkan kedalam tabung reaksi yang telah diletakkan di rak tabung reaksi. Larutan iod sebanyak 5 tetes ditambahkan kedalam masing-masing sampel. Perubahan warna yang terjadi pada larutan diamati. Reaksi positif pada iod test adalah warna biru.
MENGIDENTIFIKASI METABOLISME KARBOHIDRAT LANJUTAN
1. Uji Fehling
Uji Fehling digunakan untuk menunjukkan sifat khusus karbohidrat dengan adanya karbohidrat pereduksi. Hasil uji menunjukkan bahwa glukosa dansukrosa merupakan gula yang dapat mereduksi larutan fehling dan sebagai karbohidrat pereduksi. Hal ini dapat dinyatakan bahwa golongan karbohidrat monosakarida dan disakarida positif terhadap kegiatan mereduksi larutan fehling tersebut. Pereaksi fehling ditambah karbohidrat kemudian dipanaskan, akan terbentuk endapan merah bata pada hasil akhir. Berikut adalah reaksi yang terjadi:
Dalam pereaksi ini ion Cu2+ direduksi menjadi Cu+ yang dalam suasana basa akan diendapkan menjadi Cu2O. Fehling B berfungsi untuk mencegah Cu2+ mengendap dalam suasana alkalis. Sedangkan pada sampel amilum yang tetap berwarna biru disebabkan karena amilum merupakan polisakarida yang tidak dapat bereaksi positif dengan pereaksi Fehling.
Amilum bukan gula pereduksi yang tidak mempunyai gugus aldehid dan keton bebas, sehingga tidak terjadi oksidasi antara amilum dengan larutan Fehling.Pereaksi fehling dapat direduksi selain oleh karbohidrat yang mempunyai siat mereduksi, juga dapat direduksi oleh reduktor lain. Pereaksi fehling terdiri atas dua larutan, yaitu larutan fehling A dan larutan fehling B. Larutan fehling A adalah CuSO4 dalam air, sedangkanlarutan fehling B adalah larutan garam KNa-tartrat dan NaOH dalam air. Dalam pereaksi ini Cu2+ direduksi menjadi ion Cu+ yang dalam suasana basa akan diendapkan sebagai Cu2O.
BAB III
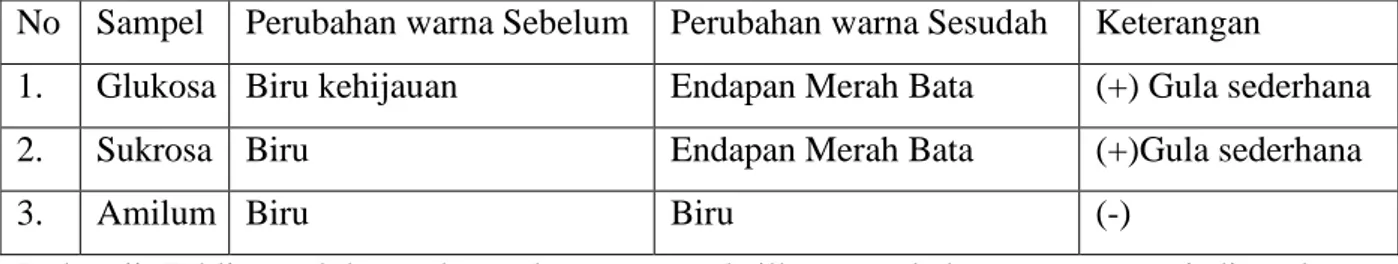
Tabel 1. Hasil Uji Fehling
No Sampel Perubahan warna Sebelum Perubahan warna Sesudah Keterangan
1. Glukosa Biru kehijauan Endapan Merah Bata (+) Gula sederhana
2. Sukrosa Biru Endapan Merah Bata (+)Gula sederhana
3. Amilum Biru Biru (-)
Pada uji Fehling, glukosa dan sukrosa mengahsilkan perubahan warna menjadi endapan merah bata yang menunjukkan bahwa glukosa dan sukrosa merupakan gula sederhana.
2. Uji Moore
Menurut Stryer (1996), uji Moore dilakukan untuk mengetahui adanya gugus alkali dengan reaksi pendamaran. NaOH sebagai sumber ion OHakan berikana dengan rantai aldehid dan membentuk aldehid dengan cabang gugus alkanolPada percobaan ini, hasil positif ditunjukkan dengan perubahan warna menjadi coklat. Glukosa dan sukrosa menunjukkan hasil positif. Bau caramel yang khas adalah akibat dari sejumlah hasil fragmentasi dan dehidrasi gula. Warna coklat tetapi tidak berbau caramel karena sampel mengandung konsentrasi gula yang sedikit.
Sedangkan jika berbau caramel tetapi berwarna coklat, memiliki konsentrasi gula yang tinggi.
Reaksi ini disebut juga reaksi pendamaran. Uji Moore menggunakan NaOH yang berfungsi sebagai sumber ion OH-(alkali) yang akan berikatan dengan rantai aldehid dan membentuk aldol aldehid yang berwarna kekuningan. Mekanisme uji Moore yaitu ketika sampel ditambahkan dengan pereaksiNaOH 10% maka NaOH akan mensubtitusi OH-. Untuk membentuk aldol aldehid yang titik leburnya lebih rendah. Kemudian dengan pemanasan maka membuat glukosa mencapai titik didihnya dan menyebabkan timbulnya aroma caramel yang khas. Pemanasan bertujuan untuk membuat ikatan karbon dengan hydrogen dan menggantikannya dengan gugus –OH. Ketika pemanasan terus berlanjut maka glukosa mencapai titik leburnya dan terbentuklah warna coklat pada larutan glukosa. Timbulnya aroma tetapi tidak menimbulkan warna coklat juga disebabkan karena konsentrasi glukosa.
NaOH 10% digunakan sebagai pereaksi yang juga berfungsi memberikan suasana alkali, menghidrolisis, serta menurunkan titik lebur dari glukosa. Jika penggunaan NaOH kurang dari 10% konsentrasinya, maka dikhawatirkan tidak akan terjadi karamelisasi pada larutan glukosa.
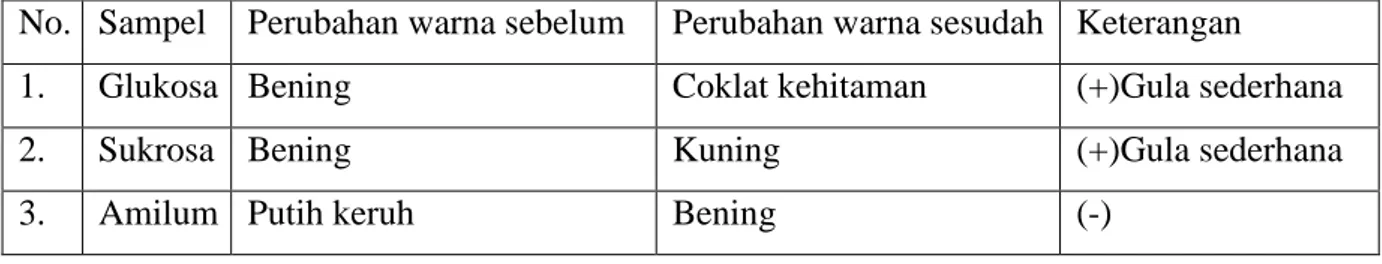
Tabel 2 Hasil uji Moore.
No. Sampel Perubahan warna sebelum Perubahan warna sesudah Keterangan
1. Glukosa Bening Coklat kehitaman (+)Gula sederhana
2. Sukrosa Bening Kuning (+)Gula sederhana
3. Amilum Putih keruh Bening (-)
3. Uji Hidrolisa
Hidrolisa dilakukan dengan tujuan untuk memecah karbohidrat kompleks menjadi sederhana. Penambahan H2so4 10% berfungsi sebagai dekstruktif dan menghidrolisis ikatan disakarida agar menajdi monosakarida. Pemanasan yang dilakukan bertujuan untuk mempercepat reaksi. Sedangkan, penambahan NaOH 10% bertujuan untuk menangkap senyawa yang tidak ikut bereaksi dan sebagai zat penguji gula. Indikator PP digunakan sebagai indikator. Test Fehling bertujuan untuk mengetahui apakah hidrolisis berlangsung dengan baik. Reaksi akhir yang menunjukkan positif adalah terbentuknya endapan merah bata. Pada percobaan ddapatkan bahwa sukrosa dan amilum menunjukkan hasil positif. Pada amilum, didapatkan warna hijau, namun sukrosa masih termasuk walaupun memiliki kandungan paling kecil. Sedangkan glukosa mengapa tidak positif karena glukosa sudah tidak dapat terhidrolisis lagi walaupun juga memliki warna hijaupada akhir reaksi. Proses hidrolisis pati yaitu pengubahan molekul pati menjadi monomernya atau unit-unit penyusunnya seperti glukosa. Hidrolisis pati dapat dilakukan dengan bantuan asam atau enzim pada suhu, pH, dan waktu reaksi tertentu. Pada hidrolisis pati menggunakan asam yaitu HCl, larutan pati ditambahkan HCl dan dipanaskan dengan variasi waktu. Larutan asam campuran dekstrin, maltose, dan, dan glukosa.
Tabel 3. Hasil Uji Hidrolisa
No Sampel Perubahan warna Sebelum +H2SO4 +NaOH +Fehling Keterangan
1. Glukosa Bening Tetap Kuning Hijau (-)
2. Sukrosa Bening Coklat Coklat Orange (+)
3. Amilum Putih Bening Bening Hijau (+)
Pada uji Hidrolisa, sukrosa dan amilum positif terhidrolisis melalui perubahan warna di akhir percobaan yaitu endapan oren pada sukrosa dan hijau kebiruan pada amilum
4. Uji Iod
Karbohidrat dengan golongan polisakarida akan memberikan reaksi dengan larutan Iodium dan memberikan warna biru kehitaman yang menunjukkan adanya amilum (pati) pada sampel. Reaksi yang terjadi sebagai berikut:
Hasil percobaan menunjukkan hanya amilum yang menunjukkan reaksi positif karena dalam larutan pati terdapat unit-unit glukosa yang membentuk rantai heliks karena adanya ikatan dengan konfigurasi pada tiap unit glukosanya. Hal inilah yang menyebabkan amilum menyebabkan warna biru kehitaman. Percbobaan tersebut sesuai dengan pendapat Fessenden (1986) yang menyatakan bentuk rantai heliks ini menyebabkan pati dapat membentuk kompleks dengan molekul iodin yang dapat masuk
ke dalam spiralnya sehingga menyebabkan warna biru tua pada kompleks tersebut. Uji pati- iodium berdasarkan pada penambahan iodium pada suatu polisakarida yang menyebabkan terbentuknya kompleks adsorpsi berwarna spesifik. Amilum atau pati dengan iodium menghasilkan warna biru, dekstran menghasilkan warna merah anggur, glikogen dan sebagian pati yang terhidrolisis bereaksi dengan iodium membentuk warna merah coklat.
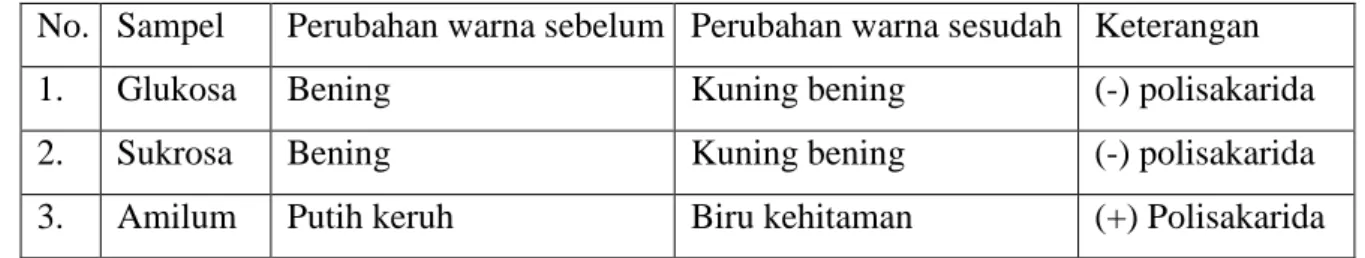
Tabel 4. Hasil Uji Iod
No. Sampel Perubahan warna sebelum Perubahan warna sesudah Keterangan
1. Glukosa Bening Kuning bening (-) polisakarida
2. Sukrosa Bening Kuning bening (-) polisakarida
3. Amilum Putih keruh Biru kehitaman (+) Polisakarida
Pada uji Iod, hanya amilum yang menunjukkan hasil positif termasuk polisakarida dengan menunjukkan perubahan warna menjadi biru kehitaman.Dalam tubuh manusia, karbohidrat dapat dibentuk dari beberapa asam amino dan sebagian dari gliserol lemak. Tetapi sebagian besar karbohidrat diperoleh dari bahan makan yang dimakan sehari-hari, terutama bahan makanan yang berasal dari tumbuh-tumbuhan. Dalam tubuh, karbohidrat berguna utnuk mencegah timbulnya ketosis, pemecahan protein yang berlebihan, kehilangan mineral, dan berguna untuk membantu metabolisme lemak dan protein.
Analisis kualitatif glukosa pada contoh biokimia seperti urin dapat dilakukan dengan menggunakan tes Tromer, tes Fehling atau Tes Nilender.
1. Reaksi Tromer dan Fehling
Reagen yang digunakan pada tes ini adalah reagen Fehling yang dimodifikasi dengan reagen Tromer dimana garam Segnet akan bereaksi dengan bentuk antara yaitu Cu(OH)2. Dengan bantuan pemanasan, reagen yang berwarna biru akan membentuk larutan kuning dan akan menjadi merah dengan pemanasan lanjut. Jika tidak ada glukosa dalam urin maka warna reagen tidak berubah
2. Reaksi Nilander
Reaksi ini sangat sensitif dalam mendeteksi glukosa dalam kadar rendah hingga konsentrasi sekitar 0,5 g/l. Reagen Nilander, yang mengandung garam bismut, direksikan dengan contoh yang mengandung glukosa dan dilakukan pemanasan dengan menggunakan penangas air.
Setelah beberapa menit, larutan akan semakin gelap dimana glukosa akan mereduksi Bi(OH)3 sampai terbentuk Bismut bebas dan endapan berwarna hitam terbentuk.
3. Reaksi Fischer
Glukosa, laktosa dan karbohidrat yang memiliki gugus aldehid bebas (aldosa) jika direaksikan dengan fenil hidrazin dan dibantu dengan pemanasan akan membentuk ozazone yang berupa kristal dengan bentuk spesifik. Kristal glukozazon berbentuk whisk sedangkan kristal laktozazon berbentuk seperti bulu babi. Selain mengamati bentuk kristal ozazon dengan mikroskop, analisis kualitatif monosakarida juga dilakukan dengan menentukan titik leleh kristal ozazon yang terbentuk. Dimana glukozazon dan fruktozazon meleleh pada 210oC, galaktozazon meleleh pada 180oC dan pentozazon meleleh pada 160oC.
Daftar Analisis Kualitatif Karbohidrat No. Te
s
Hasil positif untuk Keteranga n 1 Tes Molish Semua
karbohidrat.
Monosakarida menghasilkan warna ungu
dengan cepat Hasil negatif (kiri) dan hasil positif (kanan) sedangkan
polisakarida bereaksi lebih Lambat 2 Tes I2/KI Pati
Hasil negatif (kiri) dan hasil positif (kanan) 3 Tes Barfoed Gula pereduksi
(monosakarida)
Hasil negatif (kiri) dan hasil positif (kanan) 4 Tes Seliwanoff Ketosa
Hasil negatif (kiri) dan hasil positif (kanan)
5 Tes Benedict Gula pereduksi
Hasil negatif (kiri) dan hasil positif (kanan) 6 Tes Bial Pentosa
Hasil negatif (kiri dan tengan) dan hasil positif (kanan)
2. Analisis karbohidrat secara Kuantitatif
Penentuan kadar gula dalam beberapa sampel biokimia dapat dianalisis dengan menggunakan instrumen spektrofotometri dan kromatografi. Beberapa contoh penentuan gula dijelaskan seperti di bawah ini.
1. Penentuan Kadar Glukosa Secara Colourmetric
Prinsip analisis ini berdasarkan pengukuran hasil reaksi oksidasi glukosa melalui proses enzimatis secara colourmetric. Dengan adanya oksigen, glukosa dioksidasi oleh glukosa oksidase (GOD) menjadi asam glukonik dan hidrogen peroksida (H2O2). Hidrogen peroksida akan bereaksi dengan 4-klorofenol dan 4-aminoantipirin dengan katalis peroksidase (POD) dan membentuk quinoneimine yang berwarna merah. Intensitas zat warna yang terbentuk memiliki proporsi yang sama dengan konsentrasi glukosa dan dapat diukur menggunakan spektrofotometer.
2. Penentuan Kadar Glukosa dengan Reaksi Fehling secara Titrimetri
Kadar glukosa dalam contoh urin dapat dianalisis dengan menggunakan prinsip reaksi Fehling. Reagen Fehling yang digunakan adalah CuSO4 (Fehling I), garam Segnet yang dicampurkan dengan larutan NaOH (Fehling II). CuSO4 pada reagen Fehling akan mengalami reduksi menjadi Cu2O, dimana 1 mL reagen fehling setara dengan 0,005 gram glukosa.
Prosedur analisis ini yaitu campuran 2,5 mL Fehling I; 2,5 mL Fehling II dan 20 mL air terdistilasi dititrasi menggunakan contoh urin sambil dididihkan di atas pemanas. Warna biru
pada larutan akan berubah menjadi hijau dan kemudian menjadi kuning. Ketika warna kuning menghilang, maka titik ekuivalen tercapai. Kadar glukosa dapat ditentukan dengan cara:
glukosa = 1000 ml × 5 ml × 0,005 g a ml
Dimana a adalah volume contoh urin yang digunakan selama proses titrasi dan 5 adalah volume reagen Fehling yang digunakan.
3. Penentuan gula reduksi dengan metode Dinitro Salicylic Acid (DNS)
Pembuatan kurva standar Cara kerja :
Untuk membuat kurva standar terlebih dahulu dibuat larutan glukosa dengan konsentrasi 0, 200, 400, 600, 800, dan 1000 ppm. Setelah itu diambil 1 mL dari masing-masing konsentrasi dan dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan ke dalam tabung reaksi 1 mL reagen DNS dan dihomogenkan. Ditutup mulut tabung dengan alumunium foil dan dipanaskan dalam air mendidih selama 5-15 menit sampai larutan berwarna merah-coklat.
Kemudian ditambahkan 1 mL larutan KNa-Tartrat 40 %. Tabung reaksi didinginkan dan ditambahkan dengan aquades hingga volumenya menjadi 10 mL dan dihomogenkan.
Selanjutnya diukur absorbansinya dengan spektrofotometer pada panjang gelombang 540 nm.
Penetapan kadar gula reduksi dalam sampel : 1. Timbang sampel buah 1 g dan diekstrak dengan 20 ml air 2. Saring dan masukkan labu ukur 100 ml, tera sampai tanda batas 3. Pipet 1 ml larutan jernih sampel dan encerkan sampai 100 ml
4. Siapkan 2 tabung reaksi. Masukkan 1 ml aquades (blanko) pada salah satu tabung dan tabung yang lain diisi dengan 1 ml sampel
5. Tambahkan masing-masing tabung dengan 1 ml reagen DNS dan dihomogenkan.
6. Ditutup mulut tabung dengan alumunium foil dan dipanaskan dalam air mendidih selama 15 menit sampai larutan berwarna merah-coklat.
7. Kemudian ditambahkan 1 mL larutan KNa-Tartrat 40 %.
8.Tabung reaksi didinginkan dan ditambahkan dengan aquades hingga volumenya menjadi 10 mL dan dihomogenkan
9.Selanjutnya diukur absorbansinya dengan spektrofotometer pada panjang gelombang 540 nm. Kadar gula reduksi dihitung dengan rumus berikut :
Kadar gula reduksi:
fp = faktor pengenceran
1.8 Nilai Normal
Kadar glukosa darah dalam keadaan normal berkisar antara 70-110 mg/dl.
Nilai normal kadar glukosa dalam serum dan plasma 75-115 mg/dl, kadar gula 2 jam postprandial < 140 mg/dl, dan kadar gula darah sewaktu < 140 mg/dl (Widyastuti, 2011).
MENGIDENTIFIKASI METABOLISME PROTEIN
1.1 Pengertian
Protein merupakan komponen utama semua sel hidup. Protein ini berfungsi sebagai pembentuk struktur sel yang menghasilkan hormone, enzim, dll. Ditinjau dari segi kimia protein merupakan suatu senyawa polimer dari asam-asam amino dengan berat molekul yang tinggi. Ditinjau dari unsur yang menyusun protein terdiri atas unsure-unsur C,H,O dana N.
Beberapa diantara protein juga mengandung belerang, fosfor dan beberapa logam seperti seng, besi dan tembaga. Banyaknya unsure N dalam suatu bahan pangan merupakan criteria penetapan kadar protein. Pada umumnya protein mempunyai sifat sebagai senyawa amorf, tidak berwarna, mempunyai titik leleh dan titik didih yang tidak tetap, tak larut dalam pelarut organik dan apabila dilarutkan dalam air membentuk suatu larutan koloid. Protein mudah rusak karena pengaruh panas, penambahan logam dan pengaruh asam atau basa.
1.2 Tujuan
Mempelajari sifat protein dan menentukan kadar protein secara kualitatif dan kuantitatif.
BAB IV
1.3 Prinsip
Pengukuran kadar protein secara kualitatif yaitu memanfaatkan interaksi Cu2+ dengan ikatan peptida sehingga dihasilkan warna ungu. Warna yang terbentuk akan diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang 540 nm. Penentuan kadar protein memerlukan suatu standar (kurva standar) yang memberikan range tertentu dan Pengukuran protein secara kuantitatif dapat juga dilakukan dengan menggunakan metode biuret.
1.4. persiapan pasein
1. Tanyakan kepada pasien apakah ia sedang menjalani mengonsumsi obat-obatan tertentu, baik obat bebas maupun obat resep. Obat-obatan tertentu dapat memengaruhi kadar protein dalam urine.
2. Beritahu kepada pasien bahwa Pemeriksaan protein urine dilakukan pemeriksaan urine sewaktu dan pemeriksaan urine 24 jam.
1.5 Sampel Putih telur Ayam
1.6 Alat & Reagensia 1. Aquades
2. Penangas air 3. Tabung reaksi 4. Spektrofotometri 5. Kalium natrium tartrat 6. NaOH 10%
7. Pereaksi biuret: Reagen beuret larutkan 1.5 gr CuSO4.5H20 dan 6 g Kalium natrium tartrat dengan sedikit air kemudian tambahkan 300 ml NaOH 10%, kocok dan lartkan, diencerkan sampai 1 L larutan.
Larutan protein standar (bovin serum abumin) 5 mg/ml
MENGIDENTIFIKASI METABOLISME PROTEIN LANJUTAN
1.7 Prosedur
1. Analisa kualitatif Protein
Adanya protein dalam suatu sampel dapat diketahui secara kualitatif dengan menggunakan uji biuret dan ninhidrin sebagai berikut.
Uji Biuret
Uji ini menggunakan reagen biuret yang mengandung NaOH dan CuSO4 encer. Reagen biuret akan bereaksi dengan ikatan peptida protein pada sampel. Adanya protein sampel ditunjukkan perubahan sampel menjadi warna ungu. Pembentukan warna disebabkan karena adanya kompleks ion Cu+ dengan ikatan peptida protein.
Uji Ninhidrin
Prinsip dari uji ini adalah interaksi antara ninhidrin dengan asam amino bebas. Asam amino bebas memliki gugus -NH2 yang tidak digunakan untuk membentuk ikatan peptida dengan asam amino lain. Adanya asam amino bebas pada uji ninhidrin ditunjukkan dengan pembentukan warna biru sampel.
1. Isolasi Protein dari Bahan Pangan
Isolasi protein dari putih telur:
Campurkan 25 ml putih telur ayam dengan 150 ml aquades, mengocok campuran tersebut dengan kuat sehingga diperoleh koloid yang baik, menyaring endapannya dan filtrate yang diperoleh siap digunakan untu percobaan berikutnya.
Denaturasi karena Penambahan Asam Asetat
Tepatkanlah 5 ml larutan protein kedalam tabung reaksi dan tambahkan 10 tetes asam asetat 10% sambil dikocok, amati perubahan yang terjadi.
Panaskan tabung dalam penangas air selama 5 menit. Amati perubahannya.
BAB V
Analisa Protein secara kuantitatif
1. Analisa kuantitatif protein dengan Metode Biuret
Metode biuret salah satu cara menentukan kadar protein. Dalam larutan basa, Cu2+
membentuk kompleks dengan ikatan peptide dan suatu protein menghasilkan warna ungu pada absorbansi maksimum 540 nm. Analisa kuantitatif protein dengan metode biuret Metode biuret merupakan salah satu cara terbaik untuk menentukan kadar protein suatu bahan, dalam larutan basa Cu2+ akan membentuk kompleks dengan ikatan peptida (-CO-NH-) dari suatu protein yang menghasilkan warna ungu dengan absorbansi maksimum pada 540 nm.
Cara kerja :
Pembuatan kurva standar
Masukkan ke dalam tabung reaksi masing-masing 0 (blanko); 0,1; 0,2; 0,4;
0,6; 0,8; dan 1 ml larutan protein standar. Tambahkan air sampai volume total masing-masing 4 ml
Tambahkan 6 ml pereaksi biuret ke dalam masing-masing tabung reaksi dan campur merata
Diamkan tabung reaksi pada suhu ruang selama 30 menit sampai membentuk warna ungu sempurna
Ukur absorbansinya (OD) pada 540 nm
Buat kurva standar hubungan antara konsentrasi protein dan OD Penetapan kadar protein dalam sampel
Timbang sampel 1 g dan diekstrak dengan 20 ml air
Saring dan masukkan labu ukur 100 ml, tera sampai tanda batas
Pipet 1ml larutan sampel dan tambahkan air sampai volume total masing- masing 4 m
Tambahkan 6 ml pereaksi biuret ke dalam masing-masing tabung reaksi dan campur merata
Diamkan tabung reaksi pada suhu ruang selama 30 menit
sampai membentuk warna ungu sempurna
Ukur absorbansinya pada 520 nm
Jumlah protein dapat ditentukan berdasarkan kurva standar
Kadar protein dihitung dengan rumus berikut : Kadar Protein
fp = faktor pengenceran
1.8. Nilai Normal
1. Orang dewasa: 3,5 - 5,0 g/dl 2. Anak-anak: 4 - 5,9 g/dl 3. Bayi: 4,4 - 5,4 g/dl 4. Neonatus: 2,9 - 5,4 g/dl Secara umum:
Nilai Normal Keterangan
< 3,5 g/dl Rendah 3,5 - 5,2 g/dl Normal
> 5,2 g/dl Tinggi
MENGIDENTIFIKASI METABOLISME LIPID
1.1 Pengertian
Lipid atau lemak merupakan senyawa organik yang banyak ditemukan dalam sel jaringan, tidak larut dalam air, larut dalam zat pelarut non polar seperti (eter, kloroform, dan benzena). Lipid bersifat non polar atau hidrofolik. Penyusun utama lipida adalah trigliserida, yaitu ester gliserol dengan tiga asam lemak yang bisa beragam jenisnya. Rumus kimia trigliserida adalah CH2COOR-CHCOOR’-CH2-COOR‖ dimana R, R’ dan R‖ masing-masing adalah sebuah rantai alkil yang panjang. Ketiga asam lemak RCOOH, R’COOH dan R‖COOH. Fungsi lipid yaitu sebagai sumber energi, cadangan energi dalam bentuk triasilgliserol, sebagai insulator yaitu penahan panas agar suhu tubuh dapat dipertahankan dalam kondisi normal. Lemak dan minyak merupakan lipida sederhana. Kegunaan bahan ini dalam kehidupan sehari-hari cukup luas, seperti digunakan sebagai bahan penggorengan, bahan pengencer cat dan lain-lain. Dari segi kimia lipida dapat dipandang sebagai senyawa turunan ester dari gliserol dan asam-asam lemak tinggi. Minyak pada umumnya diperoleh dari bahan tumbuhan maupun hewan. Minyak dari tumbuhan dikenal dengan minyak nabati, sedangkan minyak yang dari hewan disebut minyak hewani.
1.2 Tujuan
1. Untuk Mengidentifikasi lipid menggunakan uji kualitatif dan Kuantitatif.
1.3 Prinsip
Lipida adalah segolongan senyawa yang berasal dari makhluk hidup relatif tidak larut dalam air, akan tetapi larut dalam zat-zat pelarut nonpolar. Tiap-tiap jenis lipida dapat mempunyai fungsi sendiri dalam tubuh
1.4 Persiapan pasien
1. Beritahukan kepada pasien bahwa uji tersebut membutuhkan sampel darah.
2. Tanyakan kepada pasien mengenai obat-obatan yang digunakan pasien yang mungkin memengaruhi hasil uji. Obat-obatan tersebut mungkin perlu dibatasi.
1.5 Sampel Minyak Goreng
BAB VI
Mentega
1.6 Alat & Reagensia 1. Beaker glass
2. Tabung reaksi 3. Labu ukur 4. Pipet ukur 5. Pipet tetes 6. Buret dan statis 7. Erlenmeyer 8. Corong 9. Aseton 10. Asam sulfat 11. Air
12. Etanol 13. KHSO4 14. Kloroform 15. Iodin hubl 16. Hcl
17. floroglusinol 18. Serbuk CaCO3
1.7. Prosedur
Penentuan adanya lipida dalam suatu bahan dapat dilakukan dengan berbagai macam analisa.
alah satunya adalah dengan menggunakan analisa kualitatif untuk menentukan adanya lipida atau tidak (Febrianto, 2013), yaitu:
1. Analisa Kualitatif Lemak
Uji Kelarutan Lipid
Ambil tabung reaksi dan masing-masing diisi dengan 2 ml larutan aseton, etanol dan air.
Kemudian dalam tiap tabung ditambahkan 1 tetes minyak dan tabung yang lain ditambahkan mentega. Tutup mulut tabung tersebut dan dikocok selama 1 menit. Selanjutnya biarkan selama 5 menit. Amati perubahan yang terjadi dalam setiap tabung reaksi.
Uji Acrolein
lemak dipanaskan setelah ditambahkan agen pendehidrasi (KHSO4) yang akan menarik air, maka bagian gliserol akan terdehidrasi ke dalam bentuk aldehid tidak jenuh atau dikenal sebagai akrolein (CH2=CHCHO) yang memiliki bau seperti lemak terbakar dan ditandai dengan asap putih.
Uji Kejenuhan
Asam lemak yang diuji ditambah kloroform sama banyaknya. Tabung dikocok sampai bahan larut. Setelah itu, tetes demi tetes pereaksi Iod Hubl dimasukkan ke dalam tabung sambil dikocok dan diamati perubahan warna yang terjadi terhadap campuran diamati. Reaksi positif ketidakjenuhan asam lemak ditandai dengan timbulnya warna merah asam lemak, lalu warna kembali lagi ke warna awal kuning bening. Warna merah yang kembali pudar menandakan bahwa terdapat banyak ikatan rangkap pada rantai hidrokarbon asam lemak. Warna merah muda yang hilang selama reaksi menunjukkan bahwa asam lemak tak jenuh telah mereduksi pereaksi iod huble.
Uji Ketengikan
Minyak yang akan diuji dicampurkan dengan HCl. Selanjutnya, sebuah kertas saring dicelupkan ke larutan floroglusinol. Floroglusinol ini berfungsi sebagai penampak bercak.
Setelah itu, kertas digantungkan di dalam erlenmeyer yang berisi minyak yang diuji. Serbuk CaCO3 dimasukkan ke dalam erlenmeyer dan segera ditutup. HCl yang ditambahkan akan menyumbangkan ion-ion hidrogennya yang dapat memecah unsur lemak sehingga terbentuk lemak radikal bebas dan hidrogen radikal bebas. Kedua bentuk radikal ini bersifat sangat reaktif dan pada tahap akhir oksidasi akan dihasilkan peroksida.
Uji Salkowoski untuk kolesterol
Kolesterol dilarutkan dengan kloroform anhidrat lalu dengan volume yang sama ditambahkan asam sulfat. Asam sulfat berfungsi sebagai pemutus ikatan ester lipid. Apabila dalam sampel tersebut terdapat kolesterol, maka lapisan kolesterol di bagian atas menjadi berwarna merah dan asam sulfat terlihat berubah menjadi kuning dengan warna fluoresens hijau.
MENGIDENTIFIKASI METABOLISME LIPID LANJUTAN 1. Uji Kelarutan Lipid
Uji ini terdiri atas analisis kelarutan lipid maupun derivat lipid terhadap berbagai macam pelarut. Dalam uji ini, kelarutan lipid ditentukan oleh sifat kepolaran pelarut. Apabila lipid dilarutkan ke dalam pelarut polar maka hasilnya lipid tersebut tidak akan larut. Hal tersebut karena lipid memiliki sifat nonpolar sehingga hanya akan larut pada pelarut yang sama-sama nonpolar.
2. Uji Acrolein
Dalam uji ini terjadi dehidrasi gliserol dalam bentuk bebas atau dalam lemak/minyak menghasilkan aldehid akrilat atau akrolein. Uji akrolein digunakan untuk menguji keberadaan gliserin atau lemak.
3. Uji Kejenuhan
Uji ketidakjenuhan digunakan untuk mengetahui asam lemak yang diuji apakah termasuk asam lemak jenuh atau tidak jenuh dengan menggunakan pereaksi Iod Hubl. Iod Hubl ini digunakan sebagai indikator perubahan. Trigliserida yang mengandung asam lemak yang mempunyai ikatan rangkap dapat diadisi oleh golongan halogen. Pada uji ketidakjenuhan, pereaksi iod huble akan mengoksidasi asam lemak yang mempunyai ikatan rangkap pada molekulnya menjadi berikatan tunggal.
4. Uji Ketengikan
Uji kualitatif lipid lainnya adalah uji ketengikan. Dalam uji ini, diidentifikasi lipid mana yang sudah tengik dengan yang belum tengik yang disebabkan oleh oksidasi lipid.
5. Uji Uji Salkowski untuk kolesterol
Uji Salkowski merupakan uji kualitatif yang dilakukan untuk mengidentifikasi keberadaan kolesterol.
2. Analisa Kuantitatif Lemak
1. Penentuan Asam Lemak Bebas (FFA) Bahan:
NaOH 0,1 N
Indicator pp 1%
Etanol 96 %
BAB VII
Minyak goreng Prosedur Kerja
1. Timbang 10 gram minyak dan masukkan 10 ml etanol, kocok hingga merata, kemudian tambahkan 3 tetes pp.
2. Titrasi dengan NaOH 0,1 N sampai warna merah jambu tercapai dan tidak hilang selama 30 detik.
2. Uji Lieberman Buchard
Uji Lieberman Buchard merupakan uji kuantitatif untuk kolesterol. Prinsip uji ini adalah mengidentifikasi adanya kolesterol dengan penambahan asam sulfat ke dalam campuran.
Bahan:
Asam asetat
Kloroform
Asam sulfat pekat Prosedur Kerja
Sebanyak 10 tetes asam asetat dilarutkan ke dalam larutan kolesterol dan kloroform (dari percobaan Salkowski). Setelah itu, asam sulfat pekat ditambahkan. Tabung dikocok perlahan dan dibiarkan beberapa menit. Mekanisme yang terjadi dalam uji ini adalah ketika asam sulfat ditambahkan ke dalam campuran yang berisi kolesterol, maka molekul air berpindah dari gugus C3 kolesterol, kolesterol kemudian teroksidasi membentuk 3,5kolestadiena. Produk ini dikonversi menjadi polimer yang mengandung kromofor yang menghasilkan warna hijau.
Warna hijau ini menandakan hasil yang positif. Reaksi positif uji ini ditandai dengan adanya perubahan warna dari terbentuknya warna pink kemudian menjadi biru ungu dan akhirnya menjadi hijau tua.
1.8. Nilai Normal
MENGIDENTIFIKASI KELAINAN DALAM PROSES METABOLISME
1.1 Pengertian kelainan Metabolisme
Kelainan Metabolisme adalah keadaan tubuh yang tidak mampu menjalankan proses metabolisme karena sesuatu dan hal lain. Yang paling berpengaruh atau ketidak bisaan tubuh yang ditemukan disebabkan oleh kelainan yang tidak memiliki suatu enzim yang diperlukan untuk membantu metabolisme. Kelainan yang sering terjadi disebabkan oleh kelainan genetik yang mengakibatkan suatu proses tertentu yang diperlukan untuk menciptakan suatu metabolisme. Yang paling sering terjadi adalah kelainan metabolisme, karbohidrat merupakan salah satu zat yang memiliki jenis-jenis yang beragam diantaranya glukosa, sukrosa dan fruktosa. Beberapa jenis KH tersebut dalam tubuh harus dimetabolisme (dipecah) sebelum digunakan tubuh. pemecahan karbohidrat memerlukan sebuah enzim. kelainan Metabolisme karbohidrat biasanya karena ketidakmampuan tubuh memiliki enzin pemecah. Beberapa jenis karbohidrat tersebut sehingga KH yang akan terpecah dalam tubuh tidak dapat ter- Metabolisme
1. Pengertian kelainan dalam proses metabolisme karbohidrat pada Diabetes melitus
Diabetes melitus (DM) didefinisikan sebagai suatu penyakit atau gangguan metabolisme kronis dengan multi etiologi yang ditandai dengan tingginya kadar gula darah disertai dengan gangguan metabolisme karbohidrat, lipid, dan protein sebagai akibat insufisiensi fungsi insulin. Insufisiensi fungsi insulin dapat disebabkan oleh gangguan atau defisiensi produksi insulin oleh sel-sel beta Langerhans kelenjar pankreas, atau disebabkan oleh kurang responsifnya sel-sel tubuh terhadap insulin .
BAB VIII
2. Pengertian kelainan dalam proses metabolisme lipid pada Hiperlipidemia
Hiperlidemia adalah suatu kondisi kelebihan lemak dalam sirkulasi darah. kondisi ketidakseimbangan lemak dalam darah, yang ditandai dengan kadar kolesterol dan trigliserida yang tinggi. Walaupun keduanya berguna bagi tubuh, bila kadarnya tinggi akan menyebabkan penumpukan plak pada dinding pembuluh darah.
3.Pengertian kelainan dalam proses metabolisme protein pada Phenylketonuria
Phenylketonuria atau PKU ialah suatu penyakit yang disebabkan karena seseorang tidak mampu merubah asam amino fenilalanin menjadi tirosin. Ketidakmampuan merubah asam amino fenilalanin menjadi tirosin disebabkan karena penderita tidak memiliki enzim fenilalanin hidroksilase (PAH) yang berfungsi merubah asam amino fenilalanin menjadi asam amino tirosin. Fenilalanin yang bersumber dari protein makanan akan terakumulasi dan menyebabkan kekurangan tirosin. Fenilalanin yang berlebihan dapat dimetabolisme menjadi phenylketones
1.2 Tujuan
1. Untuk menentukan adanya glukosa dalam darah pada Diabetes melitus 2. Untuk menentukan adanya kolesterol dalam darah pada Hiperlipidemia
3. untuk mengetahui metode terbaik untuk mendeteksi keberadaan senyawa fenilalanin pada sampel buatan dan sampel urine sehingga dapat diaplikasikan lebih lanjut untuk deteksi dini penyakit Phenylketonuria (PKU).
1.3 Prinsip
1.menentukan kelainan dalam proses metabolisme kolesterol
Gula akan mereduksi K3Fe(CN)6. Sisa K3Fe(CN)6 akan direaksikan dengan KI yang akan menghasilkan I2. I2 yang dihasilkan dititer dengan Na2S2O3. Dengan perhitungan kimia K3Fe(CN)6 yang telah tereduksi dapat diperhitungkan yang setara dengan jumlah gula.
2. menentukan kelainan dalam proses metabolisme kolesterol
Kolesterol dengan ascetic anhydride dan asam sulfat pekat pada temperature kamar membentuk senyawa bewarna hijau tua. Dengan ini cara ekstraksi dan deproteinisasi dapat ditiadakan.
3.menentukan kelainan dalam proses metabolisme protein
Penentuan kadar fenilalanin dalam serum darah dapat dilakukan menggunakan kromatografi gas. Sampel dipreparasi dengan asam nitrit membentuk asam fenilaktat. Kemudian diekstraksi dengan eter dan diderivatisasi menggunakan bis(trimetilsilil)trifloroasetamida dalam suasana mild.
1.4 Persiapan pasien
1. Beritahu pada pasein untuk Puasa selama 10 jam karena merupakan syarat yang penting dalam pemeriksaan glukosa darah, sebab hasil yang didapat lebih bermakna bila dibandingkan pemeriksaan sewaktu waktu (random)
1.5 Alat & Reagensia
1. Alat dan Reagensia menentukan adanya kelainan dalam proses metabolisme karbohidrat yaitu pada penderita Diabetes melitus
Buret micro 2 ml
Tes tube
Blood lancet
Kapas,funel
Penangas air (waterbath)
Zincsulfat 0,45%
NaOH 0,1N
K3Fe(CN)6 0,005N
KI
Asetic acid
Amilum
Na2S2O3 0,005N Fungsi reagen
Campuran Zincsulfat dan NaOH merupakan pengendap protein sebab mengganggu reaksi kimia. Amilum berfungsi sebagai indikator yang bewarna biru dengan I2.
2. Alat dan Reagensia menentukan adanya kolesterol pada penderita Hiperlipidemia
Spektrofotometer atau filter fotometer
Kuvet
Tabung reaksi
Reagensia pewarna (campuran asam asetat glacial dengan asam asetat anhidrat)
Standard kolesterol atau serum kolesterol
Serum sampel
Asam sulfat konsentrid pa
3. Alat dan Reagensia menentukan adanya kelainan dalam proses metabolisme protein yaitu pada penderita Phenylketonuria
Bejana pengembang untuk KK dan KLT
pipa kapilter
Labu takar
oven
gelas piala
pipet tetes
mikro pipet
kertas saring dan corong
asam amino standar fenilalanin PA (Sigma)
larutan ninhidrin 0,2 % dalam aseton
plat KLT Silika
Kertas Whatman No 1
Butanol
Asam asetat
Akuades.
1.7 Prosedur
1. Analisis kelainan dalam proses metabolisme lipid pada Hiperlipidemia Zat Test Blank Test Serum Standar Test Serum Sampel
Serum standar - 0,05 ml -
Serum sampel - - 0,05 ml
Aqua 0,05 ml - -
Pewarna 3 ml 3 ml 3 ml
Campur, tunggu 20 menit kemudian tambahkan masing-masing test 0,5 ml asam sulfat konsentrit pada dinding tabung tepat diatas cairan, segera setelah penambahan asam sulfat , laulu dinginkan dalam beaker yang berisi air dingin 15-25oC, tunggu 5 menit dan kocok sekaligus ketiga test, kemudian baca setelah 10 menit denga 610 nm atau 560-580 nm bila pakai filter.
C = As/Ast x konsentrasi standart (lihat batch) Ket : As = Absorban sample
Ast = Absorban standar Catatan :
Berhubungan reaksinya sangat sensitive terhadap kelembapan, maka pergunakanlah pipet dan alat-alat gelas yang bersih dan kering. Serum yang mengandung bilirubin akan memberikan nilai yang lebih besar , 1 mg/ 100 ml bilirubin menghasilkan kenaikan nilai kolesterol sebesar 5-6 mg/ 100 ml serum. Jangan menggunakan serum yang sudah terhemolisis.
LEMBAR HASIL PENGAMATAN
Jenis Pemeriksaan Hasil pengamatan Nilai Rujukan Satuan Ket
Kolesterol - < 200 mg/dl
2. Analisis kelainan dalam proses metabolisme karbohidrat pada Diabetes melitus
Campur NaOH dengan ZnSO4 dalam testube masing masing 1 ml dan 5 ml.
Tambahkan 0,1 ml darah kapiler, campur, lalu rebus selama 4 menit.
Saring dan cuci dengan aquadest melalui saringan kapas (2x3 ml), air cucian masukan ke filtrat.
Filtrat ditambah dengan 2 ml K3Fe(CN)6 rebus selama 15 menit, dinginkan lalu tambah 3 ml KI dan 2 ml acetic acid
Tambahkan 2-3 tetes amilum lalu titer dengan Na tiosulfat.
Blanko dibuat sama tapi tanpa darah, perlakuan yang lain sama.
Catat Na2S2O3 terpakai,kadar gula lihat tabel (sampel-blanko).
LEMBAR HASIL PENGAMATAN
Jenis Pemeriksaan Hasil Nilai Rujukan Satuan
Glukosa darah Puasa (-) 80 – 109 mg/dl
Glukosa darah 2 jam (-) 100 - 144 mg/dl
MENGIDENTIFIKASI KELAINAN DALAM PROSES METABOLISME LANJUTAN
3. Analisis kelainan dalam proses metabolisme protein pada Phenylketonuria a. Preparasi
Larutan fenilalanin standar dibuat dalam konsentrasi 1 ppm, 3 ppm, 5 ppm, 10 ppm, 25 ppm, dan 50 ppm dalam pelarut air. Selanjutnya bejana pengembang kromatografi kertas diisi dengan fasa gerak campuran butanol: asam asetat : air ( 60 : 15 : 25) sebanyak 200 ml sedangkan bejana pengembang KLT diisi fasa gerak 50 ml. Bejana pengembang disimpan dalam kondisi tertutup minimal 2 jam.Plat KLT dengan ukuran 10 cm x 10 cm diberi garis dengan pensil 1 cm dari tepi bawah dan dibagi menjadi enam bagian. Kertas Whatman No 1 ukuran 20 x 20 cm diberi garis dengan pensil 3 cm dari tepi bawah dan dibagi menjadi enam bagian.
b. Analisis fenilalanin Menggunakan Kromatografi Kertas
Kertas Whatman No 1 disiapkan, pada masing masing titik ditotolkan larutan fenilalanin 1 ppm, 3 ppm, 5 ppm, 10 ppm, 25 ppm, dan 50 ppm menggunakan pipa kapiler masing masing sebanyak 20 kali dan dibiarkan sampai mengering. Masukkan kromatografi kertas ke dalam bejana pengembang dan dijepit dibagian atas agar kertas bisa tegak lurus. Elusi kromatografi kertas sampai fasa gerak mencapai 3 cm dari batas atas, kemudian angkat dan dikeringkan.
Kromatografi Kertas disemprot dengan larutan ninhidrin 0,2 % dengan hati hati. Masukkan kedalam oven dengan suhu 80 C selama 15 menit sampai warna terbentuk. Beri tanda pada
BAB IX
bagian/spot yang berwarna ungu, kemudian ukur jarak tempuh senyawa. Hitung nilai Rf-nya.
c. Analisis fenilalanin Menggunakan Kromatografi Lapis
Tipis Plat KLT disiapkan, pada masing masing titik ditotolkan larutan fenilalanin 1 ppm, 3 ppm, 5 ppm, 10 ppm, 25 ppm, dan 50 ppm menggunakan pipa kapiler masing masing sebanyak 200 μl dan dibiarkan sampai mengering. Masukkan plat KLT ke dalam bejana pengembang yang berisi fasa gerak campuran butanol: asam asetat : air ( 60 : 15 : 25) dan elusi KLT sampai fasa gerak mencapai 2 cm dari batas atas, kemudian angkat dan dikeringkan. KLT disemprot dengan larutan ninhidrin 0,2 % dengan hati hati.Masukkan kedalam oven dengan suhu 80 C selama 15 menit sampai warna ungu terbentuk. Beri tanda pada bagian/spot yang berwarna , kemudian ukur jarak tempuh senyawa. Hitung nilai Rf-nya.
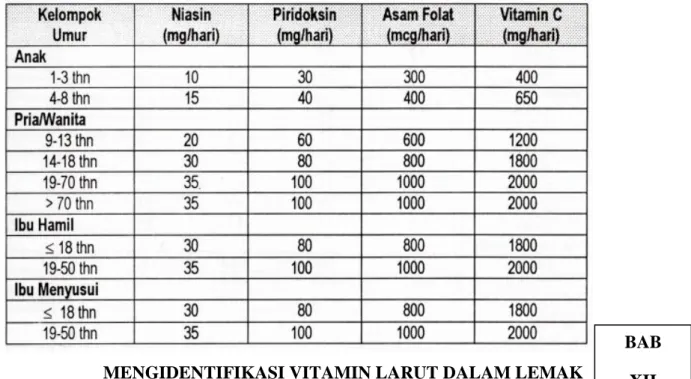
MENGIDENTIFIKASI VITAMIN YANG LARUT DALAM AIR
1.1 Pengertian
Vitamin adalah senyawa organik esensial yang terdapat dalam makanan hewani dan nabati dengan jumlah yang sangat kecil, ikut membantu mempertahankan kegiatan-kegiatan normal suatu jaringan dan berasal dari luar tubuh. vitamin yang larut dalam air disebut prakoenzim (procoenzym). Vitamin-vitamin ini dapat bergerak bebas dalam badan, darah, dan limfa. Karena sifat kelanutannya, vitamin yang larut dalam air mudah rusak dalam pengolahan dan mudah hilang atau terlarut bersama air selamat pencucian bahan. Di dalam tubuh, vitamin ini disimpan dalam julah terbatas dan kelebihan vitamin akan dikeluarkan atau dickskresikan melalui urin. Oleh karena itu, untuk mempertahankan saturasi jaringan vitamin ini harus sering dikonsumsi. Kebanyakan vitamin yang larut dalam air berperan sebagi kofaktor enzim tertentu dalam mengkatalisis berbagai reaksi biokimia. Vitamin lanut dalam air mengandung vitamin B dan C.
Vitamin B terdiri dari:
1. Vitamin B1 (Tiamin)
Tiamin merupakan koenzim yang penting pada metabolisme energi dari karbohidrat.
Vitamin ini larut dalam air dan tidak tahan panas.
2. Vitamin B2 (Riboflavin)
BAB X
Riboflavin adalah bagian dari koenzim flavin adenin dinukleotida dan flavin mononukleotida (riboflavin-5'-fosfat). Flavoprotein berfungsi sebagai enzim pada respirasi sel dan pada oksidasi substrat oleh oksigen. Jadi riboflavin merupakan komponen penting dari metabolisme antara.
3. Vitamin B3 ( Niasin)
Niasin juga dikenal sebagai vitamin B3, asam nikotinat, niacinamide, dan juga sebagai faktor pencegah pellagra (faktor anti-pellagra). Niasin datang dalam dua bentuk, sebagai asam nikotinat (niasin) dan sebagai nikotinamida. Ini adalah bagian utama dari koenzim NAD + dan NADP +.
4. Asam folat
Asam folat adalah nama generik untuk zat yang memiliki aktivitas seperti asam pteroyl monoglutamic. Asam folat hadir dalam sirkulasi dalam bentuk plasma pteroylmono-glutamat.
Asam folat yang tidak digunakan oleh sel akan dikeluarkan oleh ginjal dan dikeluarkan bersama urin dalam bentuk asam pteroil glutamat, 5 metil pteroil asam glutamat, 5.
5. Vitamin B6 (Piridoksin )
Pyridoxine adalah bentuk yang berasal dari tumbuhan, dua bentuk lain yang berasal dari jaringan hewan adalah pyridoxine dan pyridoxamine. Pyridoxine yang berasal dari hewan lebih berpotensi sebagai faktor pertumbuhan bakteri dan sebagai prekursor koenzim pyridoxal phosphate dan pyridoxamine phosphate.
6. Vitamin B12 (sianokobalamin)
Vitamin ini sangat ampuh dan sangat sedikit vitamin ini dibutuhkan oleh tubuh, untuk mencegah gejala defisiensi yaitu anemia pernisiosa dan gejala neurologis defisiensi vitamin B12. Vitamin B12 adalah nama generik untuk komponen yang memiliki struktur cincin corrin. Agar berfungsi secara aktif, vitamin B12 harus mengandung kobalt di tengah cincin corrin. Vitamin B12 berbentuk kristal berwarna merah, tahan panas, rusak di atas 210 °C, tidak tahan terhadap sinar ultraviolet, asam dan adanya logam seperti besi dan tembaga.
Vitamin B12 sangat sulit untuk diperiksa karena sangat kecil dalam makanan.
7. Vitamin C
Manusia dan beberapa hewan membutuhkan vitamin C dari makanan karena tubuh mereka tidak memiliki enzim L-gulono-a-lakton oksidase, yang diperlukan untuk sintesis vitamin C.
Meskipun berbagai proses biologis dilaporkan dipengaruhi oleh asupan vitamin C dalam berbagai tingkatan. Vitamin C dapat bertindak sebagai kofaktor enzim monoksigenase dan dioksigenase, termasuk prolil dan lisil hidroksilase dalam pembentukan jaringan kolagen
1.2. Tujuan
1. Untuk Membuktikan adanya vitamin B1 dalam suatu bahan secara kualitatif.
2. Membuktikan adanya vitamin B6dalam suatu bahan secara kualitatif.
3. Membuktikan adanya vitamin C dalam suatu bahan secara kualitatif.
4. Untuk Membuktikan uji vitamin C secara Kuantitat.
MENGIDENTIFIKASI VITAMIN YANG LARUT DALAM AIR LANJUTAN
1.3 Prinsip
1. Adanya Penentuan Vitamin B, (thiamin)
Dalam larutan netral atau alkalis, thiamin mudah rusak, sedangkan dalam keadaan asam tahan panas. Thiamin stabil pada pemanasan kering, tetapi mudah terurai oleh zat-zat pengoksidasi dan radiasi terhadap sinar ultraviolet.
2. Adanya Penentuan Vitamin B6 ( piridoksin)
Dalam vitamin B, terdiri dari tiga bentuk senyawa, yaitu pirodoksin, pirodoksal, dan pirodoksamin. Ketiga bentuk vitamin B, terdapat dalam hewan maupun tumbuhan pada beras dan gandum. Stabil pirodoksin terhadap pemanasan, alkali dan asam. Pirodoksal dan pirodoksamin mudah rusak oleh pemanasan, udara dan cahaya. Dari ketiga bentuk vitamin B, hanya pirodoksin yang paling tahan terhadap pengaruh pengolahan dan penyimpanan.
3 Adanya Penentuan Vitamin C
Vitamin C biasa disebut juga asam askorbat berupa kristal putih yang mudah teroksidasi oleh sehingga warna menjadi coklat. Sifatnya yang mudah teroksidasi ini dapat melindungi zat lain dari pengaruh oksidasi udara. Oleh karena itu, vitamin C populer dengan antioksidan.
1.4 Sampel Jeruk
BAB XI
Cabe
1.5 Alat & Reagensia
1. Adanya Penentuan Vitamin B1
Adapun alat yang digunakan adalah alat pemanas, tabung reaksi, pipet ukur dan pipet tetes.
Adapun bahan yang digunakan yaitu larutan thiamain 1%, larutan KI 5%, larutan Bismuth Nitrat, Bi(NO,), larutan Pb-asetat 10%, larutan NaOH 6N.
2. Adanya Penentuan Vitamin B6
Adapun alat yang digunakan adalah tabung reak si, pipet tetes. Adapun bahan yang digunakan dalam percobaan ini adalah larutan pirodoksin-HCI 1%, larutan CuSo, 2%, larutan NaOH 3 N, larutan besi (I) klorida, FeClh 1%.
3. Adanya Penentuan Vitamin C
Adapun alat yang digunakan adalah alat pemanas, tabung reaksi, pipet tetes dan kertas lakmus Adapun bahan yang digunakan dalam percobaan penentukan Vitamin C ini adalah larutan asam askorbat 1%, pereaksi benedict, larutan NaHCO, 5%, larutan FeCl, 1%.
4. penentuan Adanya vitamin C secara kuantitatif
Adapun alat yang digunakan adalah gelas beaker 100 dan 250 mL, Mortar, Pipet tetes, Penjepit tabung, tabung reaksi dan rak tabung reaksi, Batang pengaduk, Erlenmeyer, Iodine 0,01 N , Indikator amilum, Jeruk, Cabe, Aquades
1.6. Prosedur
1. Penentuan Adanya Vitamin B1 Percobaan A
larutan thiamin sebanyak 10 tetes masukkan kedalam tabung reaksi
Ditambahkan 10 tetes larutan Pb-asetat dan 1 ml NAOH 6 N
Dicampur dengan baik, kemudian diperhatikan timbulnya warna kuning yang terjadi
sehingga akan timbul endapan warna hitam yang menandakan vitamin B, positif.
Percobaan B
Larutan thiamin sebanyak 10 tetes dimasukkan kedalam tabung reaksi
Larutan Bismuth nitrat sebanyak ditambahkan, lalu dicampurkan dengan baik, Kemudian ditambahkan 2 tetes lanıtan KI 5%
Diamati perubahan ama yang terjadi, timbulnya warna endapan merah jingga berarti vitamin B, positif.
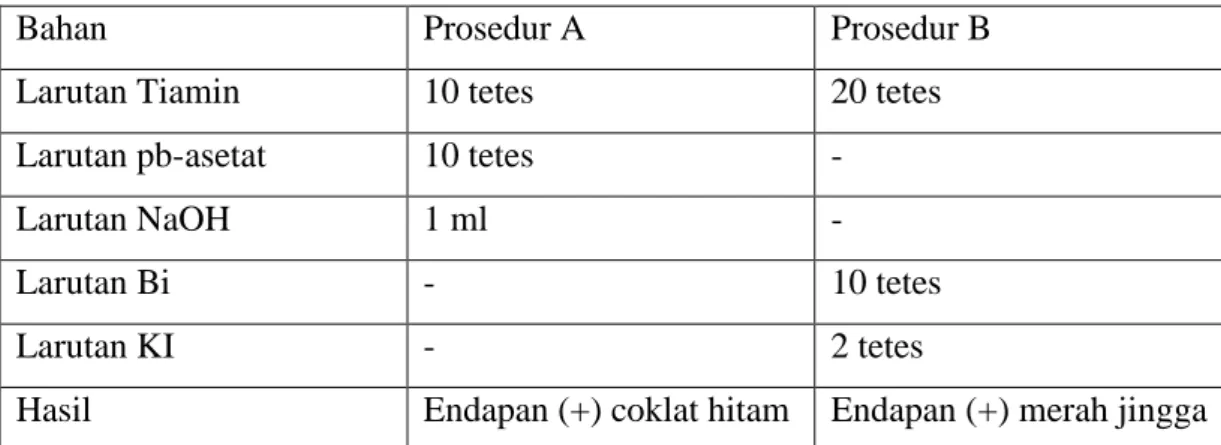
Tabel penentuan Adanya vitamin B1
Bahan Prosedur A Prosedur B
Larutan Tiamin 10 tetes 20 tetes
Larutan pb-asetat 10 tetes -
Larutan NaOH 1 ml -
Larutan Bi - 10 tetes
Larutan KI - 2 tetes
Hasil Endapan (+) coklat hitam Endapan (+) merah jingga
Hasil perubahan warna pada Tabung Reaksi
4. Adanya Penentuan Vitamin B6
larutan Pirodoksin 1% sebanyak 5 tetes dimasukkan kedalam tabung reaksi
Ditambahkan 2 tetes larutan tembaga sulfat dan 10 tetes NaOH 3N
Diamati perubahan warna yang terjadi, bila terbentuk warna biru ungu bereti vitamin B, positif
percobaan 2
larutan Pirodoksin 1% sebanyak 5 tetes dimasukkan kedalam tabung reaksi
Ditambahkan 2-3 tetes lanutan FeCls
Diamati perubahan warna yang terjadi, timbulnya warnajingga sampai merah tua berarti vitamin B positif
Tabel penentuan Adanya vitamin B6
Bahan Prosedur A Prosedur B
Larutan Piridoksin 5 tetes 5 tetes
Larutan CuSO4 2 tetes --
Larutan NaOH 10 tetes -
Larutan FeCl3 - 2-3 tetes
Hasil Biru berubah ungu Kuning
Hasil perubahan warna pada Tabung Reaksi
5. Penentuan Adanya Vitamin C Percobaan A
Larutkan asam sebagaikorbat sebanyak 5 tetes dimasukkan kedalam tabung reaksi
Ditambahkan 15 tetes pereaksi Benedict
Dipanasakan diatas api kecil sampai dih selama 2
Diperhatikan adanya pengendapan yang terbentuk, timbulnya wama hijau, menit-merah kelelawar menendakan vitamin C positif
percobaan B
Larutkan asam askorbat sebanyak 5 tetes dimasukkan kedalam tabung reaksi
Tabel penentuan Adanya vitamin C secara kualitatif
Bahan Prosedur A Prosedur B
Larutan Asam askorbat 5 tetes 5 tetes
Pereaksi Benedict 15 tetes -
pH larutan - 2-3 tetes
Larutan FeCl3 - (+)
Hasil (+) Endapan merah bata Merah
Hasil perubahan warna pada Tabung Reaksi
2. Penetuan Vitamin C secara kuantitatif
Siapkan buret dan isi dengan Iodine 0.1 N
Ambil buah apel dan potong menjadi kecil
Timbang 5 gram jeruk dan cabe dan letakkan di mortar, tambahkan akuades 25 mL dan gerus hingga menjadi suspensi
Pindahkan secara kuantitatif ke labu ukur 100 mL dan encerkan dengan akuades hingga tanda batas, kemudian disaring
Ambil 50 mL bagian yang jernih dengan pipet volum dan masukkan ke Erlenmeyer 250 mL
Tambahkan akuades 50 mL dan 1 mL pati 1%
Lakukan titrasi dengan Iodin 0,1 N dengan berwarna biru
Ulangi percobaan sebanyak 2 kali pada masing-masing sampel
Lakukan perhitungan kadar vitamin C (asam askorbat)
1.7 Nilai Normal