7 BAB II
TINJAUAN PUSTAKA
2.1 Uraian Bahan 2.1.1 Isoniazid
Menurut Ditjen BKAK (2014), uraian tentang isoniazid adalah sebagai berikut :
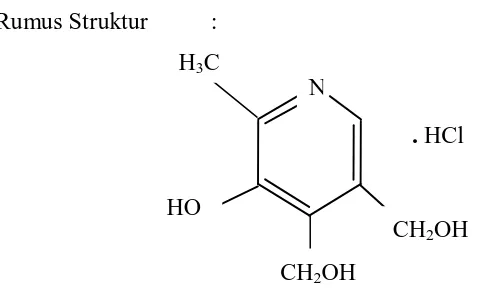
Rumus struktur :
O C NH NH2 Gambar 2.1 Struktur Isoniazid
Rumus Molekul : C6H7N3O Berat Molekul : 137,14
Nama Kimia : Asam Isonikotinat Hidrazida
Kandungan : Tidak kurang dari 98% dan tidak lebih dari 102,0% C6H7N3O, dihitung terhadap zat yang telah dikeringkan. Pemerian : Hablur putih atau tidak berwarna atau serbuk hablur
putih; tidak berbau, perlahan – lahan dipengaruhi oleh udara dan cahaya.
Kelarutan : Mudah larut dalam air; agak sukar larut dalam etanol; sukar larut dalam kloroform dan dalam eter.
8
Isoniazid mempunyai efek samping berupa mual, muntah, anoreksia, letih, malaise, lemah, gangguan saluran pencernaan lain, neuritis perifer (paling sering
terjadi dengan dosis 5mg/kgBB/hari), neuritis optikus, reaksi hipersensitivitas,
demam, ruam, ikterus, diskrasia darah, psikosis, kejang, sakit kepala, mengantuk,
pusing, mulut kering, gangguan BAK, kekurangan vitamin B6, hiperglikemia, asidosis
metabolik, ginekomastia, gejala reumatik, gejala mirip Systemic Lupus
Erythematosus (Tan dan Rahardja, 2007).
2.1.2 Piridoksin Hidroklorida
Menurut Ditjen BKAK (2014), uraian tentang piridoksin hidroklorida adalah sebagai berikut :
Rumus Struktur :
. HCl
Gambar 2.2 Struktur Piridoksin Hidroklorida Rumus Molekul : C8H11NO3.HCI
Berat Molekul : 205,64
Nama Kimia : Piridoksol hidroklorida
Pyridoxini Hydrochloridum
Kandungan : Tidak kurang dari 98% dan tidak lebih dari 102,0%
C8H11NO3.HCI, dihitung terhadap zat yang telah
dikeringkan. N H3C
HO
CH2OH
9
Pemeriaan : Hablur atau serbuk hablur putih atau hampir putih;
stabil di udara; secara perlahan-lahan dipengaruhi oleh
cahaya matahari.
Kelarutan : Mudah larut dalam air; sukar larut dalam etanol; tidak
larut dalam eter
pH : Lebih kurang 3
Vitamin B6 selain untuk mencegah dan mengobati defisiensi vitamin B6 dengan gejala berupa kelainan kulit (dermatitis), peradangan lendir mulut dan lidah- kelainan susunan syaraf pusat dan gangguan eritopoetik berupa anemia hipokrom mikrositer, juga diberikan bersama vitamin B lainnya (Tan dan Rahardja, 2007).
Efek Samping dari vitamin B6 jarang terjadi dan berupa reaksi alergi.
Penggunaan lama dari 500mg/hari dapat mencetuskan ataxia (jalan limbung) dan
neuropati serius (Tan dan Rahardja, 2007).
2.1.3 Etambutol
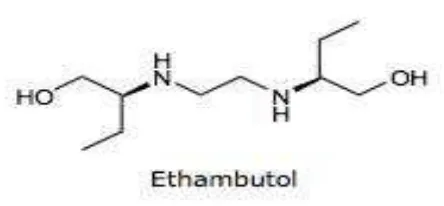
Menurut Ditjen BKAK (2014), uraian tentang etambutol adalah sebagai berikut : Rumus Struktur :
10 Rumus Molekul : C10H24N2O2 .2HCl Berat Molekul : 277,23
Nama Kimia : Etambutol Hidroklorida
Kandungan : Tidak kurang dari 98,0% dan tidak lebih dari 100,5% C10H24N2O2 .2HCl dihitung terhadap zat yang telah
dikeringkan.
Pemerian : Serbuk hablur, putih.
Kelarutan :Mudah larut dalam air; larut dalam etanol dan dalam metanol sukar larut dalam eter dan dalam kloroform.
Etambutol jarang menimbulkan efek samping. Dosis harian sebesar 15 mg/kgBB menimbulkan efek toksik yang minimal. Pada dosis ini kurang dari 2 % pasien akan mengalami efek samping yaitu penurunan ketajaman penglihatan, ruam kulit, dan demam. Efek samping lain ialah pruritus, nyeri sendi, gangguan saluran cerna, malaise, sakit kepala, pening, bingung, disorientasi, dan mungkin juga halusinasi. Rasa kaku dan kesemutan dijari sering terjadi. Reaksi anafilaksis dan leukopenia jarang dijumpai (Istiantoro dan Setiabudy, 2007).
2.2. Spektofotometri
11
Teknik analisis spektrofotometri berdasarkan interaksi radiasi elektromagnet dengan komponen atom atau molekul yang menghasilkan fenomena bermakna sebagai parameter analisis (Satiadarma, dkk., 2004).
Radiasi elektromagnetik atau cahaya merupakan suatu bentuk energi yang tingkah lakunya digambarkan dengan sifat-sifat gelombang dan partikel. Sifat-sifat optis radiasi elektromagnetik seperti difraksi paling sesuai dijelaskan dengan menggambarkan cahaya sebagai suatu gelombang. Beberapa interaksi antara radiasi elektromagnetik dengan materi seperti absorpsi dan emisi lebih baik dijelaskan dengan memperlakukan cahaya sebagai suatu partikel (Gholib, 2012).
Bagian molekul yang bertanggung jawab terhadap penyerapan cahaya disebut kromofor dan terdiri atas ikatan rangkap dua atau rangkap tiga, terutama jika ikatan rangkap tersebut terkonjugasi. Semakin panjang ikatan rangkap dua atau rangkap tiga terkonjugasi di dalam molekul, molekul tersebut akan lebih mudah menyerap cahaya (Cairns, 2008).
Gugus fungsi seperti –OH, -O, -NH2 dan –OCH3 yang memberikan transisi n → π* disebut gugus auksokrom. Gugus ini adalah gugus yang tidak dapat menyerap radiasi ultraviolet-sinar tampak, tetapi apabila gugus ini terikat pada gugus kromofor mengakibatkan pergeseran panjang gelombang ke arah yang lebih besar atau pergeseran batokromik (Rohman, 2007). Efek hipsokromik atau pergeseran biru adalah pergeseran panjang gelombang kearah yang lebih pendek. Efek hipokromik adalah efek yang menyebabkan penurunan intensitas serapan (Rohman, 2007).
12
menyebabkan transisi elektron di orbit terluarnya dari tingkat energi elektron dasar ke tingkat energi tereksitasi lebih tinggi. Besarnya absorbansi radiasi tersebut berbanding dengan banyaknya molekul analit yang mengabsorpsi dan dapat digunakan untuk analisis kuantitatif (Satiadarma, dkk., 2004)
2.2.1. Hukum Lambert-Beer
Menurut Hukum Lambert, serapan berbanding lurus terhadap ketebalan sel yang disinari. Sedangkan menurut Beer, serapan berbanding lurus dengan konsentrasi. Kedua pernyataan ini dapat dijadikan satu dalam Hukum Lambert-Beer, sehingga diperoleh bahwa serapan berbanding lurus terhadap konsentrasi dan ketebalan sel, hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan (Rohman, 2007).
Hukum Lambert-Beer umumnya dikenal dengan persamaan sebagai berikut:
A = abc Dimana: A = absorbansi a = absorptivitas b = tebal kuvet (cm) c = konsentrasi
13 2.2.2. Kegunaan Spektofotometri
Kegunaan spektrofotometri ultraviolet dalam analisis kualitatif sangat terbatas karena rentang daerah radiasi yang relatif sempit hanya dapat mengakomodasi sedikit sekali puncak absorpsi maksimum dan minimum, karena itu identifikasi senyawa yang tidak diketahui tidak memungkinkan untuk dilakukan (Satiadarma, dkk., 2004).
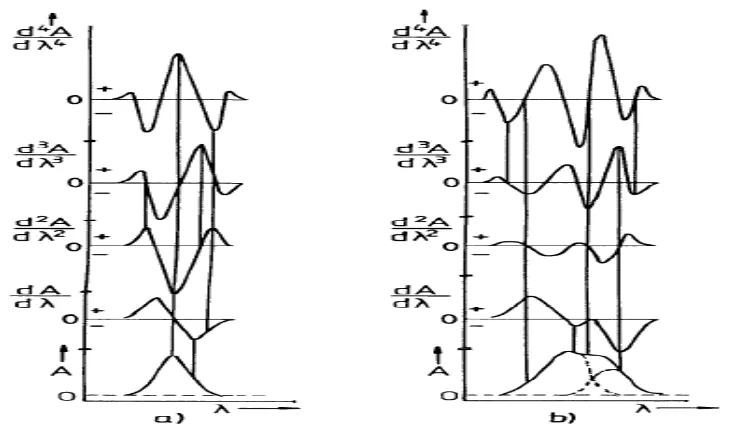
Spektrofotometri derivatif menawarkan berbagai keuntungan. Pertama pada spektra derivatif ditekankan gambaran ini lebih jelas bila meningkat dari spektra derivatif peringkat pertama hingga ke peringkat keempat (Munson, 1984).
Pada analisis kuantitatif dengan cara penetapan kadar, larutan standar obat yang akan dianalisis disiapkan, serapan sampel dan standar dapat ditentukan (Cairns, 2008), dimana konsentrasi zat dalam sampel dihitung dengan rumus sebagai berikut:
Ct
Cs
At
As
=
Keterangan: As = Absorbansi baku pembanding At = Absorbansi zat dalam sampel Cs = Konsentrasi baku pembanding Ct = Konsentrasi zat dalam sampel
14 2.3. Spektrofotometri Derivatif
Konsep derivatif telah diperkenalkan pertama kali pada tahun 1950, dimana terlihat memberikan banyak keuntungan. Aplikasi utama spektrofotometri derivatif ultraviolet–visibel adalah untuk identifikasi kualitatif dan analisis senyawa dalam sampel. Metode spektrofotometri derivatif sangat cocok untuk analisis pita absorpsi yang overlapping atau tumpang tindih (Owen, 1995).
Spektrum derivatif diperoleh dengan membuat absorban atau transmitan derivatif orde pertama atau orde lebih tinggi yang terkait dengan panjang gelombang (ΔA / Δλ) sebagai fungsi dari panjang gelombang. Spektrum dapat
menunjukkan kembali detail spektrum yang hilang dalam spektrum absorpsi biasa dan pada pengukuran konsentrasi analit yang bercampur dengan zat yang mengganggu, analisis dipermudah dan dapat ditentukan lebih akurat pada beberapa bagian dari daerah spektrum. Pengukuran absorban derivatif dapat dilakukan dengan men-scan monokromator yang terpasang pada panjang gelombang tetap, tetapi dengan perbedaan panjang gelombang yang sedikit, sehingga berguna jika analit adalah dua komponen yang mengabsorpsi radiasi pada sisi pita absorpsi dari komponen yang mengganggu (Satiadarma,dkk., 2004).
Pada spektrofotometri konvensional, spektrum serapan merupakan plot serapan (A) terhadap panjang gelombang (λ). Pada spektrofotometri derivatif, plot serapan terhadap panjang gelombang dimana:
A = f (λ), order nol
15
Menurut Talsky (1994) sesuai dengan hukum Lambert-Beer, maka ada hubungan linier antara konsentrasi dengan absorbansi untuk semua orde pada spektrofotometri derivatif adalah:
dA / dλ = �� ( 1%,1��)
d� x bc
d²A / dλ² = �²� ( 1%,1��)
d�² x bc d˟A / dλ˟ = �˟� ( 1%,1��)
d�˟ x bc
Kurva serapan derivat pertama sampai derivat keempat dapat dilihat pada Gambar 2.3.
Gambar 2.3. Kurva serapan derivat pertama sampai derivat keempat (Talsky, 1994).
Ada empat aplikasi spektrofotometri derivatif yang sering digunakan dalam anlisa kuantitatif antara lain metode zero crossing, metode peak to peak,
16
Panjang gelombang zero crossing adalah panjang gelombang dimana senyawa tersebut mempunyai serapan nol dan menjadi panjang gelombang analisis untuk zat lain dalam campurannya. Metode zero crossing memisahkan campuran dari spektrum derivatifnya pada saat panjang gelombang komponen pertama tidak ada sinyal. Pengukuran pada zero crossing tiap komponen dalam campuran merupakan fungsi tunggal konsentrasi dari yang lainnya (Nurhidayati, 2007).
Panjang gelombang serapan maksimum suatu senyawa pada spektrum normal akan menjadi λ zero crossing pada spektrum derivatif pertama, panjang gelombang tersebut tidak mempunyai serapan atau dA / dλ = 0 (Nurhidayati, 2007).
Bila campuran analit memiliki panjang gelombang zero-crossing lebih dari satu, maka yang dipilih untuk dijadikan panjang gelombang analisis adalah panjang gelombang zero crossing yang serapan pasangannya dan campurannya persis sama, karena pada panjang gelombang tersebut dapat secara selektif mengukur serapan senyawa pasangannya dan memiliki serapan yang paling besar. Pada serapan yang paling besar, serapannya lebih stabil sehingga kesalahan analisis dapat diperkecil (Nurhidayati, 2007). Kurva sederhana aplikasi zero
crossing dapat dilihat pada Gambar 2.4.
17
Metode spektrofotometri derivatif atau metode kurva turunan adalah salah satu metode spektrofotometri yang dapat digunakan untuk analisis campuran beberapa zat secara langsung tanpa harus melakukan pemisahan terlebih dahulu meskipun dengan panjang gelombang yang berdekatan (Nurhidayati, 2007).
2.3.1. Komponen Spektrofotometri Derivatif
Biasanya spektrofotometer telah mempunyai software untuk mengolah data yang dapat dioperasikan malalui komputer yang telah terhubung dengan spektrofotometer. Spektrofotometri derivatif merupakan metode manipulatif terhadap spektra pada spektrofotometri UV-Visibel (Gholib dan Rohman, 2012). 2.3.2. Kegunaan Spektrofotometri Derivatif
Teknik spektrofotometri derivatif menawarkan beberapa keuntungan dibandingkan dengan spektrofotometri konvensional seperti Spektrum derivatif yang diukur dapat digunakan untuk meningkatkan perbedaan antara spektrum yang dianalisis, untuk menyelesaikan pita serapan analit yang tumpang tindih dalam analisis kualitatif dan yang paling penting untuk mengurangi efek interferensi dari hamburan sinar, matriks , atau senyawa menyerap lainnya dalam analisis kuantitatif (Owen, 1995).
Spektrofotometri derivatif dapat memisahkan komponen secara kuantitatif, dapat menjadi karakteristik untuk komponen murni dengan menambahkan informasi dari teknis lain seperti IR, NMR, MS dan digunakan untuk analisis multikomponen (Skujins and Varian, 1986).
18 keempat (Munson, 1984).
Selain itu dapat dilakukan analisis kuantitatif suatu komponen dalam campuran dengan panjang gelombangnya saling berdekatan. Bila dibandingkan dengan kromatografi cair kinerja tinggi (KCKT), metode spektrofotometri derivatif relatif lebih sederhana, alat dan biaya operasionalnya lebih murah dan waktu analisisnya lebih cepat (Nurhidayati, 2007).
2.4. Validasi Metode Analisis
Tujuan utama yang harus dicapai dari suatu kegiatan analisis kimia adalah dihasilkannya data hasil uji yang absah (valid). Secara sederhana hasil uji yang absah dapat digambarkan sebagai hasil uji yang mempunyai akurasi (accuracy) dan presisi (precission) yang baik. Validasi adalah suatu tindakan penilaian terhadap parameter tertentu pada prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Validasi metode analisis dilakukan dengan uji laboratorium, dengan demikian dapat ditunjukkan bahwa karakteristik kinerjanya telah memenuhi persyaratan untuk diterapkan dalam analisis senyawa atau sediaan yang bersangkutan (Satiadarma, dkk., 2004). Parameter analisis yang ditentukan pada validasi adalah akurasi, presisi, limit deteksi, limit kuantitasi, kelinieran dan rentang (Rohman, 2007).
2.4.1. Akurasi
19
perolehan kembali (recovery) analit yang ditambahkan dan dapat ditentukan melalui dua cara yaitu metode simulasi (spiked placebo recovery) dan metode penambahan bahan baku atau standard addition method ( USP 30-NF 25, 2007; Ermer dan Miller, 2005).
Dalam metode simulasi, sejumlah analit bahan murni (senyawa pembanding kimia) ditambahkan kedalam campuran bahan sediaan farmasi (plasebo), lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar standar yang ditambahkan atau kadar sebenarnya. Jika plasebo tidak memungkinkan untuk disiapkan, maka sejumlah analit yang telah diketahui konsentrasinya dapat ditambahkan langsung ke dalam sediaan farmasi. Ini dinamakan metode penambahan baku standar (Harmita, 2004).
Menurut Harmita (2004) dalam metode adisi (penambahan bahan baku), sejumlah sampel yang dianalisis ditambah analit dengan konsentrasi biasanya 98% sampai 102% dari kadar analit yang diperkirakan, dicampur dan dianalisis kembali. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya. Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya:
% Perolehan Kembali = CF - CA
CA* ×100%
Keterangan: CF = Kadar zat dalam sampel setelah penambahan larutan baku
CA = Kadar zat dalam sampel sebelum penambahan larutan baku C A * = Kadar larutan baku zat yang ditambahkan
20 2.4.2. Presisi
Presisi adalah derajat kesesuaian di antara masing-masing hasil uji, jika prosedur analisis ditetapkan berulang kali pada sejumlah cuplikan yang diambil dari satu sampel homogen. Presisi dinyatakan sebagai deviasi standar atau deviasi standar relatif (Satiadarma, dkk., 2004).
Parameter-parameter seperti simpangan baku (SB), simpangan baku relatif (Relative Standard Deviation) dan derajat kepercayaan haruslah dikalkulasi untuk mendapatkan tingkat presisi tertentu (Ermer dan Miller, 2005). Nilai simpangan baku relatif dinyatakan memenuhi persyaratan jika < 2 (Ermer dan Miller, 2005).
Simpangan baku relatif = ×100%
X SB
2.4.3. Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah nilai parameter, yaitu konsentrasi analit terendah yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko (Harmita, 2004).
Batas deteksi merupakan batas uji yang secara spesifik menyatakan apakah analit yang dianalisis berada di atas atau di bawah nilai tertentu (Rohman, 2007). Batas deteksi dapat dihitung dengan rumus sebagai berikut (Harmita, 2004):
Batas deteksi (LOD) =
slope
SB
x
3
21 Batas kuantitasi (LOQ) =
slope
SB
x
10
2.4.4. Linearitas
Linieritas menunjukkan kemampuan suatu metode analisis untuk memperoleh hasil pengujian yang sesuai dengan kisaran konsentrasi analit tertentu. Hal ini dapat dilakukan dengan cara membuat kurva kalibrasi dari beberapa set larutan baku yang telah diketahui konsentrasinya. Persamaan garis yang digunakan pada kurva kalibrasi diperoleh dari persamaan y = ax + b. Persaman ini akan menghasilkan koefisien korelasi (r). Koefisien korelasi inilah yang digunakan untuk mengetahui linieritas suatu metode analisis. Kelinieran suatu metode analisis adalah kemampuan untuk menunjukkan bahwa nilai hasil uji langsung atau setelah diolah secara matematika, proporsional dengan konsentrasi analit dalam sampel dalam batas rentang konsentrasi tertentu (Satiadarma, dkk., 2004).
2.4.5. Rentang