Lampiran 1. Gambar dan Spesifikasi Sampel serta Gambar Alat Spektrofotometer Ultraviolet (UV)
Gambar 20. Sampel Minuman Berenergi
Kandungan bahan-bahan dalam sampel:
Minuman Berenergi Merek Kratingdaeng® Minuman Berenergi Merek M-150®
Taurine 800 mg Taurine 1000 mg
Kafein 50 mg Kafein 50 mg
Inositol 50 mg Inositol 50 mg
Niasinamid 20 mg Niacinamide (vitamin B3) 20 mg Tartrazin Cl 19140 Dexpanthenol (provitamin B5) 5 mg Vitamin B6 5 mg Pyridoxine HCl (vitamin B6) 5 mg
Sukrosa 25 g Vitamin B12 5 mg
Air Sukrosa 25 g
Natrium Benzoat Natrium Benzoat
Tartrazin Cl 19140 Asam sitrat
Ponceau 4R Cl 16255 Trisodium sitrat
Panjang gelombang maksimum bahan-bahan dalam sampel:
bahan Panjang gelombang
maksimum (nm)
Rujukan
Taurine 570 Draganov, dkk., 2014
Kafein 273 Moffat, dkk., 2005
Inositol 261 Moffat, dkk., 2005
Niasinamid 261 Moffat, dkk., 2005
Vitamin B6 290 Moffat, dkk., 2005
Vitamin B12 361 Moffat, dkk., 2005
Sukrosa 190 Sumantri, dkk., 2013
Natrium Benzoat 230 Moffat, dkk., 2005
Tartrazin 425 Moffat, dkk., 2005
Asam sitrat 520 Napitupulu, 2011
Ponceau 4R 506 Kartadarma, dkk., 2007
Lampiran 2. Kurva Serapan Kafein dan Asam Benzoat
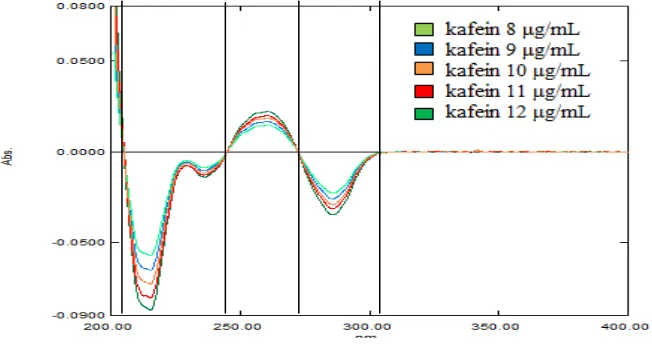
Gambar 21. Kurva serapan kafein 8 μg/mL
Gambar 23. Kurva serapan kafein 10 μg/mL
Gambar 25. Kurva serapan kafein 12 μg/mL
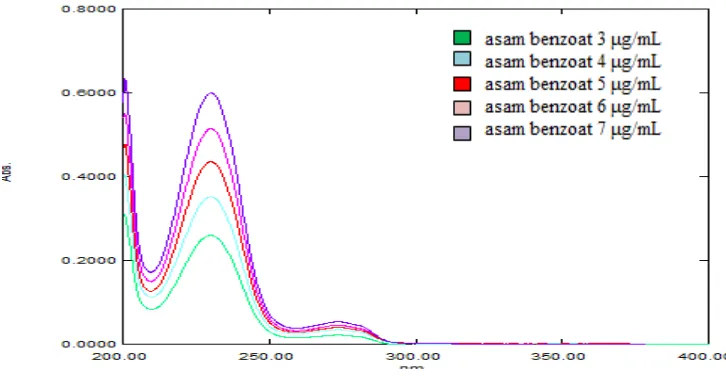
Gambar 27. Kurva serapan asam benzoat 4 μg/mL
Gambar 29. Kurva serapan asam benzoat 6 μg/mL
Lampiran 3. Kurva Serapan Derivat Pertama Kafein dan Asam Benzoat
Gambar 31. Kurva serapan derivat pertama kafein 8 μg/mL
Gambar 33. Kurva serapan derivat pertama kafein 10 μg/mL
Gambar 35. Kurva serapan derivat pertama kafein 12 μg/mL
Gambar 37. Kurva serapan derivat pertama asam benzoat 4 μg/mL
Gambar 39. Kurva serapan derivat pertama asam benzoat 6 μg/mL
Lampiran 4. Kurva Serapan Derivat Kedua Kafein dan Asam Benzoat
Gambar 41. Kurva serapan derivat kedua kafein 8 μg/mL
Gambar 43. Kurva serapan derivat kedua kafein 10 μg/mL
Gambar 45. Kurva serapan derivat kedua kafein 12 μg/mL
Gambar 47. Kurva serapan derivat kedua asam benzoat 4 μg/mL
Gambar 49. Kurva serapan derivat kedua asam benzoat 6 μg/mL
Lampiran 5. Kurva Serapan Panjang Gelombang Analisis
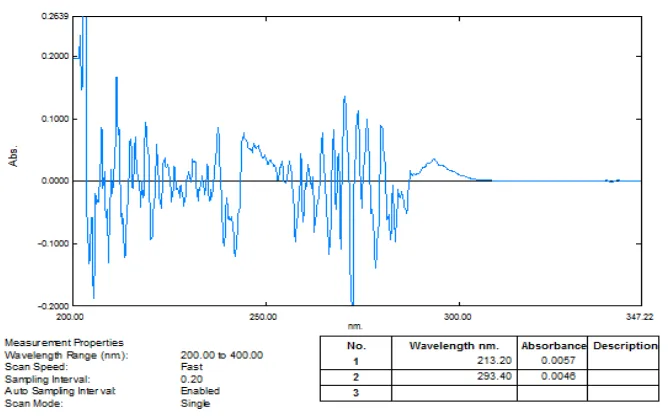
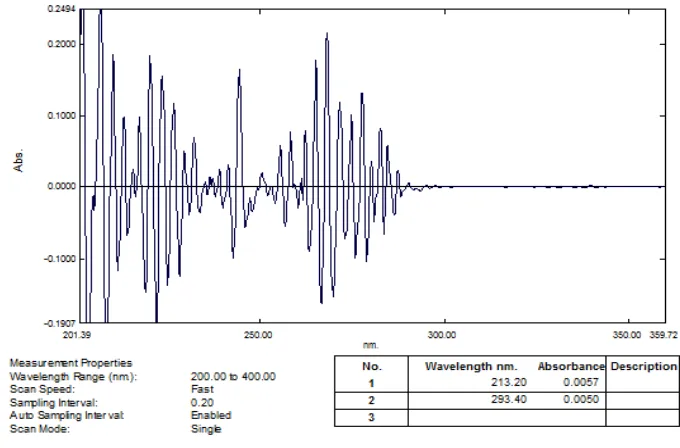
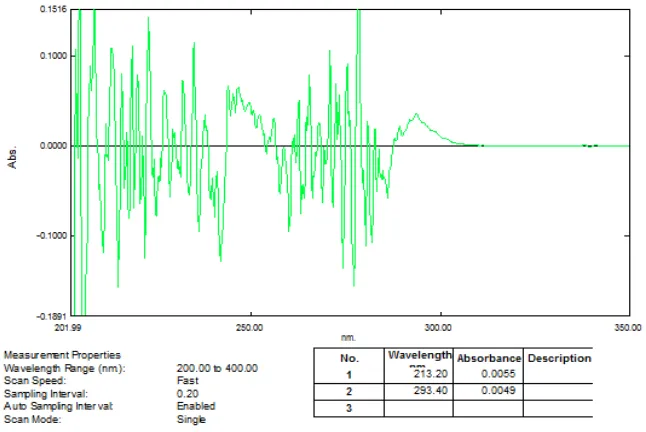
Gambar 51. Kurva Serapan Derivatif Kedua Kafein 9 μg/mL (λ= 293,40 nm)
Lampiran 6. Data Kalibrasi Kafein BPFI, Persamaan Regresi dan Koefisien Korelasi
Kalibrasi Serapan Derivat Kedua Kafein pada Panjang Gelombang 293,40 nm
No. Konsentrasi (μg/mL)(X) Absorbansi(Y)
1. 0,0000 0,0000
2. 8,0000 0,0023
3. 9,0000 0,0028
4. 10,0000 0,0030 5. 11,0000 0,0032
6. 12,0000 0,0037
Perhitungan Persamaan Garis Regresi
No. X Y X2` Y2 XY
1. 0,0000 0,0000 0,0000 0,00000000 0,0000
2. 8,0000 0,0023 64,0000 0,00000529 0,0184 3. 9,0000 0,0028 81,0000 0,00000784 0,0252 4. 10,0000 0,0030 100,0000 0,000009 0,0300 5. 11,0000 0,0032 121,0000 0,00001024 0,0352 6. 12,0000 0,0037 144,0000 0,00001369 0,0444
ΣX = 50
X
�
= 8,3333
ΣY = 0,015
Y
�
= 0,0025
ΣX2 ΣY
= 510
2
4.61 x 10
= ΣXY =
0,1532 -5
�
=
(
∑ ��
)
−
(
∑ �
)(
∑ �
)/
�
(
∑ �
2)
−
(∑ �)2�
=
(0,1532)
−
(50)(0,015)/6
(510)
−
(50)²/6
��= ���+�
�= �� − ���= (0,0025)−(3,0214. 10−4)(8,3333) =−1,7823. 10−5
Maka, persamaan garis regresinya adalah � = (3,0214� −0,1782) × 10−4
Perhitungan Koefisien Korelasi(⥾)
⥾
=
(∑ ��)−(∑ �)(∑ �)/���(∑�2)−(∑ �)2/���(∑ �2)−(∑ �)2/��
⥾
=
(0,1532) – (50)(0,015) /6�[(510)−(50)2/6][(4,61.10−5)−(0,015)2/6]
⥾
=
0,0280,02801
⥾ = 0,9996
Lampiran 7. Data Kalibrasi Asam Benzoat BPFI, Persamaan Regresi dan Koefisien Korelasi
Kalibrasi Serapan Derivat Kedua Asam Benzoat pada Panjang Gelombang 213,20 nm
No. Konsentrasi (μg/mL)(X) Absorbansi(Y)
1. 0,0000 0,0000
2. 3,0000 0,0019
3. 4,0000 0,0024
4. 5,0000 0,0033
5. 6,0000 0,0037
6. 7,0000 0,0042
Perhitungan Persamaan Garis Regresi
No. X Y X2` Y2 XY
1. 0,0000 0,0000 0,0000 0,0000 0,0000
2. 3,0000 0,0019 9,0000 3,61.10-6 0,0057
3. 4,0000 0,0024 16,0000 5,76.10-6 0,0096
4. 5,0000 0,0033 25,0000 1,089.10-5 0,0165
5. 6,0000 0,0037 36,0000 1,369.10-5 0,0222
6. 7,0000 0,0042 49,0000 1,764.10-5 0,0294
ΣX = 25
X
�
= 4,1667
ΣY = 0,0155
Y
�
= 2,583
.10�
=
(
∑ ��
)
−
(
∑ �
)(
∑ �
) /
�
(
∑ �
2)
−
(
∑ �
)
2/
�
=
(0,0834)
−
(25)(0,0155)/6
(135)
−
(25
2)/6
=
6,1027 . 10−4��= ���+�
�= �� − ���= (2,583. 10−3)−(6,1027. 10−4)(4,1667) = 0,4019. 10−4
Maka persamaan garis regresinya adalah �= (6,1027�+ 0,4019) × 10−4
Perhitungan Koefisien Korelasi(⥾)
⥾
=
(∑ ��)−(∑ �)(∑ �)/���(∑�2)−(∑ �)2/���(∑ �2)−(∑ �)2/��
⥾
=
(0,0834)−(25)(0,0155)/6�[(135)−252/6][(5,159.10−5)−(0,0155)2/6]
⥾
=
0,0834−0,06459�[3,54 � 10−4]
⥾ = 0,01881 0,018814
⥾ = 0,9998
Lampiran 8. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Kafein
Persamaan garis regresinya adalah Y = (3,0214X – 0,1782) . 10 No.
-4
X Y Yi (10-3) Y-Yi (10-5) (Y-Yi)2 (10-9)
1 0,0000 0,0000 -0,0178 1,7820 0,3168
2 8,0000 0,0023 2,3993 -9,9300 9,8605
3 9,0000 0,0028 2,7014 9,8560 9,7141
4 10,0000 0,0030 3,0036 -0,3580 0,0128
5 11,0000 0,0032 3,3057 -0,1057 11,1767
6 12,0000 0,0037 3,6079 9,2140 8,4898
Σ(Y-Yi)2 39,5707
�� = �∑(�−��)
2
�−2
=
�39,5707.10−9
6−2
= 9,9462.10
���= 3 × �������
=
3 × 9,9462.10−53,0214.10−4
= 0,9875
μg/mL-5
���= 10 × �������
=
10 × 9,9462.10−5
Lampiran 9. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Asam Benzoat
Persamaan garis regresinya adalah Y = (6,1027X + 0,4019) . 10 No.
-4
X Y Yi (10-3) Y-Yi (10-5) (Y-Yi)2 (10-9)
1 0,0000 0,0000 0,0402 4,0190 1,6152
2 3,0000 0,0019 1,8710 2,9000 0,8410
3 4,0000 0,0024 2,4813 -8,127 6,6048
4 5,0000 0,0033 3,0915 20,085 43,4556
5 6,0000 0,0037 3,7018 -0,181 0,0032
6 7,0000 0,0042 4,3121 -11, 208 12,562
Σ (Y-Yi)2 65,0818
�� = �∑(�−��)
2
�−2
=
�65,0818.10−9
6−2
= 1,2756 .10
���= 3 × �������
=
3 × 1,2756 .10−4
6,1027.10−4
= 0,209
μg/mL-4
���= 10 × ��
�����
=
10 × 1,2756.10−4
Lampiran 10. Kurva Serapan Derivat Kedua Sampel
Gambar 55. Kurva Serapan Kratingdaeng® -2
Gambar 57. Kurva Serapan Kratingdaeng® -4
Gambar 59. Kurva Serapan Kratingdaeng® -6
Gambar 61. Kurva SerapanM-150® -2
[image:30.595.119.440.463.697.2]Gambar 63. Kurva SerapanM-150® -4
[image:31.595.124.440.462.689.2]Gambar 65. Kurva SerapanM-150® -6
Lampiran 11.Hasil Analisis Kadar Natrium Benzoat dan Kafein dalam Sampel
1. Sampel Merek Kratingdaeng
No
®
Vol (mL)
A293,40 A nm Kadar Kafein (µg/mL) 213,20 nm Jumlah Kafein (mg) Kadar Asam Benzoat (mg/Kg) Kadar Natrium Benzoat (mg/Kg) 1 0,5 0,0019 0,0033 317,0526 47,5579 254,6607 300,5172 2 0,5 0,0019 0,0032 317,0526 47,5579 246,8486 291,2983 3 0,5 0,0018 0,0036 300,5232 45,0785 278,0971 328,1738 4 0,5 0,0019 0,0041 317,0526 47,5579 317,1578 374,2681 5 0,5 0,0017 0,0026 283,9912 42,5987 199,9758 235,9852 6 0,5 0,0018 0,0029 300,5232 45,0785 223,4122 263,6417
� 306,0326 45,9049 253,3587 298,9807
No Vol (mL)
A293,40 A nm Kadar Kafein (µg/mL) 213,20 nm Jumlah Kafein (mg) Kadar Asam Benzoat (mg/Kg) Kadar Natrium Benzoat (mg/Kg) 1 0,5 0,0018 0,0028 300,5232 45,0785 215,1480 253,8895 2 0,5 0,0019 0,0033 317,0526 47,5579 254,1268 299,8871 3 0,5 0,0019 0,0033 317,0526 47,5579 254,1268 299,8871 4 0,5 0,0018 0,0032 300,5232 45,0785 246,3311 290,6876 5 0,5 0,0019 0,0028 317,0526 47,5579 215,1480 253,8895 6 0,5 0,0019 0,0033 317,0526 47,5579 254,1268 299,8871
� 311,5428 46,7314 239,8346 283,0213
Lampiran 12.Contoh Perhitungan Jumlah Kafein dan Natrium Benzoat dalam SampelKratingdaeng®
Volume sampel yang digunakan = 0,5 mL Absorbansi analisis (Y) :
Kafein (293,40 nm) = 0,0019 Asam Benzoat (213,20 nm) = 0,0033
Persamaan regresi pada panjang gelombang maksimum kafein (λ=293,40 nm) : Y = (3,0214X – 0,1782) . 10
Persamaan regresi pada panjang gelombang maksimum asam benzoat -4
(λ= 213,20 nm) : Y = (6,1027X + 0, 4019) . 10
persamaan regresi pada masing-masing panjang gelombang.
Konsentrasi Kafein : Y = (3,0214X – 0,1782) . 10-4 0, 0019 = (3,0214X – 0,1782) . 10 X = 6,3474 μg/mL
-4
Kadar Kafein : ����
�
C : konsentrasi larutan sampel (μg/mL) V : volume larutan pengenceran (mL) Fp : faktor pengenceran
W : volume sampel (mL)
Maka, Konsentrasi kafein = 6,3474 µg/mL × 25 mL × 1
0,5 mL
= 317,37 µg/mL
Konsentrasi kafein dalam sampel = konsentrasi kafein x persen baku kafein = 317,37 µg/mL x 99,90%
= 317,0526 µg/mL
Volume sampel Kratingdaeng®
Jumlah kafein dalam sampel = kons. kafein dalam sampel x volume sampel = 150 mL
= 47,5579 mg
Konsentrasi Asam Benzoat : Y = (6,1027X + 0,4019) . 10-4 0, 0033 = (6,1027X + 0,4019) . 10 X = 5,3415 μg/mL
-4
Kadar Asam Benzoat : ����
�
C : kosentrasi larutan sampel (μg/mL) V : volume larutan pengenceran (mL) Fp : faktor pengenceran
W : volume sampel (mL)
Konsentrasi asam benzoat = 5,3415 µg/mL × 25 mL × 1
0,5 mL
= 267,0793 µg/mL
Konsentrasi asam benzoat = kons. asam benzoat x persen baku natrium benzoat = 267,0793 µg/mL x 100,34%
= 267,9873 µg/mL
Dilakukan penyetaraan dalam berat dengan melakukan penimbangan dalam 100 mL sampel yang wadahnya telah dikalibrasi dengan hasil sebagai berikut:
100 mL sampel setara dengan 105,2331 g sampel Kadar asam benzoat dalam sampel = 267,9873µg/mL
= 26798,73µg/105,2331 g = 254,6607 µg/g
= 254,6607 mg/Kg
Kadar natrium benzoat = kadar asam benzoat x BM natrium benzoat
BM asam benzoat
BM natrium benzoat = 144,11 ; BM asam benzoat = 122,12
Kadar natrium benzoat dalam sampel = kadar asam benzoat x BM Na benzoat
BM asam benzoat
= 254,6607 mg/Kg x 144,11
122,12
= 300,5172 mg/Kg
Lampiran 13.Contoh Perhitungan Jumlah Kafein dan Natrium Benzoat dalam Sampel M-150®
Volume sampel yang digunakan = 0,5 mL Absorbansi analisis (Y) :
Kafein (293,40 nm) = 0,0018 Asam Benzoat (213,20 nm) = 0,0028
Persamaan regresi pada panjang gelombang maksimum kafein (λ=293,40 nm) : Y = (3,0214X – 0,1782) . 10
Persamaan regresi pada panjang gelombang maksimum asam benzoat -4
(λ= 213,20 nm) : Y = (6,1027X + 0, 4019) . 10
Sehingga untuk mendapatkan kadar (X) sampel, digunakan subtitusi Y terhadap persamaan regresi pada masing-masing panjang gelombang.
Konsentrasi Kafein : Y = (3,0214X – 0,1782) . 10-4 0, 0018 = (3,0214X – 0,1782) . 10 X = 6,0164 μg/mL
-4
Kadar Kafein : ����
�
C : konsentrasi larutan sampel (μg/mL) V : volume larutan pengenceran (mL) Fp : faktor pengenceran
W : volume sampel (mL)
Maka, Konsentrasi kafein = 6,0164 µg/mL × 25 mL × 1
0,5 mL
= 300,82 µg/mL
Konsentrasi kafein dalam sampel = konsentrasi kafein x persen baku kafein = 300,82 µg/mL x 99,90%
= 300,5232 µg/mL
Volume sampel M-150®
Jumlah kafein dalam sampel = kons. kafein dalam sampel x volume sampel = 150 mL
= 300,5232 µg/mL x 150 mL = 45078,48 µg
Konsentrasi Asam Benzoat : Y = (6,1027X + 0,4019) . 10-4 0, 0028 = (6,1027X + 0,4019) . 10 X = 4,5223 μg/mL
-4
Kadar Asam Benzoat : ����
�
C : kosentrasi larutan sampel (μg/mL) V : volume larutan pengenceran (mL) Fp : faktor pengenceran
W : volume sampel (mL)
Konsentrasi asam benzoat = 4,5223 µg/mL × 25 mL × 1
0,5 mL
= 226,1139 µg/mL
Konsentrasi asam benzoat = kons. asam benzoat x persen baku natrium benzoat = 266,1139 µg/mL x 100,34%
= 266,8826 µg/mL
Dilakukan penyetaraan dalam berat dengan melakukan penimbangan dalam 100 mL sampel yang wadahnya telah dikalibrasi dengan hasil sebagai berikut:
100 mL sampel setara dengan 105,4542 g sampel Kadar asam benzoat dalam sampel = 266,8826µg/mL
= 215,1480 µg/g = 215,1480 mg/Kg
Kadar natrium benzoat = kadar asam benzoat x BM natrium benzoat
BM asam benzoat
BM natrium benzoat = 144,11 ; BM asam benzoat = 122,12
Kadar natrium benzoat dalam sampel = kadar asam benzoat x BM Na benzoat
BM asam benzoat
= 215,1480 mg/Kg x 144,11
122,12
= 253,8895 mg/Kg
Lampiran 14.Perhitungan Statistik Jumlah Kafein dan Natrium Benzoat dalam Sampel Merek Kratingdaeng
1. Jumlah Kafein
®
No. X
Kadar (mg) (� − �) (� − �)
2
1 47,5579 1,653 2,7324
2 47,5579 1,653 2,7324
3 45,0785 -0,826 0,6829
4 47,5579 1,653 2,7324
5 42,5987 -3,306 10,9309
6 45,0785 -0,826 0,6829
�= 45,9049 Σ(� − �)2= 20,4939
SD =
�
∑��−��2
�−1
=
�
20,49396−1
=
2,0245maka t(α/2,dk)
Data diterima jika t hitung < t tabel = 4,0321
t hitung 1 =
�
�−��� √�⁄
�
=
�
1,653
2,0245⁄√6
�
= 2,000003 t hitung 2 =�
�−��� √�⁄
�
=
�
1,653
2,0245⁄√6
�
= 2,000003 t hitung 3 =�
�−��� √�⁄
�
=
�
−0,826
2,0245⁄√6
�
= 0,999397 t hitung 4 =�
�−��� √�⁄
�
=
�
1,653
2,0245⁄√6
�
= 2,000003 t hitung 5 =�
�−��� √�⁄
�
=
�
−3,306
2,0245⁄√6
�
= 4,000006 t hitung 6 =�
�−��� √�⁄
�
=
�
−0,826
2,0245⁄√6
�
= 0,999397Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Jumlah Kafein dalam sampel merek Kratingdaeng® μ = � ± (t
:
α/2, dk)
= 45,9049 mg ± (4,0321 x 2,0245/√6) x SD/√n)
= (45,9049 ± 3,3325) mg
2. Kadar Natrium Benzoat No. Kadar (μg/gX
) (� − �) (� − �) 2
1 300,5172 1,5365 2,3608
2 291,2983 -7,6824 59,0193
3 328,1738 29,1931 852,2371
4 374,2681 75,2874 5668,1926
5 235,9852 -62,9955 3968,4330
�= 298,9807 Σ(� − �)2= 11799,0877 SD =
�
∑��−��2
�−1
=
�11799 ,0877 6−1=
48,5779Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1=5, maka t(α/2,dk)
Data diterima jika t hitung < t tabel = 4,0321
t hitung 1 =
�
�−��� √�⁄
�
=
�
1,5365
48,5779⁄√6
�
= 0,077476 t hitung 2 =�
�−��� √�⁄
�
=
�
−7,6824
48,5779⁄√6
�
= 0,387376 t hitung 3 =�
�−��� √�⁄
�
=
�
29,1931
48,5779⁄√6
�
= 1,472032 t hitung 4 =�
�−��� √�⁄
�
=
�
75,2874
48,5779⁄√6
�
= 3,796288 t hitung 5 =�
�−��� √�⁄
�
=
�
−62,9955
48,5779⁄√6
�
= 3,176482t hitung 6 =
�
�−��� √�⁄
�
=
�
−35,339
48,5779⁄√6
�
= 1,781932Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar natrium benzoat pada sampel merek Kratingdaeng® μ = � ± (t
:
α/2, dk)
= 298,9807μg/g ± (4,0321 x 48,5779/√6) x SD/√n)
= (298,9807 ± 79,9639) mg/Kg
Lampiran 15.Perhitungan Statistik Jumlah Kafein dan Natrium Benzoat dalam Sampel Merek M-150®
1. Jumlah Kafein
No. X
Kadar (mg) (� − �) (� − �)
2
1 45,0785 -1,6529 2,7321
2 47,5579 0,8265 0,6831
3 47,5579 0,8265 0,6831
4 45,0785 -1,6529 2,7321
5 47,5579 0,8265 0,6831
6 47,5579 0,8265 0,6831
�= 46,7314 Σ(� − �)2= 8,1966
SD =
�
∑��−��2
�−1
=
�8,1966 6−1=
1,2804maka t(α/2,dk)
Data diterima jika t hitung < t tabel = 4,0321
t hitung 1 =
�
�−��� √�⁄
�
=
�
−1,6529
1,2804⁄√6
�
= 3,162107 t hitung 2 =�
�−��� √�⁄
�
=
�
0,8265
1,2804⁄√6
�
= 1,581149 t hitung 3 =�
�−��� √�⁄
�
=
�
0,8265
1,2804⁄√6
�
= 1,581149 t hitung 4 =�
�−��� √�⁄
�
=
�
−1,6529
1,2804⁄√6
�
= 3,162107 t hitung 5 =�
�−��� √�⁄
�
=
�
0,8265
1,2804⁄√6
�
= 1,581149 t hitung 6 =�
�−��� √�⁄
�
=
�
0,8265
1,2804⁄√6
�
= 1,581149Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Jumlah Kafein dalam sampel merek M-150® μ = � ± (t
:
α/2, dk)
= 46,7314 mg ± (4,0321 x 1,2804/√6) x SD/√n)
= (46,7314 ± 2,1077) mg
2. Kadar Natrium Benzoat No. Kadar (μg/gX
) (� − �) (� − �) 2
1 253,8895 -29,1318 848,6618
2 299,8871 16,8658 284,4552
3 299,8871 16,8658 284,4552
4 290,6876 7,6663 58,7722
5 253,8895 -29,1318 848,6618
�= 283,0213 Σ(� − �)2= 2609,4614 SD =
�
∑��−��2
�−1
=
�
2609,46146−1
=
22,8449Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1=5, maka t(α/2,dk)
Data diterima jika t hitung < t tabel = 4,0321
t hitung 1 =
�
�−��� √�⁄
�
=
�
−29,1318
22,8449⁄√6
�
= 3,123588 t hitung 2 =�
�−��� √�⁄
�
=
�
16,8658
22,8449⁄√6
�
= 1,808395 t hitung 3 =�
�−��� √�⁄
�
=
�
16,8658
22,8449⁄√6
�
= 1,808395 t hitung 4 =�
�−��� √�⁄
�
=
�
7,6663
22,8449⁄√6
�
= 0,822001 t hitung 5 =�
�−��� √�⁄
�
=
�
−29,1318
22,8449⁄√6
�
= 3,123588 t hitung 6 =�
�−��� √�⁄
�
=
�
16,8658
22,8449⁄√6
�
= 1,808395Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar natrium benzoat pada sampel merek M-150® μ = � ± (t
:
α/2, dk)
= 283,0213μg/g ± (4,0321 x 22,8449/√6) x SD/√n)
= (283,0213 ± 37,6049) mg/Kg
[image:45.595.130.463.439.652.2]Lampiran 16. Kurva Serapan Uji Perolehan KembaliM-150®
Gambar 67. Kurva Serapan Uji Perolehan KembaliM-150® -2
[image:46.595.123.463.433.689.2]Gambar 69. Kurva Serapan Uji Perolehan KembaliM-150® -4
[image:47.595.131.459.433.650.2]Gambar 71. Kurva Serapan Uji Perolehan KembaliM-150® -6
Lampiran 17. Hasil Uji Perolehan Kembali Kafein dan Natrium Benzoat Setelah Penambahan Masing-Masing Larutan Standar Pada Sampel M-150®
1. Hasil Analisis Kafein Setelah Penambahan Larutan Standar Kafein Sampel Volume sampel (mL) Serapan λ 293,40 nm Konsentrasi (µg/mL) Kadar (µg/mL) Persen Perolehan Kembali (%)
1 0,5 0,0048 15,9456 796,4854 101,03
2 0,5 0,0046 15,2837 763,4213 94,14
3 0,5 0,0047 15,6149 779,9533 97,58
4 0,5 0,0050 16,6076 829,5496 107,92
5 0,5 0,0048 15,9456 796,4854 101,03
6 0,5 0,0049 16,2766 813,0175 104,47
X
�= 101,03
Sampel Volume sampel (mL) Serapan λ 213,20 nm Konsentrasi (µg/mL) Kadar (µg/g) Persen Perolehan Kembali (%)
1 0,5 0,0058 9,4381 529,8753 104,13
2 0,5 0,0057 9,2743 520,6773 100,25
3 0,5 0,0055 8,9465 502,2740 92,49
4 0,5 0,0057 9,2743 520,6773 100,25
5 0,5 0,0056 9,1104 511,4757 96,37
6 0,5 0,0055 8,9465 502,2740 92,49
X
�= 97,66
Lampiran 18. Contoh Perhitungan Uji Perolehan Kembali dengan menggunakan Sampel M-150®
Volume sampel yang digunakan = 0,5 mL Absorbansi analisis (Y) :
Kafein (293,40 nm) = 0,0048 Asam Benzoat (213,20 nm) = 0,0058
Persamaan regresi pada panjang gelombang maksimum kafein (λ=293,40 nm) : Y = (3,0214X – 0,1782) . 10
Persamaan regresi pada panjang gelombang maksimum asam benzoat -4
Konsentrasi Kafein : Y = (3,0214X – 0,1782) . 10-4 0, 0048 = (3,0214X – 0,1782) . 10 X = 15,9456 μg/mL
-4
Konsentrasi Asam Benzoat : Y = (6,1027X + 0,4019) . 10-4 0, 0058 = (6,1027X + 0,4019) . 10 X = 9,4381 μg/mL
-4
1. Perhitungan Uji Perolehan Kembali Kafein
Konsentrasi awal setelah penambahan larutan baku = 15,9456 µg/mL Konsentrasi = Konsentrasi (µg/mL )
Volume sampel (mL ) × volume (mL) × Faktor pengenceran
= 15,9456 µg/mL × 25 mL × 1
0,5 mL
= 797,2827 µg/mL CF
= 797,2827 µg/mL x 99,90%
= konsentrasi kafein x persen baku kafein
= 796,4854 µg/mL
Kadar kafein setelah ditambah larutan baku (CF
Kadar rata-rata kafein sebelum ditambah larutan baku (C
) = 796,4854 µg/mL A
Kadar larutan standar yang ditambahkan (C
) = 311,5428 µg/mL * A C ) * A
=
200 µg/mL0,5 mL
×1,2 mL
= Konsentrasi baku yang ditambahkan
=480 µg/mL
Maka persen perolehan kembali kafein = CF − CA
CA∗
×100%
=
(796,4854−311,5428) µg/mL480 µg/mL
×100%
= 101,03%
2. Perhitungan Uji Perolehan Kembali Natrium Benzoat
Konsentrasi awal setelah penambahan larutan baku = 9,4381 µg/mL Konsentrasi = Konsentrasi (µg/mL )
Volume sampel (mL ) × volume (mL) × Faktor pengenceran
= 9,4381 µg/mL × 25 mL × 1
0,5 mL
= 471,9067 µg/mL = 47190,67 µg/100 mL = 47190,67 µg/105,4542 g = 447,4992 µg/g
CF
= 447,4992 µg/g x 100,34%
= konsentrasi x persen baku natrium benzoat
= 449,0207 µg/g
Kadar natrium benzoat dalam sampel = kadar asam benzoat x BM Na benzoat
BM asam benzoat
= 449,0207 µg/g x 144,11
122,12
= 529,8753µg/g
Kadar natrium benzoat setelah ditambah larutan baku (CF Kadar rata-rata na. benzoat sebelum ditambah larutan baku (C
) = 529,8753 µg/g A
Kadar larutan standar yang ditambahkan (C
) = 283,0213 µg/g *
C*A
=
50 µg/mL0,5 mL
×2,5 mL
= Konsentrasi baku yang ditambahkan
Volume sampel
×mL yang ditambahkan
= 250 µg/mL = 25000 µg/100 mL = 25000 µg/105,4542 g = 237,0697 µg/g
Maka persen perolehan kembali na. benzoat = CF − CA
CA∗
×100%
=
�529,8753 –283 ,0213�µg/g237 ,0697 µg/g ×100% = 104,13%
Lampiran 19. Perhitungan Simpangan Baku Relatif (RSD) Jumlah Kafein
No. Persen Perolehan Kembali
(Xi) (Xi - X� ) (Xi - X� ) 2
1 101,03 0 0
2 94,14 -6,89 47,4721
3 97,58 -3,45 11,9025
4 107,92 -6,89 47,4721
5 101,03 0 0
6 104,47 3,44 11,8336
X
� = 101,03 ∑ = 125,5703
SD =
�
∑(Xi− X�)=
�
125,57035
= 5,01
RSD = SD
X
�x 100%
= 5,0114
101,03x 100%
Lampiran 20. Perhitungan Simpangan Baku Relatif (RSD) Kadar Natrium Benzoat
No. Persen Perolehan Kembali
(Xi) (Xi - X� ) (Xi - X� ) 2
1 104,13 6,47 41,8609
2 100,25 2,59 6,7081
3 92,49 -5,17 26,7289
4 100,25 2,59 6,7081
5 96,37 -1,27 1,6641
6 92,49 -5,17 26,7289
X
�= 97,66 ∑ = 110,399
SD =
�
∑(Xi− X�)2 n−1
=
�
110,3995
= 4,69
RSD = SD
X
�x 100%
= 110,399
97,66x 100%
Lampiran 21. Perhitungan Pembuatan HCl 0,1N
HCl pekat = 37% setara dengan 12 N HCl pekat = 37% x berat jenis HCl
= 37
100 x 1,19 Kg = 0,4403 Kg = 440,3 g N HCl 37% = ����
BM
= 440 ,3 g 36,45
= 12 N
Maka, untuk membuat HCl 0,1N, dimasukkan 8,3 mL HCl 37% kedalam labu tentukur 1000 mL lalu dicukupkan dengan akuades sampai garis tanda. V1 x N1 = V2 x N
V
2
1
V
x 12 N = 1000 mL x 0,1 N
1 0,1N
N 12
mL 1000
x =
Lampiran 22. Bagan Alir Prosedur Penelitian
diambil 10 mL
dimasukkan ke dalam labu tentukur 100 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
LIB II Kafein 50 μg/mL
Standar 1
8 μg/mL Standar 3
10 μg/mL
Standar 2 9 μg/mL
Standar 4 11 μg/mL
Standar 5 12 μg/mL
diambil 4 mL diambil 5 mL diambil 4,5 mL
diambil 5,5mL diambil 6 mL
diukur serapan maksimum
pada λ 200 -400 nm
λkafein= 272,60
nm Kafein BPFI
ditimbang 50 mg
dimasukkan ke dalam labu tentukur 100 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
diambil 10 mL
dimasukkan ke dalam labu tentukur 100 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
LIB II Asam Benzoat 50 μg/mL
Standar 1
3 μg/mL Standar 2 4 μg/mL Standar 3 5 μg/mL
Standar 4
6 μg/mL Standar 5 7 μg/mL
diambil 1,5 mL diambil 2 mL diambil 2,5 mL
diambil 3 mL diambil 3,5 mL
diukur serapan maksimum
pada λ 200 -400 nm
λ asam benzoat= 230,20 nm Asam Benzoat BPFI
ditimbang 50 mg
dimasukkan ke dalam labu tentukur 100 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
Larutan Standar Asam Benzoat (3; 4; 5; 6; 7μg/mL)
diukur serapan pada λ 200-400 nm ditransformasikan ke serapan derivat pertama
ditransformasikan ke serapan derivat kedua
ditentukan zero crossing ditentukan panjang gelombang analisis
dibuat kurva kalibrasi
λasam benzoat = 213,20 nm Y = (6,1027 X + 0,4019) X 10-4 Larutan Standar Kafein (8; 9; 10; 11; 12μg/mL)
diukur serapan pada λ 200-400 nm ditransformasikan ke serapan derivat pertama
ditransformasikan ke serapan derivat kedua
ditentukan zero crossing ditentukan panjang gelombang analisis
dibuat kurva kalibrasi
λkafein = 293,40 nm
Sampel
diambil 20 mL
dimasukkan ke dalam beaker gelas
dihangatkan di hotplate suhu 70oC selama 3 menit disaring
didinginkan diambil 0,5 mL
dimasukkan ke dalam labu tentukur 25 mL dilarutkan dan dicukupkan dengan HCL 0,1N diukur pada λ 213,20 nm dan 293,40 nm
DAFTAR PUSTAKA
Anonim. (2005). Scientific Committee on Consumer Products(SCCP). Opinion on Benzoic Acid and Sodium Benzoate. European Commission Health and Consumer Protection Directorate-General. Adopted by the SCCP during The Fourth Edition Plenary of 21 Juni 2005.Pages. 5 - 10.
Babu, K.M., Church, R.J., dan Lewander, W. (2008). Energy Drinks: The NewEye-Opener for Adolescents.Clinical Pediatric Emergency Medicine: Elsevier. (9): 35 - 42.
Badan Standarisasi Nasional. (1995). SNI 01-0222-1995. Bahan Tambahan Pangan. Jakarta: BSN. Hal. 95.
Badan Standarisasi Nasional. (2002). SNI 01-6684-2002. Bahan Tambahan Pangan. Jakarta: BSN. Hal. 2.
Batubara, I., Rafi, M., danDarusman, L.K. (2005). Estimasi Kandungan Kurkumin Pada Sediaan Herbal Komersial Secara Spektrofotometri Derivatif. 9(1): 28 - 34.
Cahyadi, W. (2008). Analisis dan Aspek Kesehatan Bahan Tambahan Pangan. Edisi Kedua. Jakarta: Bumi Aksara. Hal. 5 – 9, 22 - 24.
Cairns, D. (2008). Essentials of Pharmaceutical Chemistry. Edisi Ketiga. London: Pharmaceutical Press. Hal. 177 - 179.
Connors, K.A. (1982). Textbook of Pharmaceutical Analysis.Edisi Ketiga. New York: Willey - VCH. Hal. 171 - 222.
Day, R.A., dan Underwood, A.L. (1998).Quantitative Analysis Sixth Edition. Penerjemah: Sopyan, I. (2002).Analisa Kimia KuantitatifEdisi Ke Enam. Jakarta: Erlangga. Hal. 412-414.
Denney, R.C., dan Sinclair, R. (1991). Visible and Ultraviolet Spectroscopy. Analytical Chemistry by Open Learning. Singapore: John Wiley & Sons.Hal. 84-85.
Ditjen POM. (1979). Farmakope Indonesia Edisi III. Jakarta: Departemen Kesehatan RI. Hal. 53.
Ditjen POM. (1995). Farmakope Indonesia Edisi IV. Jakarta: Departemen Kesehatan RI. Hal. 254 - 255, 584, 1067.
Engel, R. (2009). Development of Analytical Methods for Determination of Water Soluble Vitamins in Functional Foods Products. Tanggal Akses 24 Juli 2014.
Epshtein, N.A. (2004). Validation of HPLC Techniques for Pharmaceutical Analysis. Pharmaceutical Chemistry Journal. 4(38): 212 - 228.
Ermer, J., dan Miller, J.H.M. (2005). Method Validation in Pharmaceutical Analysis. A Guide to Best Practice. Weinheim: Willey - VCH. Hal. 251 - 272.
Gunawan, S.G., dan Wilmana, P.F. (2007). Analgesik-Antipiretik, Analgesik Anti-Inflamasi Nonsteroid dan Obat Gangguan Sendi Lainnya. Dalam: Farmakologi dan Terapi. Edisi 5. Editor: Gunawan, S.G., dan Wilmana, P.F. Jakarta: Departemen Farmakologi dan Terapeutik Fakultas Kedokteran UI. Hal. 252 - 253.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitugannya. Majalah Ilmu Kefarmasian. 1(3): 117 - 135.
Hayun., Harianto., dan Yenti. (2006). Penetapan Kadar Triprolidina Hidroklorida dan Pseudoefedrina Hidroklorida dalam Tablet Anti Influenza Secara Spektrofotometri Derivatif. Majalah Ilmu Kefarmasian. 3(1): 94 - 105. Holme, D.J., dan Peck, H. (1983). Analytical Biochemistry. New York: Longman
Inc. Hal. 42 - 43.
Jones, D.S. (2010). Statistik Farmasi. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 21.
Kartadarma, E., Nawawi, A., dan Halida. (2007). Penentuan Kuantitatif Zat Warna Karmoisin, Ponceau 4R Dan Merah Alura yang Ditambahkan dalam Minuman Angrem. Jurnal Teknologi dan Industri Pangan. 18(1): 67 - 71. Moffat, A.C., Osselton, M.D., dan Widdop, B. (2005). Clarke’s Analysis of Drug
and Poisons. Edisi Keempat. London: Pharmaceutical Press. Pages. 965, 1028, 1173, 1521, 1772, 1988, 2017, 2038, 2142.
Munson, J.W. (1984). Pharmaceutical Analysis Part B Modern Methods. Penerjemah: Harjana. (1991). Analisis Farmasi Metode Modern Bagian B. Surabaya: Airlangga University Press. Hal. 334, 385.
Nurdiani, dan Nurhidayati, L. (2007). Simultaneous Determination of Caffeine and Nicotinamide in Energy Drinks by First-Order Derivative Spectrophotometry.Jakarta: Fakultas Farmasi Universitas Pancasila.
Nurhidayati, L. (2007). Spektrofotometri Derivatif dan Aplikasinya dalam Bidang Farmasi. Jurnal Ilmu Kefarmasian Indonesia. 5(2): 93 - 99.
Owen, A.J. (1995). Uses of Derivative Spectroscopy Aplication Note UV - Visible Spectroscopy. HP Way: Agilent Technologies. Hal. 5-10.
Pakaya, M., Naid, T., dan Kasim, S. (2011). Penetapan Kadar Parasetamol dalam Tablet Kombinasi Parasetamol Dengan Kofein Secara Spektrofotometri Ultraviolet - Sinar Tampak. Majalah Farmasi dan Farmakologi. 15(2): 77 - 82.
Rohman, A. (2007). Kimia Farmasi Analisis. Yog yakarta: Pustaka Pelajar. Hal. 235-236, 240-243, 464.
Sari, A.P., Fajrianti, A., Iqbal, M., dan Dwijayanti, R. (2013). Analisis Spektofotometri UV/Vis dari Campuran Kadar Kafein dan Natrium Benzoat dalam Minuman Berenergi “Phanter”. Tanggal Akses 10 Juni 2014.
Satiadarma, K., Mulja, M., Tjahjono, D.H., dan Kartasasmita, R.E. (2004). Asas Pengembangan Prosedur Analisis. Edisi Pertama. Surabaya: Airlangga University Press. Hal. 49, 87 - 93.
Skujins, S., dan Varian, A.G. (1986). Applications of UV - Visible Derivative Spectrophotometry. Switzerland: CH 6300 Zug. Hal. 1 - 30.
Smit, H.J. (2004). Effects of Low Doses of Caffeine on Cognitive Performance Effects of Energy Drink Constituents: Caffeine, Glucose and Carbonation. Nutritional Neuroscience. 7: 127 - 139.
Sudarmadji, S., Haryono, B., dan Suhardi. (1989). Analisa Bahan Makanan dan Pertanian. Yogyakarta: Penerbit Liberty. Hal. 167.
Sudjadi dan Rohman, A. (2008). Analisis Kuantitatif Obat. Yogyakarta: Gadjah Mada University Press. Hal. 23, 95.
Sudjana. (2005). Metode Statistika. Bandung: Penerbit Tarsito. Hal. 93, 145, 201, 225.
Talsky, G. (1994). Derivative Spectrophotometry. Low and Higher Order. Weinheim Germany: VCH Verlagsgesellschaft mbH. Hal. 16 - 43.
Tautua, A., Martin, W.B., dan Diepreye, E.R.E. (2014). Ultra-violet Spectrophotometric Determination of Caffeine in Soft and Energy Drinks Available in Yenagoa, Nigeria. Journal of Food Science and Technology. 6(2): 155 - 158.
Tan, H.T., dan Rahardja, K. (2007). Obat-Obat Penting. Edisi Keempat. Cetakan Pertama. Jakarta: Elex Media Komputindo. Hal. 105.
BAB III
METODE PENELITIAN
3.1 Jenis Penelitian
Jenis yang digunakan pada penelitian ini adalah penelitian deskriptif dengan metode spektrofotometri derivatif terhadap analisa 2 zat yang terkandung dalam 2merek sampel minuman berenergi.
3.2 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara, dimulai dari Maret 2014 sampai dengan Juni 2014. 3.3 Alat
Alat–alat yang digunakan dalam penelitian adalah spektrofotometer ultraviolet (UV-1800 Shimadzu), neraca analitik (Mettler Toledo), kuvet, kertas saring, karet penghisap, spatula, alat-alat gelas dan alat-alat lainnya yang diperlukan dalam penyiapan sampel. Gambar spektrofotometer UV dapat dilihat pada Lampiran 1 halaman 55.
3.4 Bahan
Bahan–bahan yang digunakan dalam penelitian adalah HCl 0,1N, kafein BPFI (sertifikat pengujian kafein dapat dilihat pada Lampiran 24 Halaman 114), natrium benzoat BPFI (sertifikat pengujian kafein dapat dilihat pada Lampiran 25 halaman 115) dan akuades.
3.5 Pengambilan Sampel
2005).Sampel yang digunakan pada penelitian ini adalah minuman berenergi dengan 2merek yaitu Kratingdaeng® dan M-150®
3.6 Prosedur Penelitian
yang dibeli di minimarket sekitar Universitas Sumatera Utara, Medan. Gambar dan spesifikasi sampel dapat dilihat pada Lampiran 1 halaman 55.
3.6.1 Pembuatan Pereaksi
Diencerkan 8,3ml HCl 37% (v⁄v) dengan 1 liter akuades (Ditjen POM,
1979). Perhitungan pembuatan pereaksi dapat dilihat pada Lampiran 21 halaman 108.
3.6.2Pembuatan Larutan Induk baku dan Larutan Standar
3.6.2.1 Pembuatan Larutan Induk Baku Kafein BPFI
Larutan induk baku kafein dibuat dengan menimbang secara seksama serbuk kafein BPFI sebanyak 50 mg, kemudian dilarutkan dengan 20 mL larutan HCl 0,1N di dalam labu tentukur 100 ml dan dicukupkan dengan larutan HCl
0,1N sehingga didapatkan larutan dengan konsentrasi 500 μg/ml (LIB I). Selanjutnya dipipet 10 ml larutan LIB I untuk diencerkan dalam labu tentukur 100 ml dengan HCl 0,1N sampai garis tanda. Homogenkan, sehingga diperoleh larutan dengan konsentrasi 50 μg/ml (LIB II) (Ditjen POM, 1995).
3.6.2.2 Larutan Induk Baku Asam Benzoat BPFI
tentukur 100 ml dengan HCl 0,1N sampai garis tanda. Homogenkan, sehingga diperoleh larutan dengan konsentrasi 50 μg/ml (LIB II) (Ditjen POM, 1995). 3.6.2.3 Pembuatan Larutan Standar Kafein
Dipipet Larutan Induk Baku II kafein (konsentrasi = 50 μg/ml) sebanyak 4 ml; 4,5 ml; 5 ml; 5,5 ml; dan 6 ml. Masing-masing dimasukkan ke dalam labu tentukur 25 ml, diencerkan dengan HCl 0,1N hingga garis tanda. Lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 8; 9; 10;11; dan 12 μg/ml. Kurva serapan kafein dapat dilihat pada Gambar 21 - 25 Lampiran 2 halaman 57 - 59.
3.6.2.4 Pembuatan Larutan Standar Asam Benzoat
Dipipet Larutan Induk Baku II asam benzoat (konsentrasi = 50 μg/ml) sebanyak 1,5 ml; 2 ml; 2,5 ml; 3 ml; dan 3,5 ml. Masing-masing dimasukkan ke dalam labu tentukur 25 ml, diencerkan dengan HCl 0,1N hingga garis tanda. Lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 3; 4; 5; 6; dan 7 μg/ml.Kurva serapan asam benzoat dapat dilihat pada Gambar 26 - 30 Lampiran 2 halaman 59 - 61.
3.6.3 Pembuatan Spektrum Serapan Maksimum
3.6.3.1 Pembuatan Spektrum Serapan Maksimum Kafein
3.6.3.2 Pembuatan Spektrum Serapan Maksimum Asam Benzoat
Dipipet sebanyak 2,5ml dari LIB II asam benzoat (konsentrasi = 50 μg/ml) kemudian dimasukan ke dalam labu tentukur 25 ml untuk diencerkan dengan larutan HCl 0,1N hingga garis tanda, kemudian dikocok sampai homogen untuk memperoleh larutan dengan konsentrasi 5 μg/ml. Diukur serapannya pada panjang gelombang 200-400 nm. Kurva serapan maksimum asam benzoat dapat dilihat pada Gambar 7 halaman 37.
3.6.4Pembuatan Spektrum Serapan Derivatif
3.6.4.1 Pembuatan Spektrum Serapan Derivatif Kafein
Dibuat spektrum serapan (tanpa diderivatkan) larutan standar dengan konsentrasi 8; 9; 10; 11; dan 12 μg/ml kafein pada panjang gelombang 200-400 nm.Kemudian spektrum ditransformasikan menjadi spektrum serapan derivat pertama dan derivat kedua dengan Δλ = 2 nm (Ditjen POM, 1995). Kurva serapan derivatif pertama kafein dapat dilihat pada Gambar 31 - 35 Lampiran 3 halaman 62 - 64. Kurva serapan derivatif kedua kafein dapat dilihat pada Gambar 41 - 45 Lampiran 4 halaman 67 - 69.
3.6.4.2 Pembuatan Spektrum Serapan Derivatif Asam Benzoat
Dibuat spektrum serapan (tanpa diderivatkan) larutan standar dengan konsentrasi 3, 4, 5, 6, dan 7μg/ml asam benzoat pada panjang gelombang 200-400 nm. Kemudian spektrum ditransformasikan menjadi spektrum serapan derivat
pertama dan derivat kedua dengan Δλ = 2 nm (Ditjen POM, 1995). Kurva serapan
3.6.5Penentuan Zero Crossing
Penentuan zero crossing diperoleh dengan menumpangtindihkan
(overlapping) spektrum serapan masing-masing derivat dalam berbagai
konsentrasi larutan. Zero crossing tiap spektrum serapan derivat masing-masing zat ditunjukkan oleh panjang gelombang yang memiliki serapan nol pada berbagai konsentrasi (Hayun, dkk., 2006).Zero crossingderivat pertama kafein dan asam benzoat dapat dilihat pada Gambar 10 - 11 halaman 39 - 40. Zero crossingderivat kedua kafein dan asam benzoat dapat dilihat pada Gambar 16 - 17 halaman 41. 3.6.6Penentuan Panjang Gelombang (λ) Analisis
Dibuat larutan kafein dengan konsentrasi 9 μg/ml, larutan asam benzoat dengan konsentrasi 5 μg/ml dan larutan campuran kedua zat. Kemudian dibuat spektrum serapan derivat kedua dari masing-masing zat tunggal dan dari campuran zat. Spektrum serapan derivat kedua dari larutan zat tunggal dan campuran keduanya ditumpangtindihkan. Yang dipilih untuk menjadi panjang gelombang analisis adalah pada saat serapan senyawa pasangannya nol dan serapan maksimum zat itu dan campurannya sama atau persis sama. Karena pada panjang gelombang tersebut dapat secara selektif mengukur serapan zat tersebut (Hayun, dkk., 2006). Panjang gelombang analisis dapat dilihat pada Gambar 16 - 17 halaman 41.
3.6.7Pembuatan dan Penentuan Linearitas Kurva Kalibrasi
3.6.7.1 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi Kafein
Dibuat larutan standar kafein dengan konsentrasi 8; 9; 10; 11 dan 12
konsentrasidengan serapan sehingga diperoleh persamaan regresi linear y = ax + b, dan berdasarkan nilai serapan pada panjang gelombang 293,40 nm, dilakukan pula perhitungan limit of detection (LOD) dan limit of quantitation (LOQ). Untuk menentukan batas deteksi (LOD) dan batas kuantitasi (LOQ) dapat digunakan rumus:
�� =�∑(�−��)2
�−2
���= 3��
�����
LOQ = 10��
�����
Keterangan : SB = Simpangan baku
LOD = Limit Of Detection= Batas deteksi
LOQ = Limit Of Quantitation= Batas kuantitasi
3.6.7.2 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi Asam Benzoat
Dibuat larutan standar asam benzoat dengan konsentrasi 3; 4; 5; 6; dan 7
μg/ml, kemudian diukur serapan derivat kedua (Δλ = 2 nm) pada panjang gelombang 213,20 nm. Kemudian dilakukan analisis hubungan antara konsentrasi dengan serapan sehingga diperoleh persamaan regresi linear y = ax + b, dan berdasarkan nilai serapan pada panjang gelombang 213,20 nm, dilakukan pula perhitunganLOD dan LOQ seperti rumus di atas.
3.6.8 Penentuan Jumlah Kafein dan Natrium Benzoat dalam Minuman Berenergi
sebanyak 0,5ml ke dalam labu tentukur 25 ml dan dicukupkan dengan larutan HCl 0,1N, lalu dikocok sampai homogen. Larutan kemudian diukur absorbansinya pada serapan derivat kedua dengan panjang gelombang 293,40 nm untuk analisis kafein dan 213,20 nm untuk analisis asam benzoat.
Konsentrasi asam benzoat dan kafein dapat dihitung dengan rumus: Konsentrasi (µg/ml) = Konsentrasi awal (X) (µg / ml )×volume (ml )×F. Pengenceran
Volume Sampel (ml )
Kadar natrium benzoat dapat ditentukan dari berat molekulnya (BM): Kadar natrium benzoat (µg/ml) = kadar asam benzoat x BM natrium benzoat
BM asam benzoat
Bagan alir prosedur penelitian dapat dilihat pada Lampiran 22 halaman 109. Jumlah kafein dan natrium benzoat yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis untuk mengetahui data ditolak atau diterima menggunakan uji distribusi t dengan rumus:
t hitung
Data diterima jika t =
�
X− X�SD /√n
�
Rhitung< t tabel
Menurut Sudjana (2005), mencari standar deviasi (SD) digunakan rumus: . Tabel distribusi t dapat dilihat pada Lampiran 23 halaman 113.
SD =
�
∑(X− X�) 2n−1
Keterangan : X = kadar zat dalam sampel
X
�
= kadar rata-rata zat dalam sampel n = jumlah pengulanganMenurut Sudjana (2005), menentukan kandungan kafein dan natrium
benzoat sebenarnya dalam sampel dengan interval kepercayaan 99%, α = 1%, dk
Kadar : µ = X�± (t R(α/2, dk)
Keterangan : µ = kadar sebenarnya x SD/√n )
X
� = kadar rata-rata zat dalam sampel SD = standar deviasi
dk = derajat kebebasan (dk = n - 1)
t = harga t tabel sesuai dengan dk = n - 1
α = tingkat kepercayaan 3.6.9Uji Validasi
Uji validasi yang dilakukan pada penelitian ini menggunakan uji akurasi dengan parameter persen perolehan kembali menggunakan metode penambahan baku dan uji presisi dengan parameter RSD.
Menurut Harmita (2004), persen perolehan kembali dapat dihitung dengan rumus: % perolehan kembali = CF − CA
CA∗
×100%
Keterangan: CF C
=Kadar zat dalam sampel setelah penambahan larutan baku A
C
= Kadar zat dalam sampel sebelum penambahan larutan baku *
A
3.6.9.1 Uji Akurasi
= Kadar larutan baku yang ditambahkan
Disiapkan larutan standar asam benzoat dengan cara melarutkan 11,8 mg serbuk natrium benzoat yang setara dengan 10 mg asam benzoat dalam labu ukur 50 ml, kemudian dicukupkan dengan HCl 0,1N untuk mendapatkan larutan standar asam benzoat dengan konsentrasi 200 μg/ml. Lalu dipipet 6,25 ml kedalam labu ukur 25 ml sehingga konsentrasi menjadi 50 μg/ml. Disiapkan juga larutan standar kafein dengan cara melarutkan 10 mg serbuk kafein dengan HCl 0,1N dalam labu ukur 50 ml untuk mendapatkan konsentrasi 200 μg/ml. Larutan sampel yang sebelumnya telah dibuat, dipipet0,5ml untuk dimasukkan ke dalam labu ukur 25 ml. Kemudian ditambahkan larutan standar asam benzoat sebanyak 2,5 ml yang setara dengan konsentrasi (50 µg / ml X 2,5 ml
Ditambahkan juga 1,2 ml larutan standar kafein sehingga memperoleh konsentrasi (200 µg / ml X 1,2 ml
0,5 �� = 480 μg/ml). Selanjutnya labu dicukupkan dengan HCl 0,1N
dan diukur dengan menggunakan spektrofotometer UV. Hasil spektrum
ditransformasikan menjadi derivat kedua dengan Δλ = 2 nm, kemudian dihitung
persen perolehan kembali berdasarkan nilai absorbansi pada panjang gelombang analisis zat masing-masing.
3.6.9.2 Uji Presisi
Presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Presisi yang diukur menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen, nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan (Harmita, 2004). Simpangan baku relatif dapat dihitung dengan rumus di bawah ini:
RSD =��
� x 100%
Keterangan : � = Kadar rata-rata zat dalam sampel SD = Standar deviasi
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Penentuan Kurva Serapan Maksimum
Penentuan kurva serapan maksimum dilakukan pada panjang gelombang 200–400 nm. Untuk kafein dilakukan pada konsentrasi 9 μg/ml, sedangkan untuk asam benzoat pengukuran dilakukan pada konsentrasi 5 μg/ml. Berdasarkan hasil
penelitian, diperoleh panjang gelombang maksimum pada λ = 272,60 nm untuk
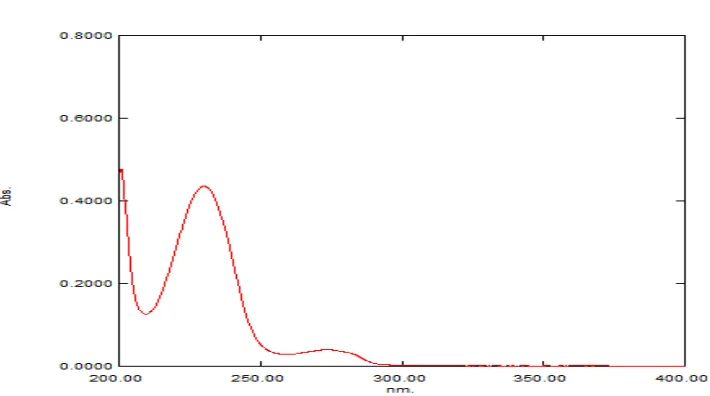
kafein dan λ = 230,20 nm untuk asam benzoat dapat dilihat pada Gambar 6 dan 7.
[image:81.595.116.471.513.711.2]Gambar 6. Kurva serapan maksimum kafein 9 μg/ml
4.2 Hasil Penentuan Kurva Serapan Kafein dan Asam Benzoat
Kurva serapan untuk larutan kafein dibuat dalam konsentrasi 8; 9; 10; 11;
[image:82.595.116.474.293.485.2]dan 12 μg/ml pada Gambar 21 – 25, dan untuk larutan asam benzoat dibuat dalam konsentrasi 3 ; 4; 5; 6; d an 7 μg /ml pada Gambar 26 – 30 dapat dilihat pada Lampiran 2 halaman 57 - 61. Kurva serapan dari masing-masing zat pada berbagai konsentrasi tersebut kemudian ditumpangtindihkan (overlapping) dapat dilihat pada Gambar 8 dan 9.
Gambar 8. Kurva tumpang tindih serapan kafein dalam berbagai konsentrasi
[image:82.595.114.477.535.723.2]4.3 Hasil Penentuan Kurva Serapan Derivat
4.3.1 Kurva Serapan Derivat Pertama
Telah didapatkan kurva serapan dari larutan kafein dan asam benzoat dari berbagai konsentrasi pada panjang gelombang 200 – 400 nm. Kurva serapan yang telah diperoleh selanjutnya ditransformasikan menjadi kurva serapan derivat
pertama dengan Δλ = 2 nm, kemudian ditumpangtindihkan. Kurva serapan derivat
pertama kafein dengan berbagai konsentrasi pada Gambar 31 – 35 dan untuk asam benzoat pada Gambar 36 – 40 dapat dilihat pada Lampiran 3 halaman 62 - 66. 4.4 Hasil Penentuan Zero Crossing
4.4.1 Zero Crossing Derivat Pertama
Penentuan zero crossing pada derivat pertama diperoleh dengan menumpangtindihkan atau mengoverlappingkan spektrum serapan derivat pertama pada masing-masing zat dari berbagai konsentrasi larutan, ditunjukkan oleh panjang gelombang yang memiliki serapan nol pada berbagai konsentrasi.
[image:83.595.114.440.522.694.2]Zero crossing kafein pada kurva serapan derivat pertama dapat dilihat pada
Gambar 10 dan asam benzoat dapat dilihat pada Gambar 11.
Gambar 11. Zero crossing asam benzoat derivat pertama dengan λ = 209,40; 230,20; 258,80; 273,0; dan 299,80 nm
4.5 Hasil Penentuan Panjang Gelombang Analisis
Penentuan panjang gelombang analisis dilakukan berdasarkan pengamatan pada kurva serapan masing-masing derivat, kemudian dilanjutkan dengan pengukuran absorbansi pada masing-masing zero crossing. Hasil dapat dilihat pada Gambar 12 – 17.
Gambar 12. Kurva tumpang tindih serapan derivat pertama kafein 9 μg/ml,asam
[image:84.595.117.497.463.667.2]Gambar 13. Zero crossing derivat kedua kafein pada λ = 293,40 nm
Gambar 14. Zero crossingderivat kedua asam benzoat pada λ = 213,20 nm
Dari gambar diatas, diperoleh panjang gelombang yang dapat dipakai adalah pada serapan derivat kedua. Hal ini diketahui berdasarkan pemilihan panjang gelombang analisis pada setiap derivat. Panjang gelombang analisis didapatkan dengan menentukan zero crossing untuk masing-masing zat dimana ditentukan panjang gelombang dengan absorbansi salah satu zat berada pada nilai nol sedangkan pada zat lain memiliki nilai positif.
[image:85.595.119.501.314.500.2]Gambar 10, untukasam benzoat zero crossing ditemukan pada panjang gelombang 209,40; 230,20; 258,80; 273,0; dan 299,80 nm dapat dilihat pada Gambar 11. Namun saat ditumpangtindihkan dengan campurannya dilihat pada Gambar 12, panjang gelombang analisis untuk kafein dapat ditemukan, sedangkan panjang gelombang analisis untuk asam benzoat tidak ditemukan, sehingga penentuan kadar sampel tidak bisa dilakukan pada derivat pertama.
Oleh karena itu dibuat spektrum serapan derivat kedua, kemudian dilakukan penentuan panjang gelombang analisis dengan cara yang sama seperti cara derivat pertama. Dari hasil spektrum serapan derivat kedua, zero crossing
setelah spektrum serapan derivat kedua dari kafein 9 μg/ml, asam benzoat 5 μg/ml
dan campuran kafein 9 μg/ml dengan asam benzoat 5 μg/ml ditumpangtindihkan, didapatkan panjang gelombang analisis untuk kafein pada 293,40 nm dapat dilihat pada Gambar 13 dan untuk asam benzoat pada 213,20 nm dapat dilihat pada Gambar 14. Panjang gelombang analisis dan absorbansinya dapat dilihat pada Tabel 1.
Tabel 1. Panjang Gelombang Analisis dan Absorbansinya Analit / Zat
Spektrum Serapan Derivat Kedua Pada Panjang gelombang (nm) 213,20 229,40 237,20 274,40 289,60 293,40 Kafein
(9 μg / ml) 0 0 0 -0,001 0,001 0,003
Asam Benzoat
(5 μg / ml) 0,003 -0,004 -0,003 0 0 0
Campuran 0,003 -0,003 -0,002 -0,003 0,002 0,003
panjang gelombang analisis ini didasarkan pada nilai absorbansi ketiga larutan pada panjang gelombang tersebut. Pada panjang gelombang 213,20 nm, nilai absorbansi kafein adalah nol, sedangkan nilai absorbansi untuk asam benzoat dan larutan campuran keduanya memiliki nilai serapan sama yaitu 0,003, sehingga untuk asam benzoat panjang gelombang analisisnya adalah pada 213,20 nm. Demikian juga untuk kafein, panjang gelombang analisis yang dipakai adalah 293,40 nm, karena pada panjang gelombang ini, nilai absorbansi dari asam benzoat adalah nol, sedangkan nilai absorbansi untuk kafein dan larutan campuran keduanya memiliki nilai serapan sama yaitu 0,003, sehingga untuk kafein panjang gelombang analisisnya adalah pada 293,40 nm. Spektrum dan absorbansi zat dapat dilihat pada Gambar 51 – 53 pada Lampiran 5 halaman 72 - 73.
Dibuat juga kurva tumpang tindih campuran kafein dan asam benzoat dengan sampel Kratingdaeng® dan M-150®dapat dilihat pada Gambar 15 dan zero
crossing untuk kafein dan asam benzoat dengan sampel Kratingdaeng® dan
M-150® pada Gambar 16 dan 17 untuk memastikan hanya pada panjang gelombang tersebut dapat secara selektif mengukur serapan zat yang akan dianalisis (Hayun, dkk., 2006).
Gambar 15. Kurva tumpang tindih campuran kafein 9 μg/ml dan asam benzoat 5
[image:87.595.115.455.564.712.2]Gambar 16.Kurva tumpang tindih kafein 9 μg/ml dan asam benzoat 5 μg/ml dengan sampel M-150®
Gambar 17. Kurva tumpang tindih kafein 9 μg/ml dan asam benzoat 5 μg/ml dengan sampel Kratingdaeng®
Dari Gambar 15, 16 dan 17 dapat diketahui bahwa kurva serapan kedua sampel serupa dengan kurva serapan laru tan stand ar k afein 9 μg /ml d an asam
[image:88.595.121.496.365.564.2]4.6 Hasil Penentuan Linearitas Kurva Kalibrasi
4.6.1 Kurva Kalibrasi
[image:89.595.116.388.360.526.2]Linearitas kurva kalibrasi menunjukkan hubungan yang linier antara absorbansi dengan konsentrasi. Kurva kalibrasi untuk kafein pada Gambar 18 diperoleh persamaan regresi Y = (3,0214X – 0,1782) x 10-4.dengan korelasi r = 0,9996. Sedangkan untuk asam benzoat pada Gambar 19 diperoleh persamaan regresi Y = (6,1027X + 0,4019) x 10-4 dengan korelasi r = 0,9998. Nilai r > 0,99 menunjukkan adanya korelasi linier hubungan antara X dan Y (Watson, 2005). Data kalibrasi dan perhitungan regresi dapat dilihat pada Lampiran 6 dan 7 halaman 74 - 77.
Gambar 18.Kurva kalibrasi kafein pada panjang gelombang 293,40 nm
Gambar 19.Kurva kalibrasiasam benzoat pada panjang gelombang 213,20 nm
Y= (3,0214X – 0,1782) . 10-4 r = 0,9996
[image:89.595.128.402.574.726.2]4.6.2 Batas Deteksi dan Batas Kuantitasi
Batas deteksi dan batas kuantitasi dihitung dari persamaan regresi yang diperoleh dalam kurva kalibrasi. Batas deteksi dan batas kuantitasi analisis kafein yang diperoleh secara berturut-turut adalah 0,9875μg/ml dan 3,2919μg/ml. Sedangkan untukasam benzoat, batas deteksinya adalah 0,209μg/ml dan batas kuantitasinya adalah 2,0902μg/ml. Perhitungan batas deteksi dan batas kuantitasi ini dapat dilihat pada Lampiran 8 dan 9 halaman 78 dan 79.
Hal ini menunjukkan bahwa pengukuran kadar kafein dengan konsentrasi
9 μg/ml dan asam benzoat dengan konsentrasi 5 μg/ml dapat terdeteksi dan terkuantitasi menggunakan metode spektrofotometri derivatif.
Batas deteksi merupakan parameter uji batas yang dilakukan untuk mendeteksi jumlah terkecil analit dalam sampel yang masih memberikan respon signifikan dengan blanko. Sedangkan batas kuantitasi merupakan kuantitas terkecil analit yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
4.7 Hasil Penentuan Jumlah Kafein dan Natrium Benzoat dalam Sampel Minuman Berenergi
Berdasarkan label yang tercantum, kedua merek minuman berenergi ini mengandung kafein dengan jumlah 50 mg per sajiannya dan natrium benzoat sebagai bahan pengawet tidak tercantum kandungannya di label. Penetapan kadar kafein dan natrium benzoat dapat dilakukan secara spektrofotometri derivatif. Natrium benzoat dalam sampel akan bereaksi dengan penambahan pelarut asam klorida membentuk asam benzoat.
spektrum serapan derivat kedua dengan Δλ = 2 nm. Dari spektrum ini dapat
[image:91.595.120.512.345.480.2]ditentukan absorbansi kafein dan asam benzoat pada panjang gelombang analisis yang telah diperoleh sebelumnya, yaitu pada panjang gelombang 293,40 nm untuk kafein dan pada 213,20 nm untuk asam benzoat. Spektrum serapan sampel Kratingdaeng® dan M-150®
Tabel 2. Jumlah Kafein dan Natrium Benzoat dalam sampel
dapat dilihat pada Gambar 54 – 65 halaman 80 - 85, data perhitungan dan contoh perhitungan kadar sampel yang diukur dapat dilihat pada Lampiran 10, 11, 12 dan 13 halaman 86 - 92. Data hasil perhitungan jumlah kafein dan natrium benzoat pada sampel setelah dilakukan analisa secara statistik dapat dilihat pada Tabel 2.
No. Sampel Jumlah Kafein (mg) Kadar Natrium Benzoat (mg/kg)
1. Kratingdaeng® 45,9049 ± 3,3325 298,9807 ± 79,9639 2. M-150® 46,7314 ± 2,1077 283,0213 ± 37,6049
Standarisasi Nasional, 1995). Jadi kedua zat ini yaitu kafein dan natrium benzoat di dalam sampel memenuhi persyaratan SNI 01-6684-2002. Perhitungan kadar sampel secara statistika dapat dilihat pada Lampiran 14 dan 15 halaman 93 - 98. 4.8 Hasil Uji Validasi
Parameter validasi yang diuji adalah akurasi (kecermatan), presisi (keseksamaan), batas deteksi dan batas kuantitasi. Akurasi dinyatakan dalam persen perolehan kembali (% recovery) yang ditentukan dengan menggunakan metode penambahan baku (standard addition method). Uji presisi dilakukan dengan menggunakan parameter RSD (Harmita, 2004).
4.8.1 Hasil Uji Akurasi
Tabel 3. Perolehan kembali kafein dan natrium benzoat dengan metode penambahan baku standar pada minuman M-150
Kadar Kafein (µg / ml)
®
(%) kafein
Kadar Natrium Benzoat (µg / g)
(%) benzoat Sebelu m Penamb ahan Baku Setelah Penamba han Baku Pena mba han Stan dar Sebelum Penamba han Baku Setelah Penamb ahan Baku Penamb ahan Standar
311,54 796,48 480 101,03 283,02 529,87 237,06 104,13 311,54 763,42 480 94,14 283,02 520,67 237,06 100,25 311,54 779,95 480 97,58 283,02 502,27 237,06 92,49 311,54 829,54 480 107,92 283,02 520,67 237,06 100,25 311,54 796,48 480 101,03 283,02 511,47 237,06 96,37 311,54 813,01 480 104,47 283,02 502,27 237,06 92,49 X
�= 101,03 X�= 97,66
Berdasarkan Tabel di atas diperoleh rata-rata persen perolehan kembali untuk kafein adalah 101,03% dan untuk natrium benzoat adalah 97,66% memenuhi syarat akurasi yang telah ditetapkan yaitu berada pada rentang 80% – 120% (Ermer dan Miller, 2005). Persen perolehan kembali tersebut menunjukkan kecermatan atau akurasi yang baik.
4.8.2 Hasil Uji Presisi
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang dilakukan, maka dapat disimpulkan:
1. Metode spektrofotometri derivatif dapat digunakan untuk menganalisa kandungan kafein dan natrium benzoat dalam minuman berenergi, dengan spektrum serapan derivat kedua menggunakan metode zero crossingΔλ=
2 nm, diperoleh λ kafein 293,40 nm danasam benzoat 213,20 nm.
2. Jumlahper sajian kafein pada Kratingdaeng®yaitu 45,9049 ± 3,3325 mg dan natrium benzoat yaitu 298,9807 ± 79,9639 mg/kg. Pada M-150®
3. Validasi metode spektrofotometri derivatif dengan persen perolehan kembali untuk kafein 101,03% dan natrium benzoat 97,66% memenuhi persyaratan 80 – 120%. RSD kafein adalah 4,96% dan natrium benzoat adalah 4,81% masih memenuhi persyaratan yaitu dibawah 10 – 20%. jumlah per sajian kafein yaitu 46,7314 ± 2,1077 mg dan natrium benzoat yaitu
283,0213 ± 37,6049 mg/kg. Kedua zat ini memenuhi persyaratan SNI 01-6684-2002 tentang minuman berenergi yaitu kafein maksimum 50 mg/sajian dan natrium benzoat maksimum 600 mg/kg.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Minuman Berenergi
Minuman energi
Minuman berenergi bertujuan memberi peningkatan energi melalui kombinasi zat stimulan seperti kafein, ginseng, vitamin B, asam amino dan gula. Asupan makanan antara lain berfungsi untuk menggantikan energi tubuh yang hilang akibat beraktivitas. Jika energi tersebut tidak segera diganti maka orang tersebut akan kekurangan energi sehingga tubuhnya akan menjadi lemas dan kurang bersemangat (Tautua, dkk., 2014).
adalah minuman yang mengandung satu atau lebih bahan yang mudah dan cepat diserapoleh tubuh untuk menghasilkan energi dengan atau tanpa bahan tambahanmakanan yang diizinkan (Badan Standarisasi Nasional, 2002).
Sebuah penelitian yang mengkaji manfaat minuman berenergi dalam memberi peningkatan energi pada tubuh yang diteliti oleh Smit (2004), hasil penelitian menunjukkan bahwa minuman energi dibandingkan dengan plasebo dapat memberikan efek peningkatan energi pada kelompok yang berumur 18 hingga 55 tahun.
Menurut Babu, dkk., (2008) kandungan minuman berenergi terdiri dari:
a. Kafein merupakan kunci utama minuman berenergi selain asam amino, vitamin B dan suplemen herbal yang memberikan efek terhadap tubuh yaitu dapat menstimulasi sistem saraf pusat sehingga memberi efek “alert” dan meningkatkan denyut jantung, tekanan darah serta menyebabkan dehidrasi tubuh. Konsentrasi kafein pada kopi 56 – 100 mg/100 ml, instan kopi dan the 20 – 73 mg/100 ml dan pada kola 9 – 19 mg/100 ml. Pada coklat 5 - 20 mg/100 g, untuk pengobatan seperti NoDoz dan Midol masing-masing antara 100 dan 200 mg kafein per tablet. Kafein atau 1,3,7-trimetilxantin cepat dan komplit terabsorbsi setelah pemberian oral, dengan kecepatan bioavaibilitas 100%.
b. Taurin terdapat dalam asam amino jaringan hewan diperoleh dari metabolisme metionin dan sistein. Taurin dapat meregulasi denyut jantung, kontraksi otot dan meningkatkan energi. Merupakan inhibitor neurotransmitter ringan.
c. Guarana didapat dari biji Paullinia cupana, tumbuhan di Amerika Selatan yang merupakan zat stimulan yang meningkatkan “alertness” dan meningkatkan energi, mempunyai efek yang sama dengan kafein. Guarana terdiri dari kafein 4-8%, teobromin, teofilin, dan tanin dengan konsentrasi tinggi.
2.2 Uraian Bahan
2.2.1 Kafein
Kafein merupakan derivat xantin, terdapat dalam kopi yang didapat dari biji Coffea arabica, dalam satu cangkir kopi rata-rata mengandung 1 – 2% kafein, kadar kafein dalam daun teh lebih kurang 2% dari daun Camelia sinensis, dan dari biji Theobroma cacao kadar kafein sekitar 0,7 - 2% (Gunawan dan Wilmana,2007).
[image:97.595.222.381.334.477.2]Meurut Ditjen POM (1995), kafein memiliki: Rumus struktur:
Gambar 1. Struktur Kafein
Rumus Molekul : C8H10N4O2
Nama Kimia : Coffein Berat Molekul : 194,19
Kandungan :Tidak kurang dari 98,5% dan tidak lebih dari 101,0%C8H10N4O2
Pemerian : Serbuk putih atau bentuk jarum mengkilat putih; , dihitung terhadap zat anhidrat.
Bentuk hidratnya mekar di udara.
Kelarutan : Agak sukar larut dalam air, dalam etanol, mudah larutdalam kloroform; sukar larut dalam eter.
Kafein memiliki efek stimulasi, inilah daya tarik minuman yang mengandung kafein. Selain merangsang SSP, kafein dapat menimbulkan diuresis, merangsang otot jantung dan merelaksasi otot polos terutama bronkus (Gunawan dan Wilmana,2007).
Kadar kafein yang lebih tinggi menyebabkan takikardia bahkan pada individu yang sensitif mungkin akan menyebabkan aritmia, misalnya kontraksi ventrikel pada bayi yang prematur, aritmia ini dapat dialami oleh orang yang minum kafein berlebihan (Gunawan dan Wilmana,2007).
Tidak dapat disangkal lagi bahwa popularitas minuman xantin ditentukan oleh daya stimulasinya, sedangkan daya stimulasi ini berbeda pada setiap individu. Pasien dengan tukak peptik yang aktif dan hipertensi sebaiknya tidak minum minuman yang mengandung kafein (Gunawan dan Wilmana,2007).
Penggunaan kafein sebagai zat penyegar yang bila digunakan terlampau banyak (lebih dari 20 cangkir sehari) dapat bekerja adiktif. Minum kopi lebih dari 4 - 5 cangkir sehari meningkatkan kadar homosistein dalam darah dan dapat menimbulkan resiko penyakit jantung namun bila dihentikan se