54 `Lampiran 2. Ethical Clearence
Lampiran 3. Bagan kerja penelitian
1. Pembuatan serbuk simplisia, karakterisasi simplisia dan skrining fitokimia
Dicuci dari pengotor sampai bersih
Ditiriskan lalu ditimbang berat basah
Disortasi kering
Ditimbang berat kering
Dihaluskan Daun Titanus
Simplisa
Serbuk Simplisia
Karakterisasi Simplisia Skrinning Fitokimia
- Penetapan kadar air
- Penetapan kadar sari larut air
- Penetapan kadar sari
larut etanol
- Penetapan kadar abu
total
- Penetapan kadar abu
tidak larut
- Pemeriksaan alkaloid
- Pemeriksaan glikosida
- Pemeriksaan glikosida
antrakuinon
- Pemeriksaan saponin
- Pemeriksaan flavonoid
56 Lampiran 3. (Lanjutan)
2. Pembuatan ekstrak etanol daun titanus (EEDT)
Dimasukkan dalam sebuah bejana
Ditambahkan sebanyak 75 bagian
etanol 96%
Ditutup
Dibiarkan selama 5 hari terlindung
dari cahaya sambil diaduk
Diperas
Dicuci ampas
dengan etanol
96%, disaring
hingga diperoleh
100 bagian
Dipindahkan kedalam bejana tertutup
Dibiarkan ditempat sejuk dan terlindung
cahaya selama 2 hari
Dienap tuangkan atau disaring
Dipekatkan dengan rotary evaporator pada
suhu tidak lebih dari 40o C
Ekstrak etanol kental Serbuk simplisia
daun titanus
Maserat Ampas
Maserat
Maserat
Lampiran 3. (Lanjutan)
3.Bagan kerja pengukuran kontraksi ileum marmut terisolasi
Didislokasi tulang belakang Marmut
Pengujian kontraksi
seri konsentrasi
Asetilkolin terhadap
otot polos ileum
Pengujian efek
relaksasi ekstrak
etanol daun Titanus
pada kontraksi otot
polos ileum melalui
induksi Asetilkolin
Pengujian efek
relaksasi Atropin
Sulfat pada kontraksi
otot polos ileum
melalui induksi
Asetilkolin Tahapan pengujian
Ekulibrasi selama 45 menit
58
Lampiran 4. Gambar sediaan daun Titanus (Leea aequata L.) di pasaran
Serbuk daun titanus
sediaan daun titanus
Lampiran 5. Gambar bagian makroskopik tumbuhan dari daun titanus (Leea aequata L.)
Tumbuhan titanus (Leea aequata L.)
60
Lampiran 6. Gambar simplisia dan serbuk simplisia daun titanus
Simplisia daun titanus
Lampiran 7. Gambar hasil pemeriksaan mikroskopik serbuk simplisia daun titanus(perbesaran 10x40)
Keterangan :
1. Rambut penutup
2. Rambut kelenjar
3. Kristal kalsium oxalat bentuk jarum
62
Lampiran 8. Data pengujian kontraksi seri konsentrasi asetilkolin terhadap otot polos ileum
Konsetrasi
Asetilkolin
(M)
% Kontraksi ileum *
Rerata SEM
1 2 3
1x10-8 1.1111 2.1052 1.1765 1.464267 0.32
3x10-8 8.8889 6.3158 11.7647 8.9898 1.57
1x10-7 16.6667 10.5262 21.1765 16.12313 3.09
3x10-7 22.2222 14.7368 28.2353 21.73143 3.90
1x10-6 28.8889 21.0526 38.8235 29.58833 5.14
3x10-6 43.3333 29.4737 51.7647 41.5239 6.50
1x10-5 66.6667 35.7895 61.1765 54.54423 9.51
3x10-5 82.2222 68.4211 74.1176 74.9203 4.00
1x10-4 82.2222 76.8421 76.4706 78.51163 1.86
3x10-4 94.4444 81.0526 81.1765 85.55783 4.44
1x10-3 93.3333 82.1053 81.1765 85.53837 3.91
3x10-3 100,0000 100,0000 100,000 100,0000 0
Keterangan :
* = %relaksasi dihitung dari titik kontraksi maksimal yang dicapai
oleh pemberian asetilkolin
Lampiran 8. (Lanjutan) 2. Hitungan EC80 asetilkolin
Log EC80 =
[
80 – Y1
Y2-Y1
x
�
x
2-x
1�
]+ x
1Keterangan:
X1 : Log. konsentrasi dengan respons tepat di bawah 80%
X2 : Log. konsentrasi dengan respons tepat di atas 80%
Y1 : %respons tepat di bawah 80%
Y2 : %respons tepat di atas 80%
a. Log EC80 =
[
80 – 66,6667
82,2222-66,6667 x�-5-(-4,5�
]
+(-4,5)Log EC80 = -4,9285 EC80 = 1,1789 x 10-5 M
b.Log EC80 =
[
80 – 76,8421
81,0526-76,8421 x�-4-(-3,5)�
]
+(-3,5)Log EC80 = -3,875 EC80 = 1,3335 x 10-5 M
c.Log EC80 =
[
80 – 76,4706
81,1765-76,4706 x�-3,5-(-3)�
]
+(-3)Log EC80 = -3,3749
EC80 = 4,2179 x 10-4 M
Rerata EC80 = 1,1789 x 10 -5
M+ 1,3335 x 10-5 M+ 4,2179 x 10-4 M 3
64
Lampiran 9. Data efek relaksasi ekstrak etanol daun titanus pada kontraksi ileum melalui induksi asetilkolin 1,889x10-4 M
Keterangan :
* = %relaksasi dihitung dari titik kontraksi maksimal yang dicapai oleh pemberian
asetilkolin 1,889x10-4 M Dosi s ekst rak (mg/ ml)
% Relaksasi Ileum *
Rera
ta
SEM
1 2 3 4 5 6
0,5
28.3018 23.9130 37.5000 26.4705 38.4615 20.0000 29.1
078 3.03
02
1
84.9056 65.2173 60.7142 35.2941 76.9230 34.2857 59.5
567 8.57
29
1,5
96.2264 78.2608 83.9285 85.2941 102.7581 85.7124 88.6
967 3.68
12
2
111.3207 86.9565 94.6428 105.8823 111.5384 95.7124 101.
0089 4.11
10
2,5
113.2075 104.3478 107.1428 111.7647 115.3846 107.1428 109.
8317 1.73
6862
3
115.0943 106.5217 110.7142 111.7647 119.2307 111.4285 112.
4590 1.75
73
3,5
115.0943 106.5217 117.8571 117.6470 119.2307 112.8571 114.
8680 1.91
00
4
115.0943 106.5217 117.8571 117.6470 119.2307 114.2857 115.
1061 1.87
44
Lampiran 10. Data efek relaksasi atropin sulfat pada kontraksi ileum melalui induksi asetilkolin 1,889x10-4 M.
Keterangan :
* = %relaksasi dihitung dari titik kontraksi maksimal yang dicapai
oleh pemberian asetilkolin 1,889x10-4 M Konsen
trasi Atropin
Sulfat (M)
% Relaksasi Ileum *
Rerata SEM
1 2 3 4 5 6
1x10-8 24.5238 17.6470 27.7777 18,0000 44.1176 35.8974 27.993 4.2484
3x10-8 41.5094 32.3529 44.4444 26,0000 50,0000 46.1538 40.076 3.7164
1x10-7 54.7169 47.0588 75,0000 38,0000 58.8235 53.8461 54.574 5.0564
3x10-7 62.2641 47.0588 83.3333 50,0000 61.7647 56.4102 60.138 5.2692
1x10-6 66.0377 102.9411 87.5000 52,0000 76.4705 76.9230 76.978 7.1383
3x10-6 84.9056 102.9411 113.8888 110,0000 88.2352 133.333 105.55 7.2894
1x10-5 116.981 107.3529 116.6666 116,0000 144.117 133.333 122.40 5.5402
66
Lampiran 11. Data AUC efek relaksasi ekstrak etanol daun Titanus
pada kontraksi ileum melalui induksi asetilkolin 1,889 x 10-4M
Marmut
AUC*
Total
1 2 3 4 5 6 7
1
56.6037 90.566 103.7736 112.2641 114.1509 115.0943 115.0943 707.5469
2
44.5652 71.7391 82.6087 95.6522 105.4348 106.5217 106.5217 613.0434
3
49.1071 72.3214 89.2857 100.8928 108.9285 114.2857 117.8571 652.6783
4
30.8823 60.2941 95.5882 108.8235 111.7647 114.7059 117.647 639.7057
5
57.6923 89.8406 107.1483 113.4615 117.3077 119.2307 119.2307 723.9118
6
27.1429 59.9991 90.7124 101.4276 109.2857 112.1428 113.5714 614.2819
Rerata
44.33225 74.12672 94.85282 105.4203 111.1454 113.6635 114.987 658.528
SEM
5.254547 5.528915 3.783095 2.91511 1.716339 1.711067 1.888552 19.22928
Keterangan :
* = %relaksasi dihitung dari titik kontraksi maksimal yang dicapai oleh pemberian
asetilkolin 1,889x10-4 M
Lampiran 12. Data AUC efek relaksasi atropin pada kontraksi ileum melalui induksi asetilkolin 1,889 x 10-4M
Marmut
AUC*
Total
1 2 3 4 5 6 7
1
33.0166 48.11315 58.4905 64.1509 75.47165 100.9434 116.9811 497.1673
2
24.99995 39.70585 47.0588 74.99995 102.9411 105.1470 109.5586 504.4113
3
36.11105 59.7222 79.16665 85.41665 100.6944 115.2777 116.6666 593.0553
4
22.0000 32.0000 44.0000 51.0000 81.0000 113.0000 116.0000 459.0000
5
47.0588 54.41175 60.2941 69.1176 82.35285 116.1764 147.0588 576.4703
6
41.0256 49.99995 55.12815 66.6666 105.1282 133.3333 133.3333 584.6151
Rerata
27.19773 38.99216 48.16834 57.44752 73.74333 91.75742 101.0442 438.3507
SEM
3.87431 4.101204 5.082658 4.680845 5.328101 4.582553 5.748007 22.8700
Keterangan :
* = %relaksasi dihitung dari titik kontraksi maksimal yang dicapai oleh pemberian
68
Lampiran 13.Hasil uji korelasi efek relaksasi ekstrak etanol daun Titanus pada kontraksi ileum melalui induksi asetilkolin 1,889 x 10-4 M
Correlations
Dosis Relaksasi
Dosis Pearson Correlation 1 .891**
Sig. (2-tailed) .003
N 8 8
Relaksasi Pearson Correlation .891** 1
Sig. (2-tailed) .003
N 8 8
**. Correlation is significant at the 0.01 level (2-tailed).
Lampiran 14. Hasil uji-t independen nilai %relaksasi ekstrak etanol daun Titanus 2,5 mg/ml dengan nilai %relaksasi atropin sulfat 1 x 10-5M
terhadap kontraksi otot polos ileum oleh asetilkolin 1,889 x 10-4 M
Descriptives
%relaksasi Statistic Std. Error
Sampel Ach+EEDT Mean 105.420283 2.9151098
95% Confidence Interval
for Mean
Lower Bound 97.926755
Upper Bound 112.913812
5% Trimmed Mean 105.516220
Median 105.125550
Variance 50.987
Std. Deviation 7.1405315
Minimum 95.6522
Maximum 113.4615
Range 17.8093
Interquartile Range 12.9808
Skewness -.172 .845
Kurtosis -1.864 1.741
Ach+Atropi
n
Mean 113.979633 4.5825526
95% Confidence Interval
for Mean
Lower Bound 102.199807
Upper Bound 125.759460
5% Trimmed Mean 113.628665
Median 114.138850
Variance 125.999
Std. Deviation 11.2249156
Minimum 100.9434
Maximum 133.3333
Range 32.3899
Interquartile Range 16.3695
Skewness .924 .845
70 Lampiran 14. (lanjutan)
Tests of Normality
%relaksasi
Kolmogorov-Smirnova Shapiro-Wilk
Statistic Df Sig. Statistic Df Sig.
Sampel Ach+EEDT .212 6 .200* .918 6 .489
Ach+Atropin .256 6 .200* .924 6 .532
a. Lilliefors Significance Correction
*. This is a lower bound of the true significance.
Group Statistics
%relaksasi N Mean Std. Deviation Std. Error Mean
Sampel Ach+EEDT 6 105.420283 7.1405315 2.9151098
Ach+Atropin 6 113.979633 11.2249156 4.5825526
Independent Samples Test
Levene's
Test for
Equality
of
Variance
s t-test for Equality of Means
F Sig. T df Sig. (2-tailed ) Mean Differenc e Std. Error Differenc e 95% Confidence
Interval of the
Difference
Lower Upper
Samp el Equal variance s assume d .22 1 .64 8 -1.57 6
10 .146
-8.559350 0 5.431174 2 -20.660760 3 3.542060 3 Equal variance s not assume d -1.57 6 8.47 7
.152
-8.559350 0 5.431174 2 -20.961988 3 3.843288 3
Lampiran 15. Gambar alat organ bath
A
72 Lampiran 15. Lanjutan
C
D
Keterangan:
A = empat set organ bath volume 50,0 ml C = transduser isometrik
B = termostat D = computer
Lampiran 16. Gambar pola kontraksi dan relaksasi ileum marmut terisolasi Gambar a. Pola kontraksi otot polos organ ileum terisolasi yang dikontraksi
dengan pemberian seri konsentrasi asetilkolin (10-8 – 3 x 10-3 M).
74 Lampiran 16. (Lanjutan)
Gambar c.Pola relaksasi setelah pemberian seri konsentrasi atropin sulfat pada otot polos ileum terisolasi yang dikontraksi dengan asetilkolin 1,889 x10-4 M.
Gambar d. Pola setelah pemberian Dimetil sulfoksida (DMSO) 0,2 % pada otot polos ileum terisolasi yang dikontraksi dengan asetilkolin 1,889 x 10-5M.
DAFTAR PUSTAKA
Abrams, P., Karl-erik, A., Jerry, J.B., Christoper, C., William, C.G., Alison, D.F., Gary, K., Alan, L., Neil, M.N., Pankaj, J.P dan Alan, J.P. (2006). Muscarinic receptor: their distribution and function in body systems, and the implications for treating overactive bladder: a review. British Journal of Pharmacology. 148: 565-578.
Anas, Y., Agung, E.N., Sugeng, R. (2014). Kajian Reversibilitas Marmin Terhadap Reseptor Histamin H1, Asetilkolin Muskarinik Ach M3 dan β2- Adrenergik. Thesis. Yogyakarta : Universitas Gadjah Mada. Halaman 7.
Bertoluzza, A., Bonora, S., Battaliga, M.A., dan Monti, P. (1979). Raman and Infrared Study on the Effects of Dimethylsulphoxide (DMSO) on water structure. J. Raman. Spectors. 8(5): 231-235.
Brown, V.K., Robinson, J., dan Stevenson, D.E. (1963). A Note on the Toxicity and Solvent Properties of Dimethylsulphoxide. J.Parm. Pharmacol. 15(1): 688-692.
Depkes RI. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 30.
Depkes RI. (1986). Sediaan Galenik. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 10,19,21.
Depkes RI. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 7.
Depkes RI. (1995). Materia Medika Indonesia. Jilid Keenam. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 297-326, 333-340.
Depkes RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Jakarta: Departemen kesehatan Republik Indonesia. Halaman 10-12, 14-17, 31-31.
Depkes RI. (2001). Inventaris Tanaman Obat Indonesia. Jilid Kedua. Jakarta: Departemen Kesehatan dan Kesejahteraan Sosial Republik Indonesia Badan Penelitian dan Pengembangan Kesehatan. Halaman 195.
Ditjen POM RI. (2012). Atropin Sulfat. Jakarta: Sentra Informasi Keracunan Nasional (Sikernas).
50
Goodman dan Gilman. (2008). Manual of Pharmacology and Therapeutics. United States of America: McGraw-Hill Companies, inc. Halaman 97.
Handa, S.S., Khanuja, S.P.S., Longo, G., dan Rakesh, D.D. (2008). Extractions Tecnologies for Medicinal and Aromatic Plants. Trieste: ICS-UNIDO. Halaman 22.
Harahap, U., Marianne., Yuliasmi, S., Husori, D.I., dan Ernawaty. (2015). Sistem Saraf Perifer dan Kontribusi Bahan Alam Untuk Memahami Fungsi dan Mekanismenya. Medan: USU Press. Halaman 102.
Harborne, J.B. (1984). Phytochemical Methods. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. (1987). Metode Fitokimia. Bandung: Penerbit ITB. Halaman 147.
Herman, R.B. (2004). Fisiologi Pencernaan. Padang. Andalas University Press.
Husori, D.I. (2011). Peranan Epitelial Terhadap Efek Relaksasi Senyawa Marmin dari Aegle marmelos Correa pada Otot Polos Trakea Marmut Terisolasi. Tesis. Yogyakarta: Fakultas Farmasi Universitas Gadjah Mada.
Irianto, K. (2004). Struktur dan Fungsi Tubuh Manusia untuk paramedis. Bandung: Yrama Widya. Halaman 66-67, 187.
Khan, A.U., dan Gilani, A.H. (2008). Pharmacodynamic Evaluation of Terminalia bellerica for Its Antihypertensive Effect. Journal of Food and Drug Analysis. 16(3): 6-14.
Khare, C.P. (2007). Indian Medicinal Plants. New Delhi: Springer Science + Business Media, LCC. Halaman 366.
Kitchen, I. (1984). Textbook of in vitro Practical Pharmacology.London: Blackwell Scientific Publications. Halaman 4.
LIPI. (2015). Hasil Identifikasi/ Derterminasi Tumbuhan. Cibinong: Lembaga Ilmu Pengetahuan Indonesia.
Li, M., Johnson, C.P., Adams, M.B dan Sarna, S.K. (2002). Cholinergic and nitrergic regulation of in vivo giant migrating contractions in rat colon. Am. J. Physiol. Gastrointest. Liver. Physiol. 283: G544-G552.
Lulmann. (2000). Colos Atlas of Pharmacology. Second Edition. Germany: Thieme. Halaman 97.
Malinda, I. (2015). Skrining Fitokimia dan Uji Aktivitas Antibakteri Ekstrak Etanol Daun Titanus (Leea aequata L.) Pengobatan Tradisional Karo. skripsi. Medan: Universitas sumatera utara. Halaman 38, 39, 40.
Matsui, M., Motomura, D., Fujikawa, T., Jiang, J., Takahashi, S., Manabe, T., dan Taketo, M.M. (2002). Mice lacking M2 anf M3 muscarinic acetylcholine reseptors are devoid of cholinergic smooth muscle contrations but still viable. J. Neurosci. 22: 10627-10632.
Nugroho, A.E. (2012). Farmakologi Obat-Obat Penting dalam Pembelajaran Ilmu Farmasi dan Dunia Kesehatan. Yogyakarta: Pustaka Pelajar. Halaman 16, 22-23, 26-35,183.
Perry, W.L.M. (1970). Pharmacological Experiments on Isolated Preparations. Edisi II. Edinburgh: Churcill Livingstone. Halaman 25.
Rahardjo, R. (2009). Kumpulan Kuliah Farmakologi. Edisi Kedua. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 52-53.
Rahman, M.A., Imran T. B., dan Islam, S. (2012). Antioxidative, Antimicrobial and Cytotoxic Effects Of The Phenolics Of Leea indica Leaf Extract. Saudi Journal of Biological Sciences. 20(2): 222.
Raihan, M.O., Md. R.H., Afrina, B., Md, M.R., Md, M.S., Mashudul, M, (2011). Sedatif and anxiolytic effect on the methanolic extract of Leea indica (Burm. F.) Merr. Leaf. In: Drug Discoveries & Therapeutics. Bangladesh: ddtjournal. 5(4): 185-189.
Robinson, T. (1991).The Organic Constituents of High Plant.6th edition. Penerjemah: Kosasih Padmawinata. (1995). Kandungan Organik Tumbuhan Tinggi. Edisi keenam. Bandung: Penerbit ITB. Halaman 19, 154, 157.
Setiawati, A dan Gan, S. (2007). Obat Otonom. Dalam: Gunawan, S.G. (Ed). Farmakologi dan terapi. Edisi Kelima. Jakarta: FKUI. Halaman 33.
Sherwood, L. (2001). Fisiologi Manusia dari Sel ke Sistem. Editor: Beatricia I. Santoso. Edisi Kedua. Jakarta: ECG. Halaman 544, 570.
Sundari, D., Nugroho, Y,A., dan Nuratmi, B. (2005). Uji Khasiat Antidiare Ekstrak Daun Sendok (Plantago Major Linn.) Pada tikus Putih. Jakarta : Media Litbang Kesehatan. 15(3): 19-23.
Syamsudin dan Darmono. (2011). Buku Ajar Farmakologi Eksperimental. Jakarta: UI-Press. Halaman 76.
52
Tjay, T.H dan Kirana, R. (2007). Obat-obat Penting. Edisi keenam. Jakarta: PT Elex Media Komputindo. Halaman 512.
Torres-Piedra, M., Figueroa, M., Hernandez-Abreu, O., Ibarra-Barajas, M., Navarrete-Varquez, G. and Estrada-Soto, S. 2011. Vasorelaxant effect of flavonoids through calmodulin inhibitor: ex vivo, in vitro, and in silico approaches. Bioorganic and Medicinal Chemistry. 19: 542-546.
Virtual Medical Centre. (2006). Gastrointestinal system. Tanggal akses 17 Juli 2016. http://www.myvmc.com/anatomy/gastrointestinal-system.
Velasco, R., Trujillo, X., Vasquez, C., Huerta, M., dan Trujillo-Hernandez, B. (2003). Effect of Dimethyl Sulfoxide on Excitation-Contraction Coupling in Chicken Slow Skeletal Muscle. J. Pharmacol. Sci. 93: 149-154.
Tiwari, T.S. (2011). VPD Surveillance Manual : Tetanus. Edisi kelima. 16: 1.
Tyrode, M.V. (1910). The Mode of Action of Some Purgative Salts. Arch. Intern. Pharmacodyn. 17, 205-209.
Vogel, H.G., Bernward, A.S., Jurgen, S., Gunter, M., dan Wolfgang, F.V. (2002). Drug Discovery and Evaluation: Pharmacological Assays. Germany: Spinger-Verlag, Berlin Heidelberg.
WHO. (1998). Quality Control Methods for Medicinal Plant Materials. England: World Health Organization. Halaman 31-33, 228.
Zunilda. (2007). Agonis dan Antagonis Muskarinik. Dalam: Gunawan, S.G. (Ed). Farmakologi dann terapi. Edisi Kelima. Jakarta: FKUI. Halaman 48-48,57.
BAB III
METODE PENELITIAN
3.1 Lokasi Penelitian
Penelitian dilakukan di Laboratorium Farmakologi dan Farmakognosi
Fakultas Farmasi Universitas Sumatera Utara.
3.2 Jenis Penelitian
Metode yang digunakan pada penelitian ini adalah metode
eksperimental. Tujuan metode eksperimental untuk mengetahui pengaruh variabel
bebas terhadap variabel terikat. Prosedur yang dilakukan meliputi tahapan
persiapan bahan pengujian dan tahapan pengujian efek ekstrak etanol daun titanus
pada kontraksi ileum menggunakan alat organ bath.
3.3 Alat dan Bahan Penelitian 3.3.1 Alat Penelitian
Alat-alat yang digunakan pada penelitian ini meliputi alat-alat gelas
laboratorium, neraca analitik (Boeco Germany), timbangan hewan (Presica
Geniweigher), satu set alat preparasi organ (Germany), vortex (Boeco Germany),
pengaduk (Dell), empat set organ bath volume 50,0 ml (ML0146/50, Panlab
magnet (Bel-Art Products), transduser isometrik (MLT0201, Panlab,
ADInstruments, Spain), komputer, ADInstruments, Spain), pipet volume mikro
(Socorex, Switzerland), heating and magnetic stirrer (Velp Scientifica, Europe),
22
T15-0676, ADInstruments, Australia), Quad Bridge Amplifier (serial 224-0448,
ADInstruments, Australia).
3.3.2 Bahan Penelitian
Sampel yang digunakan dalam penelitian ini adalah daun titanus (Leea
aequata L.), bahan kimia yang digunakan adalah larutan tirode ( terdiri dari NaCl,
KCl, MgCl2, NaH2PO4, CaCl2, NaHCO3, dan D-Glukosa) (Merck), gas karbogen mengandung 95% oksigen dan 5% karbondioksida (Tri Gases, Medan, Indonesia),
asetilkolin klorida (Sigma, Switzerland), atropin sulfat (Sigma , USA), dimetil
sulfoksida (DMSO) (Merck) dan akuades.
3.4 Hewan Percobaan
Hewan percobaan yang digunakan adalah marmut jantan (Cavia cobaya),
berat badan antara 300-450 gram, usia 3-4 bulan dengan kondisi sehat (Vogel, et
al., 2002). Hewan ini diaklimatisasi selama seminggu dengan tujuan untuk
menyeragamkan makanan dan hidupnya dengan kondisi yang serba sama
sehingga dianggap memenuhi syarat untuk penelitian.
3.5 Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengumpulan bahan tumbuhan,
identifikasi tumbuhan, dan pembuatan simplisia daun titanus.
3.5.1 Pengumpulan Bahan
Sampel yang digunakan adalah daun titanus yang masih segar berwarna
hijau (tidak terlalu tua dan tidak terlalu muda) yang diambil dari Desa Suka Nalu,
Kecamatan Barus Jahe, Kabupaten Karo, Provinsi Sumatera Utara. Pengumpulan
sampel dilakukan secara purposif tanpa membandingkan dengan tumbuhan yang
sama dari daerah lain
3.5.2 Identifikasi Sampel
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani
Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.5.3 Pengolahan Sampel
Sebanyak 4 kg daun titanus dibersihkan dari pengotor dengan cara
mencuci dibawah air mengalir hingga bersih, ditiriskan, ditimbang berat basah,
dikeringkan dalam rak pengering selama 5 hari, disortasi kering, ditimbang berat
kering. Sampel dianggap kering apabila sudah rapuh, kemudian
sampel diserbukan dan disimpan dalam wadah plastik.
3.6 Pembuatan Ekstrak Daun Titanus Secara Maserasi 3.6.1 Pembuatan Ekstrak Etanol Daun Titanus
Sebanyak 500 g simplisia dimasukkan kedalam wadah gelas berwarna
gelap, dituangi 75 bagian cairan penyari (etanol 96%), ditutup, dibiarkan selama 5
hari dan terlindung dari cahaya sambil sering diaduk, diperas, dan dicuci ampas
dengan cairan penyari secukupnya hingga diperoleh 100 bagian. Pindahkan
kedalam bejana tertutup, biarkan ditempat sejuk dan terlindung dari cahaya
selama 2 hari, enap tuangkan atau saring (Depkes, RI., 1979). Filtrat diuapkan
24 3.7. Tahapan Persiapan Percobaan 3.7.1 Pembuatan Larutan Tirode
Larutan buffer fisiologis yang digunakan adalah larutan Tirode. Untuk
membuat 1 liter larutan Tirode ditimbang:
CaCl2 : 0,20 gram MgCl2 : 0,10 gram KCl : 0,20 gram
NaCl : 8,00 gram
NaH2PO4 : 0,05 gram
NaHCO3 : 1,00 gram D-Glukosa : 1,00 gram
Bahan (NaCl, KCl, MgCl2, NaH2PO4, CaCl2) dilarutkan terpisah dengan
akuades sampai larut. NaHCO3 dan D-Glukosa ditambahkan terakhir setelah semua bahan tercampur agar tidak terjadi pengendapan garam kalsium yang
ditandai dengan kekeruhan. Setelah semua bahan tercampur, larutan diaerasi
dengan karbogen (O2 95%, CO2 5%). Selanjutnya larutan diatur pada pH 7,4.
Larutan tirode dapat bertahan selama 24 jam (Kitchen, 1984).
3.7.2 Pembuatan Larutan Asetilkolin Klorida
Dalam penelitian ini, agonis kolinergik yaitu asetilkolin klorida digunakan
sebagai penginduksi. Senyawa ini dapat menyebabkan kontraksi otot polos pada
ileum. Dibuat larutan induk dengan cara melarutkan asetilkolin klorida ke dalam
akuades sehingga didapat konsentrasi 2 x 10-1 M. Kemudian dibuat larutan yang lebih encer sampai kadar 2 x 10-6 M dengan faktor pengenceran 5 kali.
i. Pembuatan larutan baku asetilkolin klorida
Timbang seksama asetilkolin klorida (BM 181,60 g/mol) seberat 181,60 mg
kemudian dilarutkan dalam 5,0 ml akuades. Diperoleh larutan asetilkolin
klorida 2 x 10-1 M.
ii. Pembuatan seri konsentrasi asetilkolin klorida
- Asetilkolin klorida 2 x 10-2M
Dipipet 500 μl larutan baku asetilkolin 2 x 10-1 M. Masukkan ke dalam tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
- Asetilkolin klorida 2 x 10-3 M
Dipipet 500 μl larutan baku asetilkolin 2 x 10-2 M. Masukkan ke dalam tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
- Asetilkolin klorida 2 x 10-4M
Dipipet 500 μl larutan baku asetilkolin 2 x 10-3 M. Masukkan ke dalam tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
- Asetilkolin klorida 2 x 10-5 M
Dipipet 500 μl larutan baku asetilkolin 2 x 10-4 M. Masukkan ke dalam tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
- Asetilkolin klorida 2 x 10-6 M
Dipipet 500 μl larutan baku asetilkolin 2 x 10-5 M. Masukkan ke dalam
tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
3.7.3 Pembuatan Larutan Ekstrak Etanol Daun Titanus
Sejumlah 800 mg ekstrak etanol daun Titanus (EEDT) dilarutkan dengan 1
ml DMSO (Dimethil sulfoxida), kemudian dicukupkan dengan larutan tirode
hingga 5 ml. Diperoleh konsentrasi ekstrak 160 mg/ml (larutan stock). DMSO
26
senyawa dan merupakan pelarut yang semipolar, namun masih dapat bercampur
dengan media tirode (Velasco, et al., 2003; Bertoluzza, et al., 1979; Brown, et al.,
1963). Batas penggunaan jumlah pelarut DMSO yang ditambahkan ke dalam
organ bath (40ml) adalah sebesar 400 μl atau 1% v/v (Husori, 2011).
3.7.4 Pembuatan Larutan Atropin Sulfat
Dalam penelitian ini atropin sulfat digunakan sebagai antagonis
kolinergik. Senyawa ini dapat menghambat kontraksi otot polos pada ileum.
Dibuat larutan induk dengan cara melarutkan atropin sulfat ke dalam akuades
sehingga didapat konsentrasi 138,968 mg/ml. Kemudian dibuat larutan yang lebih
encer sampai kadar 0,00139 mg/ml dengan faktor pengenceran 5 kali.
i. Pembuatan larutan baku atropin sulfat
Timbang seksama atropin sulfat (BM 694,84 g/mol) seberat 694,84 mg
kemudian dilarutkan dalam 5,0 ml akuades. Diperoleh larutan atropin sulfat
138,968 mg/ml .
ii. Pembuatan seri konsentrasi atropin sulfat
- Atropin sulfat 13,8968 mg/ml
Dipipet 500 μl larutan baku atropin sulfat 138,968 mg/ml. Masukkan ke dalam
tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
- Atropin sulfat 1,3897 mg/ml
Dipipet 500 μl larutan baku atropin sulfat 13,8968 mg/ml. Masukkan ke dalam
tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
- Atropin sulfat 0,1389 mg/ml
Dipipet 500 μl larutan baku atropin sulfat 1,3897 mg/ml. Masukkan ke dalam
tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
- Atropin sulfat 0,0139 mg/ml
Dipipet 500 μl larutan baku atropin sulfat 0,1389 mg/ml. Masukkan ke dalam
tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
- Atropin sulfat 0,00139 mg/ml
Dipipet 500 μl larutan baku atropin sulfat 0,0139 mg/ml. Masukkan ke dalam
tabung reaksi, tambahkan 4500 μl akuades. Vortex selama 3 menit.
3.8 Tahapan Pengujian 3.8.1 Preparasi Organ
Marmut ditimbang dan kemudian marmut dikorbankan dengan cara
dislokasi tulang belakang kepala (cervix). Dilakukan pembedahan pada bagian
abdomen, kulit bagian abdomen dipotong dengan menggunakan gunting. Usus
dibersihkan dari lapisan mesenteric yang melindunginya. Saat jaringan sudah
rileks, dipotong segmen usus bagian bawah yang mendekati caecum sepanjang
2-3 cm. Dengan menggunakan jarum kedua ujung potongan usus diikat dengan
benang pada arah yang berlawanan. Benang bagian bawah usus diikatkan pada
batang penahan jaringan dan benang bagian atas usus dihubungkan ke transduser
daya. Jaringan usus halus dimasukkan kedalam organ bath yang berisi larutan
tirode, dengan suhu larutan dipertahankan 37 ºC sambil diaerasi dengan karbogen
secara terus menerus. Jaringan yang telah terisolasi diinkubasi selama 30 menit
dengan pergantian larutan tirode setiap 15 menit. Dibiarkan beberapa saat sampai
28
3.8.2 Pengujian Kontraksi Seri Konsentrasi Asetilkolin Terhadap Otot Polos Ileum
Pengujian terhadap agonis muskarinik dilakukan untuk mengukur batas
maksimum yang dapat ditunjukkan terhadap kontraksi ileum marmut, guna untuk
mendapatkan konsentrasi submaksimum atau Effective Concentration (EC80)
asetilkolin klorida. Pengukuran dilakukan secara bertingkat dengan pemberian
kumulatif asetilkolin sehingga diperoleh konsentrasi di dalam organ bath 10-8
sampai 3 x 10-3 M (Tabel 3.1). Ileum marmut yang telah diekuilibrasi selama 45 menit (dengan pergantian larutan tirode tiap 15 menit) diberikan larutan
asetilkolin dengan konsentrasi didalam organ bath 10-8 sampai 3 x 10-3 M (otot
polos ileum marmut menunjukkan respons kontraksi maksimum).
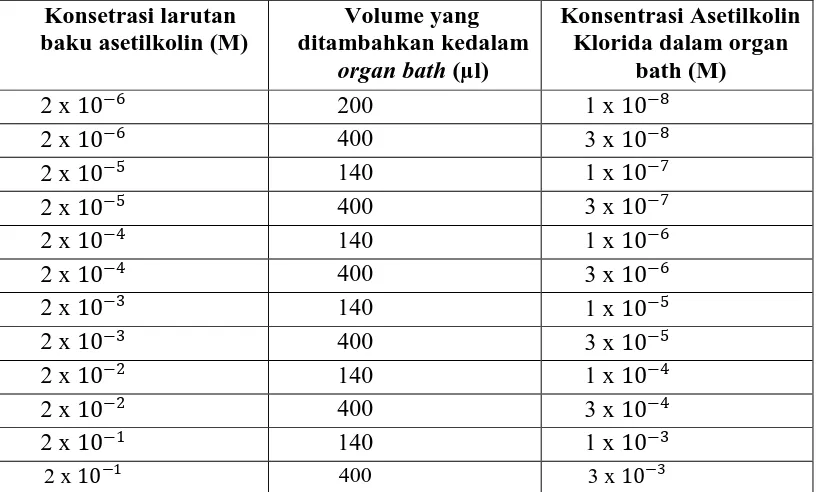
Tabel 3.1 Pemberian asetilkolin secara kumulatif pada organ bath 40 ml
Konsetrasi larutan baku asetilkolin (M)
Volume yang ditambahkan kedalam
organ bath (µl)
Konsentrasi Asetilkolin Klorida dalam organ
bath (M)
2 x 10−6 200 1 x 10−8
2 x 10−6 400 3 x 10−8
2 x 10−5 140 1 x 10−7
2 x 10−5 400 3 x 10−7
2 x 10−4 140 1 x 10−6
2 x 10−4 400 3 x 10−6
2 x 10−3 140 1 x 10−5
2 x 10−3 400 3 x 10−5
2 x 10−2 140 1 x 10−4
2 x 10−2 400 3 x 10−4
2 x 10−1 140 1 x 10−3
2 x 10−1 400 3 x 10−3
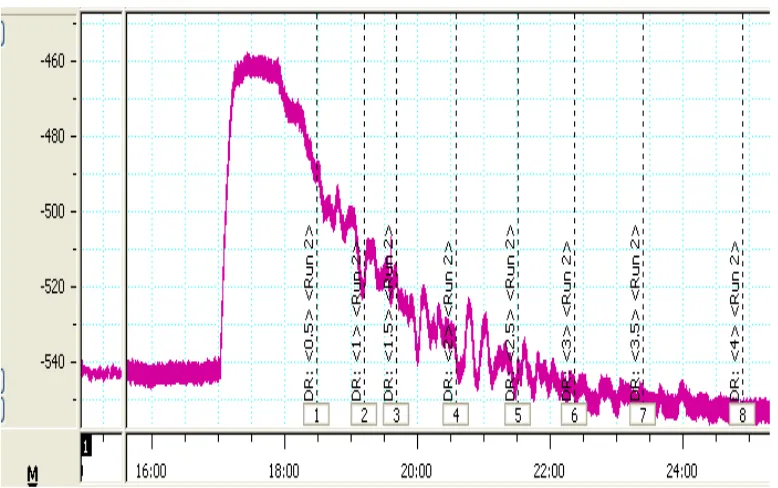
[image:34.595.109.517.430.676.2]Dari larutan baku dipipet berturut-turut asetilkolin klorida kedalam satu chamber
pada organ bath volume 40 ml sehingga diperoleh konsentrasi yang kumulatif :
i.Dipipet 200 µl asetilkolin klorida 2 x 10−6 M kedalam organ bath volume 40 ml sehingga konsentrasi yang diperoleh adalah 1 x 10−8 M, kemudian
ii.Dipipet 400 µl asetilkolin klorida 2 x 10−6 M kedalam organ bath volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 3 x 10−8 M, kemudian
iii.Dipipet 140 µl asetilkolin klorida 2 x 10−5 M kedalam organ bath volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 1 x 10−7 M, kemudian
iv.Dipipet 400 µl asetilkolin klorida 2 x 10−5 M kedalam organ bath volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 3 x 10−7 M, kemudian
v.Dipipet 140 µl asetilkolin klorida 2 x 10−4 M kedalam organ bath volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 1 x 10−6 M, kemudian
vi.Dipipet 400 µl asetilkolin klorida 2 x 10−4 M kedalam organ bath volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 3 x 10−6 M, kemudian
vii.Dipipet 140 µl asetilkolin klorida 2 x 10−3 M kedalam organ bath volume 40
30
viii.Dipipet 400 µl asetilkolin klorida 2 x 10−3 M kedalam organ bath volume 40
ml yang sama sehingga konsentrasi yang diperoleh adalah 3 x 10−5 M,
kemudian
ix.Dipipet 140 µl asetilkolin klorida 2 x 10−2 M kedalam organ bath volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 1 x 10−4 M, kemudian
x.Dipipet 400 µl asetilkolin klorida 2 x 10−2 M kedalam organ bath volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 3 x 10−4 M, kemudian
xi.Dipipet 140 µl asetilkolin klorida 2 x 10−1 M kedalam organ bath volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 1 x 10−3 M, kemudian
xii.Dipipet 400 µl asetilkolin klorida 2 x 10−1 M kedalam organ bath volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 1 x 10−3 M.
Setelah diperoleh hasil kemudian dihitung %kontraksi ileum yang
diinduksi dengan asetilkolin klorida. Tujuan perhitungannya adalah untuk
memperoleh effective concentration 80% dari asetilkolin yang mampu membuat
ileum berkontraksi. Sehingga dari hasil perhitungan diperoleh banyaknya
asetilkolin klorida yang dibutuhkan untuk membuat ileum marmut terisolasi akan
peningkatan kontraksi.
3.8.3 Pengujian Efek Relaksasi Ekstrak Etanol Daun Titanus (EEDT) pada Otot Polos Ileum melalui Induksi Asetilkolin
Pengujian aktivitas ekstrak etanol daun titanus terhadap peningkatan
kontraksi ileum marmut yang diinduksi asetilkolin klorida dilakukan dengan
penambahan ekstrak etanol daun titanus kedalam organ bath. Pemberian ekstrak
etanol daun titanus diberikan secara kumulatif sehingga diperoleh konsentrasi
bertingkat yaitu 0,5 – 4 mg/ml ekstrak etanol daun titanus.
Ileum marmut harus diekulibrasi selama 45 menit (dengan pergantian
larutan tirode tiap 15 menit) dengan tujuan agar kontraksi dan relaksasi pada
ileum stabil. Setelah ileum marmut mencapai kondisi yang stabil, kemudian ileum
diinduksi dengan asetilkolin klorida. Setelah dilakukan perhitungan effective
concentration 80% maka diperoleh bahwa dengan pemberian 38 μl larutan
asetilkolin klorida 2x10-1 M akan diperoleh konsentrasi sub maksimum asetilkolin klorida 1,889x10-4 M dalam organ bath. Sehingga dengan pemberian
[image:37.595.107.516.473.693.2]asetilkolin klorida 1,889x10-4 M maka sudah membuat ileum marmut terisolasi mengalami peningkatan kontraksi .
Tabel 3.2 Pemberian konsentrasi ekstrak etanol daun Titanus (EEDT) secara kumulatif pada organ bath volume 40 ml
Konsentrasi larutan baku EEDT(mg/ml)
Volume yang ditambahkan kedala
m organ bath (µl)
Konsentrasi EEDT dalam organ bath
(mg/ml)
160 125 0,5
160 125 1
160 125 1,5
160 125 2
160 125 2,5
160 125 3
160 125 3,5
32
Dari larutan baku dipipet berturut-turut EEDT kedalam satu chamber pada organ
bath volume 40 ml sehingga diperoleh konsentrasi yang kumulatif :
i. Dipipet 125 µl ekstrak etanol daun titanus 160 mg/ml kedalam organ bath
volume 40 ml sehingga konsentrasi yang diperoleh adalah 0,5 mg/ml,
kemudian
ii. Dipipet 125 µl ekstrak etanol daun titanus 160 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 1
mg/ml, kemudian
iii. Dipipet 125 µl ekstrak etanol daun titanus 160 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 1,5
mg/ml, kemudian
iv. Dipipet 125 µl ekstrak etanol daun titanus 160 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 2
mg/ml, kemudian
v. Dipipet 125 µl ekstrak etanol daun titanus 160 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 2,5
mg/ml, kemudian
vi. Dipipet 125 µl ekstrak etanol daun titanus 160 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 3
mg/ml, kemudian
vii. Dipipet 125 µl ekstrak etanol daun titanus 160 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 3,5
mg/ml, kemudian
viii. Dipipet 125 µl ekstrak etanol daun titanus 160 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi yang diperoleh adalah 4
mg/ml.
Setelah diperoleh hasil kemudian dilakukan perhitungan %relakasasi dari
ekstrak etanol daun titanus terhadap kontraksi ileum dan perhitungan %korelasi
antara kumlatif ekstrak dengan %relaksasi yang diberikan. Pengulangan
percobaan yang dilakukan enam kali.
3.8.4 Pengujian Efek Relaksasi Atropin Sulfat Pada Kontraksi Otot Polos Ileum Melalui Induksi Asetilkolin
Ileum marmut dikondisikan dengan larutan tirode dalam organ bath yang
terhubung pada tranduser isometrik. Ileum dikontraksi dengan pemberian 38 μl
larutan asetilkolin klorida 2x10-1 M sehingga akan diperoleh konsentrasi sub
maksimum asetilkolin klorida 1,889x10-4 M dalam organ bath. Setelah diperoleh kondisi kontraksi maksimum yang stabil kemudian dilakukan pemberian
[image:39.595.114.514.524.744.2]konsentrasi bertingkat atropin sulfat. Lihat Tabel 3.3.
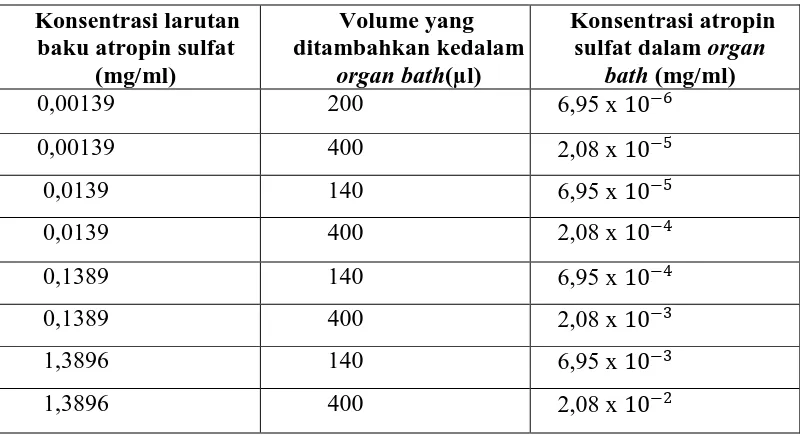
Tabel 3.3 Pemberian konsentrasi atropin sulfat secara kumulatif pada organ bath 40 ml
Konsentrasi larutan baku atropin sulfat
(mg/ml)
Volume yang ditambahkan kedalam
organ bath(µl)
Konsentrasi atropin sulfat dalam organ
bath (mg/ml)
0,00139 200 6,95 x 10−6
0,00139 400 2,08 x 10−5
0,0139 140 6,95 x 10−5
0,0139 400 2,08 x 10−4
0,1389 140 6,95 x 10−4
0,1389 400 2,08 x 10−3
1,3896 140 6,95 x 10−3
34
Dari larutan baku dipipet berturut-turut atropin sulfat kedalam satu chamber pada
organ bath volume 40 ml sehingga diperoleh konsentrasi yang kumulatif :
i. Dipipet 200 µl larutan baku atropin sulfat 0,00139 mg/ml kedalam organ bath
volume 40 ml sehingga konsentrasi atropin sulfat yang diperoleh adalah 6,95
x 10−6 mg/ml, kemudian
ii. Dipipet 400 µl larutan baku atropin sulfat 0,00139 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi atropin sulfat yang diperoleh
adalah 2,08 x 10−5 mg/ml, kemudian
iii. Dipipet 140 µl larutan baku atropin sulfat 0,0139 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi atropin sulfat yang diperoleh
adalah 6,95 x 10−5 mg/ml, kemudian
iv. Dipipet 400 µl larutan baku atropin sulfat 0,0139 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi atropin sulfat yang diperoleh
adalah 2,08 x 10−4mg/ml, kemudian
v. Dipipet 140 µl larutan baku atropin sulfat 0,1389 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi atropin sulfat yang diperoleh
adalah 6,95 x 10−4 mg/ml, kemudian
vi. Dipipet 400 µl larutan baku atropin sulfat 0,1389 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi atropin sulfat yang diperoleh
adalah 2,08 x 10−3mg/ml, kemudian
vii. Dipipet 140 µl larutan baku atropin sulfat 1,3896 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi atropin sulfat yang diperoleh
adalah 6,95 x 10−3 mg/ml, kemudian
viii. Dipipet 400 µl larutan baku atropin sulfat 1,3896 mg/ml kedalam organ bath
volume 40 ml yang sama sehingga konsentrasi atropin sulfat yang diperoleh
adalah 2,08 x 10−2mg/ml.
Setelah diperoleh hasil kemudian dilakukan perhitungan %relakasasi dari
atropine sulfat terhadap kontraksi ileum. Pengulangan percobaan yang dilakukan
enam kali.
3.9 Data dan Analisis Data 3.9.1 Data
Data yang diperoleh dalam penelitian ini adalah data kontraksi otot polos
ileum pada komputer (program komputer : LabChart® 7.02). Data yang diperoleh
dalam persentase (%) respons terhadap respons maksimum yang dicapai.
Selanjutnya, dibuat grafik hubungan antara konsentrasi terhadap % respon.
3.9.2 Analisis data
Nilai EC80 (konsentrasi agonis yang dapat menghasilkan respon sebesar
80% dari respons maksimum) agonis reseptor, dihitung berdasarkan grafik
hubungan konsentrasi terhadap %respon. EC80 dihitung berdasarkan persamaan
dibawah ini:
Log EC80 =
[
80 – �1�2−�1
x(
�
2
− �
1)
]
+
�
1
Keterangan:
36
X2 : Log. konsentrasi dengan respons tepat di atas 80%
Y1 : %respons tepat di bawah 80%
Y2 : %respons tepat di atas 80%
Selanjutnya, data disajikan dalam bentuk tabel dan nilai rata-rata ± SEM
(Standar Error Mean) (Husori, 2011). Data %kontraksi dianalisis secara statistik
dengan menggunakan uji Independent-Samples T Test. Sebelum pengujian
tersebut terlebih dahulu dilakukan uji normalitas Kolmogrov-Smirnov.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Pusat Penelitian dan
Pengembangan LIPI Bogor, menunjukkan bahwa tumbuhan yang diteliti adalah
Leea aequata L., suku Leeaceae. Hasil Identifikasi dapat dilihat pada Lampiran 1
halaman 52.
4.2 Hasil Karakteristik Simplisia 4.2.1 Hasil Pemeriksaan Makroskopik
Hasil pemeriksaan makroskopik simplisia daun titanus yaitu berwarna
hijau tua pada bagian belakang dan hijau kekuning kuningan pada bagian depan,
berbentuk lonjong, tepi daun bergerigi, ujung daun meruncing, berasa pahit, bau
khas. Hasil pemeriksaan dapat dilihat pada Lampiran 6 halaman 59.
4.2.2 Hasil Pemeriksaan Mikroskopik
Hasil pemeriksaan mikroskopik serbuk daun titanus memperlihatkan
adanya stomata tipe parasitik, kristal kalsium oxalat bentuk jarum, rambut
kelenjar dan rambut penutup (Malinda, 2015). Hasil yang diperoleh dapat dilihat
pada Lampiran 7 halaman 80.
4.2.3 Hasil Pemeriksaan Karakterisasi Serbuk Simplisia
Hasil pemeriksaan karakterisasi serbuk simplisia daun titanus dapat dilihat
38
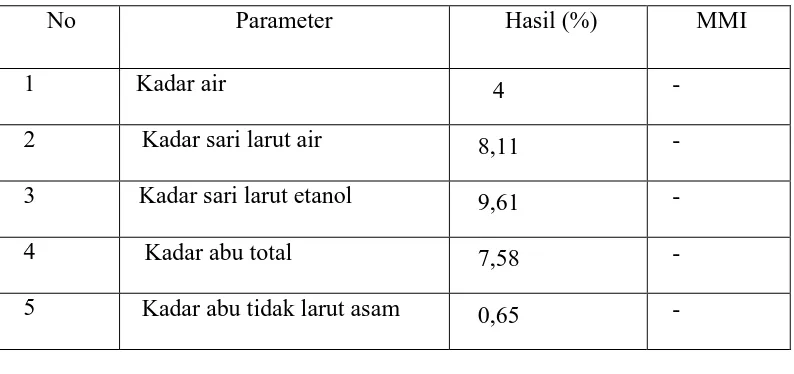
Tabel 4.1 Hasil karakterisasi serbuk simplisia daun titanus
No Parameter Hasil (%) MMI
1 Kadar air 4 -
2 Kadar sari larut air 8,11 -
3 Kadar sari larut etanol 9,61 -
4 Kadar abu total 7,58 -
5 Kadar abu tidak larut asam 0,65 -
Keterangan : (-) : tidak ada (Malinda, 2015).
Syarat kadar sari larut dalam air, kadar sari larut dalam etanol, kadar abu
total dan kadar abu tidak larut dalam asam pada umumnya untuk masing-masing
simplisia tidak sama. Pada pemeriksaan ini, karakterisasi simplisia belum tertera
didalam Materia Medika Indonesia (MMI). Hasil penetapan kadar air dari
simplisia daun titanus yaitu 4% yang menunjukkan bahwa kadar air simplisia
memenuhi persyaratan yaitu tidak melebihi dari 10% (Depkes RI, 1995).
Kadar sari larut air simplisia daun titanus 8,11% dan kadar sari larut etanol
simplisia daun titanus 9,61%. Penetapan kadar abu pada simplisia daun titanus
menunjukkan kadar abu total sebesar 7,58% dan kadar abu tidak larut dalam asam
sebesar 0,65%.
4.3 Hasil Ekstraksi
Hasil ekstraksi 500 g serbuk simplisia dengan cara maserasi menggunakan
pelarut etanol 96%, bertujuan untuk mengekstraksi senyawa yang terdapat pada
simplisia daun titanus, baik bersifat polar maupun non polar, diperoleh ekstrak
etanol daun titanus sebanyak 67 g.
4.4 Hasil Skrining Fitokimia
Penentuan golongan senyawa kimia simplisia dan ekstrak etanol daun
titanus untuk mendapatkan informasi golongan senyawa metabolit sekunder yang
ada didalamnya. Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol
dapat dilihat pada Tabel 4.2.
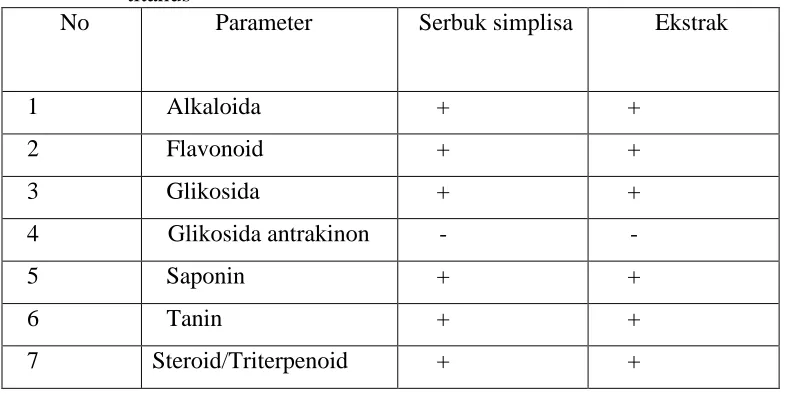
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol daun titanus
No Parameter Serbuk simplisa Ekstrak
1 Alkaloida + +
2 Flavonoid + +
3 Glikosida + +
4 Glikosida antrakinon - -
5 Saponin + +
6 Tanin + +
7 Steroid/Triterpenoid + +
Keterangan:
(+): mengandung golongan senyawa;
(-) : tidak mengandung golongan senyawa (Malinda, 2015).
Hasil skrining serbuk simplisia dan ekstrak etanol memberikan hasil yang
positif terhadap senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan
[image:45.595.107.500.330.527.2]40
4.5 Hasil Pengujian Kontraksi Seri Konsentrasi Asetilkolin Klorida Terhadap Otot Polos Ileum
Kontraksi yang dipicu oleh asetilkolin klorida dapat diamati melalui
pengamatan terhadap perubahan %respon kontraksi otot polos ileum terisolasi
terhadap penambahan seri konsentrasi asetilkolin klorida (10-8 – 3x10-3 M) pada
organ ileum. Persentase kontraksi maksimal otot polos ileum diperoleh pada
konsentrasi asetilkolin klorida adalah 3 x 10-3 M dan konsentrasi submaksimal
pada konsentrasi asetilkolin 1,889 x 10-4 M bertingkat dengan asetilkolin dilakukan untuk mendapatkan konsentrasi submaksimal atau Effective
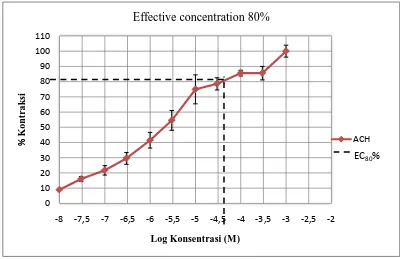
[image:46.595.112.512.359.618.2]Concentration (EC80) asetilkolin klorida.
Gambar 4.3 Grafik %konsentrasi otot polos organ ileum terisolasi yang dikontraksi dengan pemberian seri konsentrasi asetilkolin (-8,0=10-8; -7,5=3x10-8; -7,0=10-7; -6,5=3x10-7; -6,0=10-6; -5,5=3x10-6; -5,0=10-5; -4,5=3x10-5; -4,0=10-4; -3,5=3x10-4; -3,0=10-3; -2,5=3x10-3 M). Data yang disajikan adalah nilai rata-rata ± SEM, n=3.
0 10 20 30 40 50 60 70 80 90 100 110
-8 -7,5 -7 -6,5 -6 -5,5 -5 -4,5 -4 -3,5 -3 -2,5 -2
% K on tr ak si
Log Konsentrasi (M) Effective concentration 80%
ACH
EC80%
Asetilkolin merupakan agonis kolinergik yang berarti obat yang memacu
atau meningkatkan aktivitas syaraf kolinergik. Asetilkolin akan berinteraksi
dengan reseptor asetilkolin muskarinik pada sel organ efektor syaraf kolinergik
misalnya sel perietal lambung, otot jantung, dan otot polos saluran pencernaan.
Pada ileum, asetilkolin akan berinteraksi dengan reseptor muskarinik yang akan
menimbulkan peningkatan motilitas otot polos (Nugroho, 2012). Hasil yang
diperoleh sesuai dengan teori yang diperoleh (Gambar 4.3), dengan adanya
peningkatan konsentrasi asetilkolin, maka motilitas usus akan meningkat
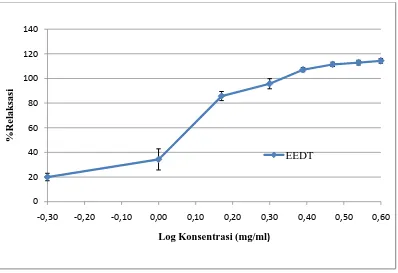
4.6 Hasil Pengujian Efek Relaksasi Ekstrak Etanol Daun Titanus (EEDT) Pada Kontraksi Otot Polos Ileum Melalui Induksi Asetilkolin Klorida
Pengujian efek relaksasi ekstrak etanol daun titanus (EEDT) terhadap otot
polos ileum terisolasi dilakukan dengan cara mengkontraksi otot polos ileum
dengan asetilkolin 1,889 x10-4 M, dilanjutkan dengan pemberian seri konsentrasi ekstrak 0,5 – 4 mg/ml. Efek relaksasi ekstrak diamati melalui pengamatan
terhadap perubahan %efek relaksasi ekstrak pada organ ileum. Pemberian seri
konsentrasi ekstrak etanol daun titanus (EEDT) menghasilkan efek relaksasi
terhadap kontraksi yang diinduksi oleh asetilkolin klorida 1,889 x10-4 M (Gambar
4.4).
Korelasi yang terjadi pada persentase efek relaksasi dengan konsentrasi
ekstrak etanol daun titanus (EEDT) merupakan korelasi positif dengan nilai
korelasi 0,891 (korelasinya mendekati 1) dan nilai R Square (R2) 0,794. Ini dapat dinyatakan bahwa sebanyak 79,4% peningkatan persentase efek relaksasi
42
persentase efek relaksasi ekstrak pada otot polos ileum meningkat sejalan dengan
[image:48.595.116.514.138.411.2]peningkatan konsentrasi.
Gambar 4.4 Grafik %relaksasi setelah pemberian seri konsentrasi ekstrak etanol
daun titanus (-3=0.5; 0=1; 0.17=1.5; 0.3=2;
0.39=2.5; 0.47=3; 0.54=3.5; 0.6=4 mg/ml) pada otot polos ileum terisolasi yang dikontraksi dengan asetilkolin 1,889x10-4 M. Data yang disajikan adalah nilai rata-rata ± SEM, n=6.
4.7 Hasil Pengujian Efek Relaksasi Atropin Sulfat pada Kontraksi Otot Polos Ileum Melalui Induksi Asetilkolin Klorida
Pengujian efek relaksasi atropin sulfat terhadap otot polos ileum terisolasi
dilakukan dengan cara mengkontraksi otot polos ileum dengan asetilkolin
1,889x10-4 M, dilanjutkan dengan pemberian seri konsentrasi atropin sulfat 6,95x10-6 – 2,08x10-2 mg/ml. Pemberian seri konsentrasi atropine sulfat
menghasilkan efek relaksasi terhadap kontraksi yang diinduksi
oleh asetilkolin 1,889 x10-4 M (Gambar 4.5). 0
20 40 60 80 100 120 140
-0,30 -0,20 -0,10 0,00 0,10 0,20 0,30 0,40 0,50 0,60
%R
el
ak
sas
i
Log Konsentrasi (mg/ml)
EEDT
Gambar 4.5 Grafik %relaksasi setelah pemberian seri konsentrasi atropin sulfat (-5.2=6.95x10-6; -4.7=2.08x10-5; -4.2=6.95x10-5; -3.7=2.08x10-4; -3.2=6.95x10-4; -2.7=2.08x10-3; -2.2=6.95x10-3; -1.7 = 2.08 x 10- 2 mg/ml) pada otot polos ileum terisolasi yang dikontraksi dengan asetilkolin 1,889x10-4 M. Data yang disajikan adalah nilai rata-rata ± SEM, n=6.
Efek relaksasi atropin sulfat diamati melalui pengamatan terhadap
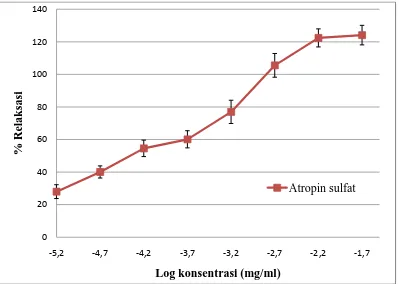
perubahan %relaksasi pada pemberian seri konsentrasi atropin sulfat 6,95x10-6 – 2,08x10-2 mg/ml pada organ ileum. Pada Gambar 4.5 pemberian seri konsentrasi atropin sulfat menghasilkan efek relaksasi terhadap kontraksi yang di induksi oleh
asetilkolin 1,889x10-5 M. Persentase efek relaksasi atropin sulfat pada otot polos ileum meningkat sejalan dengan peningkatan konsentrasi.
Atropin berkhasiat sebagai antikolinergis kuat dan merupakan antagonis
khusus dari efek muskarin asetilkolin. Juga digunakan sebagai spasmolitikum
pada kejang-kejang disaluran lambung-usus dan urogenital, sebagai zat penawar 0
20 40 60 80 100 120 140
-5,2 -4,7 -4,2 -3,7 -3,2 -2,7 -2,2 -1,7
%
R
el
ak
sas
i
Log konsentrasi (mg/ml)
44
(antidotum) keracunan asetilkolin dan kolinergika lain (Tjay dan Kirana, 2007).
Kerja muskarinik asetilkolin dan semua obat golongan ini diblok secara selektif
oleh atropine, terutama melalui pendudukan tempat reseptor muskarinik secara
kompetitif (Goodman dan Gilman, 2002).
4.8 Perbandingan %Relaksasi Atropin Sulfat dan EEDT pada Kontraksi Otot Polos Ileum Melalui Induksi Asetilkolin Klorida
Pengujian efek relaksasi atropin sulfat dan EEDT terhadap otot polos
ileum terisolasi dilakukan dengan cara mengkontraksi otot polos ileum dengan
asetilkolin klorida 1,889 x 10-4 M, dilanjutkan dengan pemberian seri konsentrasi masing masing atropin sulfat dan EEDT. Persentase efek relaksasi atropin sulfat
dan EEDT kemudian dibandingkan kemampuannya dalam merelaksasikan otot
polos ileum terisolasi. Perbandingan ini kemudian dilakukan uji statistik bertujuan
untuk melihat apakah ada perbedaan kemampuan atropin sulfat dan EEDT dalam
merelaksasikan otot polos ileum terisolasi.
Dari grafik perbandingan %relaksasi atropin dan EEDT dapat dilihat
bahwa korelasi antara peningkatan dosis dan %relaksasi yang dihasilkan sama saa
korelasi positif. Artinya peningkatan %relaksasi berbanding lurus dengan
peningkatan dosis yang diberikan, ini dapat dilihat dari grafik perbandingan
%relaksasi dari EEDT dan atropin sulfat dapat dilihat di Gambar 4.6.
Gambar 4.6 Grafik %relaksasi setelah pemberian seri konsentrasi (A) atropin sulfat ( 1=6.95x10-6; 2=2.08x10-5; 3=6.95x10-5; 4=2.08
x10-4; 5=6.95x10-4; 6=2.08x10-3; 7=6.95x10-3; 8=2.08x102 mg/ml) dan (B) ekstrak etanol daun Titanus (EEDT) (1=0,5; 2=1; 3=1,5; 4=2; 5=2,5; 6=3; 7=3,5; 8=4 mg/ml) pada otot polos ileum terisolasi yang dikontraksi dengan asetilkolin 1,889 x 10-4 M. Data yang disajikan adalah nilai rata-rata ± SEM, n = 6.
Salah satu tujuan penelitian ini adalah membandingkan konsentrasi
tertentu atropin dan EEDT dalam merelaksasikan otot polos ileum marmut
terisolasi. Pada Gambar 4.7 dapat dilihat perbandingan efek relaksasi antara
atropin sulfat pada konsentrasi 6.95x10-3 mg/ml(113,9796±4,5825) dengan EEDT pada pemberian ekstrak 2,5 mg/ml (105,4203±2,9151) terhadap kontraksi ileum
yang diinduksi dengan asetilkolin klorida. Hasil uji statistik menunjukkan bahwa
perbedaan persentase relaksasi antara atropin sulfat pada konsentrasi 6.95x10-3
mg/ml (113,9796±4,5825) dengan EEDT pada pemberian ekstrak 2,5 mg/ml 0 10 20 30 40 50 60 70 80 90 100 110 120 130
0 1 2 3 4 5 6 7 8
46
[image:52.595.114.514.110.396.2](105,4203±2,9151) keduanya tidak berbeda signifikan (p > 0,05)
Gambar 4.7 Nilai %relaksasi pemberian ekstrak etanol daun titanus konsentrasi 2,5 mg/ml dan atropin sulfat 6,95 x 10-3 mg/ml setelah dikontraksi dengan asetilkolin 1,889 x 10-4 M. Data yang disajikan adalah nilai rata-rata ± SEM, n = 6.
Mekanisme kerja atropin sulfat dalam merelaksasikan otot polos ileum
terisolasi adalah secara selektif menghambat reseptor muskarinik pada otot polos.
Hambatan yang dihasilkan oleh atropin bersifat reversible. Atropin memblok
asetilkolin endogen maupun eksogen, tetapi hambatannya jauh lebih kuat terhadap
asetilkolin eksogen (Zunilda, 2007).
Mekanisme kerja EEDT dalam merelaksasikan otot polos ileum terisolasi
belum dapat diketahui secara pasti. Adanya kemampuan efek relaksasi dari EEDT
ini mungkin karena adanya metabolit sekunder yang berperan. Malinda (2015)
melaporkan bahwa metabolit sekunder dari Leea aequata L. yaitu alkaloid, 10 30 50 70 90 110 130
EEDT 2,5 mg/ml Atropin Sulfat 6,95x10-3 mg/ml % r el ak as as i Konsentrasi
EEDT 2,5 mg/ml
Atropin Sulfat 6,95x10-3 mg/ml
glikosida, steroid/terpenoid, flavonoid dan tannin. Raihan, dkk., (2011)
melaporkan bahwa Leea indica yang memiliki family yang sama dengan Leea
aequata L. yaitu Leaecea memiliki efek sedative yang kuat pada tikus dan
menurut Rahman, dkk., (2012) Leea indica memiliki metabolit sekunder yang
sama dengan Leea aequata L.
Tarannita (2013) menduga bahwa alkaloid dapat merelaksasikan usus
halus melalui antagonis reseptor M3. Reseptor M3 merupakan reseptor yang sebarannya paling banyak dalam otot polos usus halus. Torres-Piedra, et all.,
(2011) melaporkan bahwa tumbuhan tradisional yang kaya flavonoid dan gugus
fenol dapat digunakan sebagai vasorelaksasi. Selain alkaloid dan flavonoid, Khan
dan gilani (2008) mengemukakan bahwa tannin dan sterol berperan dalam
menurunkan tekanan darah dan relaksasi pada otot jantung yang terisolasi.
Belum diketahui secara pasti bagaimana ekstrak etanol daun titanus ini.
Ada banyak jalur untuk dapat merelaksikan otot polos ileum. Penelitian ini hanya
bertujuan untuk melihat apakah ektrak etanol daun titanus dapat merelaksasikan
48 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian efek relaksasi ekstrak etanol daun titanus (Leea
aequata L.) terhadap kontraksi otot polos ileum marmut (Cavia cobaya) terisolasi
secara in vitro, maka dapat disimpulkan :
a. Ekstrak etanol daun titanus (Leea aequata L.) memiliki efek relaksasi
terhadap kontraksi otot polos ileum marmut terisolasi yang diinduksi
oleh asetilkolin klorida.
b. Ekstrak etanol daun titanus (Leea aequata L.) konsentrasi 2,5mg/ml
kemampuan yang tidak jauh berbeda dengan atropin sulfat 6,95x10 -3
mg/ml dalam menurunkan kontraksi otot polos ileum marmut terisolasi
yang diinduksi oleh asetilkolin klorida 1,889x10-4 M (p > 0,05).
5.2 Saran
Dari penelitian yang telah dilakukan maka disarankan untuk melakukan :
a. Pengujian efek relaksasi ekstrak etanol daun titanus terhadap organ
terisolasi lain seperti trakea, jantung dan otot rangka serta pengujian secara
in vivo.
b. Pengujian lebih lanjut tentang mekanisme efek ekstrak dalam
merelaksasikan otot polos ileum marmut terisolasi.
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi morfologi tumbuhan, nama asing, sistematika,
manfaat dan kandungan kimia.
2.1.1 Morfologi Tumbuhan
Tumbuhan Leea aequata L. merupakan tumbuhan perdu, tahunan,
tingginya 1,5–3 m. Batang tumbuhan ini berkayu, bercabang, bentuk bulat , masih
muda berambut dan hijau. Daun tumbuhan majemuk, anak daun lanset, bertangkai
pendek, tepi daun bergerigi, ujung daun runcing, pangkal membulat, panjangnya
6-25 cm, lebarnya 3-8 cm, berambut dan berwarna hijau. Bunga tumbuhan
majemuk, bentuk malai, kelopak bulat telur, panjang 2-5 cm, kuning keputih-
putihan. Buahnya berbentuk bulat, diameter ± 12 mm, masih muda hijau dan
setelah tua ungu kehitaman dengan biji kecil, bentuk segitiga, dan berwarna putih
kekuningan. Tumbuhan ini termasuk tumbuhan berakar tunggal dengan warna
coklat muda (Depkes RI, 2001).
2.1.2 Nama Asing
Leea aequata L. memiliki nama lain seperti : ginggiyang (Sunda), girang
(Jawa Tengah), jirang (Madura), kayu ajer perempuan (Melayu), mali-mali
9 2.1.3 Sistematika Tumbuhan
Klasifikasi tumbuhan titanus adalah sebagai berikut (Depkes RI, 2001: LIPI,
2015) :
Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Dicotyledonae
Bangsa : Rhamnales
Suku : Leeaceae
Marga : Leea
Jenis : Leea aequata L.
2.1.4 Manfaat Tumbuhan
Daun Leea aequata L. berkhasiat sebagai obat luka baru dan pegal linu.
Untuk obat luka baru dipakai ±30 gram daun segar Leea aequata L., dicuci,
ditumbuk sampai lumat, ditempelkan pada luka dan dibalut dengan kain bersih
(Depkes RI, 2001).
2.1.5 Kandungan Kimia
Biji Leea aequata L. mengandung saponin, flavonoid dan polifenol
(Depkes RI, 2001). Malinda (2015) melporkan bahwa daun Leea aequata L.
mengandung alkaloid, flavonoid, glikosida, saponin, tanin dan
steroid/triterpenoid.
2.2 Simplisia
Simplisia adalah bahan alam yang digunakan sebagai obat yang belum
mengalami pengolahan apapun juga, kecuali dinyatakan lain, berupa bahan yang
telah dikeringkan. Simplisia terbagi atas simplisia nabati, simplisia hewani dan
simplisia mineral. Simplisia nabati adalah simplisia yang berupa tanaman utuh,
bagian tanaman dan eksudat tanaman (Depkes RI, 1979).
2.3 Ekstraksi
Ekstraksi merupakan istilah umum yang digunakan dalam bidang farmasi,
yang berkaitan dengan pemisahan bahan aktif yang berkhasiat pada tumbuhan
atau jaringan hewan dari komponen yang tidak aktif dengan menggunakan pelarut
selektif menggunakan prosedur standard ekstraksi (Handa, dkk., 2008).
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang
sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah
ditetapkan (Depkes RI, 1995).
Ekstraksi dengan menggunakan pelarut dapat dilakukan dengan berbagai
cara, yaitu :
a) Cara dingin
1. Maserasi
Maserasi adalah cara penarikan simplisia dengan merendam
simplisia tersebut dalam cairan penyari dengan beberapa kali
pengocokkan atau pengadukkan pada temperatur kamar sedangkan
remaserasi merupakan pengulangan penambahan pelarut setelah
dilakukan penyaringan maserat pertama dan seterusnya (Depkes RI,
11 2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
terjadi penyarian sempurna yang umumnya dilakukan pada temperatur
kamar (Depkes RI, 2000).
b) Cara panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif
konstan dengan adanya pendingin balik (Depkes RI, 2000).
2. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet,
dimana pelarut akan terdestilasi dari labu menuju pendingin, kemudian
jatuh membasahi dan merendam sampel dalam tabung soklet, kemudian
setelah pelarut mencapai tinggi tertentu maka akan turun ke labu destilasi
seterkah melewati pipa sifon, demikian berulang-ulang (Depkes RI,
2000).
3. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada
temperatur yang lebih tinggi dari temperatur ruangan yaitu secara umum
secara umum dilakukan pada temperature 40-50o C (Depkes RI, 2000). 4. Infudasi
Infus adalah sediaan cair yang dibuat dengan menyari simplisia
nabati dengan air pada suhu 90o C selama 15 menit (Depkes RI, 2000).
5. Dekoktasi
Dekok adalah sediaan cair yang dibuat dengan menyari simplisia
nabati dengan air pada waktu yang lebih lama ±30 menit dengan
temperature sampai titik didih air (Depkes RI, 2000).
2.4 Metode Organ Terisolasi
Organ terisolasi adalah suatu metode percobaan in vitro.Pada prinsipnya
adalah menggunakan organ yang terendam dalam larutan fisiologis yang sesuai,
temperatur diatur atau dikondisikan pada kondisi yang sama dari mana organ
tersebut berasal serta pengaturan aliran oksigen. Percobaan organ terisolasi ini
menggunakan alat organ bath (Perry, 1970).
Metode organ terisolasi merupakan metode klasik dalam percobaan
farmakologi yang dapat digunakan untuk menganalisa hubungan dosis-respon
suatu senyawa obat. Hasil penelitian Anas, dkk., (2010) mengatakan bahwa
dengan metode ini, konsentrasi agonis dan antogonis reseptor pada tingkat
jaringan dapat diketahui secara pasti. Metode ini mempunyai kemampuan dengan
intensitas maksimum. Hal ini tidak sepenuhnya dapat dilakukan ketika
menggunakan organisme utuh (pengujian secara in vivo). Selain itu, metode ini
juga dapat mengukur konsentrasi agonis terkecil yang dapat menginduksi respon
biologis.
Syamsudin dan Darmono (2011) melaporkan bahwa untuk mendapatkan
hasil percobaan yang akurat, maka diperlukan persiapan yang baik dan seluruh
percobaan harus betul-betul terkontrol. Hewan percobaan yang digunakan
13
yang diambil segera dimasukkan kedalam cairan fisiologis dan dikontrol
oksigenasinya dan dihubungkan ke tranducer dan diteruskan kealat pencatat
misalnya, kymograph atau maclab komputer.
Organ yang umum digunakan dengan metode organ terisolasi
mengunakan alat organ bath adalah uterus, usus halus, otot skeletal, vas deferens,
jantung dan lambung (Kitchen, 1984).
2.5 Otot Polos
Otot polos terdiri dari sel-sel otot polos. Sel otot ini bentuknya seperti
gelendong, dibagian tengah terbesar dan kedua ujungnya meruncing. Otot polos
memiliki serat yang arahnya searah dengan panjang sel disebut myofibril. Serat
myofibril terdiri dari miofilamen dan masing-masing miofilamen terdiri dari
protein otot yaitu aktin dan myosin. Otot polos merupakan otot tak sadar, karena
bekerja diluar kesadaran kita dan dipengaruhi oleh susunan saraf otonom (Irianto,
2004).
Otot polos bergerak secara lambat dan teratur dan tidak cepat lelah.
Walapun kita tidur, otot polos mampu bekerja. Otot polos terdapat pada dinding
alat-alat dalam tubuh, misalnya pada dinding usus, dinding pembuluh darah,
pembuluh limfe, dinding saluran cerna, trakea dan cabang tenggorokan, pada iris
dan muskularis sirliaris mata, otot polos dalam kulit, saluran kelamin dan saluran
ekskresi (Irianto, 2004).
2.6 Persyarafan Sistem Percernaan
Ada dua sistem pencernaan yang memegang peranan penting dalam
fungsi saluran pencernaan, yaitu sistem intrinsik yang terdiri atas sistem syaraf
enterik dan sistem syaraf ekstrinsik yang terdiri atas sistem syaraf otonom
parasimpatis dan simpatis.
2.6.1 Sistem Syaraf Intrinsik – Sistem Syaraf Enterik
Sistem syaraf ini terbentang didalam dinding saluran pencernaan mulai
dari esophagus sampai ke anus. Sistem syaraf enterik terbagi atas dua pleksus,
yaitu :
a) Pleksus mientrikus (pleksus Auerbach)
Pleksus ini terbentang diantara lapisan otot longitudinal dari lapisan otot
sirkuler. Fungsinya mengontrol fungsi motorik saluran pencernaan.
b) Pleksus submukosa atau pleksus Meissner
Pleksus ini terbentang didalam lapisan submukosa. Fungsinya terutama
untuk mengontrol kecepatan sekresi saluran pencernaan. Disamping itu,
pleksus submukosa sangat berperan dalam mengendalikan aktivitas otot
polos submukosa yang bila berkontraksi akan menimbulkan lipatan-lipatan
pada mukosa saluran pencernaan serta meningkatkan absorbsi dan aliran
darah disekitarnya (Herman, 2004).
2.6.2 Sistem Syaraf Ekstrinsik – Sistem Syaraf Otonom Sistem syaraf ekstrinsik terbagi menjadi dua, yaitu :
a) Sistem syaraf parasimpatis
Neuron pascaganglion (postganglion neuron) sistem parasimpatis terletak
15
pleksus submukosa. Ujung serat syaraf parasimpatis menyekresikan
asetilkolin sebagai neurotransmitternya. Stimulasi parasimpatis pada
umumnya menyebabkan peningkatan aktivitas sistem syaraf enterik yang
selanjutnya meningkatkan aktivitas saluran pencernaan.
b) Sistem syaraf simpatis
Ujung serat syaraf simpatis menyekresikan neurotransmitter norepinefrin.
Sistem syaraf ini merangsang sistem pencernaan melalui dua cara, yaitu:
1. Secara langsung pada otot polos saluran pencernaan
2. Secara tidak langsung, yaitu melalui neuron sistem syaraf enterik.
2.7 Usus Halus
Usus halus adalah tempat berlangsungnya sebagian besar pencernaan dan
penyerapan. Usus ini berada dalam keadaan bergelung didalam rongga abdomen
dan terentang dari lambung sampai usus besar. Usus halus dibagi menjadi tiga
segmen, yaitu duodenum, jejunum dan ileum (Sherwood, 2001).
2.7.1 Histologi Usus Halus
Herman (2004) membagi lapisan dinding usus halus menjadi empat
lapisan (Gambar 2.1), yaitu :
a) Lapisan serosa
Lapisan serosa adalah lapisan terluar dari dinding saluran pencernaan.
Lapisan ini berupa suatu membran yang terdiri atas jaringan penyambung
dan sel-sel epitel. Pada lapisan ini terdapat pembuluh darah dan syaraf
yang berukuran lebih besar yang berjalan diantara jaringan penyambung
dan jaringan lemak (adipose tissue) yang terdapat didaerah ini. Lapisan
serosa yang terletak dibawah diafragma (sekat rongga badan) ikut
membentuk dan merupakan bagian dari peritoneum secara keseluruhan
dan disebut peritoneum viseral.
b) Lapisan muskularis
Lapisan muskularis di dinding saluran pencernaan selain dari telah yang
disebutkan diatas adalah berupa otot polos yang terdiri atas dua lapis.
Lapisan sebelah dalam adalah lapisan sirkuler yang bila berkontraksi
menyebabkan pengecilan diameter lumen saluran pencern