LAPORAN PRAKTIKUM BIOKIMIA
UJI KANDUNGAN KARBOHIDRAT, LIPID DAN PROTEIN
Oleh : Syafiq Ubaidillah NIM. 161820401001
PROGRAM MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
Ciri organisme hidup adalah bagaimana mengorganisasi molekul penting untuk saling berinteraksi dan melakukan proses reaksi biokimia, yang pada intinya adalah berupa reaksi metabolisme pembentuk senyawa (anabolisme) dan penguraian (katabolisme) (Campbell et al., 2012). Bahan dasar metabolisme tersebut biasanya diperoleh dari lingkungannya dalam bentuk nutrien yang selanjutnya akan diubah menjadi ribuan jenis bahan kimia yang berbeda, masing-masing dengan peranan biologis khusus.Molekul penting yang menyusun makhluk hidup terdiri dari karbohidrat, protein, lipid dan asam nukleat. Kandungan yang berperan dalam proses metabolisme sel meliputi karbohidrat, protein dan lipid, sedangkan asam nukleat berperan dalam pengendalian sifat.
Karbohidrat merupakan senyawa aldehid atau keton beserta turunannya yang megikat banyak gugus hidroksil atau dengan kata lain karbohidrat adalah senyawa polihidroksil dari aldehid atau keton. Rumus empiris dari karbohidrat dapat ditulis sebagai CH2O. Penyusun utama karbohidrat adalah C, H, dan O, dengan perbandingan jumlah atom H dan O adalah 2 : 1 seperti dalam air. Bentuk molekul karbohidrat yang paling sederhana terdiri dari satu molekul gula sederhana (Campbell et al., 2012). Banyak karbohidrat yang merupakan polimer yang tersusun dari molekul gula yang terangkai menjadi rantai yang panjang serta bercabang-cabang. Karbohidrat merupakan bahan makanan penting dan sumber tenaga yang terdapat dalam tumbuhan dan hewan. Selain sumber energi, karbohidrat juga berfungsi untuk menjaga keseimbangan asam basa di dalam tubuh, berperan penting dalam proses metabolisme dan pembentuk struktur sel.
Protein adalah molekul makro yang mempunyai berat molekul antara lima ribu hingga beberapa juta. Protein terdiri atas rantai-rantai panjang asam amino yang terikat satu sama lain dalam ikatan peptida. Protein merupakan zat makanan penting untuk pertumbuhan dan perkembangan. Semua enzim, berbagai hormon, pengangkut zat-zat gizi dan darah, matriks intraseluler dan sebagainya adalah protein. Di samping itu asam amino yang membentuk protein bertindak sebagai prekursor sebagian besar koenzim, hormon, asam nukleat, dan molekul-molekul yang esensial untuk kehidupan. Protein mempunyai fungsi khas yang tidak dapat digantikan oleh zat gizi lain yaitu membangun serta memelihara sel-sel jaringan tubuh (Fery dan Trimarsanto, 2010.
Lipid (Yunani, lipos = lemak) adalah sekelompok besar senyawa alam yang tak larut dalam air, tetapi larut dalam pelarut organik non polar seperti n-heksan, kloroform, dan dietil eter. Sifat inilah yang membedakan lipid dari karbohidrat, protein, asam nukleat, dan kebanyakan molekul hayati lainnya yang memegang peranan penting dalam struktur dan fungsi sel. Senyawa yang termasuk kelompok lipid adalah trigliserida, lilin, fosfolipid, glikolipid, steroid, terpen, prostaglandin, dan lain-lain(Campbell et al., 2012).
Molekul seperti karbohidrat, protein dan lipid memiliki fungsi yang krusial dalam metabolisme yang tidak dapat digantikan. Keberadaan molekul tersebut diperlukan tubuh sebagai sumber nutrien yang akan dimanfaatkan dalam reaksi metabolisme. Nutrisi yang mengandung molekul seperti karbohidrat, protein dan lipid dapat ditemukan baik hewan maupun tumbuhan. salah satu tumbuhan yang memiliki ketiga komponen tersebut adalah golongan dari biji-bijian seperti kedelai dan jagung. Kadar atau tingkat kandungan molekul karbohidrat, protein dan lipid dalam kedelai dan jagung penting dilakukan analisis untuk membandingkan antara kedua jenis biji-bijian tersebut sebagai bahan pertimbangan dalam menentukan nutrisi yang sesuai. Oleh karena itu, dalam praktikum kali ini dilakukan uji kandungan molekul karbohidrat, lipid dan protein yang terkandung di dalam kedelai maupun jagung. Uji kandungan karbohidrat dapat dilakukan melalui berbagai cara. Uji kandungan glukosa dapat dilakukan dengan menggunakan metode Dinitrosalicylic acid colorimetri (DNS), uji kandungan sukrosa dengan menggunakan metode resorchinol, sedangkan uji kandungan pati atau starch dilakukan dengan menggunakan metode iodine colour. Uji lipid merupakan uji secara kualitatif dengan menggunakan kertas buram untuk mengetahui persentase lipid pada bahan. Dan uji kandungan protein pada bahan dilakukan dengan menggunakan reagent bradford.
1.2 Rumusan Masalah
Berdasarkan latar belakang, dapat diambil rumusan masalah sebagai berikut: 1. Bagaimanacara pengujian kandungan glukosa menggunakan metode uji DNS kolorimetri dan perbandingan hasil kandungan glukosa antara
2. Bagaimana cara pengujian kandungan sukrosa menggunakan resorchinol dan perbandingan hasil kandungan sukrosa antara sampel jagung dan kedelai?
3. Bagaimana cara pengujian kandungan pati atau starch menggunakan resorchinol dan perbandingan hasil kandungan pati atau starch antara sampel jagung dan kedelai?
4. Bagaimana cara pengujian kandungan lipid menggunakan metode Bligh-Dyer dan perbandingan hasil kandungan lipid antara sampel jagung dan kedelai?
5. Bagaimana cara pengujian kandungan protein menggunakan pengujian Bradford dan perbandingan hasil kandungan protein antara sampel jagung dan kedelai?
6. Bagaimana pola protein yang terbentuk hasil isolasi dari sampel jagung dan kedelai menggunakan elektroforesis SDS-PAGE?
7. Bagaimana aktivitas enzim sellulase dan amilase dari sampel jagung dan kedelai menggunakan isolat Aspergillus sp.?
1.3 Tujuan
Adapun tujuan dari praktikum kali ini adalah sebagai berikut :
1. Mengetahuikandungan glukosa yang merupakan monosakarida dengan menggunakan metode Uji DNS kolorimetri serta membandingkan hasil pengukuran kandungan glukosa pada sampel jagung dan kedelai
2. Mengetahuikandungan sukrosa yang merupakan disakarida dengan menggunakan resorcinol serta membandingkan hasil pengukuran kandungan sukrosa pada sampel jagung dan kedelai
3. Mengetahuikandungan pati atau starch yang merupakan polisakarida dengan menggunakan metode Iodine Colour serta membandingkan hasil pengukuran kandungan pati atau starch pada sampel jagung dan kedelai 4. Mengetahuikandungan lipid menggunakan metode Bligh-Dyer dan
perbandingan hasil kandungan lipid antara sampel jagung dan kedelai 5. Mengetahuikandungan protein menggunakan pengujian Bradforddan
6. Mengetahui pola protein yang terbentuk hasil isolasi dari sampel jagung dan kedelai menggunakan elektroforesis SDS-PAGE.
7. Mengetahui dan mengukur aktivitas enzim sellulase dan amilase dari sampel jagung dan kedelai menggunakan isolat Aspergillus sp
BAB 2 TINJAUAN PUSTAKA 2.1 Karbohidrat
2.1.1 Penggolongan Karbohidrat
Karbohidrat memegang peranan penting dalam alam karena merupakan sumber energi utama bagi manusia dan hewan yang harganya relatif murah. Semua karbohidrat berasal dari tumbuh-tumbuhan. Melalui fotosintesis, klorofil tanaman dengan bantuan sinar matahari mampu membentuk karbohidrat dari karbondioksida (CO2) berasal dari udara dan air (H2O) dari tanah. Karbohidrat yang dihasilkan adalah klarbohidrat sederhana glukosa. Di samping itu dihasilkan oksigen (O2) yang lepas di udara(Campbell et al., 2012).
Sinar matahari
Klorofil
6 CO2 + 6 H2O C6H12O6 + 6 O2
Karbohidrat
Berdasarkan hidrolisisnya, karbohidrat digolongkan menjadi monosakarida, disakarida, dan polisakarida. Sebagian besar monosakarida dikenal sebagai heksosa, karena terdiri atas 6-rantai atau cincin karbon. Atom-atom hidrogen dan oksigen terikat pada rantai atau cincin ini secara terpisah atau sebagai gugus hidroksil (OH). Ada tiga jenis heksosa yang penting dalam ilmu gizi, yaitu glukosa, fruktosa, dan galaktosa. Ketiga macam monosakarida ini mengandung jenis dan jumlah atom yang sama, yaitu 6 atom karbon, 12 atom hidrogen, dan 6 atom oksigen. Perbedaannya hanya terletak pada cara penyusunan atom-atom hidrogen dan oksigen di sekitar atom-atom karbon. Perbedaan dalam susunan atom inilah yang menyebabkan perbedaan dalam daya larut, dan sifat lain ketiga monosakarida tersebut. Monosakarida yang terdapat di alam pada umumnya terdapat dalam bentuk isomer dekstro (D). Gugus hidroksil ada karbon nomor 2 terletak di sebelah kanan. Struktur kimianya dapat berupa struktur terbuka atau struktur cincin(Campbell et al., 2012).
Glukosadinamakan juga dekstrosa atau gula anggur, terdapat luas di alam dalam jumlah sedikit, yaitu di dalam sayur, buah, sirup jagung, sari pohon, dan
bersamaan dengan fruktosa dalam madu. Glukosa memegang peranan sangat penting dalam ilmu gizi. Glukosa merupakan hasil akhir pencernaan pati, sukrosa, maltosa, dan laktosa pada hewan dan manusia. Dalam proses metabolisme, glukosa merupakan bentuk karbohidrat yang beredar di dalam tubuh dan di dalam sel merupakan sumber energi(Campbell et al., 2012).
Tiap molekul disakarida terdiri dari dua satuan monosakarida. Dalam molekul disakarida, kedua monosakarida berikatan secara ikatan glukosida. Ikatan glikosidik ini biasanya terjadi antara atom C nomor 1 dengan atom C nomor 4 dan membentuk ikatan alfa, dengan melepaskan satu molekul air. Hanya karbohidrat yang unit monosakaridanya terikat dalam bentuk alfa yang dapat dicernakan.Disakarida dapat dipecah kembali mejadi dua molekul monosakarida melalui reaksi hidrolisis. Contoh disakarida antara lain adalah sukrosa (gula tebu), maltosa (gula gandum), dan laktosa (gula susu). Ketiganya memiliki rumus molekul C12H22O11.Salah satu contoh disakarida yang paling banyak terdapat dikelompok tumbuhan adalah sukrosa. Hidrolisis sukrosa menghasilkan glukosa dan fruktosa (Campbell et al., 2012).
2.1.2 Sumber-sumber Karbohidrat
Sumber karbohidrat adalah padi-padian atau serealia, umbi-umbian, kacang-kacang kering, dan gula. Hasil olah bahan-bahan ini adalah bihun, mie, roti, tepung-tepungan, selai, sirup, dan sebagainya. Sebagian besar sayur dan buah tidak banyak mengandung karbohidrat (Campbell et al., 2012). Sayur umbi-umbian, seperti wortel dan bit serta kacang-kacangan relatif lebih banyak mengandung karbohidrat daripada sayur daun-daunan. Bahan makanan hewani seperti daging, ayam, ikan, telur, dan susu sedikit sekali mengandung karbohidrat. Sumber karbohidrat yang banyak dimakan sebagai makanan pokok di Indonesia adalah beras, jagung, ubi, singkong, talas, dan sagu.
2.2. Lipid
2.2.1. Definisi Lipid
Lipid adalah sekelompok senyawa non heterogen yang meliputi asam lemak dan turunannya, lemak netral (trigliserida), fosfolipid serta sterol. Sifat umum lipid ada yang larut dalam air dan ada yang larut dalam pelarut non polar (Eggers and Dominik, 2016).
2.2.2. Fungsi Lipid
Lipid mempunyai fungsi sebagai penghasil panas tubuh, pembentukan dari dinding sel, pelindung organ tubuh, sumber asam lemak esensial, transporter vitamin larut lemak, dan sebagai pelumas. Lemak yang beredar dalam tubuh diperoleh dari dua sumber yaitu dari makanan dan hasil produksi organ hati. Lemak disimpan di dalam jaringan adiposa, yang berfungsi sebagai insulator panas di jaringan subkutan (Cruz et al., 2016)
2.2.3. Klasifikasi Lipid
Lipid diklasifikasikan menjadi dua yaitu lipid sederhana dan lipid kompleks. Lipid sederhana meliputi ester asam lemak dengan berbagai alkohol. Contoh lipid sederhana antara lain lemak, minyak dan wax. Lemak (fat) merupakan ester asam lemak dengan gliserol. Minyak (oil) adalah lemak dalam keadaan cair. Wax (malam) merupakan ester asam lemak dengan alkohol monohidrat yang berat molekulnya tinggi.Berbeda dengan lipid sederhana, lipid kompleks merupakan ester asam lemak yang mengandung gugus-gugus selain alkohol dan asam lemak, seperti fosfolipid dan glikolipid. Fosfolipid adalah lipid yang mengandung suatu residu asam fosfor, selain asam lemak dan alkohol, sedangkan glikolipid adalah lipid yang mengandung asam lemak, sfingosin, dan karbohidrat. Lipid kompleks lain juga meliputi sulfolipid, aminolipid, dan lipoprotein (Cheirslip et al., 2012).
2.3. Protein
2.3.1 Jenis dan fungsi protein
Protein merupakan molekul penyusun tubuh kita yang terbesar setelah air. Hal ini mengindikasikan pentingnya protein dalam menopang seluruh proses kehidupan dalam tubuh. Pada kenyataannya, kode genetik yang tersimpan dalam
rantaian DNA digunakan untuk membuat protein, kapan, dimana dan seberapa banyak. Protein berfungsi sebagai penyimpan dan pengantar seperti hemoglobin yang memberikan warna merah pada sel darah merah, bertugas mengikat oksigen dan membawanya ke bagian tubuh yang memerlukannya. Selain itu juga menjadi penyusun sel dalam tubuh, seperti keratin di rambut yang banyak mengandung asam amino Cysteine sehingga menyebabkan bau yang khas bila rambut terbakar karena banyaknya kandungan atom sulfur di dalamnya. Enzim merupakan salah satu jenis dari protein yang berfungsi sebagai katalis alam tubuh. Dengan adanya enzim, organisme dapat hidup dengan baik. Enzim memiliki beberapa kelebihan terhadap katalisator non-biologis pada kecepatan reaksi serta spesifikasi terhadap substrat yang tinggi.
3.1.2 Metode pengukuran kadar protein
Protein dalam sampel hayati dapat dikenali dengan beberapa macam reaksi. Reaksi pengenal protein, antara lain: uji biuret, uji xantoprotet, dan uji belerang. Uji biuret digunakan untuk mengetahui adanya ikatan peptida dalam protein. Bahan yang akan diidentifikasi dalam uji biuret ditetesi larutan NaOH, kemudian larutan CuSO4. Adanya protein dalam bahan tersebut ditandai terbentuknya warna ungu. Uji xantoproteat digunakan untuk mengidentifikasi gugus fenil (cincin benzena) dalam protein. Adanya cincin benzena dalam protein ditandai terbentuknya warna kuning pada pemanasan HNO3 pekat. Adanya belerang dalam protein dapat diidentifikasi dengan cara memanaskan protein bersama larutan NaOH pekat kemudian ditetesi dengan larutan Pb(CH3COOH)2. Adanya belerang ditandai dengan terbetuknya endapan hitam dari PbS.
Kadar protein dalam sampel hayati dapat ditentukan dengan metode spektrofotometri, baik menggunakan sinar uv maupun dengan sinar tampak setelah penambahan pereaksi pewarna dengan intensitas warna yang dibentuknya sebanding dengan kadar protein. Salah satu pewarnaan yang praktis dan sensitif adalah metode Bradford dibandingkan cara lainnya seperti metode Biuret atau Lowry.
Kualitas protein didasarkan pada kemampuannya untuk menyediakan nitrogen dan asam amino bagi pertumbuhan, pertahanan dan memperbaiki jaringan tubuh. Secara umum kualitas protein tergantung pada dua karakteristik yaitu Digestibilitas protein dan komposisi asam aminonya. Digestibilitas protein berarti untuk dapat digunakan oleh tubuh, asam amino harus dilepaskan dari komponen lain dan dibuat agar dapat diabsorpsi. Komposisi asam amino yang digunakan dalam sintesis protein tubuh harus tersedia pada saat yang sama agar jaringan yang baru dapat terbentuk, dengan demikian makanan harus menyediakan setiap asam amino dalam jumlah yang mencukupi untuk membentuk asam amino lain yang dibutuhkan.
2.4 Uji Aktivitas Enzim Ekstraseluler (Selulase dan Amilase)
Biomassa yang berasal dari tanaman mayoritas adalah lignoselulosa yang terdiri dari 3 tipe polimer yaitu selulosa, hemiselulosa dan lignin (Pérez et al., 2002). ketiga polimer ini bersama-bersama membentuk biomassa tanaman dengan prosentase tertentu dan berbeda antara satu jenis tumbuhan dengan yang lain. Namun, secara umum selulosa menyususun sekitar 45 % dari berat kering tanaman, hemiselulosa sekitar 25-30 %, sedangkan sisanya berupa lignin dan komponen lain (Pérez et al., 2002).
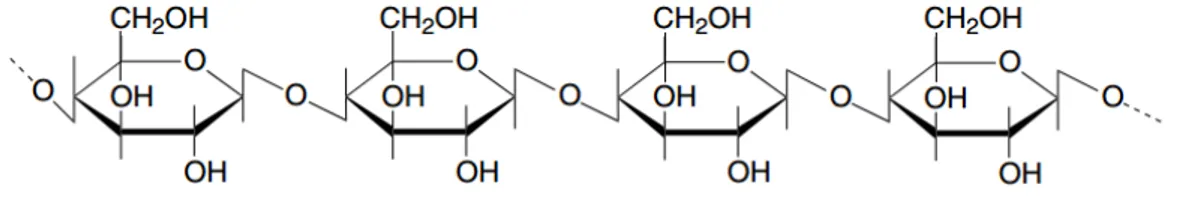
Selulosa merupakan homopolimer yang berbentuk linear, yang terdiri dari ikatan β 1,4- glikosidik yang berhubungan dengan unit D-glukopiranosa. Selulosa biasanya terbentuk dalam struktur kristalin dan amorf serta biasanya ditemukan dalam dinding tanaman ataupun fungi (Moat, Foster, & Spector, 2002)
Gambar 2.2. struktur selulosa (Moat et al., 2002)
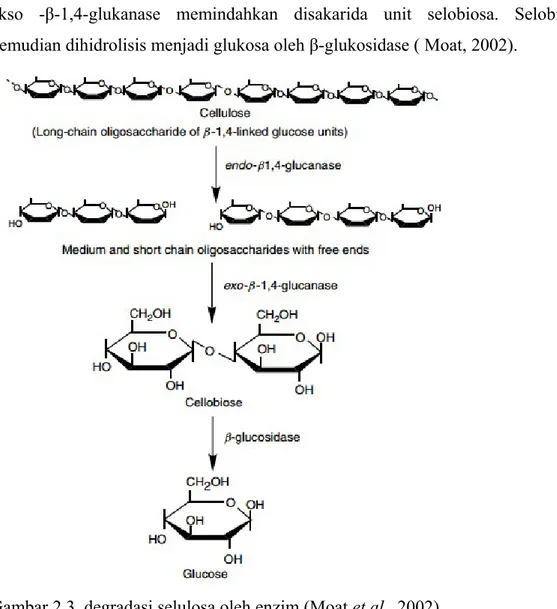
Degradasi selulosa memerlukan kombinasi dari 3 tipe enzim yaitu endo-β-1,4-glukanase yang mengubah selulosa menjadi oligosakarida yang lebih kecil,
ekso -β-1,4-glukanase memindahkan disakarida unit selobiosa. Selobiosa kemudian dihidrolisis menjadi glukosa oleh β-glukosidase ( Moat, 2002).
Gambar 2.3. degradasi selulosa oleh enzim (Moat et al., 2002)
Hemiselulosa merupakan heteropolimer karbohidrart kompleks. Polisakarida ini memiliki massa yang lebih rendah dibandingkan dengan selulosa dan terdiri dari D-xylose, D-mannosa, D-galactosa, D-glucosa, L-arabinosa, 4-O-methyl-glucuronic, D-galacturonic and asam D-glucuronic yang diikat oleh β 1,4- dan β 1,3- glikosidik (Pérez et al., 2002).
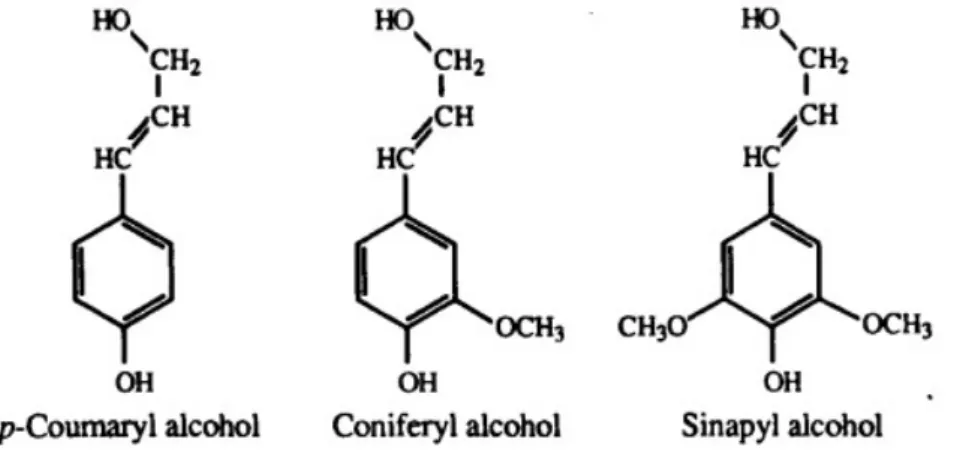
Perbedaan utama antara hemiselulosa dan selulosa adalah pada hemiselulosa terdapat cabang dengan rantai pendek yang terdiri dari gula yang berbeda. Hemiseluosa juga lebih mudah terhidrolisis dari pada selulosa (Pérez et al., 2002). Lignin merupakan polimer aromatik yang dihubungkan oleh ikatan eter dan karbon yang tersusun dari 3 kompleks bangun utama yaitu p-coumaryl
alcohol (p-hydroxyphenyl propanol), coniferyl alcohol (guaiacyl propanol), dan sinapyl alcohol (syringyl propanol) (Jeffries, 1994).
Gambar 2.5. Tiga komplek struktur lignin (Jeffries, 1994).
Struktur yang kompleks dan berat molekul yang tinggi serta sulit telarut menyebabkan lignin lebih sulit untuk didekomposisi (Pérez et al., 2002). Diperlukan enzim-enzim tertentu untuk menghidrolisis lignin. Beberapa enzim yang sering digunakan untuk menghidrolisis lignin diantaranya lignin peroxidase, manganese peroxidase (MnPs). and laccase (Jeffries, 1994).
Carboxy Methyl Cellulose(CMC) merupakan turunan selulosa,kopolimer dua unit β-D glukosa dan β-D-glukopiranosa 2-O-(karboksilmetil)-garam monosodium yang terikat melaluiikatan β-1,4-glikosidik. CMC memilikikelarutan lebih tinggi daripada selulosa,sehingga mudah dihidrolisis. HidrolisisCMC menjadi gula-gula sederhana dapat dilakukan dengan menggunakan katalis asam, enzim maupun mikroba selulolitik(Pérez et al., 2002).
BAB 3 METODE 3.1. Waktu dan Tempat
Praktikum kali ini dilakukan di Laboratorium Biokimia Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jember pada jam pelaksanaan praktikum biokimia yaitu setiap hari Kamis.
3.2. Alat dan Bahan
3.2.1. Alat dan Bahan Uji Glukosa menggunakan DNS Kolorimetri
Alat yang digunakan dalam uji kandungan glukosa meliputi tabung reaksi sebanyak 2 buah, vortex, panci, kompor, mikropipet, tip, kuvet dan spektrofotometer. Sedangkan bahan-bahan yang digunakan meliputi 1 mL larutan sampel jagung dan kedelai serta 1 mL Dinitrosalicylic Acid.
3.2.2. Alat dan Bahan Uji Sukrosa menggunakan Resorchinol
Alat yang digunakan dalam uji kandungan sukrosa meliputi tabung reaksi sebanyak 2 buah, vortex, panci, kompor, mikropipet, tip, kuvet dan spektrofotometer. Sedangkan bahan-bahan yang digunakan meliputi 100 µL larutan sampel jagung dan kedelai, 100 µL NaOH 0,5 N, 1 mL H2O, sebanyak 250 µL resorchinol 0,1 % , serta 750 µL HCl 30 %.
3.2.3. Alat dan Bahan Uji Pati atau Starch menggunakan Iodine Colour
Alat yang digunakan dalam uji kandungan sukrosa meliputi tabung reaksi sebanyak 2 buah, vortex, panci, kompor, mikropipet, tip, kuvet, spektrofotometer serta sentrifugator. Sedangkan bahan-bahan yang digunakan meliputi 10 gram sampel jagung dan kedelai, 5 mL H2O, serta 2 mL larutan Iodine.
3.2.4. Alat dan Bahan Uji Lipid menggunakan Bligh-Dyer method
Alat yang digunakan dalam uji kandungan lipid meliputi tabung sentrifuge sebanyak 2 buah, vortex, pipet pasteur, gelas ukur,oven, timbangan serta sentrifugator. Sedangkan bahan-bahan yang digunakan meliputi 2,5 gram sampel jagung dan kedelai, 5 mL larutan chloroform-methanol (1:2), serta 2 mL H2O.
Alat yang digunakan dalam uji kandungan protein meliputi mortar dan pestle,micropipet dan tip, eppendorf, vortex serta sentrifugator. Sedangkan bahan-bahan yang digunakan meliputi 2gram sampel jagung dan kedelai, buffer ekstraksi (100 mM Tris-HCl (pH 7,5), 10 mM MgCl2, 1 mM EDTA, 10 mM β-2 mercaptoethanol, dan 10 % PVP), serta reagent Bradford yang berisi 100 mg Coomasie Brilliant Blue G-250 dalam 50 mL ethanol 95% yang ditambahkan 100 mL (w/v) phosporic acid dan ditambah aquadest sampai volume 1 L.Reagent Bradford disaring terlebih dahulu dengan kertas Whatman sebelum digunakan.
3.2.6. Alat dan Bahan Elektroforesis Protein menggunakan SDS-PAGE
Alat yang digunakan dalam elektroforesis protein meliputi beaker glass,micropipet dan tip, eppendorf, alat elektroforesis SDS-PAGE, penangas air, dan vortex. Sedangkan bahan-bahan yang digunakan meliputi 2 eppendorf sampel ekstraksi protein jagung dan kedelai, buffer sampel, buffer loading β-mercaptoethanol. Bahan yang digunakan dalam pembuatan gel SDS meliputi acrilamid 30% yang terdiri dari 29,2% acrilamid dan 0,8% bis acrilamid, Lower Gel Buffer terdiri dari 1,5 M Tris HCl pH 8,8 dalam 0,4% SDS, Upper Gel Buffer terdiri dari 0,5 M Tris HCl pH 6,8 dalam 0,4% SDS, APS 10% dan TEMED.
3.2.7. Alat dan Bahan Uji aktivitas enzim menggunakan CMC-ase.
Alat yang digunakan pada uji ini adalah pipet mikro 1000 ul dan 5000 ul, tabung reaksi, waterbath, dan spektrofotometer. Sedangkan bahan-bahan yang digunakan terdiri atas Carboxymethylcellulosa (CMC), crude enzim Aspergilus feotidus ESW-D4, buffer sitrat phosphat pH 6, reagen DNS dan larutan glukosa.
3.3. Skema Kerja
3.3.2. Uji kadar sukrosa sampel jagung dan kedelai dengan Resorcinol
3.3.4. Uji kadar lipid sampel jagung dan kedelai dengan Blight-Dyer method
3.3.6. Elektroforesis protein dengan menggunakan SDS-PAGE a. Preparasi SDS – PAGE 1. Pembuatan gel GEL COMPOSITION SEPARATING (UPPER) STACKING (LOWER) Acrilamide 2000 µl 665 µl 1.5 M Tris HCl pH 8.8 1250 µl -0.5 M Tris HCl pH 8.8 - 1250 µl SDS 10 % 50 µl 50 µl H2O 1675 µl 3050 µl APS 10% 25 µl 25 µl Temed 2.5 µl 5 µl
3. Running Elektroforesis SDS-PAGE
4. Pengamatan Band Protein yang terbentuk
BAB 4 HASIL DAN PEMBAHASAN 4.1 Hasil
4.1.1 Hasil Pengukuran Kadar Glukosa Sampel Jagung dan Kedelai Jenis Sampel Nilai Absorbansi Kelompok II Konsentrasi (µg/µl) Kedelai 0,746 45,78 Jagung 0,515 30,49
4.1.2 Hasil Pengukuran Kadar Sukrosa Sampel Jagung dan Kedelai Jenis Sampel Nilai Absorbansi Kelompok II Konsentrasi (µg/µl) Jagung 0,021 3,84 Kedelai 0,037 5,3
4.1.3 Hasil Pengukuran Kadar Starch Sampel Jagung dan Kedelai Jenis Sampel Nilai Absorbansi Kelompok II Konsentrasi (µg/µl) Jagung 0,748 16,81 Kedelai 0,460 10,16
4.1.4 Hasil Pengukuran Kadar Lipid Sampel Jagung dan Kedelai Sampel W0 (g) W2 (g) W3 (g) F (g/100g)
Jagung 0.5895 0.6306 1.2201 3.37
Kedelai 0.5920 0.7216 1.3136 9.89
PERHITUNGAN : F=(w 2−w 0)× 100w 3
Keterangan :
F = kadar (g/100g) lemak dalam sampel W0 = berat (g) alumunium kosong
W2 = berat (g) alumunium dengan residu kering lipid W3 = berat (g) sampel basah
1. Sampel yang sudah dilarutkan dengan chloroform/methanol (1:2)
2. Setelah penambahan air tebentuk 3 lapisan
3. Hasil dari sentrifuge, lapisan bawah
mengandung lipid
4. Kertas saring yang mengandung berat
kering residu lipid
4.1.5 Hasil Pengukuran Kadar Protein Sampel Jagung dan Kedelai Jenis Sampel Nilai Absorbansi
Kelompok II
Konsentrasi (µg/µl)
Kedelai(50X) 0,845 75,12 No
.
Gambar Keterangan
1. Sampel jagung dan kedelai yang sudah
dilarutkan pada buffer
2. Supernatan hasil dari sentrifugasi sebelum di tambah dengan reagen bradford
3. Supernatan yang sudah ditambah dengan
reagent bradford
4.1.6 Hasil
Elektroforesis SDS-PAGE Protein dari Sampel Jagung dan Kedelai J1 J1 J2 J2 M K1 K1 K2
4.1.7 Hasil analisis kuantitatif aktivitas enzim
Sampel Absorbansi Konsentrasi Aktivitas Enzim
Kedelai 0, 666 40,48 0,074
Jagung 3 194,5 0,361
4.1.8 Hasil analisis kulititatif aktivitas enzim
No Gambar Keterangan
1. Larutan sampel jagung dan kedelai yang
sudah diinokulasi dengan Aspergillus sp. dan digojog overnight
2. Media amilum dan selulosa yang di
beri larutan sampel jagung + isolat Aspergillus sp.
3. Media amilum dan selulosa yang di beri
larutan sampel kedelai + Aspergillus sp.
4. Media amilum dan selulosa yang di
beri larutan sampel jagung + isolat Aspergillus sp.yang sudah diinkubasi4 hari pada suhu 37˚C
5. Media amilum dan selulosa yang di
beri larutan sampel kedelai + isolat Aspergillus sp.yang sudah diinkubasi4 hari pada suhu 37˚C
6.
Supernatan yang sudah ditambah dengan 1 % CMC
7.
Proses inkubasi pada suhu 500C selama 30 menit
8.
Setelah penamabhan larutan DNS pada larutan enzim
4.2 Pembahasan
4.2.1 Pengukuran Kadar Glukosa Sampel Jagung dan Kedelai
Metode dengan menggunakan DNS ini digunakan untuk mengukur gula pereduksi dengan teknik kolorimetri (Torres et al., 2011). Penentuankomposisi gula reduksi dalam sampel yang mengandung karbohidrat yang digunakan adalah menggunakan pereaksi asam dinitro salisilat (3-amino,5-nitrosalicylic acid). Metode ini adalah metode kimiawi. DNS merupakan senyawa aromatis yang akan bereaksi dengan gula reduksi maupun komponen pereduksi lainnya untuk membentuk 3-amino-5-nitrosalicylic acid, suatu senyawa yang mampu menyerap dengan kuat radiasi gelombang elektromagnetik pada 560 nm (Goncalves et al, 2010). Pemanasan pada suhu 90˚C bertujuan untuk mempercepat reaksi pengikatan gula reduksi oleh DNS sehingga membentuk senyawa 3,5-dinitrosalicylic acid. Semakin banyak komponen pereduksi yang terdapat dalam sampel, maka akan semakin banyak pula molekul 3-amino-5-nitrosalicylic acid yang terbentuk dan mengakibatkan serapan semakin tinggi dalam pembacaan nilai absorbansi (Wang et al., 2010).
Reaksi glukosa dengan DNS yang terjadi merupakan reaksi redoks pada gugus aldehid gula dan teroksidasi menjadi gugus karboksil. Sementara itu DNS sebagai oksidator akan tereduksi membentuk 3-amino-5-nitrosalicylic acid. Reaksi ini berjalan dalam suasana basa. Bila terdapat gula reduksi pada sampel, maka larutan DNS yang awalnya berwarna kuning akan bereaksi dengan gula reduksi sehingga menimbulkan warna jingga kemerahan (Teixeira et al. 2012).
Berdasarkan hasil pengukuran absorbansi sampel jagung dan sampel kedelai, diketahui bahwa sampel kedelai memiliki kadar glukosa lebih tinggi dibandingkan dengan jagung dengan nilai absorbansi 0,746 dengan konsentrasi 45,78 µg/µl. Nilai konsentrasi sampel tersebut dapat diketahui dengan menggunakan kurva standar glukosa. Nilai absorbansi yang diperoleh dari masing-masing sampel kemudian dimasukkan kedalam rumus regresi pembuatan kurva standar glukosa. Berbeda dengan pernyataan Merriman et al. (2016) yang menyatakan bahwa kadar glukosa jagung relatif lebih tinggi dibandingkan dengan kedelai. Hal ini dimungkinkan karena proses homogenisasi sampel dengan jagung pada saat percobaan berlangsung kurang optimal sehingga kadar glukosa yang terlarut dalam larutan sampel tidak mewakili kadar glukosa yang terkandung dalam sampel.
4.2.2 Pengukuran Kadar Sukrosa Sampel Jagung dan Kedelai
Uji Seliwanoff adalah sebuah uji kimia yang membedakan gula aldosa dan ketosa (Gondim et al., 2015). Ketosa dibedakan dari aldosa via gugus fungsi keton/aldehida gula tersebut. Jika gula tersebut mempunyai gugus keton, ia adalah ketosa. Sebaliknya jika ia mengandung gugus aldehida, ia adalah aldosa. Uji ini didasarkan pada fakta bahwa ketika dipanaskan, ketosa lebih cepat terdehidrasi daripada aldosa (Verma et al., 2010). Reagen uji sukrosa ini terdiri dari resorcinol dan asam klorida pekat. Asam reagen ini menghidrolisis polisakarida dan oligosakarida menjadi gula sederhana.Ketosa yang terhidrasi kemudian bereaksi dengan resorcinol, menghasilkan zat berwarna merah tua (Olennikov and Thankaeva, 2008). Aldosa dapat sedikit bereaksi dan menghasilkan zat berwarna merah muda.Fruktosa dan sukrosa merupakan dua jenis gula yang memberikan uji positif. Sukrosa menghasilkan uji positif karena ia adalah disakarida yang terdiri
dari furktosa dan glukosa. Pemanasan yang dilakukan selama proses reaksi bertujuan untuk mempercepat reaksi (Datir and Snehal, 2016).
Berdasarkan hasil pengukuran absorbansi kedua sampel, diketahui bahwa kedelai memiliki nilai absorbansi yang lebih tinggi yaitu 0,037 dengan kisaran nilai konsentrasi 5,3 µg/µl, nilai absorbansi yang tinggi diasumsikan konsentrasinya sukrosa juga relatif lebih tinggi. Nilai konsentrasi sampel tersebut dapat diketahui dengan menggunakan kurva standar sukrosa. Nilai absorbansi yang diperoleh dari masing-masing sampel kemudian dimasukkan kedalam rumus regresi pembuatan kurva standar sukrosa. Hasil konsentrasi kedelai 5,3 µg/µl yang lebih tinggi dari konsentrasi jagung 3,84µg/µl berkebalikan dengan pernyataan Liu et al.(2016) yang menyebutkan bahwa kandungan sukrosa jangung lebih tinggi dibandingkan dengan kedelai.
4.2.3 Pengukuran Kadar Pati atau Starch Sampel Jagung dan Kedelai
Uji Iodine Colour bertujuan untuk mengidentifikasi polisakarida. Reagent yang digunakan adalah larutan iodine yang merupakan I2 terlarut dalam potassium iodide (Nakamura et al., 2016). Reaksi antara polisakarida dengan iodin membentuk rantai poliiodida. Polisakarida umumnya membentuk rantai heliks (melingkar), sehingga dapat berikatan dengan iodin, sedangkan karbohidrat berantai pendek seperti disakarida dan monosakarida tidak membentuk struktur heliks sehingga tidak dapat berikatan denganiodin (Nie et al., 2013). Pati atau starch dengan iodin dapat membentuk kompleks biru, amilopektin dengan iodin akan memberi warna merah ungu sedangkan dengan glikogen dan dekstrin akan membentuk warna merah coklat. Pati yang berikatan dengan iodin akan menghasilkan warna biru. Sifat ini dapat digunakan untuk menganalisis adanya pati dengan cara pembacaan nilai absorbansinya (Cole et al., 2016).
Pemanasan yang dilakukan pada homogenat sampel jagung dan kedelai berfungsi untuk mengekstraksi kandungan karbohidrat yang ada pada sampel. Setelah pemanasan dilakukan, dilakukan sentrifugasi untu memisahkan debris sampel dan juga komponen tidak terlarut seperti halnya lipid. Supernatan yang diambil berisi karbohidrat terlarut salah satunya adalah pati atau starch. Larutan
Iodine yang ditambahkan pada supernatan sampel jagung dan kedelai akan membentuk ikatan kompleks dengan pati dan sifatnya spesifik. Oleh karena itu, dengan adanya kompleks ikatan menyebabkan perubahan warna. Semakin banyak kadar pati yang ada pada sampel maka semakin banyak pula ikatan kompleks yang terbentuk (Madhu et al., 2016). Banyaknya ikatan kompleks iodine dan pati menyebabkan pembacaan nilai absorbansinya juga akan tinggi.
Hasil pembacaan nilai absorbansi kedua sampel menunjukkan jagung memiliki kandungan pati relatif lebih tinggi dibandingkan dengan kedelai. Jagung memiliki nilai absorbansi sebesar 0,748 dengan konsentrasi sebesar 16,81 µg/µl sedangkan kedelai memiliki nilai absorbansi sebesar 0,460 dengan konsentrasi sebesar 10,16 µg/µl. Nilai konsentrasi sampel tersebut dapat diketahui dengan menggunakan kurva standar pati atau starch. Nilai absorbansi yang diperoleh dari masing-masing sampel kemudian dimasukkan kedalam rumus regresi pembuatan kurva standar pati atau starch. Berdasarkan literatur yang ada, menunjukkan bahwa kandungan karbohidrat termasuk pati dari jagung lebih tinggi dibandingkan dengan kedelai (Merriman et al., 2016).
4.2.4 Pengukuran Kadar Lipid Sampel Jagung dan Kedelai
Metode yang digunakan pada praktikum analisa kadar lipid pada sampel jagung dan kedelai adalah metode Bligh-Dyer. Prinsip kerja metode ini didasarkan pada adanya perbedaan kelarutan antara lipid dengan senyawa lain yang ada pada jaringan tanaman. Isolasi berbagai golongan lipid sangat mengandalkan perbedaan kelarutannya (Eggers and Dominik, 2016). Lipid merupakan senyawa nonpolar yang hanya dapat larut dalam cairan yang bersifat nonpolar, sedangkan senyawa lain yang ada pada tanaman bersifat polar sehingga hanya dapat terlarut dalam cairan yang bersifat polar. Berdasarkan fenomena tersebut dibuatlah sebuah metode isolasi lipid dengan cara melarutkan jaringan tanaman dalam larutan campuran metanol dan chloroform. Lipid keseluruhan dapat diekstraksi dari jaringan dengan campuran metanol-chloroform (Cheirslip and Salwa, 2012). Methanol berperan sebagai larutan polar yang dapat melarutkan senyawa lain selain lipid pada jaringan tanaman, sedangkan chloroform menjadi larutan
nonpolar yang hanya dapat melarutkan lipid. Dari hasil reaksi tersebut akan terbentuk dua lapisan yakni lapisan methanol (methanol layer) yang mengandung semua senyawa selain lipid pada jaringan tanaman dan lapisan chloroform (chloroform layer) yang mengandung senyawa lipid keseluruhan yang ada pada jaringan tanaman (Cruz et al., 2016).
Sampel jagung dan kedelai yang sudah dihaluskan kemudian dihomogenisasi dan dilakukan sentrifugasi selama 10 menit untuk memisahkan methanol layer dan chloroform layer. Chloroform layer diambil menggunakan pipet pasteur dan hasilnya dituangkan pada kertas saring yang telah dikeringkan dan ditimbang. Kertas sari yang belum dituangi dengan sampel chloroform layer, ditimbang dan dicatat datanya sebagai W0, sedangkan kertas saring yang telah dituangi chloroform layer dikeringkan dalam oven hingga kadar airnya menguap kemudian ditimbang sebagai W2. W3 yang diperoleh merupakan berat sampel yang digunakan.Dari hasil pengukuran dan perhitungan yang diperoleh, diketahui bahwa kedelai memiliki persentase kandungan lipid lebih tinggi yaitu 9,89 g/100g jika dibandingkan dengan jagung yang hanya 3,37 g/100g, seperti pada hasil pengukuran yang dilakukan oleh Evangelista and Regitano pada tahun 2009 yang menyatakan kedelai dengan persentase lebih tinggi pada kandungan lipid dibandingkan jagung.
4.2.5 Pengukuran Kadar Protein Sampel Jagung dan Kedelai
Metode Bradford didasarkan pada pengikatan zat warna Coomassie Brilliant Blue G-250 ke protein, dimana zat warna ini memiliki empat formasi ion berbeda dengan nilai pKa 1.15, 1.82 dan 12.4 (Cheng et al., 2016). Bentuk kationik zat warna ini berwarna merah dan hijau dengan panjang gelombang serapan (absorbansi) maksimum pada 470 dan 650 nm. Sedangkan bentuk anioniknya berwarna biru dengan absorbansi maksimum 590 nm. Pengukuran proteinnya sendiri dilakukan dengan menentukan jumlah zat warna dalam bentuk anionik (biru), dan biasanya hal ini dilakukan dengan mengukur absorbansi larutan pada 595 nm (Golunski et al., 2016). Tingginya nilai absorbansi mengindikasikan tingginya kadar protein sampel, karena semakin banyak molekul protein yang terikat pada CBB maka kepekatannya meningkat dan menyebabkan
tingginya nilai absorbansi sampel (Sigismund and Simona, 2016). Zat warna Coomassie Blue G-250 bereaksi cepat dengan residu arginil dan lysil dari protein, sehingga hal ini menyebabkan adanya variasi hasil pengukuran untuk jenis protein yang berbeda-beda. Protein dengan residu arginil dan lysil yang lebih banyak tentu akan menghasilkan warna biru yang lebih intens dibanding protein yang residu arginil dan lysilnya lebih sedikit meskipun jumlah proteinnya sama (Caunt et al., 2016). Namun secara umum metode Bradford masih merupakan metode yang paling sesuai dan paling umum digunakan.
Dari hasil pembacaan nilai absorbansi dengan menggunakan spektrofotometri diketahui bahwa kedelai memiliki nilai absorbansi yang tinggi yaitu 0,845 setelah dilakukan pengenceran 50X dibandingkan dengan jagung sebesar 0,073 tanpa dilakukan pengenceran. Pengenceran dilakukan karena tingkat kepekatan protein sampel kedelai lebih tinggi dari jagung. Nilai absorbansi yang tinggi diasumsikan sebagai kadar protein yang tinggi pula. Nilai konsentrasi sampel dapat diketahui dengan menggunakan kurva standar protein. Nilai absorbansi yang diperoleh dari masing-masing sampel kemudian dimasukkan kedalam rumus regresi pembuatan kurva standar protein. konsentrasi protein yang tinggi ditunjukkan pada sampel kedelai walaupun sampel tersebut sudah dilakukan pengenceran 50X. Konsentrasi kedelai mencapai 75,12 µg/µl lebih tinggi dibandingkan dengan jagung yang hanya 5,88µg/µl. kedelai merupakan biji-bijian dengan kandungan protein yang tinggi (Liu et al., 2016).
4.2.6 Elektroforesis SDS-PAGE Protein dari Sampel Jagung dan Kedelai
Pada SDS-PAGE dilakukan pembuatan dua jenis gel berbeda, yaitu separating gel dan stacking gel.Separating gel berfungsi untuk memisahkan atau menseparasi protein berdasarkan berat molekulnya, bahan yang digunakan dalam praktikum yaitu akrilamid 30% sebagai bahan untuk membentuk pori-pori dalam gel agar protein dapat terpisah berdasarkan ukurannya, 1M Tris pH 8,8 untuk menstabilkan pH buffer agar muatan dari protein tidak berubah, aquadestdigunakan sebagai pelarut polar dan sebagai media polar untuk aliran listrik dalam gel, SDS digunakan untuk memutuskan ikatan disulfida dari protein
agar menjadi unfolding dan menyelubungi protein dengan muatan negatif, APS digunakan sebagai katalisator dalam polimerasi gel poliakrilamid, dan TEMED digunakan sebagai katalisator pembentukan radikal bebas dari ammonium persulfat dan sebagai pemadat sehingga pencampurannya dilakukan terakhir agar larutan tidak menjadi padat terlebih dahulu sebelum seluruh bahan tercampur. pH yang digunakan dalam separating gel yaitu 8,8 untuk mendapatkan pori-pori yang lebih kecil sehingga protein akan terseparasi dengan baik saat running (Wang et al., 2016).
Larutan gel yang telah dibuat dimasukkan dalam plate untuk mencetak gel, lalu pemberian aquadest diatas separating gel yang setengah padat bertujuan untuk membuat permukaan separating gel datar. Setelah padat aquadest diserap agar dapat dilakukan proses selanjutnya yaitu penambahan stacking gel diatas separating gel. Gel kedua yaitu stacking gel yang berfungsi untuk tempat diletakkannya sampel protein sebelum proses running dimulai. Bahan yang digunakan dalam pembuatan stacking gel ini yaitu akrilamid-bis sebagai pembentuk pori-pori untuk memisahkan protein berdasarkan ukuran yang dimilikinya, Tris pH 6,8 untuk mempertahankan pH protein agar tidak berubah, aquadest, SDS, APS, dan TEMED. Setelah seluruh bahan dicampur kemudian dituang diatas separating gel yang telah memadat untuk membuat satu rangkaian gel poliakrilamid yang dapat digunakan untuk SDS PAGE. Sisir dipasang untuk mencetak sumuran tempat sampel dimasukkan dalam gel. pH yang digunakan dalam separating gel yaitu 8,8 agar didapatkan protein tetap dalam keadaan muatan negatif (Gupta and Sheperd, 2000). pH stacking gel yang dibuat yaitu 6,8 agar kondisi pH dari stacking gel berada di bawah isoelektrik protein (pH 8) sehingga protein akan tersusun secara berjajar pada bagian bawah dari stacking gel (Wang et al., 2016)
Dalam preparasi sampel digunakan penambahan Reducing Sample Buffer atau RSB dengan perbandingan 1:1 karena RSB ini mampu memutus ikatan disulfida protein sehingga didapatkan protein dalam bentuk linier yang nantinya akan memudahkan separasi protein tersebut dalam gel saat running. Didalam RSB terdapat kandungan 1M Tris-Cl pH 6,8 untuk menjaga kondisi pH dari sampel
protein, gliserol 50% berfungsi untuk menambah berat sampel sehingga mudah turun, SDS 10% berfungsi sebagai agen pereduksi yang memutuskan ikatan disulfida sehingga protein berbentuk linier dan member muatan negatif pada protein, fungsi pembentukan muatan negatif ini untuk memudahkan separasi menuju kutub positif saat dilewatkan arus (Zhu et al., 2015). Kandungan yang lain yaitu terdapat 2-merkaptoethanol yang berfungsi untuk membantu reaksi SDS dalam memecah ikatan disulfida dari protein, dan bromophenol Blue 1% sebagai penanda atau sebagai tracking dye yang memudahkan dalam mengamati pergerakan protein saat running (Wang et al., 2016).
RSB yang digunakan dalam sampel tanaman sedikit berbeda dari sampel non tanaman, yaitu pada RSB untuk tanaman perlu ditambahkan DTT dan EDTA. Penambahan DTT ini untuk memecah ikatan disulfide dengan mendegradasi ikatan alifatik disulfide menjadi rantai polipeptida tunggal. Pada tanaman banyak terdapat jenis metabolit sekunder, sehingga untuk memaksimalkan pemecahan disulfida yang dilakukan oleh SDS dan 2-merkaptoethanol (Gupta and Sheperd, 2000). Setelah penambahan RSB, sampel protein dipanaskan pada suhu 100˚C bertujuan untuk mengoptimalkan pendenaturasian protein.
Running yang dilakukan menggunakan arus 30 mA selama 3-4 jam untuk mendapatkan hasil yang baik karena digunakan arus yang lebih kecil sehingga protein dapat terseparasi dengan baik (Wang et al., 2016). Running dilakukan untuk menseparasi protein berdasarkan berat molekul yang dimilikinya. Running buffer dengan pH 8,3 untuk menjaga kondisi fisiologis dari protein dan gel agar tetap bermuatan negatif karena berada diatas titik isoelektrik. Bagian atas dan bawah gel harus terendam running buffer karena system yang digunakan dalam elektroforesis yaitu wetsystem dan digunakan arus listrik, jika salah satu bagian tidak terendam maka arus listrik tidak dapat mengalir. Setelah running selesai, yang digunakan untuk analisis hanya separating gelsaja sedangkan stacking gel dibuang karena band-band protein hanya terdapat pada separating gel.
Langkah ahir dari SDS-PAGE yaitu staining atau pewarnaan dan destaining atau penghilangan warna. Pewarnaan ini perlu untuk dilakukan untuk membantu dalam pengamatan band protein yang terseparasi. Larutan staining yang
digunakan yaitu CBB R-250 (Coomasie Brilliant Blue), CBB ini sensitif terhadap protein yang memiliki ukuran yang beriksar antara 0,5 hingga 20 mikrogram (Wang et al.,2016). Penggoyangan perlu dilakukan untuk megoptimalkan reaksi staining yang dilakukan oleh CBB. Pencucian dengan aquadest berfungsi untuk membilas dan menghilangkan CBB yang mungkin masih tersisa pada gel. Selanjutnya dilakukan perendaman pada larutan destaining untuk menghilangkan CBB yang tersisa dan memperjelas band protein yang terbentuk serta untuk menghilangkan CBB yang tidak berada pada band protein (Zhu et al.,2015). Band protein yang ada pada gel SDS dapat dilihat setelah proses destaining.
Berdasarkan hasil SDS-PAGE yang sudah dilakukan, terlihat bahwa pada jagung terbentuk pola band protein yang sama antara ulangan J2 dan J2, J2 merupakan sampel yang diambil hasil ekstraksi jagung pada kelompok 2. Sampel J1 yang pertama, terlihat band-band proteinnya namun tipis, hal ini dimungkinkan kurang optimalnya ekstraksi protein yang dilakukan sehingga band yang terbentuk tipis. Band protein yang terbentuk tidak dapat dilihat ukurannya, karena marker yang ikut dirunning hasilnya tidak terlihat. Sampel kedelai yang muncul band proteinnya adalah sampel K1 dan K2. Sama halnya dengan sampel jagung, ukuran band protein yang terbentuk tidak dapat diketahui ukurannya. Pola band protein yang terbentuk antara jagung dan kedelai memiliki perbedaan.
4.2.7 Analisis Aktivitas Enzim Secara Kualitatif dan Kuantitatif
Biasanya enzim selulase secara komersial diproduksi dari fungi Aspergillus niger atau Trichoderma reesei (selanjutnya disebut A. niger dan T. reesei) karena dikenal memiliki produktivitas yang tinggi karena aktivitas di setiap komponen selulasenya juga tinggi. Dalam percobaan kali ini, mikroba yang dipilih sebagai isolat yang akan memproduksi sellulase dan amilase adalah Aspergilus sp.
Degradasi selulosa merupakan kerja sinergis antara endo-β-glukanase, cellobiohydrolase dan β-glukosidase. Umumnya, beberapa mikroorganisme penghasil selulase menghasilkan sedikit cellobiohydrolase dan β-glukosidase sehingga pemutasian perlu dilakukan untuk produktivitasnya.β-glukosidase adalah enzim glukosidase yang memutuskan ikatan β(1->4) glikosida antara 2 glukosa
atau molekul pengganti glukosa yang lain seperti selobiosa. Enzim ini bertindak sebagai katalis dalam proses hidrolisis residu ujung non pereduksi pada β-D-Glukosa, dengan melepaskan unit glukosa. Selulosa adalah komponen utama yang memiliki polimer ikatan β antara molekul glukosa didalamnya, dan enzim ini dibutuhkan oleh organisme tertentu seperti jamur, bakteri, dan rayap untuk bisa mengkonsumsi selulosa.
Berdasarkan hasil kualitatif uji aktivitas enzim diketahui bahwa dengan adanya penambahan Iodine akan terlihat warna ungu sebagai indikasi bahwa didalam media banyak terdapat molekul pati atau starch. Sampel jagung terbukti memiliki kandungan pati atau starch yang tinggi dengan adanya perubahan warna menjadi biru setelah dilakukan penambahan iodine. Pada kedelai belum dapat diketahui adanya aktifitas enzim sellulase maupun amilase karena tidak terjadi perubahan warna ketika ditambahkan dengan iodine.
Analisis kuantitatif menunjukkan bahwa aktivitas enzimatik paling tinggi ditunjukkan dari sampel jagung dengan tingkat aktivitas enzim mencapai 0,361. Pengukuran secara kuantitatif ini dilakukan berdasarkan nilai absorbansi sampel yang sebelumnya telah diberi DNS sebagai reagen pengikat molekul glukosa hasil pemecahan substrat yang diperoleh dari reaksi enzimatik atau aktivitas enzimnya. Baik secara kualitatif maupun kuantitatif, biakan Aspergilus sp. yang ditumbuhkan pada sampel jagung dapat dikatakan memiliki aktivitas enzim yang tinggi yaitu amilase. Tingginya aktivitas pada isolat yang dibiakkan dimedia dengan komponen sampel jagung diasumsikan bahwa jagung memiliki kadar amilum atau pati dan selulosanya juga lebih tinggi dari sampel kedelai.
BAB 5 PENUTUP 5.1 Kesimpulan
Berdasarkan data yang diperoleh, dapat disimpulkan bahwa kadar glukosa, sukrosa, lipid dan protein sampel kedelai menunjukkan nilai konsentrasi lebih tinggi dibandingkan dengan jagung. Sedangkan kadar pati atau starch pada kedelai lebih rendah dibandingkan dengan sampel jagung. Kedelai memiliki kadar glukosa sebesar 45,78 µg/µl, sukrosa 5,3 µg/µl, pati atau starch 10,16 µg/µl, kadar protein sebesar 75,12µg/µl dan kandungan lipid sebesar 9,89 g/100g. Jagung memiliki kadar glukosa sebesar 30,49 µg/µl, sukrosa 3,84 µg/µl, pati atau starch 16,81 µg/µl, kadar protein sebesar 5,88µg/µl dan kandungan lipid yang hanya 3,37 g/100g. Pola protein yang terlihat pada hasil visualisasi SDS-PAGE antara jagung dan kedelai memiliki pola protein yang berbeda, namun ukuran pastinya belum bisa diketahui karena markernya tidak terlihat. Sedangkan pada aktivitas uji enzim, isolat Aspergillus sp. yang ditumbuhkan pada media jagung memiliki nilai aktivitas enzim yang tinggi yaitu 0,361, sedangkan pada media kedelai hanya 0,074 hal ini menunjukkan bahwa aktivitas selulasenya tinggi. Selain itu analisis secara kualitatif juga menunjukkan bahwa aktivitas amilase isolat Aspergillus sp. tinggi karena terbentuk warna biru keunguan ketika ditetesi dengan Iodine.
5.2 Saran
Beberapa hasil pengukuran kadar glukosa dan selulosa yang kurang sesuai jika dibandingkan dengan literatur dimungkinkan karena proses homogenisasi yang tidak maksimal oleh karena itu, sebaiknya perlu diperhatikan proses homogenisasi agar molekul seperti glukosa dan sukrosa terekstraksi secara optimal, selain itu pada uji kualitatif perlu dilakukan pengukuran diameter zona bening dan diameter koloni agar diperoleh kisaran aktivitas enzimnya.
Daftar Pustaka
Cambell N.A., Reece J. B., Urry L. A., Cain M. L., Wasserman S. A.,
MinorskyP.V., and Jackson, R.B. 2012. Biologi, edisi 8, jilid 1. Jakarta: Erlangga
Caunt , Christopher J. , Andrew M. Kidger , and Stephen M. Keyse. 2016. Visualizing and Quantitating the Spatiotemporal Regulation of Ras/ERK Signaling by Dual-Specifi city Mitogen-Activated Protein Phosphatases (MKPs). Protein Tyrosine Phosphatases: Methods and Protocols, Methods in Molecular Biology, vol. 1447, DOI 10.1007/978-1-4939-3746-2_12 Cheirsilp, Benjamas and Salwa Torpee. 2012. Enhanced growth and lipid
production of microalgae under mixotrophic culture condition: Effect of light intensity, glucose concentration and fed-batch cultivation. Bioresource Technology 110: 510–516
Cheng, Y., Haiming Wei , Rui Sun, Zhigang Tian , and Xiaodong Zheng. 2016. Rapid method for protein quantitation by Bradford assay after elimination of the interference of polysorbate 80. Analytical Biochemistry 494 : 37-39 Cole, Marsha R., Gillian Eggleston, Audrey Gilbert and Yoo Jin Chung. 2016.
Development of an analytical method to measure insoluble and soluble starch in sugarcane and sweet sorghum products. Journal of Food Chemistry 190: 50-59
Cruz, Mutya, Miao Wang, Jessica Frisch-Daiello and Xianlin Han. 2016. Improved Butanol–Methanol (BUME) Method by Replacing Acetic Acid for Lipid Extraction of Biological Samples. Journal of Lipids 51:887–896 Datir, Sagar and Snehal Joshi. 2016. The contribution of sucrose metabolism
enzymes to sucrose accumulation in sugarcane (Saccharum officinarum L.) genotypes. Indian Jounal of Plant Physiology 21(1):76–82
Eggers, Lars F. and Dominik Schwudke. 2016. Lipid Extraction: Basics of the Methyl-tert-Butyl Ether Extraction. Encyclopedia of Lipidomics DOI 10.1007/978-94-007-7864-1_96-1
Evangelista, CM. and M.A.B. Regitano-D'Arce. 2009. Spectrophotometric analysis of the lipid fraction of microwave heated and soaked soybeans. Grasas y Aceites Vol. 50. Fase. 1: 22-25
Fery, S. Erwin, S. dan Trimarsanto, H. 2010. Analisis Perbandingan Struktur ProteinFOXP2 Normal dengan Mutan R553H. Undergraduate thesis. Facultyof Biotechnology Atma Jaya Catholic University of Indonesia
Golunski,Simone Maria, Luisa Sala, Marceli Fernandes Silva, Rogério Marcos Dallago, Jéssica Mulinari, Altemir José Mossi, Adriano Brandelli, Susana
Juliano Kalil, Marco Di Luccio, and Helen Treichel. 2016. Interference of salts used on aqueous two-phase systems on thequantification of total proteins. International Journal of Biological Macromolecules 83: 30–33 Goncavales, C., Rosa Maria R.J., Nelma Gomes, Jose A. Teixeira and Isabel Belo.
2010. Adaptation of dinitrosalicylic acid method to microtiter plates. Journal ofAnalytical Method. DOI: 10.1039/c0ay00525h
Gondim, C. de Souza, Roberto C. S. de Souza, Maurina de Paula P. E Palhares, Roberto G. J., and Scheila V. C. de Souza. 2015. Performance improvement and single laboratory validation of classical qualitative methods for the detection of adulterants in milk: starch, chloride and sucrose. Journal of Analytical Method. DOI 10.1039/c5ay01822f
Gupta, R.B. and K.W. Shepherd. 2000. Two-step one-dimensional SDS-PAGE analysis of LMW subunits of glutelin. Theor Appl Genetic 80: 65-74
Jeffries, T. W. (1994). Biodegradation of Lignin and Hemicelluloses, 233–277. Liu, Weiguo., Yuchuan Deng, Sajad Hussain, Junlin Zou, Jin Yuan, Ling Luo,
Chengyu Yang, Xiaoqing Yuan, and Wenyu Yang. 2016. Relationship between cellulose accumulation and lodging resistance in the stem of relay intercropped soybean (Glycine max (L.) Merr.). Journal of Field Crops Research 196: 261-267
Merriman, L.A., C. L. Walk, C. M. Parsons, and H. H. Stein. 2016. Effects of tallow, choice white grease, palm oil, corn oil, or soybean oil on apparent total tract digestibility of minerals in diets fed to growing pigs. Journal of
Animal Science.94:4231–4238. doi:10.2527/jas2016-0682
Nakamura, Sumiko., Junji Katsura, Kiyoko Kato, and Kenichi Ohtsubo. 2015. Development of formulae for estimating amylose content and resistant starch content based on the pasting properties measured by RVA of Japonica polished rice and starch. Journal of Bioscience, Biotechnology, and
Biochemistry Vol. 80 No. 2, 329-340
Olennikov, D.N and L.M. Tankhaeva. 2011. A Quantitative Assay for Total Fructans in Burdock (Arctium spp.) Roots. Russian Journal of Bioorganic Chemistry Vol. 37, No. 7, pp. 893–898
Madhu, Sheri., Hayden A. Evans, Vicky V. T. Doan-Nguyen, John G. Labram, Guang Wu, Michael L. Chabinyc, Ram Seshadri, and Fred Wudl. 2016. Infinite Polyiodide Chains in the Pyrroloperylene–Iodine Complex:Insights into the Starch–Iodine and Perylene–Iodine Complexes. Angew Chem 128, 1 – 5. http://dx.doi.org/10.1002/anie.201601585
Moat, A. G., Foster, J. W., & Spector, M. P. 2002. Microbial Physiology (Fourth.). A John Wiley & Sons, INC.
Nie, Jinfang., Tom Brown and Yun Zhang. 2013. New two dimensional liquid-phase colorimetric assay based on old iodine-starch complexation for simple, low-cost, portable, naked-eye detection and quantification of analytes. DOI: 10.1039/x0xx00000x.
Pérez, J. Muñoz-Dorado, J. de la Rubia, T & Martínez, J. 2002. Biodegradation and Biological Treatments of Cellulose, Hemicellulose and Lignin: An Overview. International Microbiology : The Official Journal of the Spanish Society for Microbiology, 5(2) : 53–63.
Sigismund, Sara and Simona Polo. 2016. Strategies to Detect Endogenous Ubiquitination of a Target Mammalian Protein. Proteostasis: Methods and Protocols, Methods in Molecular Biology, vol. 1449, DOI 10.1007/978-1-4939-3756-1_6
Teixeira, Ricardo S.S., Ayla Sant’Ana da Silva, Viridiana Santana F.L., and Elba Pinto da Silva Bon. 2012. Amino acids interference on the quantification of reducing sugars by the 3,5-dinitrosalicylic acid assay mislead carbohydrase activity. Carbohydrate Research 363 : 33–37
Torres, Sebastian., Jorge E. Sayago, Roxana M. Ordones and Maria Ines Isla. 2011. A colorimetric method to quantify endo-polygalacturonase activity. Enzyme and Microbial Technology 48: 123–128
Verma, A. K., S. K. Upadhyay, P. C. Verma, S. Solomon and S. B. Singh. 2010. Functional analysis of sucrose phosphate synthase (SPS) and sucrose synthase (SS) in sugarcane (Saccharum) cultivars. Journal of Plant Biology.doi:10.1111/j.1438-8677.2010.00379.x
Wang, Yan, Qing-Yun Zheng, Zhen-Ru Guo, Yuan-Yuan Qiao, Yong-Li Cao, Cai-Hong Liu, Bin-Jie Xu, Zheng-YuanWei, Lu-Juan Zong, Chen Chen, Ya-Nan Han, Qing Chen, Xi Gong, Shi-Yu Hua , You-Liang Zheng, Peng-Fei Qi, Yu-Ming Wei, Xiu-Jin Lan, and Ji-RuiWang. 2016. A missense mutation affects the mobility of high molecular weight glutenin Dy10 subunit in SDS-PAGE. Agri Gene 2 : 1–4
Wang, H., Zesheng Zhang, Liya Liang, Shengping Wen, Chunyan Liu, and Xiaojun Xu. 2010. A comparative study of high-performance liquid chromatography and colorimetric method for inulin determination. Europe Food Research and Technology 230:701–706. DOI 10.1007/s00217-009-1208-8
Zhu, Liang., Jiaheng Zhou, Meile Lv, Haitian Yu, Hang Zhao, and Xiangyang Xu. 2015. Specific component comparison of extracellular polymeric substances
(EPS) in flocs and granular sludge using EEM and SDS-PAGE. Chemosphere 121 : 26–32
LAMPIRAN 1. Kurva Standar Glukosa
0 0.2 0.4 0.6 0.8 1 1.2 0 20 40 60 80 f(x) = 66.18x - 3.59 R² = 0.99 conc Linear (conc) abs cons 0 0 0,247 10 0,445 25 0,621 35 0,821 50 0,987 65
2. Kurva Standar Sukrosa
abs 0 0.2 0.4 0.6 0.8 1 1.2 0 20 40 60 80 100 120 f(x) = 91.09x + 1.93 R² = 0.99 Linear () con c 0 0 0,045 5 0,15 15 0,304 30 0,503 50 0,677 65 0,757 75 1,127 100
abs 0 0.5 1 1.5 2 0 10 20 30 40 50 f(x) = 23.11x - 0.47 R² = 0.98 conc Linear (conc) con c 0 0 0,21 5 0,43 7 10 1,03 1 20 1,66 9 40
4. Kuva Standar Protein
abs 0 0.05 0.1 0.15 0.2 0.25 0.3 0 5 10 15 20 25 30 f(x) = 89.69x - 0.66 R² = 0.93 con Linear (con) con 0,001 0 0,053 5 0,159 10 0,246 20 0,247 25