Efek ekstrak Metanol daun kosambi (Schleichera oleosa) dalam menghambat Fibrosis Hepar pada tikus putih (Rattus novergicus) yang diinduksi Carbon tetrachloride
Teks penuh
(2) EFEK EKSTRAK METANOL DAUN KOSAMBI (Schleichera oleosa) DALAM MENGHAMBAT FIBROSIS HEPAR PADA TIKUS PUTIH (Rattus novergicus) YANG DIINDUKSI Carbon tetrachloride SKRIPSI. Diajukan Kepada: Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Maulana Malik Ibrahim Malang Untuk Memenuhi Salah Satu Persyaratan Dalam Memperoleh Gelar Sarjana Kedokteran (S.Ked). Oleh:. VICKI ANDREAN NIM. 16910004. PROGRAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS ISLAM NEGERI MAULANA MALIK IBRAHIM MALANG 2020. i.
(3) EFEK EKSTRAK METANOL DAUN KOSAMBI (Schleichera oleosa) DALAM MENGHAMBAT FIBROSIS HEPAR PADA TIKUS PUTIH (Rattus novergicus) YANG DIINDUKSI Carbon tetrachloride. SKRIPSI. Oleh:. VICKI ANDREAN NIM. 16910004. Telah Diperiksa dan Disetujui untuk Diuji: Tanggal: 18 Mei 2020. Pembimbing I,. Pembimbing II,. dr. Amalia Tri Utami, M.Biomed NIP. 19910411 20170101 2 112. dr. M. Rizal Novianto, MHPE NIP. 198511022019031006. Mengetahui, Ketua Program Studi Pendidikan Dokter. dr. Nurlaili Susanti, M.Biomed NIP. 19831024 201101 2 007. ii.
(4) EFEK EKSTRAK METANOL DAUN KOSAMBI (Schleichera oleosa) DALAM MENGHAMBAT FIBROSIS HEPAR PADA TIKUS PUTIH (Rattus novergicus) YANG DIINDUKSI Carbon tetrachloride. SKRIPSI. Oleh:. VICKI ANDREAN NIM. 16910004 Telah Dipertahankan di Depan Dewan Penguji Skripsi dan Dinyatakan Diterima Sebagai Salah Satu Persyaratan Untuk Memperoleh Gelar Sarjana Kedokteran (S.Ked) Tanggal: 18 Mei 2020 Penguji Utama. drg. Anik Listiyana, M.Biomed NIP. 198008052009122001 Ketua Penguji dr. M. Rizal Novianto, MHPE NIP. 198511022019031006 Sekretaris Penguji dr. Amalia Tri Utami, M.Biomed NIP. 19910411 20170101 2 112 Penguji Integrasi Islam Nur Toifah, M.Pd NIP. 19810915201802012216 Mengesahkan, Ketua Program Studi Pendidikan Dokter. dr. Nurlaili Susanti, M.Biomed NIP. 19831024 201101 2 007. iii.
(5) PERNYATAAN KEASLIAN TULISAN Saya yang bertanda tangan di bawah ini: Nama. : Vicki Andrean. NIM. : 16910004. Program Studi. : Pendidikan Dokter. Fakultas. : Kedokteran dan Ilmu Kesehatan. menyatakan dengan sebenarnya bahwa skripsi yang saya tulis ini benar-benar merupakan hasil karya sendiri, bukan merupakan pengambilalihan data, tulisan atau pikiran orang lain yang saya akui sebagai hasil tulisan atau pikiran saya sendiri, kecuali dengan mencantumkan sumber cuplikan pada daftar pustaka. Apabila di kemudian hari terbukti atau dapat dibuktikan skripsi ini hasil jiplakan, maka saya bersedia menerima sanksi atas perbuatan tersebut. Malang, 15 Mei 2020 Yang membuat pernyataan,. Vicki Andrean NIM. 16910004. iv.
(6) KATA PENGANTAR Assalamu’alaikum Wr. Wb. Syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT yang telah melimpahkan Rahmat dan Hidayah-Nya, sehingga penulis dapat menyelesaikan studi di Program Studi Pendidikan Dokter Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Maulana Malik Ibrahim Malang sekaligus menyelesaikan skripsi ini dengan baik. Selanjutnya penulis mengucapkan terima kasih kepada semua pihak yang telah membantu hingga terselesainya skripsi ini. Ucapan terima kasih ini penulis sampaikan kepada: 1. Prof. Dr. H. Abd. Haris, M.Ag, selaku rektor UIN Maulana Malik Ibrahim Malang, yang telah banyak memberikan pengetahuan dan pengalaman yang berharga. 2. Prof. Dr. dr. Bambang Pardjianto, Sp.B., Sp.BP-RE (K) dan dilanjutkan oleh Prof. Dr. dr. Yuyun Yueniwati Prabowowati Wadjib, M.Kes, Sp.Rad (K), selaku Dekan FKIK UIN Malang. 3. dr. Nurlaili Susanti, M.Biomed, selaku ketua Program Studi Pendidikan Dokter FKIK UIN Maulana Malik Ibrahim Malang. 4. dr. Amalia Tri Utami, M.Biomed selaku dosen pembimbing skripsi I yang telah banyak memberikan pengarahan dan pengalaman selama mengerjakan skripsi. 5. dr. Tias Pramesti Griana, M.Biomed dan dilanjutkan oleh dr. M. Rizal Novianto, MHPE selaku dosen pembimbing skripsi II yang telah banyak memberikan pengarahan dan pengalaman selama mengerjakan sk 6. drg. Anik Listiyana, M.Biomed selaku penguji utama yang telah memberikan masukan dan arahan kepada penulis. 7. Nur Toifah, S.Pd.I., M.Pd. selaku penguji integrasi yang telah memberikan saran kepada penulis. 8. Ayahanda dan Ibunda tercinta yang selalu senantiasa memberikan doa, restu dan semangat kepada penulis dalam menuntut ilmu sampai terselesainya skripsi ini. v.
(7) 9. Segenap sivitas akademika Program Studi Pendidikan Dokter, terutama seluruh dosen, terima kasih atas segala ilmu dan bimbingannya. 10. Wawan Singgih Prasetyo sebagai teman kontrakan dan sahabat yang selalu menemani penulis. 11. M. Reza Riandinata dan Aathifah selaku teman satu penelitian yang selalu ada dalam suka dan duka selama melakukan penelitian. 12. Fahrurrozi Hari P., Firnanda Salza Asmara, Basyar Adnani, Rithio Chandraca Islamy, selaku teman yang menemani penulis sampai penelitian berakhir. 13. Segenap teman-teman Neonatus 2016 yang selalu menjadi teman yang selalu memberikan canda dan tawa dari awal perkuliahan hingga penulis menyelesaikan skripsi. 14. Semua pihak yang ikut membantu dalam menyelesaikan skripsi yang tidak bisa disebutkan satu persatu. Penulis menyadari bahwa dalam penyusunan skripsi ini masih terdapat kekurangan dan penulis berharap semoga skripsi ini bisa memberikan manfaat kepada para pembaca khususnya bagi penulis secara pribadi. Amin Ya Rabbal Alamin Wassalamu’alaikum Wr. Wb. Malang, 15 Mei 2020. Penulis. vi.
(8) DAFTAR ISI HALAMAN JUDUL ................................................................................... i HALAMAN PERSETUJUAN.................................................................... ii HALAMAN PENGESAHAN .................................................................... iii PERNYATAAN KEASLIAN TULISAN .................................................. iv KATA PENGANTAR ............................................................................... v DAFTAR ISI .............................................................................................. vii DAFTAR TABEL ...................................................................................... xi DAFTAR GAMBAR ................................................................................. xii DAFTAR LAMPIRAN .............................................................................. xiv DAFTAR LAMBANG, SIMBOL, DAN SINGKATAN ........................... xv ABSTRAK ................................................................................................. xviii ABSTRACT ............................................................................................... xix BAB I PENDAHULUAN ........................................................................... 1 1.1. Latar Belakang ................................................................................... 1 1.2. Rumusan Masalah .............................................................................. 7 1.3. Tujuan Penelitian ............................................................................... 7 1.4. Manfaat Penelitian .............................................................................. 7 BAB II TINJAUAN PUSTAKA ................................................................ 8 2.1. Fibrosis Hepar .................................................................................... 8 2.1.1. Definisi Fibrosis Hepar ...................................................................... 8 2.1.2. Etiologi Fibrosis Hepar ...................................................................... 8 2.1.3. Mekanisme Terjadinya Fibrosis Hepar ............................................... 14 2.1.4. Hepatic Stellate Cell (HSC) ............................................................... 17 2.1.5. Portal Fibroblas (PF) .......................................................................... 18 2.1.6. Peran Makrofag Dalam Fibrosis Hepar .............................................. 18 2.1.7. Peran TGF-β Dalam Fibrosis Hepar ................................................... 20 2.2. Karbon tetraklorida (CCl4) ................................................................. 23 2.2.1. Biotransformasi CCl4 ........................................................................ 23 2.2.2. Patogenesa Kerusakan Jaringan Hepar Akibat Pemberian CCl4 ......... 24 2.2.3. Histopatologi Hepar Akibat CCl4 ...................................................... 26. vii.
(9) 2.2.4. Penilaian Skor Fibrosis Hepar ............................................................ 30 2.3. Kosambi (Schleichera oleosa) ............................................................. 33 2.3.1. Klasifikasi Kosambi ........................................................................... 33 2.3.2. Tempat Tumbuh Kosambi (Schleichera oleosa) ................................. 33 2.3.3. Ciri-Ciri Tanaman Kosambi (Schleichera oleosa) ............................... 34 2.3.4. Manfaat Bagian Tanaman Kosambi (Schleichera oleosa) .................... 37 2.3.5. Manfaat Terapeutik Dari Kosambi (Schleichera oleosa) ..................... 39 2.3.6. Metabolit sekunder Yang Terkandung Dalam Kosambi ...................... 41 2.4. Quercetin ............................................................................................ 51 2.4.1. Quercetin Sebagai Hepatoprotektif ..................................................... 51 2.4.2. Mekanisme Quercetin Dalam Mencegah Fibrosis Hepar ..................... 52 2.5. Hewan Coba Model Fibrosis Hepar .................................................... 55 2.5.1. Beberapa Zat Yang Dapat Digunakan Untuk Pembuatan Hewan Coba Model Fibrosis Hepar ................................................................................... 56 2.5.2. Pembuatan Hewan Coba Model Fibrosis Hepar ................................. 57 BAB III KERANGKA KONSEP DAN HIPOTESIS ............................... 59 3.1. Kerangka Konsep Penelitian ............................................................... 59 3.2. Hipotesis Penelitian ............................................................................ 62 BAB IV METODE PENELITIAN ............................................................ 63 4.1. Desain Penelitian ................................................................................ 63 4.2. Tempat dan Waktu Penelitian ............................................................. 63 4.2.1. Tempat Penelitian .............................................................................. 63 4.2.2. Waktu Penelitian ................................................................................ 64 4.3. Populasi Penelitian ............................................................................. 64 4.4. Sampel Penelitian ............................................................................... 64 4.4.1. Kriteria Inklusi ................................................................................... 66 4.4.2. Kriteria Eksklusi ................................................................................ 66 4.5. Alat dan Bahan Penelitian .................................................................. 66 4.5.1. Alat Penelitian ................................................................................... 66 4.5.2. Bahan Penelitian ................................................................................ 68 4.6. Identifikasi Variabel dan Definisi Operasional .................................... 69 4.6.1. Identifikasi Variabel .......................................................................... 69. viii.
(10) 4.6.2. Definisi Operasional .......................................................................... 69 4.7. Prosedur Penelitian ............................................................................. 70 4.7.1. Persiapan Hewan Coba ...................................................................... 70 4.7.2. Pembuatan Ekstrak Daun Kosambi .................................................... 70 4.7.3. Pembuatan Larutan Ekstrak Daun Kosambi Untuk Sonde .................. 71 4.7.4. Pembuatan Hewan Coba Model Fibrosis Hepar Dengan Metode Injeksi CCl4 Secara Intraperitoneal .................................................... 74 4.7.5. Pengambilan Organ Hepar ................................................................. 75 4.7.6. Pembuatan Preparat Histopatologi ..................................................... 75 4.7.7. Pemeriksaan Histopatologi ................................................................. 78 4.8. Alur Penelitian ................................................................................... 79 4.9. Analisis Data ........................................................................................ 80 4.9.1. Cara Skoring ...................................................................................... 80 4.9.2. Analisis Data di SPSS ........................................................................ 81 4.9.3. Analisa Gambaran Histopatologi Secara Deskriptif ............................ 82 BAB V HASIL DAN PEMBAHASAN ...................................................... 83 5.1. Hasil ..................................................................................................... 83 5.1.1. Berat Tikus Selama Perlakuan ............................................................ 83 5.1.2. Berat Hepar Tikus Setelah Perlakuan ................................................. 84 5.1.3. Gambaran Hepar Makros ................................................................... 84 5.1.4. Gambaran Histopatologi Fibrosis Hepar ............................................. 86 5.1.5. Gambaran Histopatologi dan Persentase Nekrosis Hepar .................... 90 5.1.6. Hasil Analisis Data SPSS ................................................................... 94 5.2. Pembahasan .......................................................................................... 96 5.2.1. Berat Tikus Selama Perlakuan ............................................................ 96 5.2.2. Berat Hepar Tikus Setelah Perlakuan ................................................. 99 5.2.3. Gambaran Hepar Makros ................................................................... 101 5.2.4. Gambaran Histopatologi Fibrosis Hepar ............................................. 102 5.2.5. Gambaran Histopatlogi dan Persentase Nekrosis Hepar ...................... 107 5.2.6. Pembahasan Analisis Data SPSS ........................................................ 110 5.2.7. Pembahasan Berbasis Integrasi Islam ................................................. 114 BAB VI KESIMPULAN DAN SARAN .................................................... 119. ix.
(11) 6.1. Kesimpulan .......................................................................................... 119 6.2. Saran .................................................................................................... 119 DAFTAR PUSTAKA ................................................................................ 120 LAMPIRAN ............................................................................................... 140. x.
(12) DAFTAR TABEL Tabel 2.1. Perbandingan Skor Ishak Dengan METAVIR.............................. 32 Tabel 2.2. Hasil Uji Fitokimia Ekstrak Daun Kosambi ................................ 42 Tabel 5.1. Berat Hepar Tikus Saat Dibedah vs Berat Hepar Seharusnya ...... 84 Tabel 5.2. Skor Fibrosis METAVIR ............................................................ 89 Tabel 5.3. Rerata Persentase Nekrosis Hepar (Mean±SD) ........................... 94 Tabel 5.4. Hasil Uji Post Hoc Mann-Whitney Skor Fibrosis METAVIR ...... 95 Tabel 5.5. Hasil Uji Post Hoc Bonferroni Persentase Nekrosis Hepar .......... 96. xi.
(13) DAFTAR GAMBAR Gambar 2.1. Skema Patogenesis NASH Menyebabkan Fibrosis ................. 10 Gambar 2.2. Patogenesis Dari Fibrosis Karena Alcohol Liver Disease (ALD) ........................................................................ 12 Gambar 2.3. Mekanisme Seluler Fibrosis Hepar ......................................... 16 Gambar 2.4. Aktivasi Hepatic Stellate Cell (HSC) .......................................... 17 Gambar 2.5. Peran TGF-β dalam mengaktifkan HSC dan makrofag ........... 22 Gambar 2.6. Steatosis Hepatosit .................................................................. 29 Gambar 2.7. Nekrosis Hepatosit .................................................................. 29 Gambar 2.8. Jaringan Fibrosa Pada Hepar ................................................... 30 Gambar 2.9. Staging Fibrosis Hepar ............................................................ 30 Gambar 2.10. Sistem Skor METAVIR ........................................................ 31 Gambar 2.11. Pohon Kosambi..................................................................... 34 Gambar 2.12. Batang Kosambi.................................................................... 35 Gambar 2.13. Daun Kosambi ...................................................................... 35 Gambar 2.14. (B) Bunga Kosambi, (C) Bunga jantan Dengan Kepala Sari .. 36 Gambar 2.15. (A) Buah Kosambi, (B) Biji Kosambi ................................... 37 Gambar 2.16. Struktur Kimia Alkaloid........................................................ 44 Gambar 2.17. Pembagian Flavonoid............................................................ 46 Gambar 2.18. Struktur Kimia Flavonoid (Alkaloid Hisperidin, Quercetin, Rutin) ................................................................................... 46 Gambar 2.19. Struktur Kimia Terpenoid (Thymol, Geranial, Retinol) ......... 47 Gambar 2.20. Struktur Kimia Steroid (Asam Cholic, Aldosterone, Yamogenin) .......................................................................... 49 Gambar 2.21. Struktur Kimia Asam Tanin .................................................. 51 Gambar 2.22. Mekanisme Quercetin ........................................................... 55 Gambar 3.1. Kerangka konsep .................................................................... 59 Gambar 4.1. Cara Pemilihan Lapang Pandang Preparat Hepar..................... 78 Gambar 4.2. Alur Penelitian ....................................................................... 79 Gambar 4.3. Pembagian zona dalam lobulus hepar ...................................... 80 Gambar 5.1. Grafik Berat Badan Tikus Selama Perlakuan .......................... 83. xii.
(14) Gambar 5.2. Gambar Hepar Tikus Setelah Dibedah .................................... 85 Gambar 5.3. Gambar Triad Portal Pada Kelompok (K-) ............................. 86 Gambar 5.4. Gambar Triad Portal Pada Kelompok (K+) ............................ 87 Gambar 5.5. Gambar Triad Portal Pada Kelompok P1 ................................ 87 Gambar 5.6. Gambar Triad Portal Pada Kelompok P2 ................................ 88 Gambar 5.7. Gambar Triad Portal Pada Kelompok P3 ................................ 89 Gambar 5.8. Skor Fibrosis METAVIR ....................................................... 90 Gambar 5.9. Gambar Hepatosit Pada Kelompok (K-) ................................. 91 Gambar 5.10. Gambar Hepatosit Pada Kelompok (K+) .............................. 91 Gambar 5.11. Gambar Hepatosit Pada Kelompok P1 .................................. 92 Gambar 5.12. Gambar Hepatosit Pada Kelompok P2 .................................. 92 Gambar 5.13. Gambar Hepatosit Pada Kelompok P3 .................................. 93 Gambar 5.14. Persentase Nekrosis Hepar ................................................... 94. xiii.
(15) DAFTAR LAMPIRAN Lampiran 1. Keterangan Lolos Uji Etik ...................................................... 140 Lampiran 2. Surat Determinasi Daun Kosambi .......................................... 141 Lampiran 3. Hasil Uji Fitokimia Daun Kosambi (Schleichera oleosa) ........ 142 Lampiran 4. Berat Badan Tikus Selama Perlakuan ..................................... 143 Lampiran 5. Berat Hepar Tikus .................................................................. 145 Lampiran 6. Skoring METAVIR Fibrosis Hepar ........................................ 146 Lampiran 7. Persentase Nekrosis Hepar ..................................................... 148 Lampiran 7.1. Contoh Perhitungan Sel Nekrosis Menggunakan Imagej ..... 148 Lampiran 7.2. Persentase Nekrosis Hepar Kelompok (K-) ......................... 148 Lampiran 7.3. Persentase Nekrosis Hepar Kelompok (K+) ......................... 150 Lampiran 7.4. Persentase Nekrosis Hepar Kelompok P1 ............................. 151 Lampiran 7.5. Persentase Nekrosis Hepar Kelompok P2 ............................ 152 Lampiran 7.6. Persentase Nekrosis Hepar Kelompok P3 ............................ 153 Lampiran 8. Perhitungan Statistik Skor Fibrosis METAVIR ...................... 155 Lampiran 9. Perhitungan Statistik Persentase Nekrosis Hepar .................... 162 Lampiran 10. Foto Kegiatan Penelitian ...................................................... 164 Lampiran 10.1. Pembuatan Ekstrak Daun Kosambi .................................... 164 Lampiran 10.2. Pembuatan Larutan CCl4 .................................................. 165 Lampiran 10.3. Pembuatan Stok Larutan Sonde ......................................... 166 Lampiran 10.4. Kandang Tikus .................................................................. 167 Lampiran 10.5 Injeksi CCl4 ....................................................................... 167 Lampiran 10.6. Proses Menyonde Tikus .................................................... 168 Lampiran 10.7. Pembedahan Tikus Dan Pengambilan Organ ..................... 168. xiv.
(16) DAFTAR LAMBANG, SIMBOL, DAN SINGKATAN SINGKATAN 5-HT. : 5-Hydroxy Tryptamine. AB. : Apoptotic Bodies. aHSCs. : active HSC. AIH. : Autoimune Liver disease. AILD. : Autoimune Liver Disease. ALD. : Alcoholic Liver Disease. ANOVA. : Analysis of Variance. aPFs. : Activated Portal Fibroblast. AST. : aspartate aminotransferase. ATP. : Adenosine Triphosphate. CCl3. : Trichloromethyl. CCl3O2. : Trichloromethyldioxy. CCl4. : Carbon tetrachloride. CFC. : Chlorofluorocarbon. CO. : Carbon Monoxyde. COX. : Cyclooxygenase. CYP450. : Cytochrome P450. DAMPs. : Damage Associated Molecular Patterns. DMN. : Dimethylnitrosamine. DNA. : Deoxyribonucleic Adcid. DPPH. : 2,2-difenil-1-pikrillhidrazil. ECM. : Extracellular Matrix. EMT. : Epithelial Mesenchymal Transition. FA. : Fatty Acid. FFA. : Free Fatty Acid. FGFR4. : Fibrogenic Growth Faktor Receptor 4. HAI. : Histological Activity Index. HBV. : Hepatitis Virus B. HBV-Tg. : HBV-Transgenik. xv.
(17) HBx. : Hepatitis B X protein. HCC. : Hepatocellular Carcinoma. HCV. : Hepatitis C Virus. HO-1. : Heme Oxygenase-1. HSC. : Hepatic Stellate Cells. IL -10. : Interleukin-10. IL-1. : Interleukin-1. IL-12. : Interleukin-12. IL-1β. : Interleukin-1β. IL-4. : Interleukin-4. IL-6. : Interleukin-6. IL-8. : Interleukin-8. KC. : Kupffer Cell. LC3. : Light Chain 3. LDL. : Low Density Lipoprotein. LPS. : Lipopolisakarida. MCP-1. : Monocyte Chemoattractant Protein-1. MIP-1. : Macrophage Inflammatory Protein-1. MMP-13. : Matrix Metalloproteinase-13. MMP-2. : matrix metalloproteinase-2. MMPs. : Matrix Metalloproteinases. NADPH. : Nicotinamide Adenine Dinucleotide Phosphate. NAFLD. : Non Alcoholic Fatty Liver Disease. NASH. : Nonalcoholic Steatohepatitis. NKT. : Natural Killer T. NO. : Nitric Oxide. Nrf2. : Nuclear factor E2-related factor-2. NS3. : HSV nonstructural protein 3. NSAID. : Nonsteroidal Anti-Inflammatory Drug. P62. : Protein 62. PAF. : Platelet Activating Factor. PAMPs. : Pathogen Associated Molecular Patterns. xvi.
(18) PBC. : Primary Biliary Cholangitis. PDGF. : Platelet Derived Growth Factor. PF. : Portal Fibroblast. PGE2. : Prostaglandin E2. PI3K. : Phosphoinositide 3 Kinase. PSC. : Primary Slerosing Cholangitis. PUFA. : Poly Unsaturated Fatty Acid. PVR. : Prolifetarive Vitreoretinophaty. qHSCs. : Quiescent HSCs. ROS. : Reactive Oxygen Species. TAA. : Tiocetamide. TGF-β. : Transforming Growth Factor-β. TGF-β1. : Transforming Growth Factor-β1. TGF-βRI. : Transforming Growth Factor-β Reseptor I. TGF-βRII. : Transforming Growth Factor-β Reseptor II. TIMP-1. : Tissue Inhibitor of Metalloproteinase-1. TIMPs. : Tissue Inhibitor of Metalloproteinase. TLR-4. : Toll-Like Receptor-4. TNF. : Tumor Necrosis Factor. TNF-α. : Tumor Necrosis Faktor-α. TβRI. : TGF-β Receptor I. TβRII. : TGF-β Receptor II. α-SMA. : α-Smooth Muscle Actin. LAMBANG α. : Alpha. β. : Beta. xvii.
(19) ABSTRAK Andrean, Vicki. 2020. EFEK EKSTRAK METANOL DAUN KOSAMBI (Schleichera oleosa) DALAM MENGHAMBAT FIBROSIS HEPAR PADA TIKUS PUTIH (Rattus novergicus) YANG DIINDUKSI Carbon tetrachloride. Skripsi. Program Studi Pendidikan Dokter Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Maulana Malik Ibrahim Malang. Pembimbing: (I) dr. Amalia Tri Utami, M.Biomed (II) dr. Tias Pramesti G, M.Biomed dan dr. M. Rizal Novianto, MHPE Kata Kunci: Fibrosis Hepar, Kosambi (Schleichera oleosa), Tikus, CCl4 Fibrosis hepar adalah keadaan patologis dari penyakit hepar kronik yang ditandai dengan terbentuknya jaringan parut pada parenkim hepar sebagai respon dari penyembuhan luka akibat jejas yang berlangsung kronik. Fibrosis hepar ditandai dengan adanya akumulasi Extracellular Matrix (ECM). Sampai sekarang masih belum tersedia obat yang dipakai secara luas sebagai obat anti fibrotik yang digunakan oleh manusia. Penelitian ini bertujuan untuk membuktikan bahwa pemberian ekstrak daun kosambi (Schleichera oleosa) dapat menghambat progresifitas fibrosis hepar dalam pengamatan histopatologi. Desain penelitian merupakan penelitian eksperimental post test only control group dengan menggunakan 25 ekor tikus Rattus novergicus jantan yang dibagi menjadi 5 kelompok perlakuan, yaitu kelompok kontrol negatif (K-) tidak diberi perlakuan, kelompok kontrol positif (K+) diberikan injeksi CCl4 intraperitoneal dosis 0,5 µl/grBB, dan kelompok P1, P2 dan P3 yang diinjeksi CCl4 intraperitoneal dosis 0,5 µl/grBB dan masing-masing diberikan ekstrak daun kosambi 200 mg/kgBB, 400 mg/kgBB, dan 600 mg/kgBB. Penelitian ini dilakukan selama 6 minggu dengan injeksi CCl4 secara intraperitoneal 2 kali seminggu dengan dosis 0,5 µl/grBB. Setelah perlakuan, tikus di terminasi, organ hepar diambil dan diproses untuk pembuatan preparat histopatologi. Parameter yang diperiksa yaitu persentase nekrosis hepar dan skor fibrosis METAVIR. Analisis data menggunakan uji one-way ANOVA yang dilanjutkan dengan analisis Post hoc Bonferroni. Hasil penelitian one-way ANOVA persentase jumlah nekrosis terdapat perbedaan signifikan (p<0,05). Uji post hoc Bonferroni persentase jumlah nekrosis hepar menunjukkan perbedaan signifikan antara kelompok (K+) dengan kelompok (K-), P2, dan P3 (p<0,05) tetapi tidak terdapat perbedaan signifikan antara kelompok (K+) dengan kelompok P1 (p>0,05). Simpulan dari penelitian ini adalah pemberian ekstrak daun kosambi (Schleichera oleosa) dosis 400 dan 600 mg/kgBB dapat menghambat progresifitas fibrosis hepar dan menurunkan kejadian nekrosis sel-sel hepar.. xviii.
(20) ABSTRACT Andrean, Vicki. 2020. EFFECT OF METHANOLIC KOSAMBI (Schleichera oleosa) LEAF EXTRACT INHIBIT LIVER FIBROSIS IN WHITE RAT (Rattus novergicus) INDUCED Carbon tetrachloride. Thesis. Medical Departement, Medical and Health Sciences Faculty, The Islamic State University Maulana Malik Ibrahim of Malang. Advisor: (I) dr. Amalia Tri Utami, M.Biomed (II) dr. Tias Pramesti G, M.Biomed and dr. M. Rizal Novianto, MHPE Keywords: Liver Fibrosis, Kosambi (Schleichera oleosa), Rat, CCl4 Liver fibrosis is a pathological condition of chronic liver disease characterized by the formation of scar tissue in the liver parenchyma in response to wound healing due to chronic lesions. Liver fibrosis is characterized by the accumulation of Extracellular Matrix (ECM). Thus far, there is still no drug widely used as anti fibrotic drug used by human. This study aims to prove that administration of kosambi (Schleichera oleosa) leaf extract can inhibit the progression of liver fibrosis in histopathological observation. The study design was an experimental post test only control group use 25 male rat (Rattus novergicus) which divided into 5 groups, negative control group (K-) were not treated, positive control group (K+) was given intraperitoneal injection CCl4 dose 0,5 µl/grb.w., and P1, P2, P3 group injected with CCl4 intraperitoneal dose 0,5 µl/grb.w. and each given a 200 mg/kgb.w., 400 mg/kgb.w., and 600 mg/kgb.w. kosambi leaf extract. This study was conducted for 6 weeks with intraperitoneal injection of CCl4 twice a week at a dose of 0,5 µl/grb.w.. After treatment, the rats were terminated, the liver was taken and processed for histopathology slide. The parameters examined were the percentage of liver necrosis and fibrosis METAVIR score. Data analysis used one-way ANOVA test followed by Bonferroni Post hoc test. The results of one-way ANOVA showed that there was a significant difference in the percentage of necrosis (p<0,05). Bonferroni Post hoc test percentage of liver necrosis showed significant differences between (K+) group with (K-), P2, and P3 groups (p<0,05), but there were no significat differences between (K+) group and P1 group (p>0,05). The conclusion of this study is administration of kosambi (Schleichera oleosa) leaf extract at dose 400 and 600 mg/kgb.w. can inhibit the progression of liver fibrosis and reduce the incidence of necrosis of liver cells.. xix.
(21) BAB I PENDAHULUAN 1.1 Latar Belakang Menurut Depkes pada tahun 2016, diperkirakan terdapat 18 juta orang Indonesia menderita hepatitis B dan 3 juta orang menderita hepatitis C. Sekitar 50% dari penderita hepatitis B dan hepatitis C berpotensi kronis dan 10% berpotensi menjadi fibrosis hepar yang dapat menyebabkan kanker hepar (Depkes, 2016). Etiologi dari fibrosis hepar adalah infeksi virus hepatitis, Alcoholic Liver Disease (ALD), autoimun, NonAlcoholic Fatty Liver Disease (NAFLD), Nonalcoholic Steatohepatitis (NASH) (Kitano, 2016). Nonalcoholic Steatohepatitis (NASH) adalah penyebab utama dari fibrosis hepar. NASH merupakan bagian dari Nonalcoholic Fatty Liver Disease (NAFLD) (Bataller, 2005). Fibrosis hepar adalah keadaan patologis dari penyakit hepar kronik yang ditandai dengan terbentuknya jaringan parut pada parenkim hepar sebagai respon dari penyembuhan luka akibat jejas yang berlangsung kronik (Henderson dan Iredale, 2007). Proses terjadinya fibrosis hepar yaitu akibat dari kerusakan hepar secara kronik yang ditandai terakumulasinya Extracellular Matrix (ECM) (Leija, 2007). Nonalcoholic Steatohepatitis (NASH) disebabkan karena keadaan sindrom metabolik dengan penanda seperti diabetes mellitus tipe-2, obesitas, dislipidemia, dan resistensi insulin (Bataller, 2005). Obesitas dan resistensi insulin mengakibatkan stress metabolik dan merupakan faktor dalam lipotoksisitas. Insulin. 1.
(22) 2. mengurangi pelepasan Fatty Acid (FA) dari adiposit. Ketika terjadi resistensi insulin dapat menyebabkan hepar penuh dengan Fatty Acid (FA) yang dihasilkan adiposit (Cusi, 2016). Akumulasi lipid yang tidak normal, seperti diacyl glycerol, cholesterol, phosphepardylcholines, dan Fatty Acid (FA) bersifat toksik pada hepatosit dan merupakan penyebab dari NASH (Marra, 2018). Ketika hepatosit cedera karena penumpukan lemak beracun, maka akan memicu kematian sel. Keseimbangan antara cedera dan perbaikan menentukan progesifitas NASH akan dapat dihentikan atau tetap berlanjut (Loomba, 2018). Kelebihan timbunan lemak dalam tubuh dan sindrom metabolik memicu respon inflamasi (Diehl, 2017). Ketika terjadi inflamasi atau cedera pada hepar maka memicu Hepatic Stellate Cells (HSC) untuk memproduksi Extracellular Matrix (ECM) di hepar (Koyama, 2016). Hepatic Stellate Cells (HSC) diyakini berasal dari sel-sel mesenkimal selama embriogenesis (Cassiman, 2002). HSC adalah sel yang menghasilkan ECM (Extracellular Matrix) pada hepar yang mengalami inflamasi. Di hepar yang normal, HSC berada di space of disse (ruang antara hepatosit dan sel endotel sinusoidal), dimana vitamin A disimpan. Jika mengalami inflamasi yang kronis, HSC akan berdiferensiasi menjadi sel miofibroblas. Miofibroblas menghasilkan kolagen tipe I, yaitu sumber utama ECM (Wastsky, 2010). HSC yang teraktivasi akan bermigrasi ke tempat jaringan diperbaiki, dan akan mensekresi ECM serta meregulasi degradasi dari ECM (Walace, 2008). HSC adalah sel fibrogenik utama yang terdapat di area perisentral, sementara miofibroblas dihasilkan jika terdapat inflamasi hepar di daerah triad portal (Rockey, 2003). Selain HSC, sel lain yang berkontribusi dalam pembentukan miofibroblas pada fibrosis hepar adalah Portal.
(23) 3. Fibroblast (PF) (Dranoff and Wells, 2010). Portal Fibroblast (PF) adalah salah satu dari beberapa populasi fibroblas di hepar (Wells, 2014). PF berada di bawah epitel saluran empedu dan merupakan sumber miofibroblas utama pada sirosis bilier. Dalam kondisi fisiologis, PF terdiri dari sel yang mengelilingi vena portal untuk menjaga integritas saluran portal (Dranoff dan Wells, 2010). Cedera hepar akan mengaktivasi PF dan akan berdiferensiasi menjadi miofibroblas yang mensintesis Extracellular Matrix (ECM) (Dranoff dan Wells, 2010). Dalam kasus cedera hepar kolestatik, PF merespon dengan cepat terhadap peningkatan kadar TGF-β1 (Liu, et al., 2003) Ketika terjadi cedera pada hepar, makrofag akan direkrut ke tempat cedera. Proses perekrutan diperantarai oleh kemokin, yaitu Monocyte Chemotactic Protein1 (MCP-1). Makrofag mengatur proses inflamasi dan proses fibrosis dengan menghasilkan Transforming Growth Factor-β (TGF-β), Interleukin-1β (IL-1β), Interleukin-8 (IL-8), Platelet Derived Growth Factor (PDGF) (Ramachandran, 2012). PDGF dihasilkan oleh sel kupffer (makrofag di sel hepar). Diantara faktorfaktor pertumbuhan tersebut, TGF-β1 adalah mediator utama dalam proses fibrogenesis (Shek, 2004). TGF-β1 menginduksi transformasi HSC menjadi miofibroblas dan merangsang sintesis protein ECM (Rockey, 2003). Mekanisme fibrosis hepar yang semakin jelas, maka semakin banyak pula diketahui cara untuk menghambat fibrosis hepar. Sampai sekarang masih belum tersedia obat yang dipakai secara luas sebagai obat anti fibrotik yang digunakan oleh manusia. Syarat obat anti fibrotik dapat dikonsumsi, yaitu dapat ditoleransi dengan baik saat pemberian jangka lama, bekerja secara spesifik di sel hepar dan mempunyai efek merugikan yang minimal pada jaringan lain (Ramon, 2005)..
(24) 4. Karena inflamasi mempercepat proses fibrogenesis, maka diusulkan penggunaan obat anti inflamasi untuk menghambat fibrosis hepar. Cara lain adalah dengan menghambat HSC, yaitu dengan mengatur aktivasi dan proliferasi. Beberapa zat antioksidan seperti S-adenosyl-L-methionine, phosphepardylcholine, vitamin E, dan silymarin dapat mencegah apoptosis hepatosit, menghambat aktivasi dari HSC, dan dapat mengurangi fibrosis hepar (Bataller, 2005). Kosambi (Schleichera oleosa) di Indonesia banyak tumbuh di pulau Jawa, Nusa Tenggara, Bali, Maluku, Sulawesi, Pulau Kai dan Pulau Seram (Suita, 2012). Kosambi (Schleichera oleosa) adalah salah satu tumbuhan yang mempunyai potensi untuk mengobati berbagai penyakit kulit. Ghosh, et al., (2011) menyatakan bahwa tumbuhan kosambi (Schleichera oleosa) telah digunakan sebagai obat tradisional, yaitu sebagai antibiotik dan melawan disentri. Daun kosambi (Schleichera oleosa) mengandung senyawa obat seperti alkaloid, flavonoid, steroid, fenolik dan tannin (Situmeang, 2016). Flavonoid telah dilaporkan mempunyai aktivitas anti inflamasi in vivo dan in vitro. (Kim, 2004). Quercetin adalah salah satu flavonoid yang berlimpah di alam, terdapat pada sayuran, buah-buahan, teh, minyak zaitun, dan termasuk terdapat pada daun kosambi. Quercetin mempunyi efek terapeutik terhadap berbagai macam penyakit, seperti penyakit jantung, aterosklerosis, fibrosis hepar, cedera ginjal, dan obstruksi bilier kronis (Wu LC, et al., 2011). Quercetin mampu menurunkan ekspresi TGF-β1 yang dapat menghambat perkembangan fibrosis hepar. Quercetin juga dapat menghambat pelepasan sitokin proinflamasi TNF- α. Sebelumnya, telah dilakukan penelitian bahwa quercetin menghambat ekspresi TGF-β1 pada fibroblas paru embrionik manusia secara in vitro (Kleemann, 2011)..
(25) 5. Pemberian quercetin terhadap tikus yang diinduksi CCl4 dapat meningkatkan antioksidan dan mencegah kerusakan sel (Hernández, 2012). Dalam Al-Qur’an telah dijelaskan bahwa setiap tanaman yang diciptakan Allah itu baik, seperti pada QS. Asy-Syu’ara’ ayat 7 dan 8:. َ ۡ اََوَﻟ ۡﻢ َﯾَﺮۡوا ِاَﻟﻰ ا ( ِاﱠن٧) ض َﻛ ۡﻢ اَ ۡۢﻧَﺒۡﺘَﻨﺎ ِﻓۡﯿﮭَﺎ ِﻣۡﻦ ُﻛﱢﻞ َزۡوجٍ َﻛِﺮۡﯾٍﻢ ِ ﻻۡر (٨) ﻚ َ ٰﻻَﯾﺔً ؕ ﱠوَﻣﺎ َﻛﺎَن اَۡﻛَﺜُﺮھُ ۡﻢ ﱡﻣۡﺆِﻣِﻨۡﯿﻦ َ ِﻓۡﻰ ٰذ ِﻟ Artinya: “Dan apakah mereka tidak memperhatikan bumi, betapa banyak Kami tumbuhkan di bumi itu berbagai macam pasangan (tumbuh-tumbuhan) yang baik? (7) Sungguh, pada yang demikian itu terdapat tanda (kebesaran Allah), tetapi kebanyakan mereka tidak beriman (8)” (QS. Asy-Syuára: 7-8) Ayat diatas menjelaskan bahwa Allah menciptakan berbagai macam tumbuhan yang baik. Hal tersebut membuktikan bahwa setiap tumbuhan pasti mempunyai manfaat bagi manusia. Semua bergantung bagaimana cara manusia memanfaatkan tumbuhan yang ada di muka bumi ini. Manusia yang beriman akan menggunakan tumbuhan-tumbuhan ciptaan Allah dengan sebaik-baiknya, yaitu dengan mencari tahu manfaat dari tumbuhan tersebut dan mengetahui kandungan di dalam tanaman tersebut supaya bermanfaat dalam berbagai bidang, terutama digunakan dalam pengobatan. Karbon tetraklorida (CCl4) merupakan zat toksik pada hepar yang sering dipakai untuk penelitian yang berhubungan dengan toksisitas pada hepar. The National. Toxicology. Program’s. fifth. Annual. Report. on. Carcinogen. mengemukakan bahwa CCl4 merupakan zat yang mempunyai toksisitas dengan tingkat yang parah dan dapat menjadi senyawa karsinogen (Junieva, 2006). CCl4.
(26) 6. dapat mengakibatkan hepar mengalami kerusakan yang dipicu oleh pembentukan radikal bebas, CC14 memerlukan aktivasi dari enzim sitokrom P450 yang terletak di hepar. Proses aktivasi tersebut mengubah senyawa CC14 menjadi CCl3, yaitu suatu zat yang bersifat lebih toksik sehingga akan membuat hepar baik pada hewan coba maupun pada manusia mengalami kerusakan (Lestari, 2008). Penelitian Robert Domitrovic, et al., (2009) menunjukkan bahwa pemberian CCl4 0,4 ml/kgBB secara intraperitoneal pada mencit 2 kali seminggu selama 6 minggu dapat menyebabkan fibrosis hepar. Pemberian CCl4 selama 4 minggu berturut-turut akan menyebabkan gambaran fibrosis yang terletak di lobulus hepatis dan hampir mengenai seluruh bagian dengan proses menuju sirosis hepar (Doi, et al., 1991). Pemberian CCl 4 selama 10 minggu dapat menyebabkan keadaan sirosis hepatis (Zhang, et al., 2009). Berdasarkan latar belakang diatas, peneliti melakukan penelitian untuk menguji efek ekstrak daun kosambi (Schleichera oleosa) pada tikus model fibrosis hepar. Di Indonesia penggunaan kosambi sebagai obat anti fibrotik jarang diteliti atau bahkan belum ada yang meneliti..
(27) 7. 1.2. Rumusan Masalah Penelitian 1. Bagaimana. pengaruh. pemberian. ekstrak. metanol. daun. kosambi. daun. kosambi. (Schleichera oleosa) dalam menghambat fibrosis hepar? 1.3. Tujuan Penelitian 1.3.1. Tujuan Umum Membuktikan (Schleichera. bahwa. pemberian. ekstrak. oleosa) dapat menghambat progresifitas fibrosis hepar.. 1.3.2. Tujuan Khusus Mengamati pengaruh pemberian ekstrak daun kosambi (Schleichera oleosa) terhadap fibrosis hepar dengan melihat gambaran histopatologi. 1.4. Manfaat Penelitian 1.4.1. Manfaat Akademik Hasil. penelitian. ini. diharapkan. dapat. digunakan. untuk. pengembangan penelitian tentang fibrosis hepar dan dapat digunakan sebagai penelitian lanjutan tentang efek ektrak metanol daun kosambi terhadap fibrosis hepar. 1.4.2. Manfaat Aplikatif Dari hasil penelitian ini diharapkan nantinya akan memberikan pengetahuan kepada masyarakat bahwa tanaman kosambi (Schleichera oleosa) bisa digunakan sebagai obat alami untuk penyakit fibrosis hepar. Selain itu, dapat dikembangkan obat anti fibrotik dari ekstrak daun kosambi (Schleichera oleosa) dan dapat diproduksi secara massal karena tanaman kosambi banyak terdapat di Indonesia..
(28) BAB II TINJAUAN PUSTAKA 2.1. Fibrosis Hepar Fibrosis hepar merupakan masalah kesehatan yang dapat menyebabkan sirosis hepar dan Hepatocellular Carcinoma (HCC). Fibrogenesis terjadi karena aktivasi dari miofibroblas yang disebabkan karena cedera hepar (Kisseleva, 2008). Onset fibrosis hepar biasanya tersembunyi, pada umumnya morbiditas dan mortalitas terjadi setelah sirosis berkembang. Pada kebanyakan pasien, progresi menuju sirosis terjadi setelah 15-20 tahun (Leija, et al., 2007). 2.1.1. Definisi Fibrosis Hepar Fibrosis hepar adalah suatu respon terhadap penyembuhan cedera hepar dan ditandai dengan akumulasi Extracellular Matrix (ECM) (Bataller, 2005). Fibrosis hepar awalnya dianggap sebagai proses yang reversibel, tetapi jika bersifat progresif maka akan menjadi sirosis yang dapat ireversibel dan menyebabkan gangguan fungsi hepar (Friedman 2008). 2.1.2. Etiologi Fibrosis Hepar Etiologi utama fibrosis hepar adalah infeksi virus hepatitis, Non Alcoholic Steatohepatitis (NASH), kolestasis, dan autoimun (Weiskirchen, 2016). a.. Infeksi Virus Hepatitis Dua faktor yang berperan dalam fibrosis hepar yang disebabkan oleh. Hepatitis B Virus (HBV) adalah faktor virulensi virus Hepatitis B dan peradangan hepar yang disebabkan oleh HBV (Kao, et al., 2000). Selain itu, protein virus HBV berperan dalam perkembangan fibrosis. Martin Vilchez, et al., menemukan bahwa ekspresi hepatitis B X protein (HBx) dalam. 8.
(29) 9. hepatosit menyebabkan aktivasi dari HSC. Pada manusia dan tikus HSC yang diaktivasi oleh HBx akan meningkatkan ekspresi kolagen tipe 1, α-Smooth Muscle Actin (α-SMA), TGF-β, dan peningkatan laju proliferasi sel (Martin, et al., 2008). Jin, et al., mengembangkan model fibrosis hepar yang diinduksi CCl4 pada tikus HBV-transgenik (HBV-Tg). Fibrosis hepar berkembang secara spontan pada tikus HBV-Tg dengan peningkatan kolagen tipe 1, Matrix Metalloproteinase-2 (MMP-2), dan Tissue Inhibitor of Metalloproteinase-1 (TIMP-1). Selain itu, jumlah sel Natural Killer T (NKT) hepar meningkat setelah pengobatan CCl4. Sitokin inflamasi IL-4 dan IL-13 yang diproduksi oleh sel NKT berperan dalam aktivasi HSC dalam percobaan kultur in vitro. Data ini menunjukkan bahwa sel NKT dari tikus HBV-Tg menginduksi aktivasi HSC dalam fibrogenesis hepar (Jin, et al., 2011). b.. Non Alcoholic Steatohepatitis (NASH) Non Alcoholic Steatohepatitis (NASH) adalah bentuk yang lebih parah. dari Non Alcoholic Fatty Liver Disease (NAFLD) yang dapat menyebabkan fibrosis yang progresif dan sirosis. NAFLD menjadi penyakit hepar kronis yang paling umum pada orang barat. NASH terjadi karena akumulasi lemak dalam sel hepar (steatosis) yang dapat memicu serangkaian kerusakan jaringan sehingga mengakibatkan fibrosis (Clark, 2006). Resistensi Insulin, diet tinggi lemak jenuh, dan diet tinggi karbohidrat menyebabkan tertimbunnya Free Fatty Acid (FFA) dan akan menginduksi cedera hepar melalui lipotoksisitas sehingga terjadi NASH (Neuschwander, 2010). Resistensi insulin menjadi penyebab utama dalam NASH dan.
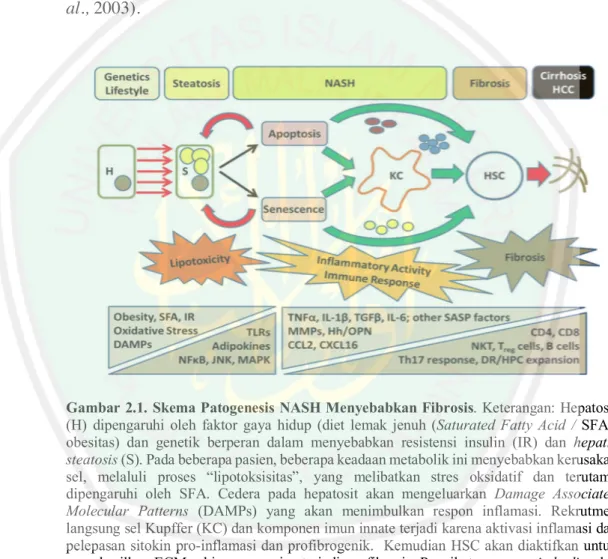
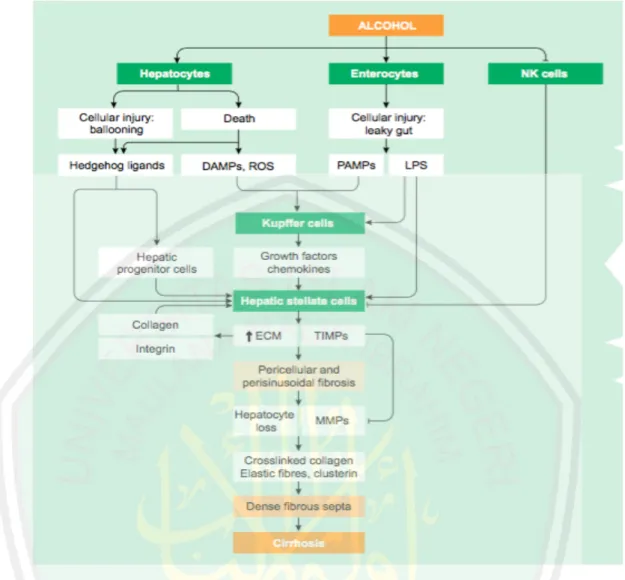
(30) 10. menyebabkan terjadinya stres oksidatif (Malaguarnera, et al., 2009). Akumulasi lipid dalam hepatosit dapat menginduksi TGF-β dan produksi ECM (Svegliati, et al., 1998). Apoptosis hepatosit berhubungan dengan kelebihan FFA di hepar sehingga bersifat profibrogenik pada penyakit hepar. Penelanan Apoptotic Bodies (AB) oleh sel kupffer telah terbukti meningkatkan aktivasi HSC dan meningkatkan produksi TGF-β (Canbay, et al., 2003).. Gambar 2.1. Skema Patogenesis NASH Menyebabkan Fibrosis. Keterangan: Hepatosit (H) dipengaruhi oleh faktor gaya hidup (diet lemak jenuh (Saturated Fatty Acid / SFA), obesitas) dan genetik berperan dalam menyebabkan resistensi insulin (IR) dan hepatic steatosis (S). Pada beberapa pasien, beberapa keadaan metabolik ini menyebabkan kerusakan sel, melaluli proses “lipotoksisitas”, yang melibatkan stres oksidatif dan terutama dipengaruhi oleh SFA. Cedera pada hepatosit akan mengeluarkan Damage Associated Molecular Patterns (DAMPs) yang akan menimbulkan respon inflamasi. Rekrutmen langsung sel Kupffer (KC) dan komponen imun innate terjadi karena aktivasi inflamasi dan pelepasan sitokin pro-inflamasi dan profibrogenik. Kemudian HSC akan diaktifkan untuk menghasilkan ECM sehingga memicu terjadinya fibrosis. Pengikatan apoptotic bodies dan faktor-faktor yang dihasilkan oleh sel-sel tua (senescence) dapat mempengaruhi aktivasi HSC secara langsung (Peverill, et al., 2014)..
(31) 11. c.. Alcohol Liver Disease (ALD) Penyalahgunaan alkohol yang berlebihan menyebabkan steatohepatitis. yang dapat berkembang menjadi Alcohol Liver Disease (ALD). Protein sitokrom P450 2E1 (CYP2E1) adalah anggota dari sistem pengoksidasi etanol yang berperan dalam metabolisme etanol, dan berperan dalam fibrogenesis yang diinduksi alkohol (Lu Y, 2008). Produk dari metabolisme alkohol adalah asetaldehid (Zhong, 2018). Asetaldehid dianggap sebagai penyebab utama dalam fibriogenesis yang diinduksi alkohol (Casini, et al., 1991). Asetaldehid mempunyai peran dalam aktivasi dari Hepatic Stellate Cells (HSC) (Puche, et al., 2013). Ketika terjadi metabolisme alkohol dan membentuk asetaldehid, akan terjadi peningkatan kebutuhan oksigen, hipoksia, kerusakan mitokondria, stres oksidatif, dimana ditandai dengan hepatocellular ballooning dan kematian sel (Lackner, 2011). Balloning (sel menggelembung) dan kematian hepatosit akan memproduksi hedgehog ligand dan akan memicu HSC sehingga terjadi penumpukan Extracellular Matrix (ECM) disekitar ballooned hepatosit (Witek, et al., 2009). Aktivasi dari HSC akan memproduksi Tissue Inhibitor of Metalloproteinase (TIMPs) yang akan menurunkan aktivitas penghancuran ECM oleh matrix metalloproteinase (MMPs) (Zoubek, et al., 2017)..
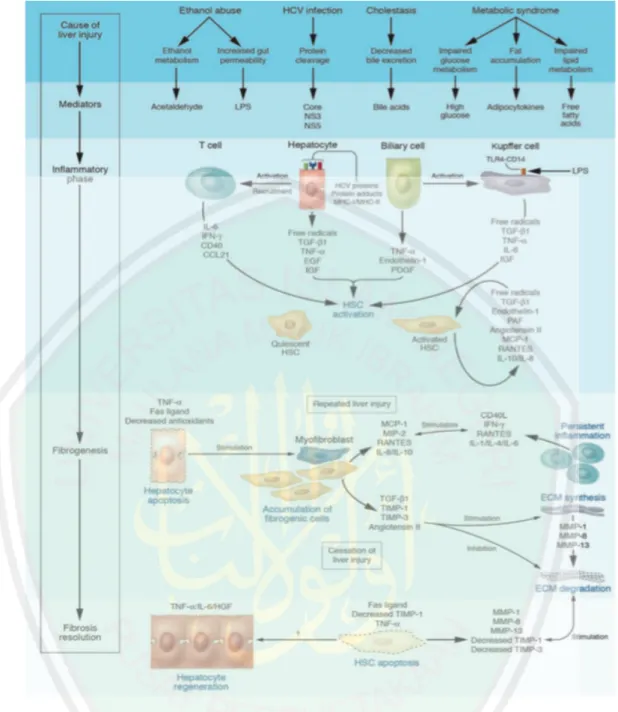
(32) 12. Gambar 2.2. Patogenesis Dari Fibrosis Karena Alcohol Liver Disease (ALD). Alkohol (asetaldehid) akan menyebabkan cedera pada hepar yang ditandai dengan ballooning dan akan memicu pelepasan hedgehoc ligands. Hedgehoc ligands dan aktivasi dari HSC akan menyebabkan penumpukan dari ECM di sekitar ballooning hepatosit. Pelepasan hedgehoc ligands juga bisa berasal dari kematian hepatosit. Aktivasi dari HSC dan aktivasi sel kupffer akan memicu pelepasan Damage Associated Molecular Patterns (DAMPs) dari kematian sel dan Pathogen Associated Molecular Patterns (PAMPs) dan lipopolisakarida (LPS) dari penurunan fungsi usus akibat alkohol. Tissue Inhibitor of Metalloproteinase (TIMPs) diproduksi oleh aktivasi HSC dan akan menghambat Matrix Metalloproteinase (MMPs) dan menyebabkan pematangan fibrosis. Akumulasi dari serat elastis akan memicu pembentukan jaringan fibrosa padat di septa yang menyerupai septa pada hepatitis virus kronis. Fibrogenesis yang terus berlangsung dan hilangnya jaringan parenkim akan memicu terjadinya kerusakan dan mengakbatkan sirosis (Lackner, et al., 2018).. d.. Kolestasis Kolestasis terjadi akibat kegagalan produksi hepatobilier dan ekskresi. empedu, dimana empedu tidak bisa mengalir dari hepar ke duodenum sehingga menyebabkan empedu masuk ke sirkulasi (Guicciardi dan Gores, 2002). Asam empedu adalah molekul amfipatik (mengandung daerah.
(33) 13. hidrofobik dan hidrofilik sekaligus) yang disintesis oleh hepatosit dan mempunyai aksi deterjen (emulsifikasi lemak) yang berguna untuk penyerapan lemak. Kenaikan konsentrasi asam empedu akan menyebabkan kematian sel hepatosit (Jang, et al., 2012). Cedera pada hepatosit yang disebabkan karena kolestasis akan memicu mediator hipotoksisitas, yaitu Tumor Necrosis Faktor-α (TNF-α) (Schwabe, 2006). TNF-α akan memicu aktivasi Hepatic Stellate Cell (HSC), selanjutnya HSC akan memicu pengeluaran Tissue Inhibitor Metalloproteinase-1 (TIMP1) yang dapat menghambat Matrix Metalloproteinase (MMPs) (Tarrats, et al., 2011). e.. Autoimune liver disease (AILD) Autoimune Liver Disease (AILD) meliputi 3 penyakit klinis utama yang. berbeda, yaitu Autoimune Induced Hepatitis (AIH), Primary Biliary Cholangitis (PBC), Primary Schlerosing Cholangitis (PSC) (Arndtz dan Hirschfield, 2016). Patofisiologi AILD terjadi karena hilangnya toleransi kekebalan yang mengarah pada penghancuran sel yang dimediasi oleh limfosit T (Liaskou, et al., 2014). Ada sesuatu yang kompleks yang melibatkan predisposisi genetik menjadi autoimun dan dikombinasikan dengan paparan dari lingkungan yang akan menyebabkan reaksi antigen dengan sel imun yang tidak terkontrol sehingga menyebabkan cedera pada hepar atau cedera bilier. Respon imun terhadap cedera dan respon terhadap cedera hepatosit akan menyebabkan perkembangan dari fibrosis (Chalasani, et al., 2000)..
(34) 14. 2.1.3. Mekanisme Terjadinya Fibrosis Hepar Fibrosis hepar adalah hasil dari respon penyembuhan luka dari cedera hepar yang berulang (Friedman, 2003). Setelah terjadi cedera hepar (misal: hepatitis), sel parenkim menjadi apoptosis atau nekrotik. Proses ini dihubungkan oleh karena respon inflamasi dan penumpukan dari Extracellular Matrix (ECM). Jika cedera menetap, maka regenerasi sel akan gagal dan hepatosit akan dipenuhi oleh ECM dalam jumlah banyak (Iridale, 2007). Ketika akumulasi ECM menetap, akan menyebabkan penggantian parenkim hepar secara progresif dengan jaringan parut (Hernandez dan Friedman, 2011). Hepatic Stellate Cell (HSC) adalah sel utama yang memproduksi ECM (Gabele, et al., 2003). Di hepar yang normal, HSC berada di Space of Disse yang merupakan tempat utama penyimpanan vitamin A. Ketika terjadi cedera kronik, HSC akan berdiferensiasi menjadi miofibroblas. Platelet Derived Growth Faktor (PDGF) diproduksi oleh sel kupffer yang berperan untuk aktivasi HSC (Leija, et al., 2007). Sel Kupffer bisa diaktivasi oleh Reactive Oxidatice Species (ROS) yang dihasilkan oleh sel yang nekrosis. Sel kupffer dapat mensekresi mediator proinflamasi, selain itu juga dapat menstimulasi rekruitmen dari sel T dan netrofil. Proses inflamasi semakin parah dengan keluarnya sitokin proinflamasi, seperti interleukin-6 (IL-6), Tumor Necrosis Faktor (TNF), IL-1β, dan faktor pertumbuhan seperti Transforming Growth Faktor-β (TGF-β), Platelet Derived Growth Faktor (PDGF). Faktor pertumbuhan dan sitokin porinflamasi tersebut selanjutnya akan mengaktivasi HSC untuk berdiferensiasi menjadi miofibroblas fibrogenik. TGF-β adalah sitokin dalam fibrosis utama yang dapat menginduksi miofibroblas untuk.
(35) 15. menghasilkan kolagen tipe-1 dan α-Smooth Muscle Actin (α-SMA) sehingga membentuk matriks fibrotik (Pellicoro, et al., 2014). Pada fase awal HSC dan sel kupffer mampu menghasilkan Matrix Metalloproteinase (MMP) tetapi tidak menghasilkan Tissue Inhibitor of Metalloproteinase (TIMP), sehingga proses pembentukan kolagen tipe-1 akan diikuti degradasi ECM oleh MMP. Namun saat HSC teraktivasi terus menerus, ekspresi dari MMP akan turun dan TIMP mulai diekspresikan sehingga MMP yang bekerja untuk mendegradasi matriks akan terhambat. Perubahan tersebut mengakibatkan gangguan dari keseimbangan sekresi dan degradasi matriks yang menyebabkan akumulasi matriks yang berlebihan (Henderson dan Iredale, 2007)..
(36) 16. Gambar 2.3. Mekanisme Seluler Fibrosis Hepar. Perbedaan tipe dari agen hepatotoksik memproduksi mediator yang dapat menyebabkan respon inflamasi di sel hepar. Kerusakan hepatosit dan bilier melepaskan sitokin inflamasi yang dapat mengaktivasi sel Kupffer dan mengaktivasi sel T. Inflamasi ini menyebabkan aktivasi dari HSC ke fibrogenik miofibroblas. HSC yang teraktivasi juga melepaskan sitokin. Jika cedera hepar menetap, akumulasi dari HSC yang teraktivasi dan portal miofibroblas terjadi, maka akan terjadi sintesis ECM dalam jumlah banyak dan menyebabkan fibrosis. Degradasi ECM dihambat oleh peran sitokin seperti TIMPs. Apoptosis sel hepatosit menyebabkan peran fibrogenik dari HSC. Jika penyebab cedera hepar diatasi, maka fibrosis akan berhenti. HSC: hepatic stellate cell, ECM: Extracellular Matrix, TIMPs: Tissue Inhibitor Metalloproteinase, MCP-1 : Monocyte Chemoattractant Protein-1, MIP-1 : Macrophage Inflammatory Protein-1, NS3 : HSV nonstructural protein 3, PAF : Platelet Activating Factor (Bataller dan Brenner, 2005).
(37) 17. 2.1.4. Hepatic Stellate Cell (HSC) HSC adalah sel penghuni hepar yang berasal dari mesenkim embrionik, pada hepar orang dewasa yang sehat berjumlah sekitar 10% dari total sel-sel hepar. Pada keaadaan fisiologis, HSC menunjukkan quiescent phenotype (fenotip diam) dan merupakan tempat utama penyimpanan vitamin A. Quiescent HSCs (qHSCs) berlokasi di space of disse (ruang antara hepatosit dan sel endotel sinusoidal). Sebagai respon terhadap cedera hepar dan pelepasan TGF-β1, qHSCs dengan cepat menjalani aktivasi dengan menurunkan regulasi vitamin A dan berdiferensiasi menjadi active HSC (aHSCs) dan akan berubah menjadi miofibroblas (Forbes dan Parola, 2011). HSC juga meregulasi produksi dari Matrix Metalloproteinase (MMP), khususnya MMP-13 dan inhibitor MMP, yaitu TIMPs. Aktivasi HSCs dipicu paling sering oleh peningkatan kadar profibrogenik TGF-β1 (Hao, et al., 2013). Kerusakan hepatosit dan aktivasi sel kupffer juga berperan dalam aktivasi HSC (Nieto, et al., 2002). Namun regulasi produksi MMP oleh HSC terjadi dalam kondisi yang berbeda dengan diferensiasi HSC menjadi miofibroblas.. Gambar 2.4. Aktivasi Hepatic Stellate Cell (HSC). Induksi berbagai macam zat toksik pada hepar seperti ethanol, virus, steatosis pada hepatosit akan memicu sel kupffer untuk mengeluarkan TGF-β. TGF-β ini akan mengubah quiescent stellate cell menjadi ke bentuk yang aktif yaitu activated stellate cell. Sel stellate yang sudah aktif ini memproduksi Extracellular Matrix (ECM) dan jika tidak didegradasi oleh MMP akan menjadi fibrosis hepar (Mormone, et al., 2011)..
(38) 18. 2.1.5. Portal Fibroblas (PF) Portal fibroblas berada di bawah epitel saluran empedu dan merupakan sumber miofibroblas utama pada sirosis bilier, yang disebabkan oleh obstruksi bilier (Dranoff dan Wells, 2010). Portal fibroblas adalah salah satu dari beberapa populasi fibroblas di hepar. Istilah “portal fibroblas” mengacu pada setiap fibroblas di wilayah portal, dan istilah “portal miofibroblas” mengacu ke semua fibroblas yang berasal dari area portal dan tidak berasal dari HSC (Wells, 2014). Dalam kondisi fisiologis, PF terdiri dari populasi kecil sel yang mengelilingi vena portal untuk menjaga integritas saluran portal (Dranoff dan Wells, 2010). Activated PFs (aPFs) terlibat dalam patogenesis cedera hepar kolestatis, dimana akan berdiferensiasi menjadi miofibroblas yang dapat menghasilkan α-Smooth Muscle Actin (α-SMA) yang mensintesis ECM (Yata, et al., 2003). PF menjadi sel pengekspresi elastin utama (selain dari sel otot polos pembuluh darah) di hepar, dan beberapa peneliti menunjukkan bahwa deposisi elastin meningkat ketika PF berkembang dan fibrosis berkembang (Lorena, et al., 2004). 2.1.6. Peran Makrofag Dalam Fibrosis Hepar Makrofag dapat diklasifikasikan menjadi dua, yaitu M1 dan M2. M1 dikenal sebagai makrofag klasik atau proinflamasi dan M2 dikenal sebagai makrofag alternatif atau antiinflamasi (Mosser dan Edward, 2008). Makrofag M1 akan kuat selama permulaan cedera dan akan melepaskan Matrix Metalloproteinase (MMP) yang akan menurunkan ECM. Sedangkan makrofag M2 mensekresi faktor antiinflamasi, seperti IL-10, arginase, TGF-β, dan Heme Oxygenase (HO)-1 (Braga, et al., 2015). Makrofag M2 merangsang lingkungan antiinflamasi dan memicu regenerasi dan penyembuhan luka. Namun, jika cedera menjadi kronis, makrofag.
(39) 19. M2 akan mengambil peran profibrotik yang mensekresikan faktor profibrotik, seperti TGF-β dan PDGF (Sun, et al., 2017) Kupffer Cell (KC) adalah makrofag jaringan yang berasal dari turunan monosit, merupakan 15% dari total populasi sel hepar, dan tinggal terutama di daerah periportal. KC mempunyai fungsi yang banyak dalam patofisiologi hepar, termasuk fagositosis, presentasi antigen, dan sekresi mediator yang memicu respon imun dan inflamasi. Setelah diaktifkan, KC mengeluarkan sejumlah besar mediator proinflamasi dan fibrogenik, yang dapat mendorong aktivasi HSC (Gao, et al., 2008). Kupffer Cell (KC) juga merupakan sel yang kontak pertama dengan produk bakteri, termasuk endotoksin yang berasal dari saluran pencernaan. Maka dari itu KC adalah target utama Lipopolisakarida (LPS), dan KC akan mengeluarkan TollLike Receptor-4 (TLR4), yaitu reseptor imun bawaan yang ligan utamanya adalah LPS (Gao, et al., 2008). Kupffer Cell (KC) terlibat dalam proses produksi sitokin dan faktor pertumbuhan yang menginduksi HSC untuk berdiferensiasi menjadi miofibroblas dan juga meregulasi produksi Matrix Metalloproteinase (MMP) dan inhibitornya (TIMP) (Xidakis, et al., 2005). Studi in vitro juga menunjukkan bahwa sel kupffer dapat menginduksi Platelet Derived Growth Faktor (PDGF) yang dapat meningkatkan proliferasi dari HSC. TNF- α, IL-1 dan Monocyte Chemoattractant Protein-1 (MCP-1) juga diproduksi oleh sel kupffer yang bersifat mitogenik dan kemotraktan pada HSC (Kolios, et al., 2006)..
(40) 20. 2.1.7. Peran TGF-β Dalam Fibrosis Hepar Transforming Growth Faktor- β (TGF-β) memiliki beberapa efek profibrogenik tetapi juga antiinflamasi dan imunosupresif. Selain efek fibrogeniknya yang menyebabkan diferensiasi sel-sel stelata hepatic (HSC) ke dalam miofibroblas, TGF-β juga merupakan regulator penting proliferasi dan penginduksi apoptosis (Gressner, et al., 2002). TGF-β akan mengaktivasi HSC melalui jalur SMAD2 dan SMAD3. Setelah fosforilasi membentuk kompleks trimetrik SMAD2, SMAD3 dengan SMAD4, kemudian akan di translokasi ke nukleus dan berasosiasi dengan faktor transkripsi lain untuk mengatur ekspresi gen yang akan mengaktifkan HSC (Fabregat, et al., 2016). TGF-β dapat menginduksi polarisasi makrofag seperti M2 melalui SNAIL. Ekspresi SNAIL akan dipicu oleh jalur SMAD2/ 3 yang diinduksi TGF-β. Setelah itu ekspresi SNAIL pada makrofag akan mengekspresikan penanda M2 (CD2016), menginduksi antiinflamasi IL-10 dan meghambat sitokin yang terkait dengan M1 yang proinflamasi (TNF- α dan IL-12). Makrofag yang diisolasi dari tikus fibrotik menunjukkan keseimbangan antara makrofag M2 dan M1 (Zhang, et al., 2016). Persinyalan TGF-β1 akan menginduksi HSC untuk mensintesis protein matriks dalam jumlah berlebih, seperti fibronektin, kolagen tipe I, III, dn IV (Kanzler, et al., 1999). TGF-β1 memicu fibrogenesis melalui tiga mekanisme. Pertama, TGF-β1 menghambat degradasi ECM dengan menekan MMP dan memicu TIMP inhibitor alami. Kedua TGF-β1 menginduksi pembentukan miofibroblas melalui tubular Epithelial Mesenchymal Transition (EMT). Ketiga, TGF-β1 menginduksi produksi matriks melalui mekanisme terkait SMAD3 atau non-SMAD (Xu, et al., 2016)..
(41) 21. TGF-β1 mengubah keseimbangan sintesis dan degradasi kolagen dengan meningkatkan ekspresi gen kolagen tipe I dan menghambat degradasi kolagen melalui induksi TIMP-1 (Blobe, et al., 2000). TGF-β1 memicu regulasi mRNA kolagen tipe I disertai dengan penurunan regulasi dari MMP-1 (Schaefer, et al., 2003). Dengan demikian TGF-β1 memicu produksi ECM dan menghambat degradasinya (Dudas, et al., 2001). Epithelial Mesenchymal Transition (EMT) adalah proses dimana sel-sel epitel kehilangan polaritas sel dan kemampuan adhesi sel-sel mereka, dan bersifat invasif menjadi sel mesenkimal (Kalluri dan Neilson, 2003). Kaimori, et al., melaporkan bahwa TGF-β1 mampu memediasi EMT dalam hepatosit. TGF-β1 secara signifikan meningkatkan ekspresi mRNA kolagen α1 dan deposisi kolagen tipe I, yang didefinisikan sebagai karakteristik keadaan EMT (Kaimori, et al., 2007). Proses EMT akan mengakibatkan hilangnya gen epitel, seperti E-chaderin dan cytokeratin yang akan memicu gen mesenkimal, seperti N-chaderin dan αSmooth Muscle Actin (α-SMA) (Fabregat, et al., 2016). TGF-β1 adalah subtipe dari keluarga TGF-β pada mamalia yang terutama memainkan efek biologis melalui reseptor spesifik I, II, dan III. TGF-βRI dan TGFβRII bekerja dalam transduksi sinyal TGF-β1/SMAD3 jalur pensinyalan reseptor utama. Ketika TGF-βRII kinase diaktifkan, substrat protein SMAD dapat difosfolirasi yang akan memimpin sinyal TGF-β ke dalam sel (Ottesen, et al., 2004). SMAD 2,3,4 adalah protein yang berikatan dengan mikrotubulus. Ketika mengalami stimulasi TGF-β, aktivasi transkripsi SMAD akan meningkat dan selanjutnya merangsang reseptor TGF-β (Meng, et al., 2012)..
(42) 22. Gambar 2.5. Peran TGF-β Dalam Mengaktifkan HSC dan Makrofag. Rute sebelah kiri menunjukkan peran TGF-β dalam mengaktifasi HSC. Dimana TGF-β akan berikatan dengan TGFβRII yang akan memicu fosforilasi SMAD2, SMAD3, dan SMAD4 yang akan di translokasi ke nukleus dan berasosiasi dengan faktor transkripsi lain untuk mengatur ekspresi gen yang akan mengaktifkan HSC dan membentuk miofibroblas. Sedangkan rute sebelah kanan adalah peran TGFβ dalam mengaktifkan makrofag terutama M2 melalui jalur SMAD2/3. Kemudian akan mengekspresikan SNAIL, dimana SNAIL akan mengekspresikan CD2016 dan IL-10 (Fabregat dan Diaz, 2018)..
(43) 23. 2.2. Carbon Tetrachloride (CCl4) Carbon Tetrachloride (CCl4) adalah suatu zat kimia dimana bukan bersumber dari alam tetapi dihasilkan dengan jumlah banyak untuk diperlukan di berbagai bidang industri, seperti bahan bakar dan industri refrigerant. Zat ini diperlukan dalam bahan pokok untuk pembentukan chlorofluorocarbons (CFC) dan digunakan untuk pembuatan bahan kimia lainnya (Junieva, 2006). Karbon tetraklorida (CCl4) adalah zat hepatotoksik yang menghasilkan zat radikal bebas yang dapat tertimbun di dalam hepar, lemak tubuh dan di sumsum tulang belakang. CCl4 mengakibatkan hepar mengalami kerusakan melalui mekanisme biokimia dan reaksi stres oksidatif (Monika, 2012). 2.2.1. Biotransformasi CCl4 Di dalam tubuh, karbon tetraklorida akan ditransformasi menjadi zat reaktif oleh enzim sitokrom P450. Hasil biotransformasi tersebut adalah triklorometil (CCl3), yaitu radikal bebas yang terbentuk dari pembelahan homolitik CCl4. Radikal bebas CCl3 secara kovalen dapat mengikat lipid tidak jenuh sehingga dapat mengakibatkan peroksidasi lipid. Proses peroksidasi lipid ini akan menyebabkan membran mitokondria dan RE menjadi rentan (Sulistianto, et al., 2004). Zat CCl3 kemudian akan dioksidasi menjadi triklorometil peroksil (CCl3O2). Senyawa radikal CCl3O2 lebih reaktif dibandingkan dengan CCl3 namun umurnya lebih pendek (Lutz, et al., 2003). Radikal CCl3O2 juga dapat menyebabkan peroksidasi lipid, yaitu dengan cara menghancurkan lipid membran di RE dengan cepat melebihi radikal CCl3. Reaksi peroksidasi lipid yang disebabkan oleh CCl3O2. menyebabkan. gangguan. homeostasis. mengakibatkan kematian sel (Panjaitan, et al., 2007).. sehingga. akhirnya. akan.
(44) 24. Biotransformasi zat CCl4 dibagi menjadi dua, yaitu reaksi fase I dan fase II. Proses oksidatif akan dilibatkan dalam biotransformasi pada fase 1. P450 dan NADPH sitokrom P450 reduktase adalah enzim yang berperan dalam mengkatalis proses biotransformasi tersebut. Sistem ini berada dalam RE dan memiliki enzim monooksigenase. Enzim ini terikat pada mikrosom, yang merupakan bagian pecahan dari RE yang terjadi pada sentrifugasi terfraksi dari homogenat hepatosit. Reaksi biotransformasi digambarkan berikut ini (Sulistianto, et al., 2004): P-H + NADPH+ O2 + H+ à P-OH + NADP + H2O. Substrat (P-H) pertama-tama akan diikat oleh enzim sitokrom P450 yang selanjutnya akan mengalami reaksi dengan NADPH (Nicotinamide Adenine Dinucleotide Phosphate) lewat sistem transport elektron dan juga akan mengaktivasi O2. Kemudian subtrat dipindahkan sehingga terbentuk subtrat terhidrosilasi (P-OH) dan air. Sedangkan biotransformasi di fase II senyawa asal diubah menjadi metabolit yang akan terbentuk konjugasi. Sifat metabolit dan konjugasi yaitu lebih larut di dalam air dan polar, sehingga dapat dengan mudah dikeluarkan lewat ginjal (Maulina, 2018). 2.2.2. Patogenesa Kerusakan Jaringan Hepar Akibat Pemberian CCl4 CCl4 akan mengakibatkan hepatosit menjadi rusak dan akan mengaktivasi sistem imun. Sel hepatosit yang rusak akan melepaskan ROS, sitokin profibrogenik, serta akan menyebabkan perekrutan sel darah putih oleh sel inflamasi (Tjok dan Wibawa, 2012). CCl4 juga akan mengaktivasi sel kupffer sehingga terbentuk ROS dan sitokin yang akan memperparah proses inflamasi (Kim, et al., 2011)..
(45) 25. Penelitian oleh Fu, et al., Menunjukkan bahwa induksi dari CCl4 pada hewan coba akan mengakibatkan fibrosis hepar. Respon dari hepar hewan coba yang diinduksi CCl4 hampir sama dengan hepar pada penderita sirosis hepatis (Fu, et al., 2008). Metabolisme CCl4 di hepar akan menstimulasi proses peroksidasi lipid yang akan menghasilkan radikal bebas sehingga menyebabkan inflamasi dan nekrosis pada sel hepatosit (Basu, 2003). Inflamasi yang terjadi pada hepar akan memicu sitokin proinflamasi IL-6 untuk menstimulasi sintesis kolagen. Sel stelata hepatosit (HSC) yang teraktivasi akan memproduksi IL-6 yang akan memicu produksi Extracellular Matrix (ECM) termasuk kolagen tipe I, sehingga menyebabkan fibrosis hepar (Fu, et al., 2008). Efek toksik CCl4 pada hepar disebabkan oleh konversi CCl4 menjadi radikal bebas. Atom hidrogen dari membran lipid yang banyak terdapat Poly Unsaturated Fatty Acid (PUFA) akan dipisahkan oleh CCl3 dan CCl3O2 hasil konversi CCl4 (abstraksi hydrogen) sehingga menyebabkan reaksi peroksidasi lipid. Reaksi peroksidasi lipid ini akan menghasilkan senyawa akhir berupa aldehid, alkana, dan carbonyl yang terbentuk dalam ikatan kovalen (Weber, et al., 2003). Reaksi ini mempunyai sifat autokatalitik yang akan mengakibatkan struktur dan fungsi sel mengalami kerusakan dengan cepat (Kumar et al., 2009) Kerusakan membran karena reaksi peroksidasi lipid akan menyebabkan inaktivasi plasma membran Na+, K+, dan Ca2+ ATP-ase sehingga Ca2+ dari luar sel akan masuk kedalam sitosol (Weber, et al., 2003). Peningkatan kalsium di sitosol oleh karena peroksidasi lipid akan menyebakan deplesi ATP sehingga terjadi kerusakan pada membran sel (Kumar, et al., 2009). Deplesi ATP kemudian akan membuat sel untuk melakukan respirasi secara anaerob guna memproduksi ATP,.
(46) 26. hasil samping respirasi anaerob akan meyebabkan akumulasi dari asam laktat. Akumulasi asam laktat dapat membuat pH seluler turun yang dapat mengakibatkan ribosom lepas dari RE kasar, dan akan menyebabkan peningkatan dari degradasi sel (Kemp, et al., 2008). Paparan CCl4 akan memicu stres oksidatif yang berat sehingga akan menyebabkan peningkatan kalsium intraseluler yang dapat memicu kerusakan membran sel (Moslen, 2001). Kadar dari kalsium tinggi dan tidak terkendali di dalam hepatosit akan mengaktivasi beberapa enzim katabolik, seperti protease, fosfolipase dan endonuklease (Khalaf, et al., 2009). Aktivasi dari enzim protease akan mengakibatkan protein membran dan sitoskeleton mengalami kerusakan yang akan membuat membran sel lepas dari kerangka sel, hal ini menyebabkan sel sangat rentan untuk ruptur. Aktivasi dari enzim fosfolipase dapat membuat kandungan fosfolipid membran turun yang akan memicu membran sel mengalami kerusakan. Sedangkan aktivasi dari enzim endonuklease mengakibatkan fragmentasi kromatin dan DNA. Semua aktivasi dari enzim diatas dapat menyebabkan nekrosis pada hepatosit (Kumar, et al., 2009). 2.2.3. Histopatologi Hepar Akibat CCl4 Toksisitas yang dialami jaringan akibat induksi dari CCl4 pada pemeriksaan histopatologi tampak berupa degenerasi sel, nekrosis yang dapat merusak struktur sel, dan penimbunan lemak (steatosis) (Yasuda et al., 2000). Induksi CCl4 dengan konsentrasi yang tinggi kurang dari 30 menit akan menyebabkan sintesis protein hepar turun, sedangkan induksi rentang waktu kurang lebih 2 jam akan menyebabkan pembengkakkan RE halus dan ribosom lepas dari RE kasar (Kumar et al., 2009).
(47) 27. Steatosis adalah suatu proses degenerasi yang ditimbulkan melalui berbagai macam proses yang berbeda, khususnya terjadi pada hepatosit (Abrams, 1994). Dalam keadaan normal hepatosit akan terlihat aktif sehingga lipid akan terkumpul di dalam hepar (Botham dan Mayes, 2006). Berdasarkan sistem skoring untuk NASH, jika terjadi steatosis berkisar 0-5% dari keseluruhan hepatosit menandakan hepar masih dalam keadaan normal (Kleiner, et al., 2005). Apabila lipid terakumulasi secara berlebihan (>5%), merupakan kondisi patologis karena metabolisme lipid di dalam hepar mengalami gangguan (Botham dan Mayes, 2006). Mekanisme steatosis hepatosit dilihat dalam 3 pola, yaitu steatosis perifer, difus, dan sentral. Steatosis perifer diakibatkan karena adanya gangguan nutrisi, kemudian steatosis sentral biasanya disebabkan karena kondisi hipoksia dan terpapar zat toksik seperti CCl4, sedangkan steatosis difus dapat terjadi karena paparan kronis dari alkohol (Sandritter, 1989). Induksi CCl4 dapat menyebabkan steatosis sentral, steatosis ini dapat mencapai sepertiga hingga setengah pada setiap lobulus hepar (Fawcett, 2002). Toksisitas akut akibat CCl4 akan menyebabkan akumulasi lipid pada hepatosit sebelum munculnya nekrosis (Moslen, 2001). Proses nekrosis sel dapat dicirikan dengan timbulnya kebocoran sel dan pembengkakan, infiltrasi dari sel-sel yang mengalami inflamasi serta perubahan dari nukleus akibat dari penguraian DNA secara spesifik. Perubahan tersebut dapat berupa kariolisis, karioreksis, dan piknosis (Kumar, et al., 2009). Kariolisis (lisisnya nukelus), karioreksis (fragmentasi nukleus), dan piknosis (penciutan sel dan peningkatan basofilia) adalah gambaran dari perubahan sel yang mempunyai sifat ireversibel, hal tersebut disebabkan karena membran plasma rusak, hilangnya dari DNA atau mitokondria. Disfungsi mitokondria dan membran sel adalah faktor.
(48) 28. yang dapat menyebabkan kerusakan sel secara ireversibel (Kemp, et al., 2008). Ciri khas pada fibrosis hepar adalah terdapat akumulasi dari Extracellular Matrix (ECM) yang dihasilkan karena cedera pada hepar yang disebabkan oleh berbagai macam faktor (Petitclerc, et al., 2016). Tahap fibrosis hepar ditentukan oleh skala 0-4 melalui penilaian visual dan distribusi jaringan fibrosa pada slide histopatologi. • Skala 0: tidak adanya fibrosis hepar. • Skala 1: fibrosis ringan dalam bentuk fibrosis portal. • Skala 2: fibrosis yang bermakna dalam bentuk fibrosis portal dan beberapa septa antara saluran portal atau vena hepatica. • Skala 3: fibrosis berat dalam bentuk fibrosis septum. • Skala 4: sirosis hepar dalam bentuk fibrosis difus yang menggambarkan nodul regeneratif (Kim, et al., 2012). Spesimen hepar yang telah diinduksi CCl4 menunjukkan sisa-sisa hepatosit yang mengalami degenerasi dan ballooned / nekrotik yang mengandung inklusi hialin asidofilik. Ruang sinusoidal juga diisi dengan eritrosit sebagai ciri aliran darah yang terganggu (Domitrovic, et al., 2009)..
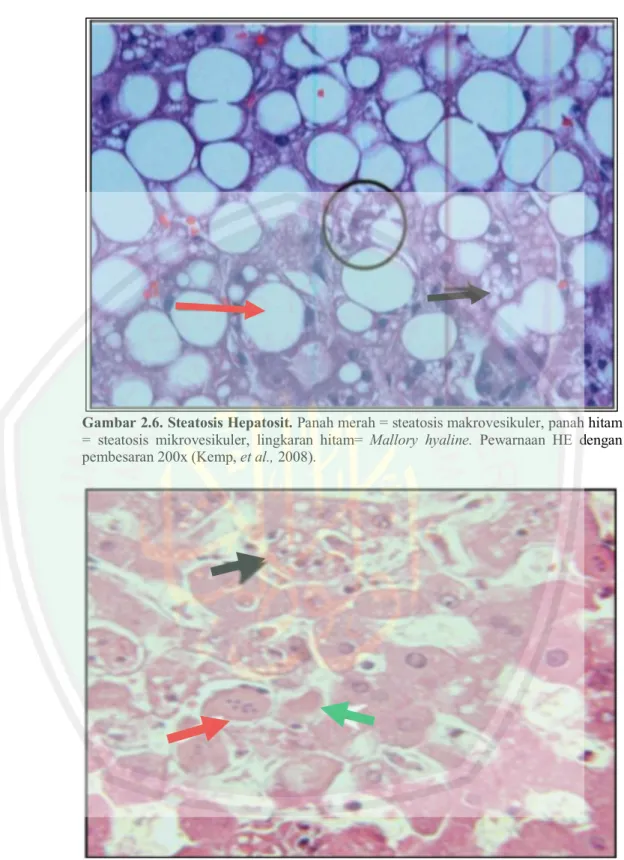
(49) 29. Gambar 2.6. Steatosis Hepatosit. Panah merah = steatosis makrovesikuler, panah hitam = steatosis mikrovesikuler, lingkaran hitam= Mallory hyaline. Pewarnaan HE dengan pembesaran 200x (Kemp, et al., 2008).. Gambar 2.7. Nekrosis Hepatosit. Panah hijau = kariolisis; panah hitam = piknosis, panah merah = karioreksis. Pewarnaan HE dengan pembesaran 400x (Mclntosh, et al., 2007).
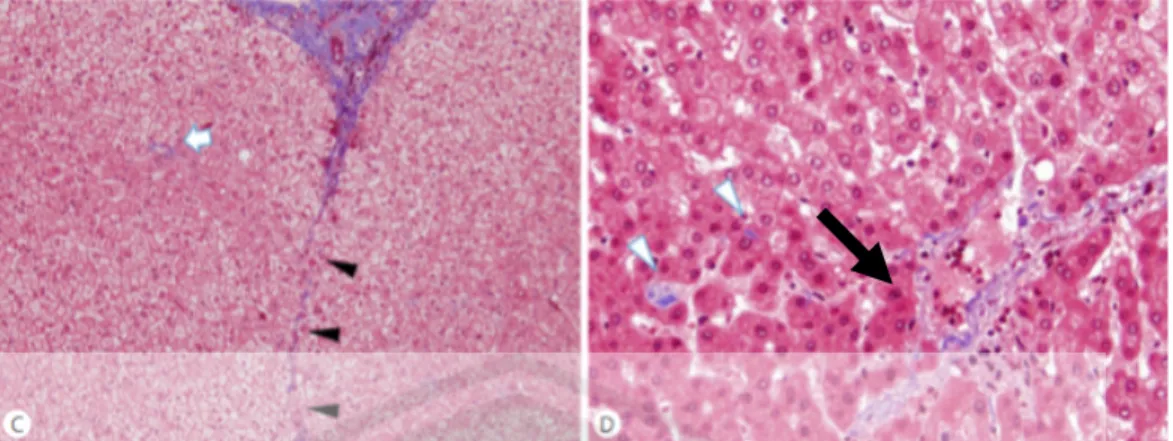
(50) 30. Gambar 2.8. Jaringan Fibrosa Pada Hepar. Keterangan: (C) kepala panah hitam = jaringan kolagen di saluran portal, (D) panah hitam: jaringan fibrosa. Pewarnaan Masson’s trichrome pembesaran 40x dan 200x (Lo dan Kim, 2017).. Gambar 2.9. Staging Fibrosis Hepar. Keterangan: 0: tidak ada fibrosis, 1: fibrosis perisinusoidal zona ringan (zona 2, terletak diantara zona 1 dan zona 3), 2: fibrosis perisinusoidal zona 3 (terletak di sekitar vena sentralis), portal dan periportal, 3: menjembatani fibrosis, 4: sirosis. Pewarnaan Masson’s trichrome Pembesaran 5x-10x (Petitclerc, et al., 2016). 2.2.4. Penilaian Skor Fibrosis Hepar Ada berbagai macam cara yang dapat digunakan untuk melakukan penilaian skor fibrosis, salah satunya yaitu dengan cara histopatologi yang dilihat dengan mikroskop. Sistem yang menggunakan 5 tingkatan (0-4), yaitu Scheuer, BattsLudwig, METAVIR, Brunt, et al., dan Kleiner, et al., dan sistem yang menggunakan 7 tingkatan (0-6), yaitu Ishak. Fibrosis dapat dinyatakan ketika jumlah skor ³ 2/4 (Almpanis, et al., 2016). Dari beberapa sistem penilaian diatas, sistem yang dikembangkan oleh Ishak dan sistem METAVIR adalah yang digunakan secara luas (Mohamadnejad, et al., 2010)..
(51) 31. a).. Sistem Skor METAVIR Skor ini diusulkan oleh kelompok studi Metavir Prancis pada tahun. 1996 untuk evaluasi histologis penyakit hepar kronis terkait hepatitis C (Mannan, et al., 2014). Skor fibrosis metavir didefinisikan sebagai berikut: • F0: tidak ada fibrosis • F1: fibrosis portal tanpa septa • F2: fibrosis portal dengan septa yang jarang • F3: banyak septa tanpa sirosis • F4: sirosis. Kelebihan skor METAVIR, yaitu kesederhanaan, reproduksibilitas, dan dapat diaplikasikan dalam sejumlah besar biopsi (Shiha dan Zalata, 2011).. Gambar 2.10. Sistem Skor METAVIR (Sumber: Shiha dan Zalata, 2011). b).. Sistem Skor Ishak Sistem ini dikenalkan pada tahun 1994 oleh Ishak yang digunakan. untuk mendeskripsikan terminologi fibrosis. Banyak peneliti telah menggunakan sistem penilaian ini untuk menilai HAI pada karier Hepatitis-.
(52) 32. B kronis asimptomatik (Mannan, et al., 2014). Sistem skor Ishak mempunyai enam tingkatan, yaitu: • 0: tidak ada fibrosis. • 1: ekspansi beberapa area portal atau tanpa septa. • 2: ekspansi dari hampir area portal atau tanpa septa. • 3: ekspansi dari hampir area portal dengan portal bridging. • 4: ekspansi dari hampir area portal dengan portal central bridging. • 5: bridging dengan kadang terdapat nodul. • 6: sirosis (Almpanis, et al., 2016). Tabel 2.1. Perbandingan Skor Ishak Dengan METAVIR. Sumber: Bedossa, et al., 2015.
(53) 33. 2.3. Kosambi (schleichera oleosa) 2.3.1. Klasifikasi Kosambi Klasifikasi kosambi (Schleichera oleosa) adalah sebagai berikut (ITIS, 2017): Kingdom. : Plantae. Infrakingdom : Streptophyta Divisi. : Tracheophyta. Subdivisi. : Spermatophytina. Kelas. : Magnoliopsida. Ordo. : Sapindales. Famili. : Sapindaceae. Genus. : Schleichera. Spesies. : Schleichera oleosa. 2.3.2. Tempat Tumbuh Kosambi (Schleichera oleosa) Pohon kosambi dapat tumbuh secara alami yang tersebar di lembah Himalaya, Indonesia, dan Sri Langka. Di Indonesia, pohon kosambi dapat tumbuh dengan baik di daerah Jawa, Nusa Tenggara, Bali, Maluku, Sulawesi, Pulau Seram dan Pulau Kai. Di wilayah Jawa Timur, kosambi di temukan di daerah Panarukan, Pasuruan, Besuki, dan daerah lainnya (Heyne, 1987)..
(54) 34. Gambar 2.11. Pohon Kosambi (Sumber: Jaiswal dan Singh, 2015). Kosambi tumbuh di daratan rendah yang mempunyai iklim kering dan dapat tumbuh di ketinggian 600 mdpl, namun umumnya ditanam di daerah sekitar pantai sampai dengan di ketinggian 250 mdpl. Di Pulau Jawa, kosambi terdapat di daerah rendah, namun juga terdapat di daerah dengan ketinggian mencapai (900–1200) m. Untuk hidup, kosambi memerlukan curah hujan tahunan sekitar 750 – 2500 mm. Kosambi dapat bertahan pada suhu yang maksimum sekitar 35 – 47,50C dan suhu minimum 2,50C. Kosambi dapat tumbuh di tanah yang kering tapi terkadang tumbuh di tanah berawa. (Suita, 2012). 2.3.3. Ciri-Ciri Tanaman Kosambi (Schleichera oleosa) a).. Batang Pohon kosambi dapat tumbuh hingga mencapai 40 m, diameternya. dapat mencapai 2 m. Batang kosambi biasanya berbentuk bengkok, bermata kayu dan juga berbanir. Kulit batangnya memiliki tekstur halus dan berwarna abu-abu. Batangnya mempunyai bentuk silindris yang tipis, berkerucut, dan berbulu pendek dengan warna kuning kemerahan saat muda (Suita, 2012)..
(55) 35. Gambar 2.12. Batang Kosambi (Sumber: Herbarium JCB, 2019). b).. Daun Daun kosambi mempunyai sirip genap dengan anak daun yang terakhir. seringkali sama dengan ujung anak daun. Daunnya berbentuk lanset dan berseling, dengan panjang berukuran 11-25 cm dan lebarnya 2-6 cm. Tepi daunnya rata, dan ujungnya lancip. Pertulangan daun menyirip, tangkai daunnya bulat dengan panjang + 1 cm dan daunnya berwarna hijau (Suita, 2012).. Gambar 2.13. Daun Kosambi (Sumber: Kundu dan Schmidt, 2011).
Gambar

Dokumen terkait
Tujuan: Untuk membuktikan adanya pengaruh pemberian tempe kedelai hitam terhadap sel lemak hepar tikus putih dengan diet tinggi lemak dan propiltiourasil (PTU).. Metode:
Tujuan : Untuk membuktikan pengaruh pemberian minyak goreng deep frying berulang empat kali lebih terhadap gambaran histologi hepar tikus putih (Rattus
Pengaruh Ekstrak Daun Jambu biji merah (Psiidium Guajava L.) Terhadap Kerusakan Sel Hepar Tikus Putih (Rattus Novergicus Strain Wistar) Akibat Paparan Isoniazid
Memberi informasi ilmiah tentang pengaruh ekstak buah pare ( Momordica Charantia L ) terhadap histopatologi sel hepar pada tikus ( Rattus Norvegicus Strain Wistar) yang
Skripsi berjudul ” Pengaruh Pemberian Ekstrak Buah Mahkota Dewa (Phaleria macrocarpa) Terhadap Gambaran Makroskopis Hepar Tikus Putih (Rattus norvegicus) Galur Sprague dawley yang
Penelitian ini bertujuan untuk mengetahui adanya pengaruh pemberian ekstrak daun sirsak ( Annonna muricata Linn ) terhadap kerusakan sel hepar tikus putih ( Rattus
Mengetahui pengaruh astaxanthin terhadap aktivitas spsesifik enzim GPx jaringan hepar tikus putih (Rattus norvegicus) jantan galur wistar yang diberi formaldehid secara
Hasil rerata persentase hepatosit normal, diameter vena sentralis, lebar sinusoid dan berat hepar yang tidak berbeda nyata antara kelompok kontrol normal dan kontrol positif