KINETIKA ADSORPSI ION LOGAM Cu, Cd DAN Mn DALAM AIR LIMBAH MENGGUNAKAN ADSORBEN
SERBUK GERGAJI KAYU MERANTI
SKRIPSI
JENI SETYOWATI
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2018 M / 1440 H
KINETIKA ADSORPSI ION LOGAM Cu, Cd DAN Mn DALAM AIR LIMBAH MENGGUNAKAN ADSORBEN
SERBUK GERGAJI KAYU MERANTI
Skripsi
Sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh:
JENI SETYOWATI 11140960000020
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2018 M / 1440 H
ABSTRAK
JENI SETYOWATI. Kinetika Adsorpsi Ion logam Cu, Cd dan Mn dalam Air Limbah Menggunakan Adsorben Serbuk Gergaji Kayu Meranti. Dibimbing oleh NURHASNI dan ISALMI AZIZ
Limbah hasil kegiatan industri berupa ion logam berat banyak menyebabkan pencemaran lingkungan sehingga dibutuhkan cara untuk mengurangi dampak dari pencemaran tersebut. Penelitian ini memanfaatkan serbuk gergaji kayu meranti untuk menyerap ion logam berat. Penelitian bertujuan untuk menentukan efisiensi adsorpsi, kapasitas adsorpsi, jenis isotherm adsorpsi dan kinetika adsorpsi dari adsorben terhadap ion logam Cuprum (Cu), Kadmium (Cd) dan Mangan (Mn).
Analisis adsorben dilakukan dengan menggunakan FTIR dan SEM. Aktivasi adsorben dilakukan dalam tiga metode, yaitu tanpa aktivasi, aktivasi fisika dan aktivasi kimia. Hasil penelitian ini menunjukan bahwa adsorben yang terbaik adalah yang diaktivasi secara fisika dengan konsentrasi adsorben optimum sebesar 2,5%, konsentrasi adsorbat 10 ppm dengan efisiensi adsorpsi mencapai 100%, pH optimum adalah pH 5 untuk ion logam Cu dan Cd dan pH 6 untuk ion logam Mn.
Suhu dan waktu optimum yang didapatkan pada 60 oC selama 60 menit. Jenis isotherm adsorpsi ion logam Cu, Cd dan Mn adalah isotherm Freundlich dengan nilai R2 sebesar 0,9242; 0,9946 dan 0,9784 dan kinetika adsorpsinya mengikuti alur orde nol untuk ion logam Cu, Cd dan Mn. Hasil analisis FTIR menunjukan adanya gugus –OH pada adsorben serbuk gergaji kayu meranti yang dapat mengikat ion logam pada adsorbat. Hasil dari analisis menggunakan SEM menunjukan morfologi sebelum adsorpsi bersih dan berongga sedangkan setelah adsorpsi adsorben menjadi lebih padat dan bergelombang. Hal ini menunjukan jika ion logam telah berikatan dengan gugus yang ada pada adsorben.
Kata Kunci: Isotherm Freundlich, kinetika adsorpsi, orde nol
ABSTRACT
JENI SETYOWATI. The Adsorption Kinetics of Cu, Cd dan Mn Metal Ion in Wastewater Using Sawdust of Meranti Wood Absorbent. Advisor by NURHASNI and ISALMI AZIZ
Waste resulting from industrial activities in the form of heavy metals causes a lot of environmental pollution, so we need a way to reduce the impact of the pollution. This study utilizes meranti wood sawdust to absorb heavy metal ions.
Study aims to determine the adsorption efficiency, adsorption capacity, type of adsorption isotherm and adsorption kinetics from adsorbents on Cuprum (Cu), Cadmium (Cd) and Manganese (Mn) metal ions. Adsorbent analysis was carried out using FTIR and SEM. Activation of adsorbents is carried out in three method, namely without activation, physical activation and chemical activation. The results of this study indicate that the best adsorbent is physically activated with optimum adsorbent concentration of 2.5%, adsorbate concentration of 10 ppm with adsorption efficiency reaching 100%, optimum pH is pH 5 for Cu and Cd metals and pH 6 for Mn metals ions. The optimum temperature and time obtained at 60 oC for 60 minutes. The types of adsorption of Cu, Cd and Mn metals are Freundlich isotherms with a R2 value of 0.9242; 0.9946 and 0.9784 and the adsorption kinetics follow the zero order flow for Cu, Cd and Mn metals. The results of FTIR analysis showed the presence of -OH groups on the adsorbent of meranti wood sawdust which can bind metal ions to the adsorbate. The results of the analysis using SEM showed morphology before the adsorption was clean and hollow while after adsorption the adsorbent became more dense and wavy. This shows that metal ions have bonded to the groups present in the adsorbent.
Keywords: Freundlich isotherm, adsorption kinetics, zero order
viii
KATA PENGANTAR
Syukur Alhamdulillah penulis haturkan kehadirat Allah Subhanahu Wa Ta’ala yang telah memberikan rahmat dan karunia-Nya kepada penulis, sehingga
penulis dapat menyelesaikan skripsi yang berjudul Kinetika Adsorpsi Ion logam Cu, Cd dan Mn dalam Air Limbah menggunakan Adsorben Serbuk Gergaji Kayu Meranti. Dalam pelaksanaan penyusunan skripsi ini, penulis mendapat banyak bantuan, bimbingan, dan arahan dari berbagai pihak. Oleh sebab itu dalam kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang tulus kepada:
1. Nurhasni, M.Si, selaku Pembimbing I yang telah memberikan ilmu pengetahuan, bimbingan serta waktunya dalam mengarahkan penulis selama penelitian;
2. Isalmi Aziz, M.T, selaku Pembimbing II yang telah memberikan bimbingan dan arahan serta waktunya untuk berdiskusi dengan penulis;
3. Dr. Hendrawati dan Nurmaya Arofah, M.Eng, selaku Penguji yang telah banyak memberikan kritik dan saran dalam penyusunan skrispsi ini;
4. Drs. Dede Sukandar, M.Si, selaku Ketua Program Studi Kimia Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta;
5. Dr. Agus Salim, M.Si, selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta;
6. Seluruh Dosen dan Laboran Program Studi Kimia UIN Syarif Hidayatullah Jakarta yang selama ini telah memberikan ilmu pengetahuan serta bimbingan kepada penulis selama mengikuti perkuliahan dan penelitian;
ix 7. Bapak Jamio dan Ibu Suparti selaku Orang Tua dan Adik penulis (Niko dan Fitrriana) serta Keluarga tercinta yang senantiasa membantu penulis dengan selalu memberikan do’a dan dukungan baik secara material maupun moril;
8. Sariana Harahap, Riska Isnaeny, Muhammad Fajar serta teman-teman mahasiswa Program Studi Kimia angkatan 2014 yang telah memberi dukungan kepada penulis;
9. Muhammad Akbar Tafdila, Zelda Zein HZ, Ita Lailatul Latifah, dan Niah Kusuma Hapsari yang telah membantu penulis selama proses penelitian;
10. Tim Riders, UnKnown, dan Social Squad yang selalu membantu dan mendukung penulis selama penyusunan skripsi;
11. Semua pihak yang telah membantu penulis selama penelitian berlangsung yang tidak dapat disebutkan satu persatu.
Semoga arahan, motivasi, dan bantuan yang telah diberikan menjadi amal ibadah bagi keluarga, bapak, dan rekan-rekan, sehingga memperoleh balasan yang lebih baik dari Allah Subhanahu Wa Ta’ala.
Jakarta, Oktober 2018
Penulis
x DAFTAR ISI
Halaman
KATA PENGANTAR ...viii
DAFTAR ISI ...x
DAFTAR TABEL ...xiii
DAFTAR GAMBAR ...xiv
DAFTAR LAMPIRAN ...xvi
BAB I PENDAHULUAN ...1
1.1 Latar Belakang ...1
1.2 Rumusan Masalah ...5
1.3 Hipotesis ...5
1.4 Tujuan Penelitian ...6
1.5 Manfaat Penelitian ...6
BAB II TINJAUAN PUSTAKA ...7
2.1 Air Limbah...7
2.2 Serbuk Gergaji Kayu Meranti ...9
2.3 Adsorpsi ...11
2.3.1 Isotherm Adsorpsi Langmuir ...13
2.3.2 Isotherm Adsorpsi Freundlich ...15
2.4 Kinetika Adsorpsi ...16
2.5 Logam Berat ...18
2.5.1 Logam Cuprum (Cu) ...20
2.5.2 Logam Kadmium (Cd) ...21
2.5.3 Logam Mangan (Mn) ...23
2.6 Spektroskopi Serapan Atom (SSA) ...24
2.7 Fourier Transform Infrared Spectroscopy (FT-IR) ...26
2.8 Scanning Electron Microscopy (SEM) ...28
xi
BAB III METODE PENELITIAN ...30
3.1 Tempat dan Waktu Penelitian ...30
3.2 Alat dan Bahan ...30
3.2.1 Alat ...30
3.2.2 Bahan ...30
3.3 Diagram Alir Penelitian ...31
3.4 Prosedur Kerja ...32
3.4.1 Preparasi Serbuk Gergaji Kayu Meranti ...32
3.4.2 Aktivasi Serbuk Gergaji Kayu Meranti ...32
3.4.2.1 Tanpa aktivasi ...32
3.4.2.2 Aktivasi secara fisika ...32
3.4.2.3 Aktivasi secara kimia ...32
3.4.3 Penentuan Kondisi Optimum Adsorpsi Tanpa Aktivasi ...33
3.4.3.1 Konsentrasi adsorben ...33
3.4.3.2 Konsentrasi adsorbat ...33
3.4.3.3 pH ion logam ...34
3.4.3.4 Waktu dan suhu adsorpsi ...34
3.4.4 Analisis Gugus Fungsi dengan Fourier-Transform Infrared Spectroscopy (FT-IR)...35
3.4.5 Analisis Morfologi Permukaan dengan Scanning Electron Microscopy (SEM) ...35
3.4.6 Penentuan Isotherm Adsorpsi...36
3.4.7 Penentuan Kinetika Adsorpsi ...36
3.4.8 Regenerasi Adsorben ...36
BAB IV HASIL DAN PEMBAHASAN ...37
4.1 Adsorben Serbuk Gergaji Kayu Meranti ...37
4.2 Kondisi Optimum Adsorpsi ...40
4.2.1 Konsentrasi adsorben ...40
4.2.2 Konsentrasi adsorbat ...43
4.2.3 pH ion logam ...46
4.2.4 Metode aktivasi adsorben ...49
xii
4.2.5 Waktu dan suhu ...50
4.3 Isotherm Adsorpsi ...52
4.4 Kinetika Adsorpsi ...55
4.5 Regenerasi adsorben ...59
4.6 Analisis gugus Fungsi dengan Fourier-Transform Infrared Spectroscopy (FT-IR) ...62
4.7 Morfologi Permukaan dengan Scanning Electron Microscopy (SEM) ...64
BAB V PENUTUP ...66
5.1 Simpulan ...66
5.2 Saran ...66
DAFTAR PUSTAKA ...67
LAMPIRAN ...74
xiii
DAFTAR TABEL
Halaman
Tabel 1. Komposisi kimia kayu Meranti ...10
Tabel 2. Nilai rata-rata R2 ...56
Tabel 3. Regenerasi adsorben ...61
Tabel 4. Gugus fungsi adsorben ...63
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Selulosa ...11
Gambar 2. Plot antara (x/m) terhadap C ...15
Gambar 3. Plot antara log (x/m) terhadap log C...16
Gambar 4. Skema umum komponen pada Alat SSA ...26
Gambar 5. Skema kerja FT-IR ...27
Gambar 6. Skema kerja SEM ...29
Gambar 7. Diagram Alir Penelitian ...31
Gambar 8.(a) aktivasi fisika (b) aktivasi kimia (c) tanpa aktivasi ...38
Gambar 9. Mekanisme reaksi hidrolisis asam pada selulosa ...39
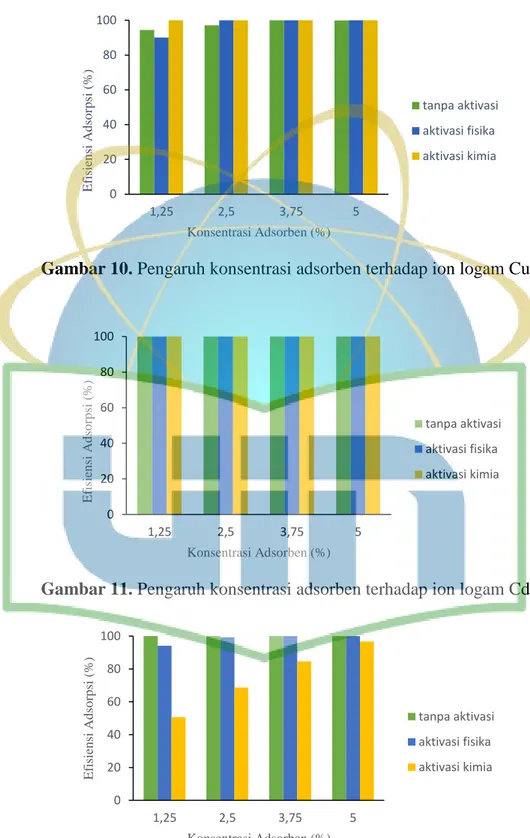
Gambar 10. Pengaruh konsentrasi adsorben terhadap ion logam Cu ...41
Gambar 11. Pengaruh konsentrasi adsorben terhadap ion logam Cd ...41
Gambar 12. Pengaruh konsentrasi adsorben terhadap ion logam Mn ...41
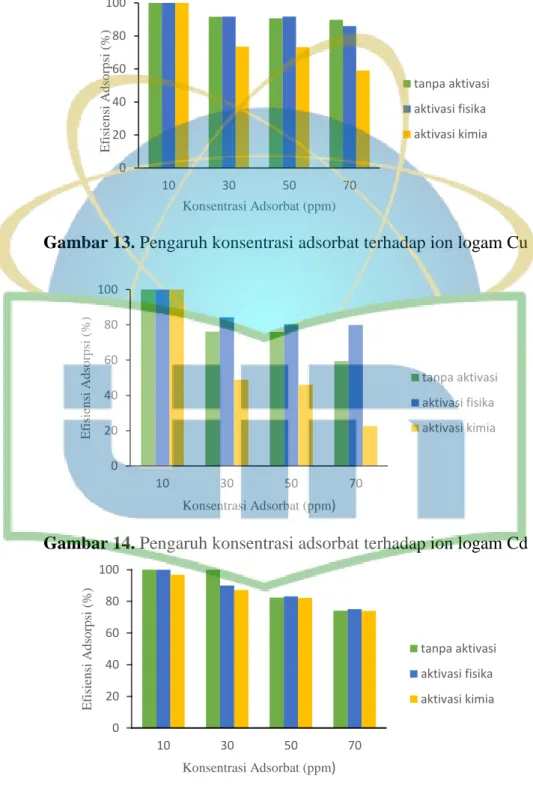
Gambar 13. Pengaruh konsentrasi adsorbat terhadap ion logam Cu ...44
Gambar 14. Pengaruh konsentrasi adsorbat terhadap ion logam Cd ...44
Gambar 15. Pengaruh konsentrasi adsorbat terhadap ion logam Mn ...44
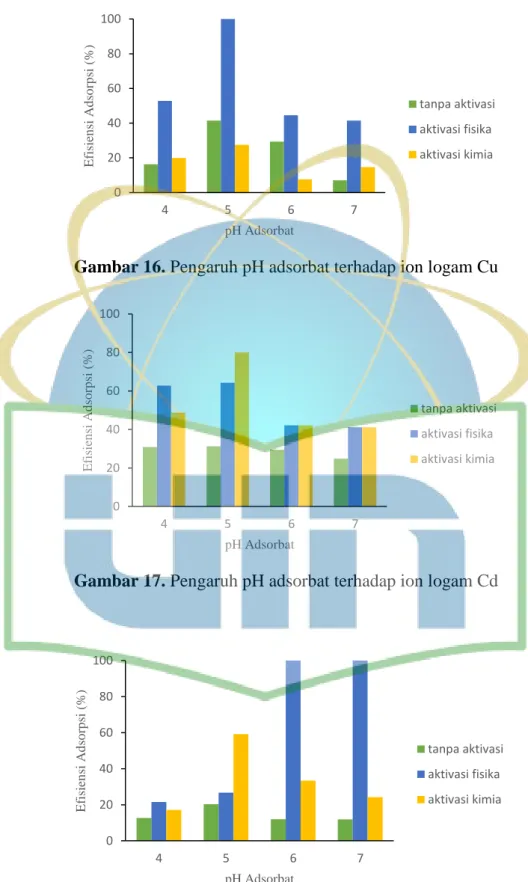
Gambar 16. Pengaruh pH adsorbat terhadap ion logam Cu ...47
Gambar 17. Pengaruh pH adsorbat terhadap ion logam Cd ...47
Gambar 18. Pengaruh pH adsorbat terhadap ion logam Mn ...47
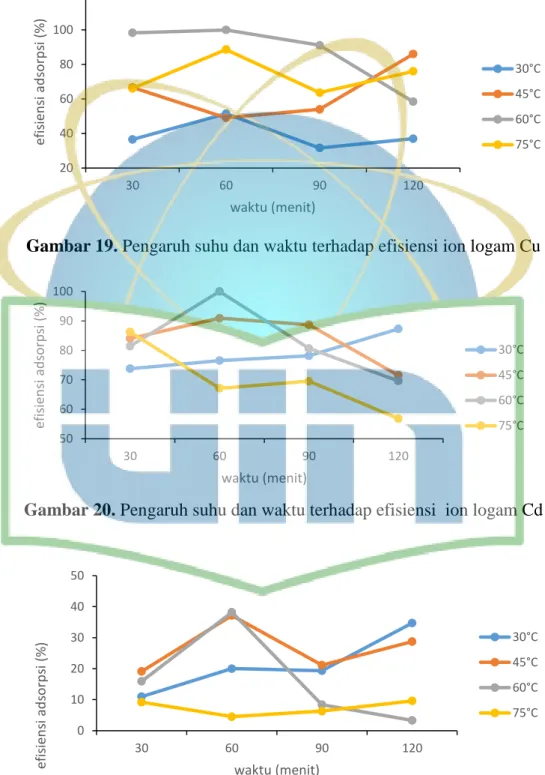
Gambar 19. Pengaruh suhu dan waktu terhadap ion logam Cu ...51
Gambar 20. Pengaruh suhu dan waktu terhadap ion logam Cd ...51
Gambar 21. Pengaruh suhu dan waktu terhadap ion logam Mn ...51
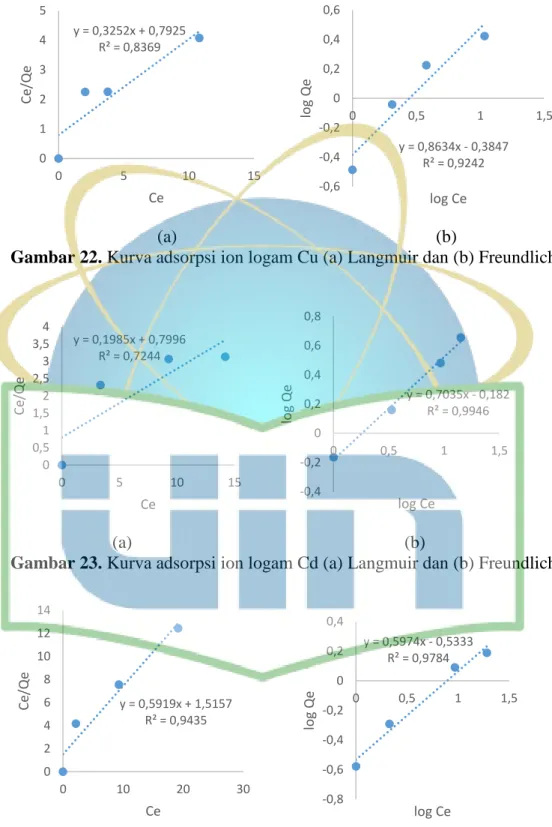
Gambar 22. Kurva adsorpsi ion logam Cu (a) langmuir dan (b) freundlich ...53
Gambar 23. Kurva adsorpsi ion logam Cd (a) langmuir dan (b) freundlich ...53
Gambar 24. Kurva adsorpsi ion logam Mn (a) langmuir dan (b) freundlich...53
Gambar 25. Kurva regresi linear ion logam Cu...58
Gambar 26. Kurva regresi linear ion logam Cd...58
Gambar 27. Kurva regresi linear ion logam Mn ...58
Gambar 28. Mekanisme desorpsi menggunakan EDTA ...60
xv Gambar 29. Spektrum gugus fungsi adsorben ...63 Gambar 30. Permukaan adsorben aktivasi fisika sebelum adsorpsi (a)
sesudah adsorpsi (b) perbesaran 5000x ...64 Gambar 31. Morfologi permukaan pembanding sebelum adsorpsi (a) dan
sesudah adsorpsi (b) ...65
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data adsorpsi ...74
Lampiran 2. Grafik kapasitas adsorpsi ...85
Lampiran 3. Data isotherm adsorpsi...89
Lampiran 4. Data kinetika adsorpsi ...92
Lampiran 5. Data perhitungan archenius ...95
Lampiran 6. Grafik orde kinetika adsorpsi ...97
Lampiran 7. Perhitungan ...100
Lampiran 8. Pembutan larutan ...101
Lampiran 9. Pembuatan pH buffer ...103
Lampiran 10. Panjang Gelombang Maksimum Larutan Uji ...104
Lampiran 11. Baku mutu air limbah ...107
Lampiran 12. Hasil spektrum FT-IR ...108
Lampiran 13. Hasil analisis SEM ...109
Lampiran 14. Gambar alat, bahan dan proses penelitian ...111
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Pencemaran dapat terjadi salah satunya disebabkan oleh banyaknya air limbah mengandung zat berbahaya yang dibuang begitu saja ke badan air tanpa melalui pengolahan terlebih dahulu atau sudah diolah tetapi belum memenuhi persyaratan. Logam berat yang masuk ke dalam lingkungan perairan akan mengalami pengendapan, kemudian diserap oleh organisme yang hidup di perairan tersebut (Fitriyah et al., 2013). Pencemaran yang disebabkan oleh logam berat merupakan masalah serius yang harus diselesaikan. Logam berat yang kandungannya melebihi ambang batas jika terakumulasi di dalam tubuh dapat menyebabkan penyakit serius bagi kesehatan manusia jika tetap tinggal dalam jangka waktu yang lama (Kundari & Slamet, 2008). Kegiatan manusia seperti penambangan logam, pelapisan dan pencampuran logam, industri minyak dan pigmen, pembuatan pestisida dan industri penyamakan kulit sangat berpotensi menghasilkan limbah yang mengandung ion logam berat (Igwe & Abia, 2006).
Logam Cu banyak digunakan dalam industri batu baterai, logam Cd banyak digunakan pada lempengan elektroda dan logam Mn digunakan dalam industri tekstil dan sebagai campuran dari logam (alloy). Ekstraksi pertambangan Cd merupakan hasil samping dari tambang seng (kandungan Cd sebesar lebih kurang 3 kg dalam 1 ton Zn) yang berpotensi mencemari lingkungan. Uji kandungan kadar ion logam yang dilakukan di Muara DAS Barito, mengandung kadar Cadmium (Cd) pada stasiun pengamatan rerata sebesar 0,002 ppm sampai 0,0067 ppm (Sofarini et al., 2010) . Uji kadar ion logam Cu dilakukan di sungai Surabaya dengan kandungan
2 Cu dalam air antara 0,37-0,81 ppm melebihi ambang baku mutu (Fitriyah et al., 2013). Konsentrasi logam Mn di Pesisir Teluk Lampung yaitu sekitar 106,01 ppm hingga 107,69 ppm (Frederica et al., 2016). Produsen atau perusahaan tekstil nasional berada di Jawa Barat atau di sepanjang DAS Citarummencapai 60 persen.
Sebanyak 48 persen industri yang diamati, rata-rata pembuangan limbahnya 10 kali melampaui baku mutu yang telah ditetapkan (Desriko, 2016). Limbah industri ini dapat memperburuk kondisi lingkungan terutama lingkungan perairan. Logam berat lainnya yang berbahaya dan mencemari lingkungan antara lain merkuri (Hg), timbal (Pb), arsenik (As), khromium (Cr), dan nikel (Ni) (Darmono, 1995). Metode menghilangkan kandungan logam berat dalam limbah dapat dilakukan dengan cara adsorpsi. Proses adsorpsi lebih banyak dipakai dalam industri karena mempunyai beberapa keuntungan, yaitu lebih ekonomis dan tidak menimbulkan efek samping yang beracun (Wulandari et al., 2015).
Adsorben (zat penyerap) yang dapat digunakan pada proses adsorpsi antara lain karbon aktif, silika dan alumina, zeolit, arang tulang, dan oksida-oksida ion logam (Suzuki, 1990). Penelitian mengembangkan adsorben telah banyak dilakukan menggunakan bahan-bahan organik. Penelitian adsorben ini dilakukan dalam rangka mencari metode dan bahan yang relatif murah dan mudah (Lestari et al., 2003). Bahan baku yang berasal dari bahan organik dapat dibuat menjadi arang
aktif karena bahan baku tersebut mengandung karbon. Metode aktivasi ini dilakukan secara fisika (Sembiring, et al., 2003). Adsorben yang diaktivasi secara kimia dilakukan dengan proses aktivasi menggunakan larutan kimia salah satunya adalah HCl (Irawan, et al., 2015). Bahan organik yang digunakan beberapa diantaranya adalah sekam padi (Nurhasni et al., 2014), jamur Mucor rouxii (Yan &
3 Viraraghavan, 2003), ganggang hijau (Pavasant et al., 2005), bakteri Thiobacillusthiooxidans (Liang Liu et al., 2004). Bahan-bahan organik ini
digunakan sebagai adsorben karena tersedia dalam jumlah yang banyak, ramah lingkungan dan murah (Deans & Dixon, 1992). Firman Allah Subhanahu Wa Ta’ala dalam Al-Qur’an Surah Asy-Syu’ara’ ayat 7:
Artinya: Dan apakah mereka tidak memperhatikan bumi, berapakah banyaknya Kami tumbuhkan di bumi itu berbagai macam tumbuh-tumbuhan yang baik? (Q.S Asy-Syu’ara’ [26]: 7).
Surah Asy-Syu’ara’ ayat 7 menegaskan bahwa Allah telah menciptakan segala macam tumbuh-tumbuhan yang ada di bumi ini dengan berbagai manfaat untuk segala makhluk hidup. Tumbuh-tumbuhan begitu banyak manfaatnya yang Allah ciptakan seperti tumbuhan yang digunakan untuk obat-obatan, untuk makanan sehari-hari, dan sebagainya. Bahan organik yang disebutkan sebelumnya yang telah banyak digunakan pada penelitian untuk mencari manfaat dari tumbuhan dalam mengembangkan ilmu pengetahuan. Tumbuhan pohon Meranti yang kayunya biasanya dimanfaatkan pada industri pembuatan pintu, lemari dan lain- lain. Kandungan dalam kayu Meranti yang kaya akan selulosa juga dapat dimanfaatkan untuk menyerap ion logam berat dalam suatu limbah.
Limbah pengolahan kayu pada industri kecil di pedesaan belum dimanfaatkan secara optimal, sedangkan potensi limbah gergaji kayu tersebut sangat besar.
Limbah ini akan menimbulkan masalah karena pada kenyataannya di lapangan masih ada yang ditumpuk, sebagian dibuang ke aliran sungai (pencemaran air), atau dibakar secara langsung sehingga perlu dilakukan penanganan yang maksimal.
4 Limbah penggergajian sederhana di pedesaan Jawa Barat sekitar 41,44 m3/bulan dan selama satu tahun diperkirakan akan mencapai 498,55 m3. Limbah penggergajian yang dihasilkan di Indonesia sebanyak 6 juta ton pertahun (Hengky
& Dewi, 2009).
Hajar et al (2016) menjelaskan tentang efektivitas adsorpsi ion logam Pb2+
dan Cd2+ menggunakan media adsorben cangkang telur ayam yang di aktivasi menggunakan HCl 0,1 M. Model kinetika adsorpsi penjerapan Pb2+ mengikuti model kinetika orde dua, sedangkan kinetika adsorpsi penjerapan Cd2+ mengikuti model kinetika orde nol. Penelitian menggunakan serbuk gergaji pernah dilakukan oleh Dey et al (2016) yang menjelaskan jika serbuk gergaji dapat dimanfaatkan untuk adsorpsi ion logam timbal (Pb). Adsorben teraktivasi asam nitrat 1 M ini menghasilkan pH optimum 6, berat optimum 400 mg, dan kapasitas adsorpsi optimum sebesar 0,15 mg Pb/mg serbuk gergaji. Nurhasni et al (2014) melakukan penelitian adsorben menggunakan sekam padi yang diaktivasi secara fisika untuk menyerap ion logam tembaga dan timbal dalam air limbah menggunakan metode statis (batch) dengan efisiensi penyerapan tertinggi pada air limbah multikomponen mencapai 99,38% untuk ion logam Pb dan 78,57% untuk ion logam Cu.
Penelitian ini akan menguji kemampuan serbuk gergaji kayu meranti dalam mengadsorpsi ion logam Cu, Cd dan Mn serta mengkaji kinetika adsorpsi terhadap ion logam. Kinetika adsorpsi menggambarkan laju penyerapan yang terjadi pada adsorben terhadap adsorbat. Kemampuan penyerapan adsorben terhadap adsorbat dapat dilihat dari laju adsorpsi dengan menduga orde reaksinya. Parameter yang diteliti adalah pengaruh konsentrasi adsorben, konsentrasi ion logam, pH, waktu dan suhu adsorpsi serta menentukan isoterm adsorpsi dan kinetika adsorpsi.
5 Adsorben yang digunakan terbagi menjadi 3 jenis yaitu tanpa aktivasi dan diaktivasi secara fisika dan kimia. Penentuan kondisi optimum dilakukan dengan menggunakan metode batch, kemudian dianalisis kapasitas penyerapan ion logamnya menggunakan SSA lalu adsorben dengan aktivasi terbaik dikarakterisasi dengan menggunakan FTIR dan SEM.
1.2 Rumusan Masalah
Rumusan masalah dari penelitian ini adalah:
1. Metode aktivasi (tanpa aktivasi, aktivasi fisika dan aktivasi kimia) manakah yang memiliki kemampuan adsorpsi lebih baik dalam menyerap ion logam?
2. Apakah konsentrasi adsorben, konsentrasi adsorbat, pH, waktu dan suhu adsorpsi mempengaruhi efisiensi adsorpsi dalam air limbah?
3. Bagaimana jenis isotherm adsorpsi pada penyerapan ion logam dengan adsorben serbuk gergaji kayu meranti?
4. Bagaimana persamaan kinetika adsorpsi ion logam menggunakan adsorben serbuk kayu meranti meliputi orde reaksi dan konstanta kecepatan reaksi?
1.3 Hipotesis
Hipotesis dari penelitian ini adalah:
1. Metode aktivasi secara fisika dan kimia memiliki kemampuan adsorpsi yang lebih baik dalam menyerap ion logam.
2. Konsentrasi adsorben, konsentrasi adsorbat, pH, waktu dan suhu adsorpsi berpengaruh terhadap efisiensi adsorpsi dalam air limbah.
6 3. Jenis isotherm adsorpsi pada penyerapan ion logam dengan adsorben serbuk
kayu meranti mendekati isotherm Freundlich daripada isotherm langmuir.
4. Kinetika adsorpsi ion logam pada adsorben serbuk gergaji kayu meranti mengikuti persamaaan orde nol.
1.4 Tujuan Penelitian Tujuan Penelitian ini adalah:
1. Menentukan metode aktivasi pada serbuk gergaji kayu meranti yang memiliki kemampuan adsorpsi lebih baik dalam menyerap ion logam.
2. Menentukan kondisi optimum konsentrasi adsorben, konsentrasi adsorbat, pH, waktu dan suhu adsorpsi.
3. Menentukan jenis isotherm adsorpsi pada penyerapan ion logam dengan serbuk gergaji kayu meranti.
4. Menentukan persamaan kinetika adsorpsi meliputi konstanta laju adsorpsi dan orde reaksi adsorpsi ion logam menggunakan adsorben serbuk gergaji kayu meranti.
1.5 Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah menggunakan limbah serbuk gergaji kayu meranti sebagai penyerap logam berat pada air limbah dan berguna sebagai adsorben alternatif dalam mengurangi pencemaran lingkungan akibat aktivitas industri, khususnya pada lingkungan perairan.
7 BAB II
TINJAUAN PUSTAKA
2.1 Air Limbah
Air limbah atau yang disebut dengan sewage biasanya berasal dari air limbah rumah tangga, manusia, dan binatang tapi kemudian berkembang selain dari sumber-sumber tersebut air limbah juga berasal dari kegiatan industri, run off, dan infiltrasi air bawah tanah. Air limbah pada dasarnya 99,94% berasal dari sisa kegiatan sehari-hari dan 0,06% berasal dari material yang terlarut oleh proses alam (Lin, 2001).
Menurut PP No. 18 tahun 1999 pengertian limbah adalah sisa suatu usaha dan/atau kegiatan. Limbah bahan berbahaya dan beracun disingkat menjadi limbah B3 adalah sisa suatu usaha dan/atau kegiatan yang mengandung bahan berbahaya dan/atau beracun yang karena sifat dan/atau konsentrasinya dan/atau jumlahnya, baik secara langsung maupun tidak langsung, dapat mencemarkan dan/atau merusakan lingkungan hidup, dan/atau dapat membahayakan lingkungan hidup, kesehatan, kelangsungan hidup manusia serta makhluk hidup lain (Riyanto, 2013).
Berbagai negara mempunyai definisi yang berbeda tentang limbah yang berbahaya, misalnya The Federal Republic of Germany Federal Act tentang pembangunan limbah menyebutkan limbah khusus adalah limbah yang berbahaya bagi kesehatan manusia, udara, air, atau eksplosif, mudah terbakar, atau boleh jadi menyebabkan penyakit. The Ontario Waste Management Corporation sebuah biro propinsi yang di bentuk lembaga konstitusi Ontorio, Kanada mendefinisikan limbah khusus adalah cairan industri dan limbah yang berbahaya yang tidak layak disuling
8 dan dibuang pada sistem penyulingan limbah, pembakaran atau di tanam di daratan karena memerlukan perlakuan khusus (Riyanto, 2013).
Karakteristik air limbah umumnya terbagi ke dalam sifat fisika, kimia, dan biologi. Sifat fisika, kimia, dan biologi air limbah sangat tergantung pada sumber kegiatan penghasil air limbah tersebut apakah itu masyarakat, industri, atau komoditas lain. Menurut Lin (2001) sifat fisika, kimia dan biologi air limbah dijelaskan sebagai berikut :
1. Sifat Fisika Air Limbah
Temperatur dan zat padat pada air limbah adalah faktor penting untuk proses pengolahan air limbah. Temperatur mempengaruhi reaksi kimia dan aktivitas biologi. Zat padat seperti total suspended solid (TSS), volatile suspended solid (VSS) dan settleable solid mempengaruhi teknik pengoperasian dan ukuran unit pengolahan. Zat padat terdiri dari material tersuspensi dan terlarut dalam air dan air limbah.
2. Sifat Kimia Air Limbah
Zat padat terlarut dan tersuspensi pada air limbah mengandung material organik dan anorganik. Material organik terdiri dari karbonat, lemak, minyak surfaktan, protein, pestisida, senyawa kimia pertanian lain, senyawa organik volatil, dan senyawa kimia racun lain. Material anorganik terdiri dari logam berat, pospor, pH, alkali, klorida, sulfur, dan polutan anorganik lain.
3. Sifat Biologi Air Limbah
Mikroorganisme yang terdapat pada air limbah adalah bakteri, jamur, protozoa, tumbuh-tumbuhan mikroskopik, binatang, dan virus. Banyak
9 mikrooranisme (bakteri, protozoa) yang berhubungan langsung dan menguntungkan untuk proses pengolahan biologi air limbah (Lin, 2001).
2.2 Serbuk gergaji kayu Meranti
Industri kayu lapis adalah salah satu industri dari sektor kehutanan yang selain menghasilkan produk utama juga banyak menghasilkan produk samping (limbah) yang masih sangat minim pemanfaatannya. Limbah pabrik kayu tersebut yang berupa serbuk kayu diketahui mengandung selulosa yang berpotensi untuk menyerap ion logam. Serbuk gergaji dihasilkan sebanyak 20–30% dari aktivitas penggergajian. Bila produksi total kayu gergajianan Indonesia mencapai 2,6 juta m3 pertahun, maka dihasilkan limbah penggergajian sebanyak 0,78 juta m3 pertahunnya (Bakkara, 2007).
Meranti adalah kayu serbaguna yang banyak digunakan untuk aplikasi dekoratif termasuk furniture, finishing interior, panel, cetakan, skirting dan architrave. Kayu Meranti merupakan salah satu jenis tanaman khas daerah tropis
yang cukup terkenal. Pohon meranti dapat tumbuh di dataran rendah maupun di hutan hujan seperti Sumatra, Kalimantan, Maluku dan Sulawesi. Kalimantan merupakan penghasil kayu meranti dengan kualitas terbaik di Indonesia, sehingga meranti sering disebut sebagai kayu Kalimantan. Kayu meranti memiliki tekstur yang padat dan kokoh, sehingga banyak digunakan untuk kebutuhan furniture dan sebagainya (Ahmad et al., 2009). Komposisi kimia dari kayu meranti sendiri terdiri dari:
10 Tabel 1. Komposisi Kimia Kayu Meranti (Supartini, 2009).
Komponen Kimia Kadar (%) Selulosa 63,97 Lignin 20,94 Hemiselulosa 13,37
Abu 0,86 Silika 0,86
Ciri-ciri dari kayu meranti sendiri adalah sebagai berikut:
a. Meranti memiliki tinggi berkisar antara 30,40, hingga 70 meter;
b. Batang lurus dan bulat dan diameter pohon berkisar 50, 100, hingga 450 meter;
c. Meranti memiliki daya tahan yang relatif baik;
d. Terdapat alur dalam atau dangkal berwarna terang, gelap, kadang-kadang berwarna coklat kemerahan;
e. Struktur yang agak kasar dan memiliki kepadatan kayu rata-rata 630 kg/m3 f. Termasuk jenis kayu yang keras dengan bobot rendah, sedang, hingga berat.
Kayu meranti memiliki komponen kimia yaitu selulosa yang cukup tinggi.
Komponen ini sangat dibutuhkan didalam adsorben. Selulosa merupakan komponen kimia utama yang terdapat dalam kayu, bersama dengan hemiselulosa dan lignin saling terikat erat dengan sistem dan sifat yang teratur seperti kristal dengan kisi kristal berbentuk monoklin (Fengel & Wegener, 1995).
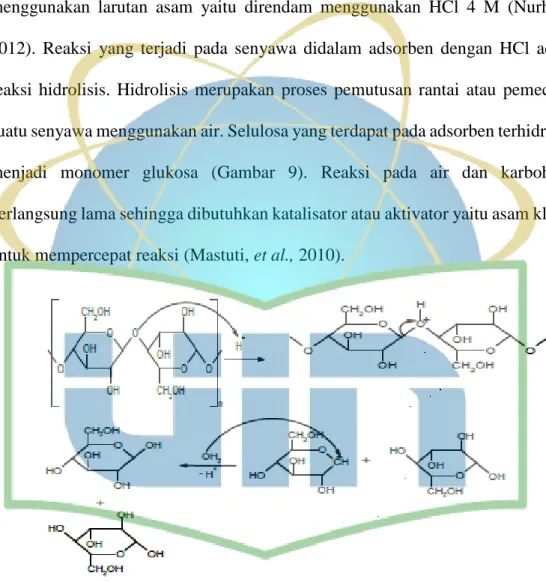
11 Gambar 1. Struktur Selulosa (Zugenmaier, 2008)
Selulosa kira-kira 40-50% terdapat pada komponen kayu kering. Selulosa tersusun dari unit-unit anhidroglukopiranosa yang tersambung dengan ikatan β-1,4- glikosida membentuk suatu rantai makromolekul tidak bercabang. Setiap unit anhidroglukopiranosa memiliki tiga gugus hidroksil (Potthast et al., 2006;
Zugenmaier, 2008). Seperti yang terlihat pada Gambar 1 selulosa mempunyai rumus empirik (C6H10O5)n dengan n ~ 1500 dan berat molekul ~ 243.000 (Rowe et al., 2009).
2.3 Adsorpsi
Adsorpsi adalah peristiwa menempelnya atom atau molekul suatu zat pada permukaan zat lain karena ketidakseimbangan gaya dalam permukaan. Zat yang teradsorpsi disebut adsorbat dan zat pengadsorpsi disebut adsorben (Atkins, 1997).
Proses adsorpsi digambarkan sebagai proses molekul meninggalkan larutan dan menempel pada permukaan zat penyerap akibat ikatan fisika dan kimia (Sawyer et al., 1994).
Proses adsorpsi dapat terjadi secara kimia maupun fisika. Pada proses adsorpsi secara fisika gaya yang mengikat adsorbat oleh adsorben adalah gaya-gaya Van Der Walls. Molekul terikat sangat lemah dan energi yang dilepaskan pada
12 adsorpsi fisika relatif rendah yaitu <20 kJ/mol. Adsorpsi fisika umumnya terjadi pada temperatur rendah dan dengan bertambahnya temperatur jumlah adsorpsi berkurang dengan signifikan (Castellan, 1983). Pada proses adsorpsi secara kimia, adsorpsi memerlukan energi aktivasi dan nilai kalor adsorpsi mencapai 100 kJ/mol yang dibutuhkan agar terjadi interaksi ikatan-ikatan kimia. Molekul-molekul yang teradsorpsi pada permukaan bereaksi secara kimia, sehingga terjadi pemutusan atau pembentukan ikatan. Teradsorpsinya molekul pada antar muka menyebabkan pengurangan tegangan permukaan dan adsorpsi akan berlangsung terus sampai energi bebas permukaan mencapai minimum (Adamson, 1990).
Logam berat dalam limbah cair juga dapat dipisahkan secara biologis melalui proses biosorpsi. Proses biosorpsi adalah pengikatan ion logam melalui adsorpsi dengan menggunakan organisme inaktif atau mati (Okuo et al., 2006). Keunggulan biosorpsi dalam mengadsorpsi logam berat pada limbah adalah prosesnya berlangsung cepat, tingkat penyerapannya tinggi dan selektif. Biomassa, waktu kontak, jenis dan luas permukaan biosorben berpengaruh terhadap efektifitas biosorpsi (Alam, 2006). Proses biosorpsi banyak diaplikasikan untuk menurunkan konsentrasi ion logam pada lingkungan maupun limbah. Biosorpsi merupakan teknologi alternatif sehingga biosorben yang digunakan harus murah dan mudah penyediaannya (Sahmoune et al., 2008). Luas permukaan biosorben yang besar dapat meningkatkan jumlah situs aktif yang tersedia untuk pengikatan logam berat (Dutta et al., 2012). Isotherm adsorpsi adalah proses adsorpsi yang berlangsung pada temperatur tetap. Model isotherm adsorpsi yang paling umum dan banyak digunakan dalam adsorpsi adalah model isotherm Langmuir dan model isotherm Freundlich.
13 Efisiensi adsorpsi (%) dapat dihitung dengan menggunakan rumus sebagai berikut:
Efisiensi adsorpsi (%) : (Co−Ct)
Co x 100%...(1) Keterangan:
C0 = konsentrasi awal larutan uji (ppm) Ct = konsentrasi akhir larutan uji (ppm)
Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus sebagai berikut:
Q = (Co−Ct)
w x V...(2) Keterangan :
Q = Kapasitas adsorpsi per bobot molekul (mg/g) C0 = Konsentrasi awal larutan (ppm)
Ct = Konsentrasi akhir larutan (ppm) w = Massa adsorben (g)
V = Volume larutan (L)
2.3.1 Isotherm adsorpsi Langmuir
Isotherm adsorpsi Langmuir mendefinisikan bahwa kapasitas adsorpsi maksimum terjadi akibat adanya lapisan tunggal (monolayer) adsorbat di permukaan adsorben dan semua situs permukaannya bersifat homogen karena masing-masing situs aktif hanya dapat mengadsorpsi satu molekul adsorbat (Oscik, 1982). Adsorpsi isotherm Langmuir didasarkan pada asumsi bahwa:
a. Situs-situs aktif yang proporsional pada permukaan adsorben dengan luas permukaan adsorben masing-masing situs aktif hanya dapat mengadsorpsi satu molekul saja, dengan demikian adsorpsi terbatas pada pembentukan lapis tunggal (monolayer).
14 b. Pengikat adsorbat pada permukaan adsorben dapat secara kimia atau fisika, tetapi harus cukup kuat untuk mencegah perpindahan molekul teradsorpsi pada permukaan (adsorpsi terlokalisasi).
c. Energi adsorpsi tidak tergantung pada penutupan permukaan.
Model isotherm adsorpsi Langmuir dapat diterapkan untuk mempelajari dan menjelaskan data adsorpsi yang diperoleh dari eksperimen. Data kesetimbangan biasanya digambarkan dalam bentuk kurva isotherm adsorpsi. Pendekatan dengan model terhadap kurva isotherm dapat membantu menganalisis karakteristik isotherm berupa kapasitas adsorpsinya (Amri et al., 2004). Persamaan umum adsorpsi isotherm Langmuir dapat ditulis:
x
m
=
α. β.C1+β.C
...
(3) Keterangan:x
m = Jumlah dari adsorbat yang diserap per unit berat dari adsorben (mg/g) C = konsentrasi adsorbat dalam larutan pada saat kesetimbangan (ppm) β = konstanta Langmuir (L/mg)
α = maksimum adsorbat yang dapat diserap (mg/g)
Konstanta α dan β dapat ditemukan dari kurva hubungan terhadap 𝐶
𝑥/𝑚 dengan persamaan :
C x/m
=
1α β
+
1αC
...
(4)Persamaan 4 adalah persamaan linier, yang kemudian dibuat grafik seperti pada Gambar 2 berikut:
15 Gambar 2. Plot antara (x/m) terhadap C
2.3.2 Isotherm adsorpsi Freundlich
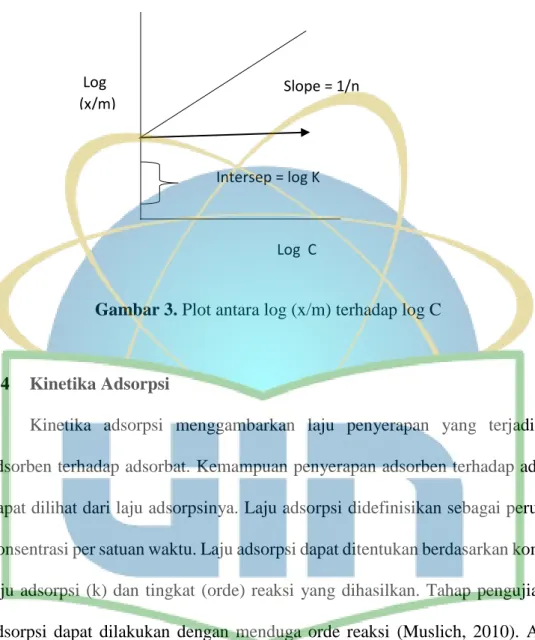
Isotherm adsorpsi Freundlich mengasumsikan bahwa terdapat lebih dari satu lapisan permukaan (multilayer) dan bersifat heterogen, yaitu adanya perbedaan energi pengikat pada tiap-tiap situs dimana proses adsorpsi di tiap-tiap sisi adsorpsi mengikuti isotherm Langmuir (Schnoor, 1996). Persamaan umum model adsorpsi isotherm Freundlich dapat ditulis:
x
m
=
K C1/n...
(5) keterangan:x
m = jumlah dari adsorbat yang diserap per unit dari adsorben (mg/g) K = konstanta Freundlich
C = konstentrasi adsorbat dalam larutan pada saat kesetimbangan (ppm) 1/n = ketidak linieran (tanpa satuan)
Persamaan 5 dibuat menjadi persamaan linier menjadi:
log x
m
=
log K+
1nlog C
...
(6)16 Grafik yang diperoleh adalah garis linier dengan slope 1/n dan intersep log K, yang kemudian dibuat grafik seperti pada Gambar 3 berikut:
Gambar 3. Plot antara log (x/m) terhadap log C
2.4 Kinetika Adsorpsi
Kinetika adsorpsi menggambarkan laju penyerapan yang terjadi pada adsorben terhadap adsorbat. Kemampuan penyerapan adsorben terhadap adsorbat dapat dilihat dari laju adsorpsinya. Laju adsorpsi didefinisikan sebagai perubahan konsentrasi per satuan waktu. Laju adsorpsi dapat ditentukan berdasarkan konstanta laju adsorpsi (k) dan tingkat (orde) reaksi yang dihasilkan. Tahap pengujian laju adsorpsi dapat dilakukan dengan menduga orde reaksi (Muslich, 2010). Analisa kinetika adsorpsi didasarkan pada kinetika orde nol, orde satu dan orde dua yaitu sebagai berikut (Dogra & Dogra, 1984):
Suatu reaksi dikatakan mempunyai orde nol jika besarnya laju adsorpsinya tidak dipengaruhi oleh berapapun perubahan konsentrasi pereaksinya. Artinya seberapapun peningkatan konsentrasi pereaksi tidak akan mempengaruhi besarnya
Log C Log
(x/m)
Slope = 1/n
Intersep = log K
17 laju adsorpsi. Persamaan linear orde reaksi nol dinyatakan dalam rumus sebagai berikut:
- dCA
dt = k ...(7) ʃ-dcA = ʃ k dt ...(8)
C
A= C
AO- kt ...
(9)Orde satu adalah suatu reaksi yang kecepatannya bergantung hanya pada salah satu zat yang bereaksi atau sebanding dengan salah satu pangkat reaktannya.
Persamaan linear orde reaksi satu dinyatakan dalam rumus sebagai berikut:
- dCA
dt = k CA...(10) ʃ- dCA
C A = ʃ k dt...(11)
lnC
A= -kt + ln C
Ao...
(12)Reaksi orde dua adalah suatu reaksi yang kelajuannya berbanding lurus dengan hasil kali konsentrasi dua reaktannya atau berbanding langsung dengan kuadrat konsentrasi salah satu reaktannya. Jika mekanisme adsorpsi yang terjadi adalah reaksi orde dua dimana kecepatan adsorpsi yang terjadi berbanding lurus dengan dua konsentrasi pengikutnya atau satu pengikut berpangkat dua. Laju kinetika reaksi orde dua dinyatakan dalam persamaan linear berikut:
- dCA
dt = kCA2...(13) ʃ - dCA
CA2 = ʃ k dt ...(14)
1 CA
-
1CA0
= kt...
.(15)18 Keterangan:
CA = konsentrasi A pada saat t = t (mol/L) CA0 = konsentrasi A pada saat t = 0 (mol/L) k = konstanta kinetika (mol/L. menit-1 ) t = waktu (menit)
Umumnya nilai konstanta laju adsorpsi dipengaruhi oleh faktor tumbukan, energi aktivasi dan suhu reaksi yang bisa dinyatakan dalam bentuk persamaan matematis sesuai persamaan Arrhenius:
k =
Ae
-Ea/RT...
(16)ln k = ln A – Ea/R.T...(17) Keterangan:
k = Konstanta laju adsorpsi A = Faktor frekuensi tumbukan Ea = Energi aktivasi
R = Konstanta gas ideal T = Suhu
2.5 Logam Berat
Logam berat umumnya bersifat racun terhadap makhluk hidup walaupun beberapa diantaranya diperlukan dalam jumlah kecil. Melalui berbagai perantara, seperti udara, makanan, maupun air yang terkontaminasi oleh logam berat, logam tersebut dapat terdistribusi ke bagian tubuh manusia dan sebagian akan terakumulasikan. Jika keadaan ini berlangsung terus menerus, dalam jangka waktu lama dapat mencapai jumlah yang membahayakan kesehatan manusia. Logam berat tidak dapat diuraikan oleh mikroorganisme dan terakumulasi pada organisme yang menyebabkan berbagai macam penyakit dan kelainan (Bailey et al., 1999).
19 Beberapa logam berat banyak digunakan dalam berbagai keperluan sehari- hari dan secara langsung maupun tidak langsung dapat mencemari lingkungan dan apabila sudah melebihi batas yang ditentukan berbahaya bagi kehidupan. Logam berat yang berbahaya yang sering mencemari lingkungan antara lain merkuri (Hg), timbal (Pb), arsenik (As), kadmium (Cd), khromium (Cr), dan nikel (Ni). Logam berat tersebut diketahui dapat terakumulasi di dalam tubuh suatu mikroorganisme, dan tetap tinggal dalam jangka waktu lama sebagai racun. Peristiwa yang menonjol dan dipublikasikan secara luas akibat pencemaran logam berat adalah pencemaran merkuri (Hg) yang menyebabkan Minamata desease di teluk Minamata, Jepang dan pencemaran kadmium (Cd) yang menyebabkan Itai-itai disease di sepanjang sungai Jinzo di Pulau Honsyu, Jepang (Sastrawijaya, 2000).
Unsur-unsur logam berat juga dibutuhkan oleh organisme hidup dalam berbagai proses metabolisme untuk pertumbuhan dan perkembangan sel-sel tubuhnya. Sebagai contoh, kobalt (Co) dibutuhkan untuk pembentukan vitamin B12, besi (Fe) dibutuhkan untuk pembuatan haemoglobin, sedangkan seng (Zn) berfungsi dalam enzim-enzim dehidrogenase. Toksisitas (daya racun) logam berat tergantung pada jenis, kadar, efek sinergis antagonis dan bentuk fisika kimianya.
Semakin besar kadar logam berat, daya toksisitasnya semakin besar pula. Sebagai contoh, 50% kerang biru (Mynlus edulis) yang dipelihara dalam air yang mengandung Pb 0,5 ppm mati dalam waktu 150 hari. Sedangkan dalam air yang mengandung Pb 5 ppm, 50% kerang biru tersebut mati dalam waktu 105 hari (Komarawidjaja, 2017). Adanya efek sinergis dari beberapa ion logam, juga akan memperbesar toksisitas logam berat. Selain faktor-faktor tersebut, faktor lingkungan perairan seperti pH, kesadahan, suhu dan salinitas juga turut
20 mempengaruhi toksisitas logam berat. Tingkat kandungan logam setiap tempat berbeda-beda tergantung dari kondisi dan tingkat pencemarannya (Darmono, 2001).
2.5.1 Logam Cuprum (Cu)
Logam Cu termasuk pada golongan logam I B dengan nomor atom 29. Logam Cu memiliki massa atom 63,54, densitas 8,9 gr/cm3 dan titik leleh 1083,2 oC. Unsur di alam, dapat ditemukan dalam bentuk ion logam bebas, akan tetapi lebih banyak ditemukan dalam bentuk persenyawaan atau sebagai senyawa padat dalam bentuk mineral. Logam Cu merupakan jenis logam penghantar listrik terbaik setelah perak, karena itu banyak digunakan dalam bidang elektronika atau pelistrikan. Cu juga dapat membentuk alloy dengan berbagai macam logam lainnya seperti dengan seng, timah atau timbal (Cu-Zn-Sn-Pb) dalam bentuk kuningan yang banyak digunakan dalam peralatan rumah tangga. Senyawa Cu banyak digunakan dalam industri cat sebagai antifoling, industri insektida dan fungsida, sebagai katalis, baterai, elektroda, penarik sulfur dan sebagai pigmen serta pencegah pertumbuhan lumut.
Kadar maksimum ion logam Cu di perairan menurut Peraturan Pemerintah RI No.
82 tahun 2001 sebesar 0,02 mg/L dan bagi pengolahan air minum Cu <1 mg/L.
Tembaga (Cu) yang diperlukan untuk proses enzimatik biasanya sangat sedikit sedangkan dalam keadaan lingkungan yang tercemar akan menghambat sistem enzim (enzim inhibitor). Kadar Cu ditemukan pada jaringan beberapa spesies hewan air yang mempunyai regulasi sangat buruk terhadap logam. Pada binatang lunak (molusca) sel leukositi sangat berperan dalam sistem translokasi dan detoksikasi logam. Hal ini terutama ditemukan pada kerang kecil (oyster) yang
21 hidup dalam air yang terkontaminasi tembaga (Cu) yang terikat oleh sel leukositi, sehingga menyebabkan kerang tersebut berwarna kehijau-hijauan. Pencemaran perairan oleh Cu umumnya hanya bersifat lokal yaitu pada daerah pantai, teluk, estuari, dan tempat pembuangan limbah. Sifat racunnya tidak terlalu membahayakan bila dibandingkan dengan Pb dan Cd (Bryan, 1976).
Manusia biasanya terpapar Cu melalui tanah, debu, makanan, serta minuman yang tercemar Cu yang berasal dari pipa bocor pada penambangan Cu atau industri yang menghasilkan limbah Cu. Kira-kira 75-99% total intake Cu berasal dari makanan dan minuman. Setiap hari, manusia bisa terpapar Cu yang antara lain berasal dari peralatan dapur atau koin (Widowati, 2008).
2.5.2 Logam Kadmium (Cd)
Kadmium (Cd) merupakan golongan logam transisi yang berada pada golongan II B periode 5. Kadmium memiliki nomor atom 48, massa atom 112, 41, titik didih 765 oC, titik leleh 320,9 oC dan densitas 8,65 gr/cm3. Kadmium banyak digunakan pada lempengan elektroda, industri baterai, pengecatan, campuran dari logam (alloy) galvanisasi karena Cd memiliki keistimewaan nonkorosif. Kadmium di alam ditemukan dengan campuran logam lain terutama dalam pertambangan zink dan timbal ditemukan kadmium dengan kadar 0,2 – 0,4 % sebagai hasil samping dari pemurnian zink dan timbal (Darmono, 1995).
Kadmium termasuk golongan logam berat berwarna putih perak, lunak, mengkilap, mudah bereaksi, serta menghasilkan kadmium oksida bila dipanaskan.
Pada perairan alami yang bersifat basa, kadmium mengalami hidrolisis, teradsorpsi oleh padatan tersuspensi dan membentuk ikatan kompleks dengan bahan organik.
22 Kadmium pada perairan alami membentuk ikatan kompleks dengan ligan baik organik maupun anorganik, yaitu: Cd2+, CdCO3, Cd(OH)+, CdSO4 dan CdCl+ (Sanusi, 2006).
Kadmium bersifat toksik bagi semua organisme hidup,bahkan juga sangat berbahaya bagi manusia. Kandungan kadmium dalam konsentrasi tertentu dalam perairan dapat membunuh biota laut dan perairan lainnya. Kadar maksimum ion logam Cd di perairan menurut Peraturan Pemerintah RI No. 82 tahun 2001 sebesar 0,02 mg/L. Keracunan pada ikan dapat terjadi jika konsentrasinya mencapai 200 µg/L (Nurhasni, 2007). Logam kadmium juga mengalami proses biotransformasi dan bioakumulasi dalam organisme makhluk hidup seperti pada tumbuhan, hewan dan manusia. Keracunan yang disebabkan oleh kadmium bersifat akut dan kronis.
Organ tubuh yang dapat mengalami kerusakan akibat dari ion logam kadmium antara lain ginjal, paru-paru, kerapuhan tulang, kekurangan darah, mengganggu sistem reproduksi dan organ-organ lain serta dapat menyebabkan timbulnya kanker pada manusia akibat paparan dari logam kadmium (Palar, 1994).
Kadmium belum diketahui fungsinya secara biologis dan dipandang sebagai xenobiotik dengan toksisitas yang tinggi dan merupakan unsur lingkungan yang persisten. Kadmium bentuk asap atau gas akan berakibat fatal bila konsentrasi Cd 40-50 mg/m3 terinhalasi selama 1 jam (Bastarache, 2003).
Keracunan Cd dapat menyebabkan tekanan darah tinggi, kerusakan jaringan testicular, kerusakan ginjal dan sel-sel darah merah (Widowati, 2008). Itai-itai merupakan salah satu kerapuhan tulang karena Cd. Selain itu Cd dapat menyebabkan gangguan pertumbuhan, reproduksi, hipertensi, teratogenesis bahkan kanker (Linder, 1992).
23 2.5.3 Logam Mangan (Mn)
Mangan (Mn) merupakan unsur logam golongan VII B, dengan berat atom 54,93, nomor atom 25, titik lebur 1247 oC, dan titik didihnya 2032 oC dan densitas 7,4 gr/cm3. Logam mangan di alam jarang sekali berada dalam keadaan unsur.
Umumnya berada dalam keadaan senyawa dengan berbagai macam valensi.
Hubungannya dengan kualitas air yang sering dijumpai adalah senyawa mangan dengan valensi 2; 4 dan 6 (Tatsumi, 1971).
Logam mangan di dalam sistem air alami dan juga dalam sistem pengolahan air memiliki keasaman (pH) air. Pada sistem air alami mangan mempunyai valensi dua yang larut di dalam air dengan kondisi reduksi. Mn di dalam senyawa MnCO3, Mn(OH)2 mempunyai valensi dua zat tersebut relatif sulit larut di dalam air, tetapi untuk senyawa Mn seperti garam MnCl2, MnSO4, Mn(NO3)2 mempunyai kelarutan yang besar dalam air (Manahan, 1994).
Logam Mn dimanfaatkan dalam bidang metalurgi yaitu produksi besi-baja dan untuk industri logam yang memerlukan sekitar 85-90% dari seluruh kebutuhan Mn. Mn juga digunakan untuk formula stainless steel dan alloy. Beberapa jenis alloy mengandung Mn sebesar 10-15% sebagai alloy Mn. Mn dan senyawa Mn
digunakan dalam pembuatan electrical coil, korek api, kaca, cat rambut, pupuk, penyambungan logam dan pada pabrik penghasil oksigen dan klorin serta untuk mengeringkan cat warna hitam (Widowati, 2008).
Konsentrasi mangan di dalam sistem air alami umumnya kurang dari 0,1 mg/L, jika konsentrasinya melebihi 1 mg/L maka dengan cara pengolahan biasa sangat sulit untuk menurunkan konsentrasinya sampai derajat yang diijinkan sebagai air minum. Peraturan Pemerintah RI No. 82 Tahun 2001 menetapkan
24 standar kriteria mutu air mengandung konsentrasi mangan di dalam air maksimum 1 mg/L. Logam mangan di dalam tubuh manusia jika berada dalam jumlah yang kecil tidak menimbulkan gangguan kesehatan, tetapi dalam jumlah yang besar dapat tertimbun di dalam hati dan ginjal. Pendapat tentang gangguan kesehatan akibat keracunan senyawa mangan ada berbagai macam, tetapi umumnya dalam keadaan kronis menimbulkan gangguan pada sistem syaraf dan menampakkan gejala seperti parkinson. Berdasarkan percobaan yang dilakukan terhadap kelinci, keracunan mangan menimbulkan gangguan pada pertumbuhan tulang. Oleh sebab itu di dalam limbah sekalipun mangan menjadi unsur yang berbahaya karena dapat mencemari lingkungan terlebih lagi jika terpapar kepada makhluk hidup (Widowati, 2008).
2.6 Spektroskopi Serapan Atom (SSA)
Spektrometri merupakan suatu metode analisis kuantitatif yang pengukurannya berdasarkan banyaknya radiasi yang dihasilkan atau yang diserap oleh spesi atom atau molekul analit. Salah satu bagian dari spektrometri ialah Spektrometri Serapan Atom (SSA) yaitu suatu metode analisis unsur secara kuantitatif yang pengukurannya berdasarkan penyerapan cahaya dengan panjang gelombang tertentu oleh atom ion logam dalam keadaan bebas (Skoog, et al., 2000).
Apabila cahaya dengan panjang gelombang tertentu dilewatkan pada suatu sel yang mengandung atom-atom bebas yang bersangkutan maka sebagian cahaya tersebut akan diserap dan intensitas penyerapan akan berbanding lurus dengan banyaknya atom bebas ion logam yang berada dalam sel (Day & Underwood, 2002).
25 Sampel yang ingin diuji dengan menggunakan SSA harus dilarutkan, proses pelarutan dikenal dengan istilah destruksi yang bertujuan untuk membuat unsur ion logam menjadi ion logam yang bebas. Terdapat 2 cara destruksi yatu:
1). Destruksi basah: sampel ditambahkan asam-asam oksidator, jika perlu dilakukan dengan pemanasan.
2). Destruksi kering: sampel langsung dipanaskan untuk diabukan.
Hasil destruksi baik secara basah maupun kering kemudian dilarutkan.
Larutan sampel dimasukkan ke dalam nyala dalam bentuk aerosol yang selanjutnya akan membentuk atom-atomnya. Serapan akan terjadi dari radiasi suatu sinar yang sesuai dengan atom yang ditentukan. Pancaran atau emisi energi radiasi dan emisi nyala atau energi radiasi lampu eksternal yang tidak bisa hilang oleh serapan atom akan didispersi oleh monokromator dan diditeksi oleh fotomultifier, dirumuskan oleh persamaan Boltzman sebagai berikut:
Nj No
=
PjPo exp –Ej/KT
...
(18) Keterangan:K = Tetapan Boltzman T = Suhu nyala dalam Kelvin
Ej = Perbedaan energi dalam energi dari tingkat tereksitasi dasar Nj = Jumlah atom pada tingkat tereksitasi
No = Jumlah atom dalam tingkat dasar
Pj dan Po = Faktor statistik yang ditentukan oleh jumlah tingkat yang mempunyai energi yang sama dari atom yang tereksitasi dan pada tingkat dasar (Hermanto, 2009).
26 Gambar 4. Skema umum komponen SSA (Haswell, 1991)
Pada alat SSA terdapat dua bagian utama yaitu suatu sel atom yang menghasilkan atom-atom gas bebas dalam keadaaan dasarnya dan suatu sistem optik untuk pengukuran sinyal. Suatu skema umum dari alat SSA dapat dilihat pada Gambar 4. Metode SSA sebagaimana dalam metode spektrometri atomik yang lainnya atom harus diubah ke dalam bentuk uap atom. Proses pengubahan ini dikenal dengan istilah atomisasi, pada proses ini contoh diuapkan dan didekomposisi untuk membentuk atom dalam bentuk uap.
2.7 Fourier Transform Infrared Spectroscopy (FT-IR)
Spektrofotometri inframerah pada umumnya digunakan untuk melakukan penentuan jenis gugus fungsi suatu senyawa organik, mengetahui informasi struktur suatu senyawa organik dan dapat pula digunakan untuk penentuan struktur molekul suatu senyawa anorganik dengan membandingkan pada daerah sidik jarinya.
Radiasi inframerah mengandung beberapa range frekuensi tetapi tidak dapat dilihat oleh mata. Pita absrobsi inframerah sangat khas dan spesifik untuk setiap tipe ikatan kimia atau jenis gugus fungsi. Infra merah merupakan suatu teknik yang sangat sesuai untuk mengidentifikasi bahan secara kuantitatif (Bernath, 1995).
27 Gambar 5. Skema kerja FT-IR
Mekanisme yang terjadi pada alat FT-IR (Gambar 5) dimulai dari sinar yang datang dari sumber sinar akan diteruskan, dan kemudian akan dipecah oleh pemecah sinar menjadi dua bagian sinar yang saling tegak lurus. Sinar ini kemudian dipantulkan oleh dua cermin yaitu cermin diam dan cermin bergerak. Sinar hasil pantulan kedua cermin akan dipantulkan kembali menuju pemecah sinar untuk saling berinteraksi, kemudian dari pemecah sinar sebagian sinar akan diarahkan menuju cuplikan dan sebagian menuju sumber. Gerakan cermin yang maju mundur akan menyebabkan sinar yang sampai pada detektor akan berfluktuasi. Sinar akan saling menguatkan ketika kedua cermin memiliki jarak yang sama terhadap detektor, dan akan saling melemahkan jika kedua cermin memiliki jarak yang berbeda. Fluktuasi sinar yang sampai pada detektor ini akan menghasilkan sinyal pada detektor yang disebut interferogram. Interferogram ini akan diubah menjadi spektra IR dengan bantuan komputer berdasarkan operasi matematika (Tahid, 1994). Pencirian dengan menggunakan FT-IR memiliki beberapa kelebihan, diantaranya dapat mendeteksi sinyal yang lemah, dapat menganalisis sampel pada konsentrasi yang sangat rendah, serta dapat mempelajari daerah antara 950-1500 cm-1 untuk larutan senyawa (Coates, 2000).
28 2.8 Scanning Electron Microscopy (SEM)
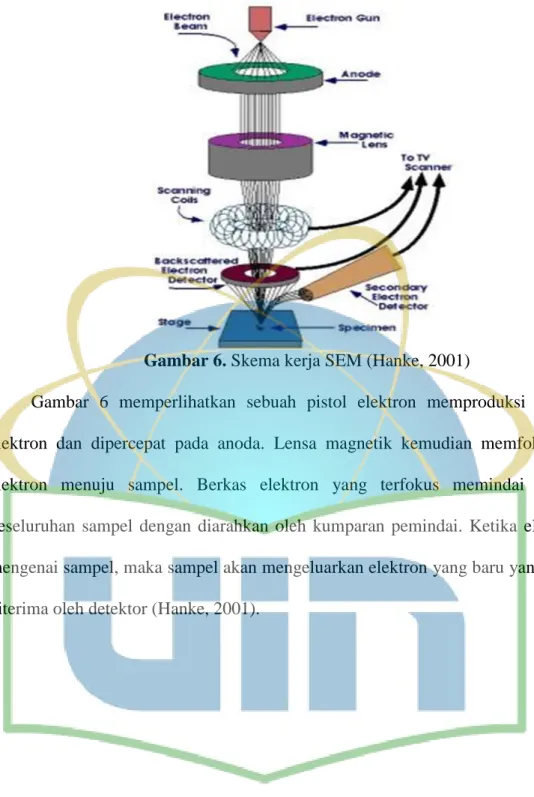
Scanning Electron Microscopy (SEM) merupakan alat yang digunakan untuk
mempelajari topografi secara keseluruhan. Keuntungan menggunakan SEM yaitu preparasi sampel tidak menghabiskan banyak tenaga maupun waktu. Keterbatasan resolusi membuat teknik ini terbatas bagi kristal yang lebih besar dari 5 nm. Diatas level ini, bentuk, ukuran, dan distribusi ukuran mudah untuk dilakukan. Investigasi SEM telah dibuat pada banyak sistem dan berguna juga untuk studi struktur pori (Nasikin et al., 2010).
Tipe sinyal yang dihasilkan oleh SEM dapat meliputi elektron sekunder, sinar-X karakteristik dan cahaya (katodaluminisens). Sinyal tersebut datang dari hamburan elektron dari permukaan unsur dan berinteraksi dengan sampel atau di dekat permukaannya. SEM dapat menghasilkan gambar dengan resolusi yang sangat tinggi dari permukaan sampel, menampakkan secara lengkap dengan ukuran 1-5nm. Agar menghasilkan gambar yang diinginkan, maka SEM mempunyai sebuah lebar fokus yang sangat besar (biasanya 25-250.000 kali pembesaran). SEM dapat menghasilkan karakteristik bentuk 3-dimensi yang berguna untuk memahami struktur permukaan dari suatu sampel.
29 Gambar 6. Skema kerja SEM (Hanke, 2001)
Gambar 6 memperlihatkan sebuah pistol elektron memproduksi berkas elektron dan dipercepat pada anoda. Lensa magnetik kemudian memfokuskan elektron menuju sampel. Berkas elektron yang terfokus memindai (scan) keseluruhan sampel dengan diarahkan oleh kumparan pemindai. Ketika elektron mengenai sampel, maka sampel akan mengeluarkan elektron yang baru yang akan diterima oleh detektor (Hanke, 2001).
30 BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan kurang lebih selama 8 bulan yang dilaksanakan dari bulan Desember 2017 – Juli 2018. Tempat pelaksanaan penelitian ini adalah di Laboratorium Penelitian Kimia, Pusat Laboratorium Terpadu (PLT) Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta dan Laboratorium pengujian QLab Universitas Pancasila, BATAN dan Laboratorium SEM ITB.
3.2 Alat dan Bahan 3.2.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah spektrofotometri serapan atom Analyst 700 Perkin Elmer (SSA), Fourier-Transform Infrared Spectroscopy (FT-IR) (IRPrestige-21-Shimadzu), Scanning Electron Microscopy
(SEM) (Carl Zeiss-EVO), shaker batch, ayakan dengan ukuran partikel 180 µm Retsch, neraca analitik, pH meter, penangas, furnace, oven, kertas saring whattman, blender, mortar, dan alat gelas lainnya.
3.2.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah serbuk gergaji kayu meranti dari toko mabel yang sudah diberikan perlakuan sebelumnya, HCl, HNO3, Na2EDTA, senyawa CuSO4.5H2O, MnSO4.H2O, CdSO4.8H2O, larutan buffer pH 4, 5, 6 dan 7 dan akuades.
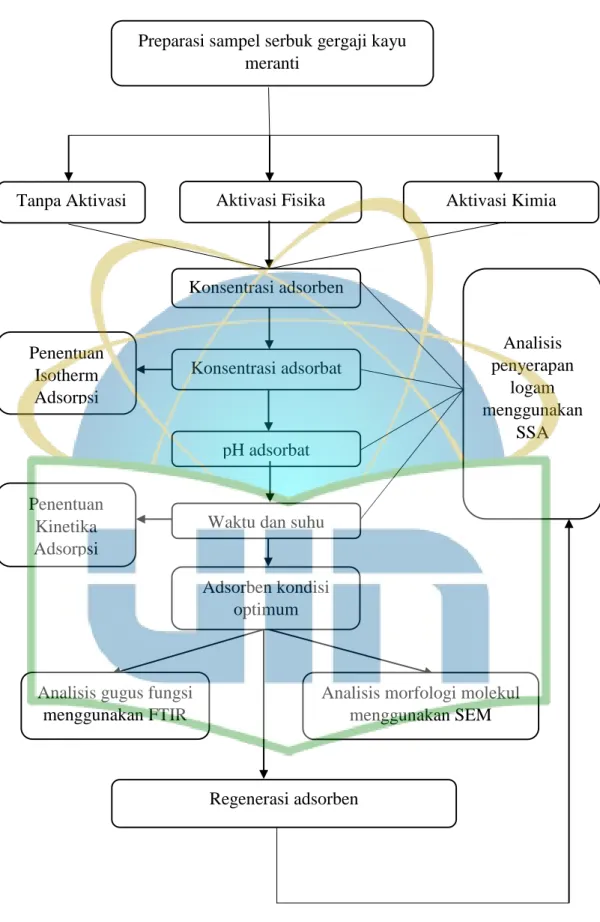
31 3.3 Diagram Alir Penelitian
Preparasi sampel serbuk gergaji kayu meranti
Penentuan Isotherm Adsorpsi
Tanpa Aktivasi Aktivasi Fisika Aktivasi Kimia
Analisis gugus fungsi menggunakan FTIR Penentuan
Kinetika Adsorpsi
Analisis morfologi molekul menggunakan SEM
Gambar 7. Diagram Alir Penelitian Regenerasi adsorben
Analisis penyerapan
logam menggunakan
SSA Konsentrasi adsorben
Konsentrasi adsorbat
pH adsorbat
Waktu dan suhu adsorpsi Adsorben kondisi
optimum
32 3.4 Prosedur Kerja
3.4.1 Preparasi serbuk gergaji kayu Meranti (Koleangan, H. S. J, 2008)
Serbuk gergaji kayu meranti dicuci bersih dengan air yang mengalir, setelah itu dikeringkan di bawah sinar matahari selama 1 minggu kemudian dihaluskan dengan blender dan dikeringkan kembali menggunakan oven selama ± 3 jam pada suhu 110 oC.
3.4.2 Aktivasi Serbuk Gergaji Kayu Meranti 3.4.2.1 Tanpa aktivasi
Serbuk gergaji kayu meranti sebanyak 100 gram yang telah dipreparasi kemudian diayak dengan pengayak menjadi ukuran partikel <180 μm dan disimpan dalam desikator. Adsorben tanpa aktivasi selanjutnya digunakan untuk penentuan kondisi optimum.
3.4.2.2 Aktivasi secara fisika (Nurhasni et al., 2014)
Serbuk gergaji kayu meranti sebanyak 100 gram yang telah dipreparasi dimasukan dalam furnace dan diaktivasi secara fisika dengan cara diarangkan pada suhu 250 oC hingga menjadi serbuk arang selama 2,5 jam. Setelah itu diayak dengan pengayak menjadi ukuran partikel <180 μm dan disimpan dalam desikator.
Adsorben selanjutnya digunakan untuk penentuan kondisi optimum.
3.4.2.3 Aktivasi secara kimia (Nurhasni et al., 2012)
Serbuk gergaji kayu meranti sebanyak 100 gram yang telah dipreparasi diayak dengan pengayak menjadi ukuran partikel <180 μm. Kemudian diaktivasi secara kimia dengan cara direndam dalam reagen HCl 4 M dengan perbandingan 1:5 selama 24 jam, selanjutnya disaring dan dinetralkan dengan akuades. Adsorben
33 yang dihasilkan kemudian dikeringkan dalam oven pada temperatur 110 oC selama 3 jam, lalu disimpan dalam desikator. Adsorben selanjutnya digunakan untuk penentuan kondisi optimum.
3.4.3 Penentuan Kondisi Optimum Adsorpsi Tanpa Aktivasi 3.4.3.1 Konsentrasi adsorben
Adsorben dengan ukuran partikel <180 µm ditimbang dengan variasi konsentrasi adsorben (1,25; 2,5; 3,75; dan 5%) dimasukkan ke dalam Erlenmeyer dengan masing-masing larutan ion logam konsentrasi awal 10 ppm sebanyak 20 mL. Erlenmeyer diletakkan pada shaker dengan kecepatan pengadukan 200 rpm pada temperatur ruang selama 1 jam. Campuran kemudian dipisahkan dengan cara disaring dengan menggunakan kertas saring. Filtrat hasil saringan diukur dengan SSA. Nilai konsentrasi masing-masing larutan uji dimasukkan ke dalam rumus efisiensi penyerapan (E) dan kapasitas adsorpsi (Q) (Persamaan 1 dan 2).
3.4.3.2 Konsentrasi adsorbat
Adsorben dengan massa optimum berukuran <180 µm ditimbang kemudian dimasukkan dalam Erlenmeyer. Larutan ion logam dengan konsentrasi (10; 30; 50;
dan 70 ppm) dimasukkan sebanyak 20 mL. Erlenmeyer diletakkan pada shaker dengan kecepatan pengadukan 200 rpm pada temperatur ruang selama 1 jam.
Campuran kemudian dipisahkan dengan cara disaring dengan menggunakan kertas saring. Filtrat hasil saringan diukur dengan SSA. Nilai konsentrasi masing-masing larutan uji dimasukkan ke dalam rumus efisiensi penyerapan (E) dan kapasitas adsorpsi (Q) (Persamaan 1 dan 2).
34 3.4.3.3 pH ion logam
Adsorben dengan massa optimum berukuran <180 µm ditimbang kemudian dimasukkan dalam Erlenmeyer. Larutan ion logam dengan konsentrasi optimum dimasukkan sebanyak 20 mL dan ditambahkan variasi pH (4; 5; 6; dan 7) yang diatur menggunakan pH meter. Larutan pH buffer dibuat dari senyawa C6H8O7.H2O konsentrasi 0,1 M dan Na2HPO4.2H2O konsentrasi 0,2 M. Erlenmeyer diletakkan pada shaker dengan kecepatan pengadukan 200 rpm pada temperatur ruang selama 1 jam. Campuran kemudian dipisahkan dengan cara disaring dengan menggunakan kertas saring. Filtrat hasil saringan diukur dengan SSA. Nilai konsentrasi masing- masing larutan uji dimasukkan ke dalam rumus efisiensi penyerapan (E) dan kapasitas adsorpsi (Q) (Persamaan 1 dan 2).
3.4.3.4 Waktu dan suhu adsorpsi
Adsorben dengan massa optimum berukuran <180 µm ditimbang kemudian dimasukkan dalam Erlenmeyer. Larutan ion logam konsentrasi optimum dimasukkan sebanyak 20 mL dengan penambahan pH optimum ke dalam Erlenmeyer yang telah berisi adsorben. Larutan kemudian dipanaskan pada variasi suhu (30; 45; 60; dan 75 oC) dengan variasi lama pemanasan (30; 60; 90; dan 120 menit). Erlenmeyer diletakkan pada shaker dengan kecepatan pengadukan 200 rpm.
Campuran kemudian dipisahkan dengan cara disaring dengan menggunakan kertas saring. Filtrat hasil saringan diukur dengan SSA. Nilai konsentrasi masing-masing larutan uji dimasukkan ke dalam rumus efisiensi penyerapan (E) dan kapasitas adsorpsi (Q) (Persamaan 1 dan 2). Adsorben yang diaktivasi secara fisika dan kimia
35 penentuan kondisi optimum adsorpsi dilakukan dengan prosedur yang sama yaitu dengan prosedur 3.4.3.
3.4.4 Analisis Gugus Fungsi dengan Fourier-Transform Infrared Spectroscopy (FT-IR) (ASTM E1252-98)
Analisis gugus fungsi adsorben terbaik yaitu adsorben yang diaktivasi fisika (sebelum dan sesudah adsorpsi) dengan menggunakan Fourier-Transform Infrared Spectroscopy (FT-IR). Sebanyak 10 gram KBr digerus kemudian ditambahkan
sampel adsorben dengan komposisi 10:1 sampel. Kemudian campuran digerus hingga homogen. Kemudian diletakkan pada sampel holder. Diketahui grafik puncak-puncak gugus fungsi yang muncul pada layar. Hasil pengukuran dianalisis dan dicetak.
3.4.5 Analisis Morfologi Permukaan dengan Scanning Electron Microscopy (SEM) ( ASTM E1508)
Analisis permukaan dan tekstur adsorben terbaik yaitu adsorben yang diaktivasi fisika (sebelum dan sesudah adsorpsi) dengan menggunakan Scanning Electron Microscopy (SEM). Sampel adsorben yang akan dianalisis diletakkan
sangat tipis merata pada plat alumunium yang memiliki dua sisi. Kemudian dilapisi dengan lapisan emas dengan waktu coating ± 30 detik. Sampel yang telah dilapisi, kemudian diamati menggunakan SEM dengan tegangan 20 kV dan perbesaran 5.000x dan 30.000x. dari gambar berupa foto SEM yang diperoleh, morfologi dan distribusi ukuran nanosfer dianalisis dengan menggunakan metode statistik.
36 3.4.6 Penentuan Isotherm Adsorpsi
Hasil penentuan variasi konsentrasi ion logam (adsorbat) berupa konsentrasi akhir (Ce) dan kapasitas adsorpsi (Q) diplotkan dengan menggunakan persamaan regresi linier. Nilai koefisien korelasi yang besarnya mendekati 1 setelah dibuat persamaan isotherm Langmuir dan isotherm Freundlich maka akan menentukan jenis isotherm adsorpsi yang terjadi pada proses adsorpsi ion logam tersebut.
3.4.7 Penentuan Kinetika Adsorpsi
Kinetika adsorpsi dihitung dengan melihat perubahan kondisi konsentrasi sebagai fungsi waktu. Kemudian ditentukan orde reaksi diantara orde 0, 1, dan 2 menggunakan Persamaan 9, 12, dan 15. Konstanta laju reaksi dapat ditentukan dengan menggunakan persamaan Arrhenius pada Persamaan 16.
3.4.8 Regenerasi adsorben
Ion logam yang telah terserap dalam material adsorben serbuk gergaji kayu meranti pada kondisi optimum dilepaskan kembali atau dielusi dengan cara menambahkan larutan HNO3 0,5 M, Na2EDTA 0,01 M dan H2O sebanyak 20 mL pada masing-masing adsorben. Kemudian filtrat dipisahkan dengan adsorben dengan menggunakan kertas saring. Selanjutnya konsentrasi ion logam didalam filtrat ditentukan kembali dengan spektrofotometer serapan atom (SSA).
37 BAB IV
HASIL DAN PEMBAHASAN
4.1 Adsorben Serbuk Gergaji Kayu Meranti
Pembuatan adsorben serbuk kayu meranti yang digunakan untuk menyerap ion logam dilakukan dalam 3 (tiga) bentuk perlakuan, yaitu tanpa aktivasi, aktivasi fisika dan aktivasi kimia. Serbuk kayu meranti yang didapatkan dari hasil limbah buangan toko mabel kayu ini sebelumnya dibersihkan dengan menggunakan air mengalir untuk menghilangkan pengotor-pengotor yang terdapat di dalam serbuk seperti pasir, tanah, batu-batuan kecil dan lain sebagainya. Serbuk kayu meranti dijemur dibawah sinar matahari selama satu minggu untuk mengurangi kadar air yang ada dalam serbuk kayu meranti agar serbuk kayu meranti menjadi kering.
Serbuk kayu meranti juga dihaluskan dengan menggunakan blender agar bentuk serbuk kayu meranti menjadi semakin kecil sehingga lebih mudah untuk dihaluskan. Kemudian serbuk kayu meranti dikeringkan kembali dengan menggunakan oven pada suhu 110 oC selama ± 3 jam. Suhu 110 oC membuat kandungan air yang ada pada serbuk kayu meranti akan menguap seluruhnya.
Adsorben tanpa aktivasi, aktivasi fisika, dan aktivasi kimia menghasilkan warna fisik yang berbeda pada ketiganya (Gambar 8). Sampel tanpa aktivasi memiliki warna coklat muda sedangkan sampel aktivasi kimia berwarna coklat gelap dan sampel aktivasi fisika berwarna hitam sebab sampel telah menjadi karbon aktif. Warna lebih gelap atau pucat pada aktivasi kimia disebabkan karena adanya reaksi hidrolisis yaitu pemecahan rantai polisakarida menjadi monosakarida (Kirk
& Othmer, 1983).