PENETAPAN KADAR PIRAZINAMIDA DENGAN METODE SPEKTROFOTOMETRI ULTRAVIOLET
DALAM SEDIAAN TABLET
SKRIPSI
OLEH:
ROMA ANITA AGUSTINA M. NIM 081524079
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENETAPAN KADAR PIRAZINAMIDA DENGAN METODE SPEKTROFOTOMETRI ULTRAVIOLET
DALAM SEDIAAN TABLET
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ROMA ANITA AGUSTINA M. NIM 081524079
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
PENETAPAN KADAR PIRAZINAMIDA DENGAN METODE SPEKTROFOTOMETRI ULTRAVIOLET
DALAM SEDIAAN TABLET OLEH:
ROMA ANITA AGUSTINA M. NIM 081524079
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: Juli 2011
Disetujui Oleh:
Pembimbing I, Panitia Penguji,
(Drs. Syafruddin, M.S., Apt.) (Prof.Dr.rer.nat. Effendy De Lux Putra, SU, Apt.) NIP 19481111197603100 NIP 195306191983031001
Pembimbing II, (Dra. Salbiah. M.Si, Apt.) NIP 194809041974122001
(Dra. Nurmadjuzita, M.Si., Apt.) (Dra. Tuty Roida Pardede, M.Si., Apt.) NIP 194809041974122001 NIP 195401101980032001
Medan, Agustus 2011
Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah
melimpahkan nikmat, rahmat, dan karuniaNya, sehingga penulis dapat
menyelesaikan skripsi yang berjudul “Penetapan Kadar Pirazinamida Dengan
Metode Spektrofotometri Ultraviolet dalam Sediaan Tablet”. Skripsi ini diajukan
sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas
Farmasi Universitas Sumatera Utara.
Tujuan penelitian ini adalah untuk menentukan kadar pirazinamida dalam
sediaan tablet dengan spektrofotometri ultraviolet. Metode ini relatif lebih murah
dan mudah dalam pelaksanaannya, namun memberikan hasil dengan akurasi dan
presisi yang baik. Dari metode yang digunakan ternyata kadar pirazinamida
dalam sediaan tablet generik dan nama dagang memenuhi persyaratan kadar
yang ditetapkan Farmakope Indonesia edisi IV, 1995.
Pada kesempatan ini penulis menyampaikan terima kasih yang
sebesar-besarnya kepada Bapak Drs. Syafruddin, M.S., Apt., dan Ibu Dra. Nurmadjuzita,
M.Si., Apt., yang telah membimbing dengan penuh kesabaran, tulus dan ikhlas
selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terima kasih
juga disampaikan kepada Dekan Fakultas Farmasi Universitas Sumatera Utara,
Prof. Dr. Sumadio Hadisahputra, Apt., yang telah memberikan bantuan dan
fasilitas selama masa pendidikan.
Ucapan terima kasih juga disampaikan kepada Bapak dan Ibu dosen
penguji yang telah memberikan kritikan, saran dan arahan kepada penulis dalam
menyelesaikan skripsi ini.
Penulis juga tidak lupa mengucapkan terima kasih dan penghargaan yang
tulus kepada Orang Tua, (Alm) Drh. M. Manalu dan (Almh) T. Aritonang, kakak
dan abang tercinta, serta teman- teman atas doa, dorongan dan pengorbanan baik
moril maupun materil dalam penyelesaian skripsi ini.
Medan, Juli 2011 Penulis,
Penetapan Kadar Pirazinamida dengan Metode Spektrofotometri Ultraviolet
dalam Sediaan Tablet
Abstrak
Pirazinamida adalah suatu obat antituberkulosis sintetik dan efektif
digunakan peroral serta bersifat bakterisidal yang digunakan bersama-sama
dengan isoniazid dan rifampisin. Pirazinamida bersifat bakterisidal kuat terhadap
organisme intrasel. Pirazinamida harus dihidrolisis secara enzimatik menjadi
asam pirazinoat yang merupakan metabolit aktif utama dari pirazinamida
Tujuan penelitian ini adalah untuk menentukan kadar pirazinamida dalam
sediaan tablet dengan metode spektrofotometri ultraviolet. Metode ini relatif
lebih murah dan mudah dalam pelaksanaannya, namun memberikan hasil dengan
akurasi dan presisi yang baik. Metode yang digunakan pada penelitian ini yaitu
secara spektrofotometri ultraviolet dalam pelarut HCl 0,1N pada panjang
gelombang 268 nm.
Dari hasil penelitian diperoleh kadar tablet pirazinamida generik (Indofarma) sebesar 100.02% ± 0,58, dan tablet nama dagang Sanazet® (Sanbe) sebesar 98,75% ± 2,13, Siranamid® (Mersi) sebesar 97,98% ± 2,34, TB Zet® (Meprofarm) sebesar 98,74% ± 1,13, Pezeta Ciba® (Sandoz) sebesar 98,67% ± 1,39.
Metode ini memenuhi persyaratan uji validasi dengan persen perolehan
kembali 99,20% dan relatif standar deviasi (RSD) 1,07%, batas deteksi (LOD) 0,2088 µg/ml dan batas kuantitasi (LOQ) 0,6962 µg/ml. Hasil penelitian
menunjukkan kadar pirazinamida dalam sediaan tablet generik dan nama dagang
memenuhi persyaratan tablet menurut Farmakope Indonesia Edisi IV tahun 1995
yaitu tidak kurang dari 93,0% dan tidak lebih dari 107,0% dari jumlah yang
tertera pada etiket.
Kata Kunci : pirazinamida, penetapan kadar, spektrofotometri ultraviolet,
Concentration Determination of pyrazinamide with Ultraviolet Spectrophotometry Method
in Tablet Preparations Abstract
Pirazinamida is a synthetic antituberculosis drug and peroral use.
Pirazinamida used together with isoniazid and rifampin. Pirazinamida is strong
bactericidal against actively dividing organisms. Pirazinamida be hydrolyzed
enzymatically into pirazinoat acid which is the active form of pirazinamida.
The purpose of this study was to determine the levels pirazinamida in
tablet dosage with ultraviolet spectrophotometric method. This method is
relatively cheap and easy in implementation, but it gives results with good
accuracy and precision. The method used in this study namely ultraviolet
spectrophotometry in HCl 0,1N at a wavelength of 268 nm.
The results were obtained levels pirazinamida generic tablets
(Indofarma) was 100.02% ± 0.58, and tablet the name of brand Sanazet ® tablets
(Sanbe) of 98.75% ± 2.13, Siranamid ® (Mersi) was 97.98 % ± 2.34,TB Zet ®
(Meprofarm) was 98.74% ± 1.13, Pezeta Ciba ® (Sandoz) was 98.67% ± 1.39.
This method meets the requirements validation test with the percent recovery of
99.20% and relative standard deviation (RSD) 1.07%, limit of detection (LOD),
0.2088 µg/ml and limit of quantitation (LOQ), 0.6962 µg/ml. The results showed
levels of pirazinamide in tablet dosage generic and trade name meets the
requirements of tablets according to the Indonesian Pharmacopoeia IV Edition
1995 is not less than 93.0% and not more than 107.0% of the total listed on the
label.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAN ... iii
ABSTRAK ... iv
ABSTRAC ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Pirazinamida ... 5
2.1.1 Sifat Fisikokimia ... 5
2.1.2 Farmakologi ... 5
2.1.3 Efek Samping ... 7
2.1.4 Dosis ... 7
2.2 Spektrofotometri Ultraviolet ... 7
2.2.1 Teori Spektrofotometri Ultraviolet ... 7
2.2.2 Hukum Lambert-Beer ... 10
2.2.3 Penggunaan Spektofotometri Ultraviolet ... 11
2.2.4 Peralatan Untuk Spektrofotometri ... 13
2.3 Validasi ... 14
BAB III METODOLOGI PENELITIAN ... 18
2.1 Waktu dan Tempat Penelitian ... 18
2.2 Alat- alat ... 18
2.3 Bahan-bahan ... 18
2.4 Pengambilan Sampel ... 18
2.5 Prosedur Penelitian ... 19
2.5.1 Pembuatan Pereaksi ... 19
2.5.2 Pembuatan Larutan Baku Pirazinamida BPFI ... 19
2.5.3 Penetapan Panjang Gelombang Serapan Maksimum ... 19
2.5.4 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi ... 19
2.5.5 Penentuan Kadar Pirazinamida dalam Sediaan Tablet ... 20
2.5.6 Uji Validasi dengan Parameter Akurasi, Presisi, Batas Deteksi dan Batas Kuantitasi ... 20
2.5.6.1 Uji Akurasi dengan Persen Perolehan Kembali (%Recovery) ... 20
2.5.6.2 Uji Presisi ... 21
2.5.7 Analisis Data secara Statistik ... 22
BAB III HASIL DAN PEMBAHASAN ……… 24
3.1 Penentuan Panjang Gelombang Serapan Maksimum Pirazinamida BPFI ... 24
3.2 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi ... 25
3.3 Penentuan Kadar Pirazinamid dalam Sediaan Tablet ... 27
3.4 Uji Validasi Metode Spektrofotometri Ultraviolet ... 28
BAB IV KESIMPULAN DAN SARAN ………. 31
4.1 Kesimpulan ... 31
4.2 Saran ... 31
DAFTAR PUSTAKA ... 32
DAFTAR TABEL
Halaman
Tabel 1. Data Absorbansi dari Kurva Serapan Maksimum ... 25 Tabel 2. Data Kurva Kalibrasi dari Pirazinamida BPFI ... 27 Tabel 3. Rentang Kadar Rata-rata Pirazinamida pada Sediaan Tablet ... 27 Tabel 4. Data Hasil Pengujian Perolehan Kembali dari Tablet Pirazinamida
(Indofarma) dengan Metode Penambahan Bahan Baku Standar
DAFTAR GAMBAR
Halaman
Gambar 1. Kurva Serapan Pirazinamida BPFI (konsentrasi 6 µg/ml) dalam Pelarut HCl 0,1 N ... 25
Gambar 2. Kurva Kalibrasi Pirazinamida BPFI dalam Pelarut HCl 0,1 N pada Panjang Gelombang 268 nm ... 26
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Konsentrasi Pengukuran Sampel ... 34 Lampiran 2. Perhitungan Persamaan Regresi Pirazinamida ... 35 Lampiran 3. Data Kadar Pirazinamida dalam Sediaan Tablet ... 36 Lampiran 4. Perhitungan Statistik Kadar Pirazinamida pada Tablet Generik
(Indofarma) ... 37 Lampiran 5 Perhitungan Statistik Kadar Pirazinamida pada Tablet Sanazet® (Sanbe) ... 39 Lampiran 6. Perhitungan Statistik Kadar Pirazinamida pada Tablet Siranamid®
(Mersi) ... 41 Lampiran 7. Perhitungan Statistik Kadar Pirazinamida pada Tablet TB Zet®
(Meprofarm) ... 43 Lampiran 8. Perhitungan Statistik Kadar Pirazinamida pada Tablet Pezeta
Ciba®
(Sandoz) ... 45 Lampiran 9. Contoh Perhitungan Penimbangan Sampel dari Tablet
Pirazinamida Generik (Indofarma) ... 47 Lampiran 10. Contoh Perhitungan Persentase (%) Perolehan Kembali dari
Tablet Pirazinamida Generik (Indofarma) ... 48 Lampiran 11. Perhitungan Kadar Sampel Tablet Pirazinamida Generik
(Indofarma) dari Lampiran 10 Setelah Penimbangan ... 49 Lampiran 12. Contoh Perhitungan Penimbangan Bahan Baku pada Persen
Perolehan Kembali ... 51 Lampiran 13. Contoh Perhitungan Penimbangan Analit pada Persen Perolehan Kembali dari Tablet Pirazinamida Generik (Indofarma) ... 52 Lampiran 14. Contoh Perhitungan Penimbangan Analit dari Tablet
Lampiran 15. Contoh Perhitungan Persen Perolehan Kembali dengan Metode Penambahan Bahan Baku (Standard Addition Method) dari Tablet
Pirazinamida Generik (Indofarma) ... 54
Lampiran 16. Data Hasil Persen Perolehan Kembali Pirazinamid pada Tablet Pirazinamida Generik (Indofarma) dengan Metode Penambahan Bahan Baku (Standard Addition Method) ... 55
Lampiran 17. Contoh Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) ... 56
Lampiran 18. Data Pengukuran Analit pada Persen Perolehan Kembali dari Tablet Pirazinamida Generik (Indofarma) ... 57
Lampiran 19. Data Pengukuran Analit pada Persen Perolehan Kembali dari Tablet Pirazinamida Generik (Indofarma) Setelah Penambahan Bahan Baku ... 58
Lampiran 20. Daftar Spesifikasi Sampel ... 59
Lampiran 21. Nilai Distribusi t ... 61
Lampiran 22. Sertifikat Bahan Baku POM ... 62
Lampiran 23. Sertifikat Bahan Baku Pirazinamida dari PT. Indofarma ... 63
Penetapan Kadar Pirazinamida dengan Metode Spektrofotometri Ultraviolet
dalam Sediaan Tablet
Abstrak
Pirazinamida adalah suatu obat antituberkulosis sintetik dan efektif
digunakan peroral serta bersifat bakterisidal yang digunakan bersama-sama
dengan isoniazid dan rifampisin. Pirazinamida bersifat bakterisidal kuat terhadap
organisme intrasel. Pirazinamida harus dihidrolisis secara enzimatik menjadi
asam pirazinoat yang merupakan metabolit aktif utama dari pirazinamida
Tujuan penelitian ini adalah untuk menentukan kadar pirazinamida dalam
sediaan tablet dengan metode spektrofotometri ultraviolet. Metode ini relatif
lebih murah dan mudah dalam pelaksanaannya, namun memberikan hasil dengan
akurasi dan presisi yang baik. Metode yang digunakan pada penelitian ini yaitu
secara spektrofotometri ultraviolet dalam pelarut HCl 0,1N pada panjang
gelombang 268 nm.
Dari hasil penelitian diperoleh kadar tablet pirazinamida generik (Indofarma) sebesar 100.02% ± 0,58, dan tablet nama dagang Sanazet® (Sanbe) sebesar 98,75% ± 2,13, Siranamid® (Mersi) sebesar 97,98% ± 2,34, TB Zet® (Meprofarm) sebesar 98,74% ± 1,13, Pezeta Ciba® (Sandoz) sebesar 98,67% ± 1,39.
Metode ini memenuhi persyaratan uji validasi dengan persen perolehan
kembali 99,20% dan relatif standar deviasi (RSD) 1,07%, batas deteksi (LOD) 0,2088 µg/ml dan batas kuantitasi (LOQ) 0,6962 µg/ml. Hasil penelitian
menunjukkan kadar pirazinamida dalam sediaan tablet generik dan nama dagang
memenuhi persyaratan tablet menurut Farmakope Indonesia Edisi IV tahun 1995
yaitu tidak kurang dari 93,0% dan tidak lebih dari 107,0% dari jumlah yang
tertera pada etiket.
Kata Kunci : pirazinamida, penetapan kadar, spektrofotometri ultraviolet,
Concentration Determination of pyrazinamide with Ultraviolet Spectrophotometry Method
in Tablet Preparations Abstract
Pirazinamida is a synthetic antituberculosis drug and peroral use.
Pirazinamida used together with isoniazid and rifampin. Pirazinamida is strong
bactericidal against actively dividing organisms. Pirazinamida be hydrolyzed
enzymatically into pirazinoat acid which is the active form of pirazinamida.
The purpose of this study was to determine the levels pirazinamida in
tablet dosage with ultraviolet spectrophotometric method. This method is
relatively cheap and easy in implementation, but it gives results with good
accuracy and precision. The method used in this study namely ultraviolet
spectrophotometry in HCl 0,1N at a wavelength of 268 nm.
The results were obtained levels pirazinamida generic tablets
(Indofarma) was 100.02% ± 0.58, and tablet the name of brand Sanazet ® tablets
(Sanbe) of 98.75% ± 2.13, Siranamid ® (Mersi) was 97.98 % ± 2.34,TB Zet ®
(Meprofarm) was 98.74% ± 1.13, Pezeta Ciba ® (Sandoz) was 98.67% ± 1.39.
This method meets the requirements validation test with the percent recovery of
99.20% and relative standard deviation (RSD) 1.07%, limit of detection (LOD),
0.2088 µg/ml and limit of quantitation (LOQ), 0.6962 µg/ml. The results showed
levels of pirazinamide in tablet dosage generic and trade name meets the
requirements of tablets according to the Indonesian Pharmacopoeia IV Edition
1995 is not less than 93.0% and not more than 107.0% of the total listed on the
label.
BAB I PENDAHULUAN 1.1Latar Belakang
Tuberkulosis atau TB adalah suatu penyakit yang disebabkan oleh bakteri
tahan asam (BTA, Mikobakterium tuberkulosa) yang ditularkan melalui udara.
Penyakit tuberkulosis masih merupakan penyebab utama kematian di
negara-negara berkembang, berkisar 10-25% dari populasi di negara-negara tersebut. Indonesia
merupakan negara pertama diantara negara-negara dengan beban TB yang tinggi
di wilayah Asia Tenggara. Saat ini Indonesia urutan ke lima diantara negara
dengan beban TB tertinggi di dunia. Penemuan kasus TB menurut provinsi yang
tertinggi adalah provinsi Sulawesi utara yakni 89,6% dan diikuti oleh DKI
Jakarta yakni 85,5% dan Banten 78,6%. Obat yang digunakan untuk penyakit ini
dibagi atas 2 golongan besar, yaitu:
1. Golongan I: isoniazid (INH), rifampisin, etambutol, streptomisin,
pirazinamida
2. Golongan II: para amino salisilat (PAS), etionamid, kanamisin,
sikloserin, kapreomisin dan amikasin (Agoes. dkk. 1994; Dirjen PP&PL,
Kemenkes RI. 2011).
Gejala TB antara lain batuk kronis, demam, berkeringat waktu malam, keluhan
pernapasan, rasa kurang enak badan (malaise), hilang nafsu makan, turunnya
berat badan, dan rasa nyeri di bagian dada (Tjay dan Rahardja. 2007).
Pirazinamida adalah suatu obat antituberkulosis yang dibuat secara sintetik
dan efektif digunakan peroral dan bersifat bakterisidal yang digunakan
terhadap organisme yang aktif membelah diri. Pirazinamida harus dihidrolisis
secara enzimatik menjadi asam pirazinoat yang merupakan bentuk aktif dari
pirazinamida (Mycek, dkk. 2001).
Pada pembuatan obat, kadar zat aktif merupakan persyaratan yang harus
dipenuhi untuk menjamin kualitas sediaan obat. Sediaan obat yang berkualitas
baik akan menunjang tercapainya efek terapeutik yang diharapkan. Salah satu
persyaratan mutu adalah kadar yang dikandung harus memenuhi persyaratan
kadar seperti yang tercantum dalam Farmakope Indonesia atau buku standar
lainnya (Depkes RI, 2009).
Menurut Moffat. dkk. (2004), berdasarkan struktur kimia dari pirazinamida
memiliki nilai Pka:0,5 dan.Dalam Farmakope Indonesia Edisi IV, 1995.
aPenetapan kadar dalam sediaan tablet pirazinamida dapat dilakukan secara
volumetri dengan titrasi semi bebas air sebagai asam dan basa. Dalam USP 30,
2007 penetapan kadar dalam sediaan tablet dapat dilakukan secara
Kromatografi, yaitu kromatografi lapis tipis, kromatografi gas maupun
kromatografi cair kinerja tinggi. Menurut Moffat. dkk. (2004). pirazinamida
mempunyai serapan maksimum dalam HCl 0,1 N pada panjang gelombang 269
nm ( 1 1
A = 659a) sehingga dapat dilakukan penetapan kadar secara
spektrofotometri ultraviolet. Berdasarkan hal maka peneliti melakukan
Penetapan kadar pirazinamida secara spektrofotometri ultraviolet
Untuk menguji validitas dari metode ini dilakukan pengujian antara lain uji
akurasi dengan parameter % recovery, uji presisi dengan parameter koefisien
variasi (RSD), uji sensitifitas dengan parameter limit deteksi (LOD) dan limit
1.2Perumusan Masalah
1. Apakah kadar pirazinamida dalam sediaan tablet dapat ditentukan dengan
metode spektrofotometri ultraviolet dalam pelarut HCl 0,1N dan
memenuhi persyaratan validasi ?
2. Apakah kadar pirazinamida dalam sediaan tablet yang beredar di pasaran
memenuhi persyaratan Farmakope edisi IV tahun 1995?
1.3 Hipotesis
1. Diduga kadar pirazinamida dalam sediaan tablet dapat ditentukan dengan
metode spektrofotometri ultraviolet dengan pelarut HCl 0,1 N dan
memenuhi persyaratan validasi.
2. Kadar pirazinamida dalam sediaan tablet yang beredar di pasaran
memenuhi persyaratan Farmakope Indonesia edisi IV tahun 1995 .
1.4Tujuan Penelitian
1. Untuk menentukan kadar pirazinamida dalam sediaan tablet secara dapat
ditentukan dengan metode spektrofotometri ultraviolet dalam pelarut HCl
0,1 N dan menguji persyaratan validasi.
2. Untuk mengetahui kadar pirazinamida dalam sediaan tablet yang beredar
di pasaran memenuhi persyaratan yang ditetapkan Farmakope Indonesia
BAB II
TINJAUAN PUSTAKA
Tuberkulosis atau TB adalah suatu penyakit yang disebabkan oleh bakteri
tahan asam (BTA, Mikobakterium tuberkulosa) yang ditularkan melalui udara.
Berdasarkan tempat atau organ yang diserang oleh mikobakterium tuberkulosa,
maka tuberkulosis dibedakan menjadi tuberkulosis paru dan tuberkulosis ekstra
paru.
1. Tuberkulosis Paru adalah tuberkulosis yang menyerang jaringan
parenkim paru, tidak pleura(selaput paru
2. Tuberkulosis Ekstra Paru adalah tuberkulosis yang menyerang organ
tubuh selain paru, misalnya Selaput otak, kelenjar lymfe, tulang,
persendiaan, kulit, usus, ginjal, saluran kencing.
Obat yang digunakan untuk penyakit ini dibagi atas 2 golongan besar, yaitu:
3. Golongan I : isoniazid (INH), rifampisin, etambutol, streptomisin,
pirazinamid
4. Golongan II : para amino salisilat (PAS), etionamid, kanamisin,
sikloserin, kapreomisin dan amikasin (Agoes. dkk. 1994; Dirjen PP&PL,
2.1 Pirazinamida 2.1.1 Sifat Fisikokimia
Rumus Struktur :
Rumus Molekul : C5H5N3O
Sinonim : Pirazinkarboksamida
Berat Molekul : 123,11
Suhu Lebur : Antara 1880 dan 1910.
Pemerian : Serbuk hablur, putih hingga praktis putih; tidak berbau
atau praktis tidak berbau.
Kelarutan : Agak sukar larut dalam air; sukar larut dalam etanol, dalam
eter dan dalam kloroform.
2.1.2 Farmakologi
Pirazinamida adalah suatu obat antituberkulosis yang dibuat secara sintetik
dan efektif digunakan bersama-sama dengan isoniazid dan rifampisin.
Pirazinamida bersifat bakterisidal terhadap organisme intrasel. Pirazinamida
dihidrolisis secara enzimatik menjadi asam pirazinoat yang merupakan metabolit
aktif utama dari pirazinamida. Asam pirazinoat selanjutnya dihidroksilasi
ini diekskresikan melalui urin. Pirazinamida mudah diserap diusus dan
disebarkan ke seluruh tubuh (Mycek, dkk. 2001; Zubaidi. 2007).
Pirazinamida adalah salah satu obat garis depan yang ditentukan untuk
pengobatan Mycobacterium tuberculosis. Dianggap sebagai prodrug dari asam
pirazinoat, yang dipercaya sebagai inhibitor aktif M. tuberculosis. Asam pirazinoat
merupakan metabolit aktif utama dari pirazinamida, yang dihasilkan oleh liver
mikrosomal deamidase kemudian asam pirazinoat ini selanjutnya dihidroksilasi
menjadi 5-asam hidroksipirazinoat oleh xantin oksidase. Jalur metabolit lainnya,
pirazinamida dioksidasi langsung menjadi 5-hidroksipirazinamida oleh xantin
oksidase. Ketiga metabolit pirazinamida ini terutama diekskresikan dalam urin.
Konsentrasi serum 30-50 μg/mL pada 1-2 jam setelah pemberian oral
dicapai dengan dosis 25 mg/kg/hari. Pirazinamida dapat dengan baik diserap dari
saluran cerna dan secara luas didistribusikan pada jaringan tubuh, termasuk selaput
otak yang terinfeksi. Waktu paruhnya adalah 8-11 jam. Pirazinamida merupakan
suatu obat fase awal pengobatan yang penting dan digunakan bersama dengan
isoniazid dan rifampin dalam pemberian jangka pendek (yaitu 6 bulan) sebagai suatu
agen sterilisator aktif untuk melawan sisa-sisa organisme intraseluler yang dapat
mengakibatkan kekambuhan (Crofton.2002).
2.1.3 Efek Samping
Efek sampingnya yang sering kali terjadi dan berbahaya adalah kerusakan
hati dan ikterus (hepatotoksis), terutama pada dosis di atas 2 g sehari. Pengobatan
harus segera dihentikan bila ada tanda-tanda kerusakan hati (Tjay dan Rahardja,
Keamanan penggunaan pada anak-anak belum ditetapkan. Hati-hati penggunaan
pada penderita dengan encok atau riwayat encok keluarga atau diabetes mellitus; dan
penderita dengan fungsi ginjal tak sempurna; penderita dengan riwayat tukak
lambung (Depkes. 2005).
2.1.4 Dosis
Dewasa dan anak sebanyak 15-30 mg/ kg BB, satu kali sehari atau 50-70
mg/ kg BB 2-3 kali seminggu. Obat ini dipakai bersamaan dg obat anti
tuberkulosis lainnya.
2.1.5 Sediaan
Dalam perdagangan pirazinamida tersedia dalam bentuk tablet
mengandung 500mg/tablet (ISO, 2009).
2.2 Spektrofotometri Ultraviolet
2.2.1 Teori Spektrofotometri Ultraviolet
Spektrofotometri serapan merupakan pengukuran suatu interaksi antara
radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia. Teknik yang
sering digunakan dalam analisis farmasi meliputi spektrofotometri ultraviolet,
cahaya tampak, infra merah dan serapan atom. Jangkauan panjang gelombang
untuk daerah ultraviolet adalah 190-380 nm, daerah cahaya tampak 380-780 nm,
daerah inframerah dekat 780-3000 nm, dan daerah inframerah 2,5-40 µ m (Ditjen
Sinar ultraviolet dan sinar tampak memberikan energi yang cukup untuk
terjadinya transisi elektronik. Transisi-transisi elektronik akan meningkatkan
energi molekuler dari keadaan dasar ke satu atau lebih tingkat energi tereksitasi.
Jika suatu molekul sederhana dikenakan radiasi elektromagnetik maka molekul
tersebut akan menyerap radiasi elektromagnetik yang energinya sesuai. Interaksi
antara molekul dengan radiasi elektromagnetik ini akan meningkatkan energi
potensial elektron dari tingkat dasar ke tingkat tereksitasi. Apabila pada molekul
yang sederhana tadi hanya terjadi transisi elektronik pada satu macam gugus
yang terdapat pada molekul, maka hanya akan terjadi satu absorpsi yang
merupakan pita spektrum. Terjadinya dua atau lebih pita spektrum diberikan oleh
molekul dengan struktur yang lebih kompleks karena terjadi beberapa transisi
sehingga mempunyai lebih dari satu panjang gelombang (Rohman dan Gandjar,
2007).
Gugus fungsi yang menyerap radiasi di daerah ultraviolet dekat dan
daerah tampak disebut gugus kromofor dan hampir semua gugus ini mempunyai
ikatan tak jenuh. Pada kromofor jenis ini transisi terjadi dari π → π*, yang
menyerap pada panjang gelombang maksimum kecil dari 200 nm (tidak
terkonyugasi), misalnya pada >C=C< dan –C ≡ C–. Kromofor ini merupakan
tipe transisi dari sistem yang mengandung elektron π pada orbital molekulnya.
Untuk senyawa yang mempunyai sistem konyugasi, perbedaan energi antara
keadaan dasar dan keadaan tereksitasi menjadi lebih kecil sehingga penyerapan
terjadi pada panjang gelombang yang lebih besar (Dachriyanus, 2004).
Gugus fungsi seperti -OH, -O, -NH2, dan -OCH3 yang memberikan
dapat menyerap radiasi ultraviolet-sinar tampak, tetapi apabila gugus ini terikat
pada gugus kromofor mengakibatkan pergeseran panjang gelombang ke arah
yang lebih besar (pergeseran batokromik).
Hal – hal yang harus diperhatikan dalam analisis spektrofotometri
ultraviolet antara lain:
1. Pemilihan panjang gelombang maksimum
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah
panjang gelombang dimana terjadi serapan maksimum. Panjang gelombang
serapan maksimum, dapat diperoleh dengan membuat kurva hubungan
antara absorbansi dengan panjang gelombang dari suatu larutan baku pada
konsentrasi tertentu. Ada beberapa alasan mengapa harus menggunakan
panjang gelombang maksimal, yaitu:
• Pada panjang gelombang maksimal, kepekaannya juga maksimal karena
pada panjang gelombang maksimal tersebut, perubahan absorbansi untuk
setiap satuan konsentrasi adalah yang paling besar.
• Disekitar panjang gelombang maksimal, bentuk kurva absorbansi datar
dan pada kondisi tersebut hukum Lambert-Beer akan terpenuhi.
• Jika dilakukan pengukuran ulang maka kesalahan yang terjadi pada
pengulangan akan kecil sekali, karena digunakan panjang gelombang
maksimal.
2. Pembuatan kurva kalibrasi
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai
konsentrasi. Masing-masing absorbansi larutan tersebut diukur, kemudian
konsentrasi. Bila hukum Lambert- Beer terpenuhi maka kurva kalibrasi
merupakan garis lurus.
3. Pembacaan absorbansi sampel atau cuplikan
Absorbansi yang terbaca pada spektrofotometer sebaiknya antara 0,2- 0,6
karena pada kisaran nilai tersebut, kesalahan fotometrik yang terjadi adalah
paling minimal (Rohman dan Gandjar, 2007).
2.2.2 Hukum Lambert-Beer
Menurut Hukum Lambert, serapan berbanding lurus terhadap ketebalan
sel yang disinari. Sedangkan menurut Beer, serapan berbanding lurus dengan
konsentrasi, ini berlaku untuk radiasi monokromatis dalam larutan yang sangat
encer. Kedua pernyataan ini dapat dijadikan satu dalam Hukum Lambert-Beer,
sehingga diperoleh bahwa serapan berbanding lurus terhadap konsentrasi dan
ketebalan sel, yang dapat ditulis dengan persamaan:
A= a.b.c (g/liter) atau A= ε. b. c (mol/liter)
Dimana: A = serapan
a = absorptivitas
b = ketebalan sel
c = konsentrasi
ε = absorptivitas molar
Berdasarkan Hukum Lambert-Beer yang menjadi dasar aspek kuantitatif
pada spektrofotometri: konsentrasi dapat dihitung dari ketebalan sel dan
serapan. Absorptivitas merupakan suatu tetapan dan spesifik untuk setiap
molekul pada panjang gelombang dan pelarut tertentu (Day dan Underwood,
Menurut Roth dan Blaschke (1981), absorptivitas spesifik (A11) juga
sering digunakan untuk menggantikan absorptivitas. Harga ini, memberikan
serapan larutan 1 % (b/v) dengan ketebalan sel 1 cm, sehingga dapat diperoleh
persamaan:
A = A11. b. c
Dimana : A11= absorptivitas spesifik
b = ketebalan sel
c = konsentrasi senyawa terlarut (g/100ml larutan)
2.2.3 Penggunaan Spektofotometri Ultraviolet
Spektrofotometri ultraviolet digunakan dalam analisis senyawa organik
yaitu:
1. Analisis kualitatif
Secara eksperimental, sangat mudah untuk mengukur banyaknya radiasi
yang diserap oleh suatu molekul sebagai fungsi frekuensi radiasi. Suatu grafik
yang menghubungkan antara banyaknya sinar yang diserap dengan frekuensi
(panjang gelombang) sinar merupakan spektrum absorpsi. Transisi yang terjadi
untuk suatu molekul dengan struktur kimia yang berbeda tidaklah sama sehingga
spektrum absorpsinya juga berbeda. Dengan demikian, spektrum dapat
digunakan sebagai bahan informasi yang bermanfaat untuk analisis kualitatif
(Rohman dan Gandjar, 2007).
2. Analisis kuantitatif
Penggunaan utama spektrofotometri ultraviolet adalah dalam analisis
mengabsorpsi radiasi, akan terjadi pengurangan kekuatan radiasi yang mencapai
detektor. Parameter intensitas atau kekuatan energi radiasi yang diabsorpsi oleh
molekul adalah absorban (A) yang dalam batas konsentrasi tertentu nilainya
sebanding dengan banyaknya molekul yang mengabsorpsi radiasi dan merupakan
dasar analisis kuantitatif. Konsentrasi larutan analit umumnya 10 sampai 20 µg/
l, tetapi untuk senyawa yang nilai absorptivitasnya besar dapat diukur pada
konsentrasi yang lebih rendah. Senyawa yang tidak mengabsorpsi radiasi
ultraviolet-sinar tampak dapat juga ditentukan dengan spektrofotometri
ultraviolet-sinar tampak, apabila ada reaksi kimia yang dapat mengubahnya
menjadi kromofor atau dapat disambungkan dengan suatu pereaksi kromofor
(Satiadarma, 2004).
Analisis kuantitatif secara spektrofotometri ultraviolet dapat dilakukan
dengan metode regresi dan pendekatan.
1. Metode Regresi
Analisis kuantitatif dengan metode regresi yaitu dengan menggunakan
persamaan regresi yang didasarkan pada harga serapan dan konsentrasi standar
yang dibuat dalam beberapa konsentrasi, paling sedikit menggunakan 5 rentang
konsentrasi yang meningkat yang dapat memberikan serapan yang linier,
kemudian diplot menghasilkan suatu kurva yang disebut dengan kurva kalibrasi.
Konsentrasi suatu sampel dapat dihitung berdasarkan kurva tersebut.
2. Metode Pendekatan
Analisis kuantitatif dengan cara ini dilakukan dengan membandingkan
serapan standar yang konsentrasinya diketahui dengan serapan sampel.
dimana As= serapan sampel, Ab= serapan standar, Cb= konsentrasi standar, dan
C= konsentrasi sampel (Holme dan Peck, 1983).
2.2.4 Peralatan Untuk Spektrofotometri
Spektrofotometer adalah alat untuk mengukur transmitans atau serapan
suatu sampel sebagai fungsi panjang gelombang. Spektrofotometer merupakan
penggabungan dari dua fungsi alat yang terdiri dari spektrometer yang
menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan
fotometer sebagai alat pengukur intensitas cahaya yang ditransmisikan atau yang
diabsorpsi (Day dan Underwood, 1999).
Unsur -unsur terpenting suatu spektrofotometer adalah sebagai berikut:
1. Sumber radiasi: lampu deuterium digunakan untuk daerah UV pada panjang
gelombang dari 190-380 nm, sementara lampu halogen kuarsa atau lampu
tungsten digunakan untuk daerah visibel pada panjang gelombang antara
380- 780 nm.
2. Monokromotor: digunakan untuk memperoleh sumber sinar yang
monokromatis. Alatnya dapat berupa prisma maupun grating. Untuk
mengarahkan sinar monokromatis yang diinginkan dari hasil penguraian.
3. Kuvet (sel): digunakan sebagai wadah sampel untuk menaruh cairan ke
dalam berkas cahaya spektrofotometer. Kuvet itu haruslah meneruskan
energi radiasi dalam dearah spektrum yang diinginkan. Pada pengukuran
didaerah sinar tampak, kuvet kaca atau kuvet kaca corex dapat digunakan,
tetapi untuk pengukuran pada daerah ultraviolet kita harus menggunakan sel
kuarsa karena gelas tidak tembus radiasi pada daerah ini. Kuvet sinar tampak
dengan ketebalan yang sangat beraneka, mulai dari ketebalan kurang dari 1
milimeter sampai 10 cm bahkan lebih.
4. Detektor: Peranan detektor penerima adalah memberikan respon terhadap
cahaya pada berbagai panjang gelombang.
5. Amplifier (penguat) dan rangkaian yang berkaitan yang membuat isyarat
listrik itu dapat dibaca.
6. Sistem pembacaan yang memperlihatkan besarnya isyarat listrik (Day and
Underwood, 1999).
2.3 Validasi
Validasi adalah suatu tindakan terhadap parameter tertentu pada prosedur
penetapan yang dipakai untuk membuktikan bahwa parameter tersebut
memenuhi persyaratan untuk penggunaannya. Validasi dilakukan untuk
menjamin bahwa metode analisis yang dilakukan akurat, spesifik, reprodusibel
dan tahan pada kisaran analit yang akan dianalisis (WHO, 1989; Rohman dan
Gandjar, 2007).
Parameter analisis yang ditentukan pada validasi adalah akurasi, presisi,
spesifikasi, limit deteksi, limit kuantitasi, linieritas dan rentang metode (Harmita,
2004; Rohman dan Gandjar, 2007).
Akurasi (kecermatan) adalah ukuran yang menunjukkan derajat
kedekatan hasil analisis dengan kadar analit sebenarnya. Akurasi dinyatakan
sebagai persen perolehan kembali (% recovery) analit yang ditambahkan dan
dapat ditentukan melalui dua cara yaitu metode simulasi (spiked placebo
recovery) dan metode penambahan bahan baku (standard addition method).
kimia) ditambahkan ke dalam campuran bahan sediaan farmasi (plasebo), lalu
campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar standar
yang ditambahkan (kadar sebenarnya). Dalam metode adisi (penambahan bahan
baku), sampel dianalisis lalu sejumlah tertentu analit yang diperiksa ditambahkan
ke dalam sampel, dicampur dan dianalisis kembali. Selisih kedua hasil
dibandingkan dengan kadar yang sebenarnya (hasil yang diharapkan). Dalam
kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara
hasil yang diperoleh dengan hasil yang sebenarnya.
% Perolehan Kembali = x100% C
B A−
Keterangan:
A = konsentrasi sampel yang diperoleh setelah penambahan baku
B = konsentrasi sampel sebelum penambahan baku
C = konsentrasi baku yang ditambahkan
Presisi dari suatu metode analisis adalah derajat kesesuaian diantara
masing-masing hasil uji, jika prosedur analisis diterapkan berulang kali pada
sejumlah cuplikan yang diambil dari sampel homogen. Presisi dinyatakan
sebagai deviasi standar atau deviasi standar relatif (koefisien variasi). Presisi
dapat diartikan pula sebagai derajat reprodusibilitas atau keterulangan dari
prosedur analisis. Ada 4 macam ukuran presisi, yaitu:
a. Kisaran (range) merupakan selisih hasil penetapan yang paling besar dengan
b. Deviasi rata-rata (mean deviation) merupakan deviasi masing-masing hasil
penetapan terhadap rata-rata, dengan tidak memperhatikan tanda deviasinya
(positif atau negatif) dan dirumuskan sebagai berikut:
d =
c. Standar deviasi (SD) merupakan akar jumlah kuadrat deviasi masing-masing
hasil penetapan terhadap mean dibagi dengan derajat kebebasannya yang
dinyatakan dalam rumus berikut:
Keterangan: X = nilai dari masing-masing pengukuran
X = rata-rata (mean) dari pengukuran
n = frekuensi penetapan
n-1 = derajat kebebasan
d. Standar deviasi relatif (relative standard deviation, RSD) merupakan ukuran
ketepatan relatif dan umumnya dinyatakan dalam persen. RSD dirumuskan
dengan persamaan:
RSD =
Keterangan: RSD = Relative Standard Deviation (%)
SD = Standard Deviation
X = Kadar rata-rata sampel
Kespesifikan dari suatu metode analisis adalah kemampuannya untuk
mengukur kadar analit secara khusus dengan akurat, disamping komponen lain
Batas deteksi (limit of detection) didefinisikan sebagai konsentrasi analit
terendah dalam sampel yang masih dapat terdeteksi. Batas deteksi dapat dihitung
dengan rumus sebagai berikut:
Batas deteksi =
Slope xSB
3
Batas kuantitasi (limit of quantitation) didefinisikan sebagai konsentrasi
analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi
yang dapat diterima pada kondisi operasional metode yang digunakan.
Batas Kuantitasi =
Slope xSB
10
Kelinieran suatu metode analisis adalah kemampuan untuk menunjukkan
bahwa nilai hasil uji langsung atau setelah diolah secara secara matematika,
proporsional dengan konsentrasi analit dalam sampel dalam batas rentang
konsentrasi tertentu.
Rentang suatu metode analisis adalah interval antara batas konsentrasi
tertinggi dan konsentrasi terendah analit yang dapat ditentukan dengan presisi,
BAB III
METODOLOGI PENELITIAN
2.1 Waktu dan tempat penelitian
Penelitian ini merupakan penelitian deskriptif dan dilaksanakan di
Laboratorium Kimia Farmasi Kuantitatif Fakultas Farmasi Universitas Sumatera
Utara pada bulan Februari sampai Mei 2011.
2.2 Alat -alat
Alat-alat yang digunakan dalam penelitian adalah spektrofotometer
ultraviolet/ visibel (UV mini 1240 Shimadzu), neraca analitik (Boeco Germany)
dan alat-alat gelas (pyrex).
2.3 Bahan - bahan
Bahan-bahan yang digunakan dalam penelitian adalah HCl37% (Merck),
pirazinamida BPFI (Badan POM RI), Pirazinamida baku pabrik (PT. Indofarma),
tablet pirazinamida generik (Indofarma), tablet nama dagang Sanazet® (Sanbe),
Siranamid® (Mersi), TB Zet® (Meprofarm) dan Pezeta Ciba® (Sandoz), akuades
(Laboratorium Kimia Dasar).
1.4 Pengambilan Sampel
Pengambilan sampel dilakukan secara purposive yaitu tanpa
membandingkan tempat pengambilan sampel antara satu sampel dengan sampel
yang lain. Sampel yang digunakan adalah 1 sediaan tablet pirazinamida generik
2.5 Prosedur Penelitian 2.5.1 Pembuatan Pereaksi
Pembuatan asam klorida 0,1 N
Diencerkan sebanyak 8,3 ml HCl(P) 37% dalam akuades kemudian dicukupkan
sampai 1000 ml (Ditjen POM, 1995).
2.5.2 Pembuatan Larutan Baku Pirazinamida BPFI
Ditimbang seksama 50 mg pirazinamida BPFI, dimasukkan ke dalam
labu tentukur 100 ml, dilarutkan dengan 5 ml HCl 0,1 N, dikocok lalu
dicukupkan dengan HCl 0,1 N sampai garis tanda, sehingga diperoleh larutan
dengan konsentrasi 500 µg/ml. Dari larutan ini dipipet 5 ml masukkan ke dalam
labu tentukur 50 ml, diencerkan dengan HCl 0,1 N sampai garis tanda lalu
dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 50
µg/ml.
2.5.3 Penetapan Panjang Gelombang Serapan Maksimum
Dipipet 6 ml larutan baku 50 µg/ml, dimasukkan ke dalam labu tentukur
50 ml, diencerkan dengan HCl 0,1 N kemudian dicukupkan sampai garis tanda
lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 6
µg/ml. Kemudian diukur serapannya pada panjang gelombang 200-400 nm
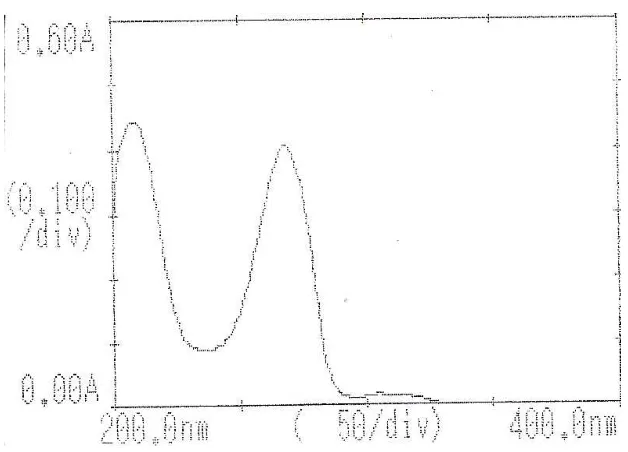
(hasil dapat dilihat pada gambar 1 dan tabel 1 halaman 11)
2.5.4 Pembuatan dan Penentuan Linieritas Kurva Kalibrasi
Dipipet larutan baku II (50 µg/ml) sebanyak 4 ml, 5 ml, 6 ml, 7 ml dan 8
ml, masing-masing dimasukkan ke dalam labu tentukur 50 ml, diencerkan
larutan dengan konsentrasi 4 µg/ml, 5 µg/ml, 6 µg/ml, 7 µg/ml dan 8 µg/ml.
Kemudian diukur serapannya pada panjang gelombang maksimum yang
diperoleh, sebagai blangko digunakan HCl 0,1 N (hasil dapat dilihat pada
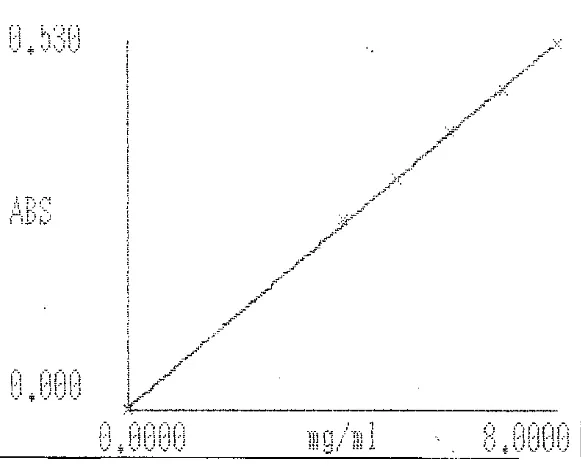
gambar 2 dan tabel 2 halaman 26 - 27).
2.5.5 Penentuan Kadar Pirazinamida dalam Sediaan Tablet
Timbang dan serbukkan 20 tablet. Timbang seksama sejumlah serbuk
setara dengan 50 mg pirazinamida (dilakukan 6 kali pengulangan), dimasukkan
ke dalam labu tentukur 100 ml, dilarutkan dengan 5 ml HCl 0,1 N, dikocok dan
dicukupkan dengan HCl 0,1 N sampai garis tanda. Kemudian disaring, 5 ml
filtrat pertama dibuang. Dipipet 5 ml filtrat, dimasukkan ke dalam labu tentukur
50 ml, diencerkan dengan HCl 0,1 N sampai garis tanda lalu dikocok sampai
homogen. Dipipet 6 ml larutan masukkan dalam labu tentukur 50 ml, diencerkan
dengan HCl 0,1 N sampai garis tanda lalu dikocok sampai homogen dan diukur
serapan pada panjang gelombang maksimum yang diperoleh (hasil dapat dilihat
pada tabel 3 halaman 27).
Penetapan kadar ditentukan dengan menggunakan persamaan regresi
yaitu:
Y = aX + b
2.5.6 Uji Validasi dengan Parameter Akurasi, Presisi, Batas Deteksi dan Batas Kuantitasi
2.5.6.1 Uji Akurasi dengan Persen Perolehan Kembali (% Recovery)
Uji akurasi dilakukan dengan metode penambahan baku (Standard
rentang spesifik 80%, 100% dan 120%, masing-masing dilakukan sebanyak 3
kali replikasi. Setiap rentang spesifik mengandung 70% analit sampel dan 30%
baku, kemudian dianalisis dengan perlakuan yang sama seperti pada penetapan
kadar sampel (hasil dapat dilihat pada tabel 4 halaman 29).
Persen perolehan kembali (% recovery) dapat dihitung dengan rumus
sebagai berikut :
% Recovery
Keterangan :
A = konsentrasi sampel yang diperoleh setelah penambahan baku
B = konsentrasi sampel sebelum penambahan baku
C = konsentrasi baku yang ditambahkan
2.5.6.2 Uji Presisi
Menurut Rohman (2007), uji presisi (keseksamaan) merupakan ukuran
ketepatan relatif ditentukan dengan parameter RSD (Relative Standard
Deviation) dan umumnya dinyatakan dalam persen. RSD dirumuskan dengan
persamaan :
RSD =
Keterangan :
RSD = Relative Standard Deviation
SD = Standard Deviation
X = Kadar Rata-rata Pirazinamida dalam Sampel
Menurut Jones, S.D (2002), untuk menghitung Standar Deviasi (SD)
digunakan rumus :
Keterangan :
SD = standar deviasi
= kadar rata-rata sampel
X = kadar sampel
n = jumlah perlakuan
2.5.6.3 Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Untuk menentukan batas deteksi (LOD) dan batas kuantitasi (LOQ) dapat
digunakan rumus :
Keterangan :
SB = Simpangan Baku
LOD = Batas Deteksi
LOQ = Batas Kuantitasi
2.5.7 Analisis Data secara Statistik
Kadar pirazinamida dihitung dengan persamaan garis regresi dan untuk
menentukan apakah data diterima atau ditolak digunakan rumus seperti di bawah
Dengan dasar penolakan data jika thitung ≥ ttabel.
Untuk mencari kadar sebenarnya dengan taraf kepercayaan 99% dengan derajat
kebebasan dk = n-1, digunakan rumus :
µ = X± t(1-1/2α)dk x
n SD
Keterangan :
µ = interval kepercayaan
X = kadar rata-rata sampel
X = kadar sampel
t = harga t tabel sesuai dengan dk = n-1
α = tingkat kepercayaan
dk = derajat kebebasan
SD = standar deviasi
n = jumlah perlakuan
3.1 Penentuan Panjang Gelombang Serapan Maksimum pirazinamida BPFI
Sebelum dilakukan penetapan kadar pirazinamida dalam sampel terlebih
dahulu dilakukan penentuan panjang gelombang serapan maksimum dalam
pelarut HCl 0,1 N ini dilakukan pada konsentrasi yang memberikan serapan
dengan kesalahan fotometrik terkecil yaitu ± 0,4343. Untuk mendapatkan
konsentrasi tersebut, dapat dihitung menggunakan nilai absorptivitas spesifik
pirazinamida (A11= 659a) (Moffat. dkk). Menurut Moffat, dkk. (2004),
pirazinamida memiliki serapan maksimum pada panjang gelombang 269nm dan
dalam Farmakope Indonesia Edisi IV, tahun 1995, pirazinamida memiliki
serapan maksimum pada panjang gelombang 268nm dalam pelarut air. Dari hasil
pengukuran penentuan panjang gelombang dengan konsentrasi pengukuran yaitu
6 µg/ml diperoleh panjang gelombang maksimum pirazinamida pada panjang
gelombang 268nm dengan serapan 0,4058 seperti terlihat pada gambar 1 dan
tabel 1. Panjang gelombang antara pirazinamida dalam pelarut HCl 0,1N dengan
pirazinamida dalam pelarut air dapat berbeda bila ditentukan pada kondisi dan
alat yang berbeda.
Dari hasil perhitungan didapatkan konsentrasi pengukuran sampel pada 6
Gambar 1. Kurva Serapan Pirazinamida BPFI (konsentrasi 6 µg/ml) dalam
Pelarut HCl 0,1 N
Tabel 1. Data Absorbansi dari Kurva Serapan Maksimum
Abscis
ABS
306.0 0.0175
268.0 0.4058
209.0 0.4438
3.2 Pembuatan dan Penentuan Linieritas Kurva Kalibrasi
Linieritas merupakan ukuran seberapa baik kurva kalibrasi yang
menghubungkan antara respon (Y) dengan konsentrasi (X). Penentuan linieritas
kurva kalibrasi pirazinamida BPFI dalam pelarut HCl 0,1 N ditentukan
berdasarkan serapan pada konsentrasi 4 µg/ml, 5 µg/ml, 6 µg/ml, 7 µg/ml dan 8
µg/ml pada panjang gelombang maksimum 268 nm (dapat dilihat pada gambar
koefisien korelasi (r) = 0,9994 dan persamaan regrasi Y = 0,06615 X + 0,003917
(perhitungan dapat dilihat pada lampiran 2 halaman 19). Menurut Rohman dan
Gandjar (2007), Berdasarkan harga r yang mendekati 1 berarti ada hubungan
yang linier antara serapan dan konsentrasi sehingga konsentrasi pirazinamida
dalam sampel dapat dihitung dengan persamaan regresi dengan mensubsitusikan
serapan terhadap Y.
Gambar 2. Kurva Kalibrasi Pirazinamida BPFI dalam Pelarut HCl 0,1 N pada
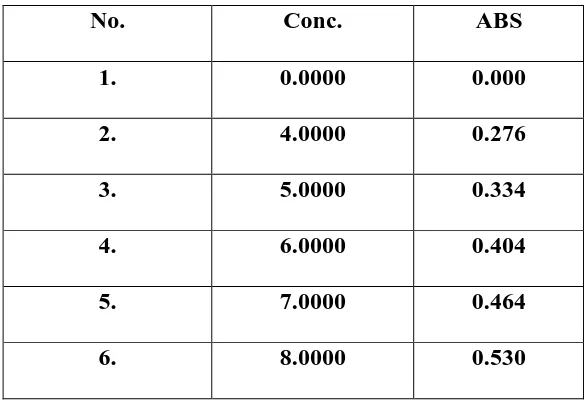
Tabel 2. Data Kurva Kalibrasi dari pirazinamida BPFI
No. Conc. ABS
1. 0.0000 0.000
2. 4.0000 0.276
3. 5.0000 0.334
4. 6.0000 0.404
5. 7.0000 0.464
6. 8.0000 0.530
3.3 Penentuan Kadar Pirazinamida dalam Sediaan Tablet
Kadar pirazinamida dihitung dengan mensubtitusikan serapan pada Y
dari persamaan regresi Y = 0,06615 X + 0,003917. Kadar pirazinamida dalam
sediaan tablet dapat dilihat pada tabel di bawah ini.
Tabel 3. Rentang Kadar Rata-rata Pirazinamida pada Sediaan Tablet
No Nama Sediaan
Kadar Rata-rata
%
Kadar Sebenarnya
%
1. Pirazinamida Generik (Indofarma) 100,02 100,02 ± 0,58
2. Sanazet® (Sanbe) 98,75 98,75 ± 2,13
3. Siranamid® (Mersi) 97,98 97,98 ± 2,34
4. TB Zet® (Meprofarm) 98,74 98,74 ± 1,13
Data di atas menunjukkan kadar pirazinamida dalam sediaan tablet
dengan nama dagang dan generik yang beredar di pasaran memenuhi persyaratan
yang tertera dalam Farmakope Indonesia edisi IV tahun 1995 yaitu tidak kurang
dari 93,0% dan tidak lebih dari 107,0% dari jumlah yang tertera pada etiket
(contoh perhitungan dapat dilihat pada halaman 36 sampai 50).
3.4 Uji Validasi Metode Spektrofotometri Ultraviolet
Pada penelitian ini dilakukan uji validasi dengan metode penambahan
bahan baku (standard addition method) terhadap sampel tablet pirazinamida
(Indofarma) yang meliputi uji akurasi dengan parameter persen perolehan
kembali (% recovery), uji presisi dengan parameter RSD (Relative Standard
Deviation), batas deteksi (LOD) dan batas kuantitasi (LOQ).
Uji akurasi dengan parameter persen perolehan kembali dilakukan
dengan membuat 3 konsentrasi sampel dengan rentang spesifik 80%, 100% dan
120%, masing-masing dengan 3 replikasi dan setiap rentang spesifik
mengandung 70% sampel dan 30% baku (contoh perhitungan dapat dilihat pada
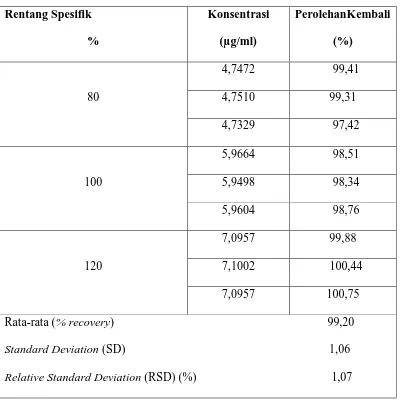
Tabel 4. Data Hasil Pengujian Perolehan Kembali dari Tablet pirazinamida
(Indofarma) dengan Metode Penambahan Bahan Baku Standar
(Standard Addition Method)
Rentang Spesifik %
Konsentrasi (µg/ml)
PerolehanKembali (%)
80
4,7472 99,41
4,7510 99,31
4,7329 97,42
100
5,9664 98,51
5,9498 98,34
5,9604 98,76
120
7,0957 99,88
7,1002 100,44
7,0957 100,75
Rata-rata (% recovery) 99,20
Standard Deviation (SD) 1,06
Relative Standard Deviation (RSD) (%) 1,07
Dari data di atas didapatkan persen perolehan kembali (% recovery)
99,20% dengan Standard Deviation (SD) sebesar 1,06. Persen perolehan kembali
ini dapat diterima karena memenuhi syarat akurasi dimana rentang rata-rata hasil
parameter Relative Standard Deviation (RSD) adalah 1,07%. Nilai RSD ini dapat
diterima karena kriteria yang diizinkan adalah ≤ 2%.
Dengan demikian dapat disimpulkan bahwa metode spektrofotometri
ultraviolet yang dikembangkan pada penelitian ini mempunyai akurasi dan
presisi yang memenuhi syarat (Harmita, 2004). Batas deteksi (LOD) sebesar
0,4807 µg/ml dan batas kuantitasi (LOQ) sebesar 1,6024 µg/ml (perhitungan
BAB V
KESIMPULAN DAN SARAN
4.1 Kesimpulan
Metode spektrofotometri ultraviolet dapat digunakan untuk penetapan
kadar pirazinamida dalam sediaan tablet menggunakan pelarut HCl 0,1 N.
Metode ini memberikan uji validasi dengan parameter akurasi dan presisi yang
memenuhi syarat dengan batas deteksi (LOD) sebesar 0,2088 µg/ml dan batas
kuantitasi (LOQ) sebesar 0,6962 µg/ml.
Dari hasil penelitian menunjukkan bahwa semua tablet yang dianalisis
baik generik maupun nama dagang memenuhi persyaratan kadar tablet menurut
Farmakope Indonesia edisi IV tahun 1995 yaitu tidak kurang dari 93,0% dan
tidak lebih dari 107,0% dari jumlah yang tertera pada etiket.
4.2 Saran
Disarankan kepada peneliti selanjutnya agar dapat menentukan kadar
obat tuberkulosis lainnya dalam sediaan tablet dengan spektrofotometri
DAFTAR PUSTAKA
Agoes, A, H, Munaf, S, Chaidir, J, Nattadiputra, S, Yodhian, F, L, Azis, S, Tanzil, S, Kamaluddin, T, M, Teodorus. (1994). Catatan Kuliah
FARMAKOLOGI . Editor:Munaf, S. Bagian III. Cetakan I. Jakarta: Buku
Kedokteran EGC. Hal 70.
Crofton. J, Horne. N, Miller. F. (2002). Tuberkulosis Klinis. Jakarta: Widya Medika. Hal:115-120
Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press. hal. 1.
Day, R.A, dan Underwood, A.L. (1999). Analisis Kimia Kuantitatif. Penerjemah: Pujaatmaka, A.H. Edisi ke V. Jakarta: Erlangga. hal. 393, 396-403.
Depkes RI. (2009). Undang-undang RI No. 36 Tentang Kesehatan. Jakarta: Departemen Kesehatan Republik Indonesia. Hal 40.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia. Hal 322 - 323, 1133.
Ditjen PP & PL.. (2011). Rencana Aksi Nasional Penguatan Laboratorium
Pengendalian Tuberkulosis. Jakarta: Kementerian Kesehatan RI. Hal i
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara
Perhitungannya. Majalah Ilmu Kefarmasian. Vol I(3). Hal 117-135.
Holme, D.J, dan Peck, H. (1983). Analytical Biochemistry. London: Longman. hal.40
Jones, S.D. (2002). Pharmaceutical Statistic. Jakarta: Penerbit Buku Kedokteran. hal. 30-32.
Mycek M, J. Harvey R, A. Champe P, C. (2001). Farmakologi: Ulasan Bergambar. Edisi II. Jakarta: Widya Medika. Hal 335-340
Moffat, A.C., M.D. Osselton., B. Widdop. (2004). Clarke‘s Analysis Of Drug
And Poisons. Thirth edition London: Pharmaceutical Press. Electronic
Rohman, A. dan Gandjar, I.G. (2007). Kimia Farmasi Analisis. Cetakan Pertama. Yogyakarta: Pustaka Pelajar. Hal 381.
Roth, J.H., dan Blaschke, G. (1998). Analisis Farmasi. Penerjemah: Kisman, dkk. Yogyakarta: UGM Press. hal. 355-357
Satiadarma, K. (2004). Azas Pengembangan Prosedur Analisis. Surabaya: Airlangga University Press. hal. 87-91
Tjay, T. H. dan Rahardja, K. (2007). Obat-Obat Penting Khasiat, Penggunaan,
dan Efek-Efek Sampingnya. Edisi ke VI. Jakarta: PT Elex Media
Komputindo: Hal.160-161 .
United States Pharmacopoeia. (2007). The National Formulary. 30th Edition. The United States Pharmacopoeia Convention. Page 1952.
WHO. (1989). The Validation of Analytical Procedures Used in the Examination
Lampiran 1. Perhitungan Konsentrasi Pengukuran Sampel
Diketahui : Nilai Absorptivitas spesifik (A11= 659) (Moffat, 2004)
Tebal sel (b) = 1cm
c =
xb A
A
1 1
c = 0,000659 /
1 659
4343 , 0
g
=
× 100 ml
c = 659,0 µg/100 ml
c 6,59 µg/ml
Konsentrasi untuk pengukuran serapan baku BPFI atau sampel digunakan 6
Lampiran 2. Perhitungan Persamaan Regresi Pirazinamida BPFI
Jadi Persamaan Regresi yang didapat :
Lampiran 4. Perhitungan Statistik Kadar Pirazinamida pada Tablet Generik
distribusi t diperoleh nilai ttabel = 4,03
Karena thitung≤ ttabel maka data diterima, maka kadar sebenarnya terletak antara :
µ = X± t(1-1/2α)dk x
n SD
= 100,02 ± ( 4,03 x 6 3556 , 0
)
Lampiran 5. Perhitungan Statistik Kadar Pirazinamida pada Tablet Sanazet
distribusi t diperoleh nilai ttabel = 4,03
Karena thitung≤ ttabel maka data diterima, maka kadar sebenarnya terletak antara :
µ = X± t(1-1/2α)dk x
n SD
= 98,75 ± ( 4,03 x 6 2973 , 1
)
Lampiran 6. Perhitungan Statistik Kadar Pirazinamida pada Tablet Siranamid®
distribusi t diperoleh nilai ttabel = 4,03
Karena thitung≤ ttabel maka data diterima, maka kadar sebenarnya terletak antara :
µ = X± t(1-1/2α)dk x
n SD
= 97,98 ± ( 4,03 x 6 4266 , 1
)
Lampiran 7. Perhitungan Statistik Kadar Pirazinamida pada Tablet TB Zet®
distribusi t diperoleh nilai ttabel = 4,03
Data ditolak jika thitung ≥ ttabel atau thitung≤ -ttabel
No Kadar [X] (%) Xi – X (Xi – X)2
distribusi t diperoleh nilai ttabel = 4,60
Data ditolak jika thitung ≥ ttabel atau thitung≤ -ttabel
Karena thitung≤ ttabel maka data diterima, maka kadar sebenarnya terletak antara:
Lampiran 8. Perhitungan Statistik Kadar Pirazinamida pada Tablet Pezeta
distribusi t diperoleh nilai ttabel = 4,03
Karena thitung≤ ttabel maka data diterima, maka kadar sebenarnya terletak antara :
µ = X± t(1-1/2α)dk x
n SD
= 98,67 ± ( 4,03 x 6 8446 , 0
)
Lampiran 9. Contoh Perhitungan Penimbangan Sampel dari Tablet
Pirazinamida Generik (Indofarma)
Berat 20 tablet = 13146.7 mg
Kandungan Pirazinamida pada etiket = 500 mg
Dibuat larutan uji dengan kadar lebih kurang 6 µg/ml.
Ditimbang serbuk setara dengan 50 mg Pirazinamida, maka berat sampel yang
ditimbang adalah :
Berat penimbangan sampel =
= 65,73 mg
Sampel yang telah ditimbang di masukkan dalam labu tentukur 100 ml, lalu
dilarutkan dalam pelarut HCl 0,1 N dan cukupkan sampai garis tanda.
Kadar larutan = = 500 µg/ml
Setelah disaring, kemudian filtrat dipipet 5 ml, lalu dimasukkan ke dalam labu
tentukur 50 ml dan dicukupkan dengan HCl 0,1 N sampai garis tanda.
Kadar larutan = = 50 µg/ml
Lalu dipipet lagi 6 ml larutan, lalu dimasukkan ke dalam labu tentukur 50 ml dan
dicukupkan dengan HCl 0,1 N sampai garis tanda.
Lampiran 10. Contoh Perhitungan Persentase (%) Perolehan Kembali dari
Tablet Pirazinamida Generik (Indofarma).
Berat 20 tablet = 13146.7 mg
Kandungan zat berkhasiat = 500 mg
Berat penimbangan zat berkhasiat pada penetapan kadar = 50 mg
Perolehan 80%
Sampel yang dibutuhkan = x mg mg
mg
Sampel yang dibutuhkan = x mg mg
mg
Sampel yang dibutuhkan = x mg mg
Lampiran 11. Perhitungan Kadar Pirazinamida Generik (Indofarma) dari
Lampiran 10 Setelah Penimbangan
Lampiran 12. Contoh Perhitungan Penimbangan Bahan Baku pada Persen
Perolehan Kembali
Perolehan 100%
Baku 30% = x 50mg
100 30
= 15 mg
Pembuatan larutan baku :
Timbang bahan baku 100 mg ditimbang dimasukkan dalam labu tentukur 50 ml,
lalu dilarutkan dalam pelarut HCl 0,1 N dan cukupkan sampai garis tanda.
Kadar larutan =
Kemudian dari larutan ini dipipet sesuai kebutuhan untuk uji validasi.
ml mg ml
mg
/ 2 50
100
Lampiran 13. Contoh Perhitungan Penimbangan Analit pada Persen Perolehan
Kembali dari Tablet Pirazinamida Generik (Indofarma)
Perolehan 100%
Analit 70% = x50mg 35mg
Setara dengan kadar pirazinamida=
100
Sampel yang telah ditimbang 46,2 mg di masukkan dalam labu tentukur 100 ml,
lalu dilarutkan dalam pelarut HCl 0,1 N 10 ml, dikocok dan cukupkan dengan
HCl 0,1 N sampai garis tanda. Kemudian disaring, 5 ml filtrat pertama dibuang.
Kadar larutan = = 351,489 µg/ml
Kemudian dipipet 5 ml larutan, lalu dimasukkan ke dalam labu tentukur 50 ml
dan dicukupkan dengan HCl 0,1 N sampai garis tanda.
Kadar larutan = = 35.1489 µg/ml
Lalu dipipet lagi 6 ml larutan, lalu dimasukkan ke dalam labu tentukur 50 ml dan
dicukupkan dengan HCl 0,1 N sampai garis tanda.
Lampiran 14. Contoh Perhitungan Penimbangan Analit dari Tablet
Pirazinamida Generik (Indofarma) dan Bahan Baku pada Persen Perolehan Kembali
Perolehan 100%
Analit 70% = x50mg 35mg
Setara dengan kadar pirazinamida=
100
Sampel ditimbang sebanyak 46,2 mg dimasukkan dalam labu tentukur 100 ml,
lalu dilarutkan dalam pelarut HCl 0,1 N 10 ml, ditambahkan baku 7,5 ml
dikocok dan cukupkan sampai garis tanda dengan HCl 0,1 N. Kemudian
disaring, 5 ml filtrat pertama dibuang.
Kadar larutan = = 501,339 µg/ml
Kemudian dipipet 5 ml larutan, lalu dimasukkan ke dalam labu tentukur 50 ml
dan dicukupkan dengan HCl 0,1 N sampai garis tanda.
Kadar larutan = = 50.1339 µg/ml
Lalu dipipet lagi 6 ml larutan, lalu dimasukkan ke dalam labu tentukur 50 ml dan
dicukupkan dengan HCl 0,1 N sampai garis tanda.
Lampiran 15. Contoh Perhitungan Persen Perolehan Kembali dengan Metode
Penambahan Bahan Baku (Standard Addition Method) dari Tablet Pirazinamida Generik (Indofarma)
Perolehan 100%
% Recovery x100%
C B A−
=
Dimana:
A = Konsentrasi sampel yang diperoleh setelah penambahan bahan baku
pirazinamid perolehan 100%
B = Konsentrasi sampel sebelum penambahan bahan baku pirazinamid perolehan
100%
C = Konsentrasi baku yang ditambahkan sebanyak 7,5 ml atau 15 mg
% Recovery Pirazinamida = 100%
µg/ml 8 , 1
µg/ml 4,1932
-µg/ml 5,9664
x
Lampiran 16. Data Hasil Persen Perolehan Kembali Pirazinamida pada Tablet
Generik (Indofarma) dengan Metode Penambahan Bahan Baku (Standard Addition Method)
Lampiran 17. Contoh Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi
(LOQ)
Persamaan garis regresinya adalah Y = 0,06615 X + 0,003917
Lampiran 18. Data Pengukuran Analit pada Persen Perolehan Kembali dari
Tablet Pirazinamida Generik (Indofarma)
a. Perolehan 80%
Sample No. ABS Conc. mg/ ml
1. 0.2233 3.3148
2. 0.2236 3.3204
3. 0.2242 3.3296
b. Perolehan 100%
Sample No. ABS Conc. mg/ ml
1. 0.2813 4.1916
2. 0.2804 4.1787
3. 0.2806 4.1824
c. Perolehan 120%
Sample No. ABS Conc. mg/ ml
1. 0.3319 4.9576
2. 0.3314 4.9502
Lampiran 19. Data Pengukuran Analit pada Persen Perolehan Kembali dari
Tablet Pirazinamida Generik (Indofarma) Setelah Penambahan Bahan Baku.
a. Perolehan 80%
Sample No. ABS Conc. mg/ ml
1. 0.3180 4.7472
2. 0.3182 4.7509
3.3. 0.3170 4.7324
b. Perolehan 100%
Sample No. ABS Conc. mg/ ml
1. 0.3986 5.9654
2. 0.3975 5.9488
3. 0.3982 5.9599
c. Perolehan 120%
Sample No. ABS Conc. mg/ ml
1. 0.4733 7.0951
2. 0.4736 7.1006
Lampiran 20. Daftar Spesifikasi Sampel
1. Pirazinamid (PT. Indofarma)
No. Batch : 1007005
No. Reg : GKL8920902710A1
Expire Date : Desember 2015
Komposisi : Pirazinamida ……… 500 mg
2. Sanazet® (PT. Sanbe) No. Batch : LC0975
No. Reg : GKL8822209310
Expire Date : Maret 2015
Komposisi : Pirazinamida ……… 500 mg
3. Siranamid® (PT. Mersi) No. Batch : 19391
No. Reg : DKL9833300209
Expire Date : Maret 2012
Komposisi : Pirazinamida ……… 500 mg
4. TB Zet® (PT. Meprofarm)
No. Batch : 3251008
No. Reg : DKL0315616810A1
Expire Date : Agustus 2012
5. Pezeta Ciba® (PT. Sandoz)
No. Batch : 7207235
No. Reg : DKL9930410110A1
Expire Date : Desember 2015
Lampiran 24. Alat Spektrofotometer Ultraviolet