OPTIMASI DAN VALIDASI METODE PENETAPAN KADAR BISFENOL A DALAM EKSTRAK AIR DAN EKSTRAK BOTOL AIR
MINUM MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh: Ina Juni Natasia NIM : 098114023
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
OPTIMASI DAN VALIDASI METODE PENETAPAN KADAR BISFENOL A DALAM EKSTRAK AIR DAN EKSTRAK BOTOL AIR
MINUM MENGGUNAKAN KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh: Ina Juni Natasia NIM : 098114023
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
vi
HALAMAN PERSEMBAHAN
Bila gunung di hadapanku tak jua berpindah
Kau berikanku kekuatan untuk mendakinya
Kulakukan yang terbaikku, Kau yang selebihnya
Tuhan selalu punya cara
Membuatku menang pada akhirnya
-Lirik Lagu Tuhan Selalu Punya Cara-
vii PRAKATA
Puji dan syukur kepada Tuhan Yesus Kristus karena berkat kasih karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Optimasi dan Validasi Metode Penetapan Kadar Bisfenol A dalam Ekstrak Air dan Ekstrak Botol Air Minum Menggunakan Kromatografi Cair Kinerja Tinggi Fase Terbalik” dengan baik. Skripsi ini disusun untuk memenuhi salah satu persyaratan mendapatkan gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam pelaksanaan penelitian hingga penyusunan skripsi ini, penulis banyak mendapatkan bantuan dan dukungan dari banyak pihak. Oleh karena itu, penulis ingin mengucapkan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. C.M. Ratna Rini Nastiti, M.Pharm., Apt., selaku Ketua Program Studi Fakultas Farmasi Sanata Dharma Yogyakarta yang turut memberikan saran dan masukan untuk penulis selama tahap penelitian.
3. Prof. Dr. Sri Noegrohati, Apt., selaku dosen pembimbing yang telah memberikan pengarahan, bantuan, tuntunan, kritik, dan saran sejak awal penelitian hingga akhir penyusunan skripsi ini.
4. Jeffry Julianus, M.Si. dan Lucia Wiwid Wijayanti, M. Si., selaku dosen penguji atas segala masukan dan bimbingannya.
viii
6. Pak Sanjaya, atas segala ilmu dan bantuan yang diberikan selama proses penelitian.
7. Segenap dosen yang telah berkenan membagikan ilmu kepada penulis selama belajar di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
8. Teman seperjuangan skripsi, Topan dan Leo, untuk kerja sama, tawa, canda, dan air mata yang dirasakan bersama.
9. Mas Bimo, Pak Parlan, Mas Kunto, Mas Kethul, Mas Ottok dan seluruh staf laboratorium Fakultas Farmasi serta staf keamanan dan kebersihan Universitas Sanata Dharma Yogyakarta atas bantuan dan kerja samanya.
10.Teman satu bimbingan skripsi, Jimmy, Yuli, Rachel, Nety, dan Jo.
11.Teman seperjuangan di laboratorium Kimia Analisis Instrumental, Novia, Agnes, Victor, Shinta, Shasya, Metri, Teti, Febrin, Wisnu, dan Ozy.
12.Teman-teman FST A 2009 dan seluruh angkatan 2009 atas dukungan dan suka duka yang diberikan, semoga pengalaman yang telah kita lalui bersama bisa menjadi bekal untuk perjuangan hidup kita kelak.
13.Teman sepermainan, Raisa, Ree, Ningsih, Chissa, Kenny, Wanda, Atin, Nopes, Listya, Bee, Melisa, Agnes, Eva, Adit, Ana Boy, Frisca, dan Nonny.
14.Semua pihak yang telah membantu dan mendukung penulis dalam pelaksanaan penelitian dan penyusunan skripsi.
ix
semua pihak. Semoga skripsi ini dapat bermanfaat bagi pembaca dan berguna bagi dunia ilmu pengetahuan.
x DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
PERNYATAAN KEASLIAN PENULIS ... iv
LEMBAR PERNYATAN PERSETUJUAN PUBLIKASI KARYA ... v
xi
D. Spektrofotometri Ultraviolet ... 13
E. Kromatografi Cair Kinerja Tinggi ... 14
1. Definisi dan Instrumentasi ... 14
2. Pemisahan Puncak dalam Kromatografi ... 21
F. Validasi Metode Analisis ... 33
G. Landasan Teori ... 35
H. Hipotesis ... 38
BAB III METODOLOGI PENELITIAN... 39
A. Jenis dan Rancangan Penelitian ... 39
B. Variabel Penelitian ... 39
1. Variabel bebas ... 39
2. Variabel tergantung ... 39
3. Variabel pengacau terkendali ... 39
C. Definisi Operasional ... 40
D. Bahan Penelitian ... 40
E. Alat Penelitian ... 41
xii
1. Penyiapan fase gerak asetonitril : air ... 41
2. Pembuatan seri larutan baku bisfenol A ... 42
3. Penyiapan sampel... 43
A. Preparasi Sistem Kromatografi Cair Kinerja Tinggi ... 52
1. Penetapan Panjang Gelombang Maksimum Bisfenol A... 52
2. Pembuatan Fase Gerak ... 56
3. Pembuatan Larutan Kerja untuk Optimasi ... 59
B. Optimasi Komposisi Fase Gerak dan Kecepatan Alir pada KCKT untuk Penetapan Kadar Bisfenol A ... 60
C. Validasi Metode Penetapan Kadar Bisfenol A ... 82
1. Selektifitas ... 82
2. Pembuatan Kurva Baku dan Linearitas ... 83
3. Akurasi... 87
4. Presisi... 90
5. Rentang ... 95
xiii
BAB V KESIMPULAN ... 97
A. Kesimpulan ... 97
B. Saran ... 97
DAFTAR PUSTAKA ... 98
LAMPIRAN ... 101
xiv
DAFTAR TABEL
Tabel I. Nilai indeks polaritas beberapa pelarut pada KCKT fase terbalik... 16 Tabel II. Data yang diperlukan untuk uji validasi ... 34 Tabel III. Komposisi optimasi fase gerak ... 41 Tabel IV. Persen perolehan kembali yang dapat diterima pada
beberapa tingkat konsentrasi analit berdasarkan Gonzales and Herrador... 50 Tabel V. Persen perolehan kembali yang dapat diterima pada
beberapa tingkat konsentrasi analit berdasarkan Horwitz and AOAC PVM ... 51 Tabel VI. Serapan baku bisfenol A dalam pelarut metanol pada
xv
Tabel XII. Hasil persamaan regresi linier baku bisfenol A ... 84 Tabel XIII. Perhitungan perolehan kembali baku adisi pada sampel air 88 Tabel XIV. Perhitungan perolehan kembali baku adisi pada sampel
botol ... 89 Tabel XV. Persen perolehan kembali yang dapat diterima pada
beberapa tingkat konsentrasi analit berdasarkan Gonzales and Herrador ... 89 Tabel XVI. Persen koefisien variasi baku bisfenol A dan bisfenol A
dalam sampel air ... 91 Tabel XVII. Persen koefisien variasi baku bisfenol A dan bisfenol A
dalam sampel botol ... 92 Tabel XVIII. Persen perolehan kembali yang dapat diterima pada
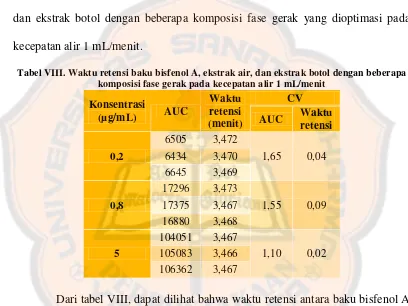
beberapa tingkat konsentrasi analit berdasarkan Horwitz and AOAC PVM ... 92 Tabel XIX. Persen perolehan kembali dan persen koefisien korelasi
xvi
DAFTAR GAMBAR
Gambar 1. Struktur bisfenol A ... 10
Gambar 2. Proses kromatografi ... 15
Gambar 3. Diagram sistem KCKT ... 20
Gambar 4. Kromatogram yang menunjukkan waktu retensi (tR), waktu kosong (t0), lebar dasar puncak (Wb), dan tinggi puncak (h) ... 22
Gambar 5. Pengaruh k’, ∝, dan N pada pemisahan... 24
Gambar 6. Diagram yang menunjukkkan perhitungan tailing factor (Tf) serta diagram yang menunujukkan fronting dan tailing ... 27
Gambar 7. Kurva persamaan van Deemter yang menunjukkan hubungan antara HETP lawan kecepatan linear rata-rata ... 29
Gambar 8. Kurva persamaan van Deemter dengan tiga kolom kemas ukuran partikel 10, 5, dan 3 µm ... 30
Gambar 9. Hubungan log k’ vs % organic solvent modifier untuk metanol, asetonitril, dan tetrahidrofuran ... 31
xvii
Gambar 16. Kurva absorbansi pada panjang gelombang maksimum vs konsentrasi baku bisfenol A ... 56 Gambar 17. Bentuk bisfenol A pada berbagai pH ... 57 Gambar 18. Bagian polar dan polar pada bisfenol A ... 61 Gambar 19. Kromatogram pada fase gerak asetonitril : air (75 : 25) dan
kecepatan alir 0,5 mL/menit ... 68 Gambar 20. Kromatogram pada fase gerak asetonitril : air (75 : 25) dan
kecepatan alir 0,8 mL/menit ... 69 Gambar 21. Kromatogram pada fase gerak asetonitril : air (75 : 25) dan
kecepatan alir 1 mL/menit ... 70 Gambar 22. Kromatogram pada fase gerak asetonitril : air (80 : 20) dan
kecepatan alir 0,5 mL/menit ... 72 Gambar 23. Kromatogram pada fase gerak asetonitril : air (80 : 20) dan
kecepatan alir 0,8 mL/menit ... 73 Gambar 24. Kromatogram pada fase gerak asetonitril : air (80 : 20) dan
kecepatan alir 1 mL/menit ... 74 Gambar 25. Kromatogram pada fase gerak asetonitril : air (70 : 30) dan
kecepatan alir 0,5 mL/menit ... 76 Gambar 26. Kromatogram pada fase gerak asetonitril : air (70 : 30) dan
kecepatan alir 0,8 mL/menit ... 77 Gambar 27. Kromatogram pada fase gerak asetonitril : air (70 : 30) dan
xviii
Gambar 28. Perbandingan peak bisfenol A dari sampel air dengan komposisi fase gerak (70 : 30) pada berbagai kecepatan alir ... 80 Gambar 29. Perbandingan peak bisfenol A dari sampel botol dengan
komposisi fase gerak (70 : 30) pada berbagai kecepatan alir ... 80 Gambar 30. Kurva hubungan AUC vs konsentrasi bisfenol A
menggunakan program Powerfit (Utrecht University Faculteit Scheikunde), dengan tarap kepercayaan 95% ... 85 Gambar 31. Kurva hubungan AUC vs konsentrasi bisfenol A
menggunakan program Powerfit (Utrecht University Faculteit Scheikunde), dengan tarap kepercayaan 95% pada rentang bawah (0,01 – 0,8 µg/mL) ... 85 Gambar 32. Kurva hubungan AUC vs konsentrasi bisfenol A
xix
DAFTAR LAMPIRAN
Lampiran 1. Label standar bisfenol A (E. Merck) ... 102
Lampiran 2. Spektrum baku bisfenol A ... 103
Lampiran 3. Absorbansi dan panjang gelombang maksimum bisfenol A pada beberapa tingkat konsentrasi ... 106
Lampiran 4. Kurva absorbansi vs konsentrasi bisfenol A ... 106
Lampiran 5. Perhitungan indeks polaritas fase gerak ... 107
Lampiran 6. Kromatogram baku bisfenol A dan bisfenol A pada ekstrak air dan ekstrak botol air minum ... 107
Lampiran 7. Nilai tailing factor, resolusi, N, HETP, ∝, dan k’ pada berbagai komposisi fase gerak dan kecepatan alir ... 117
Lampiran 8. Contoh perhitungan resolusi, tailing factor, N, HETP, ∝, dan k’ ... 119
Lampiran 9. Koefisien variasi AUC dan waktu retensi baku bisfenol A . 121 Lampiran 10. Rata-rata resolusi puncak bisfenol A pada baku, ekstrak air, dan ekstrak botol ... 121
Lampiran 11. Kromatogram bisfenol A untuk pembuatan kurva baku, penentuan linearitas, dan rentang, menggunakan fase gerak dan kecepatan alir hasil optimasi ... 122
Lampiran 12. Konsentrasi dan AUC bisfenol A untuk kurva baku ... 135
Lampiran 13. Perhitungan LOD... 140
xx
Lampiran 15. Kromatogram bisfenol A dalam ekstrak air dengan adisi
baku untuk penentuan akurasi, presisi, dan LOQ ... 142 Lampiran 16. Perhitungan persen perolehan kembali (recovery), persen
CV, dan LOQ untuk ekstrak air ... 151 Lampiran 17. Kromatogram bisfenol A dalam ekstrak botol dengan adisi
baku untuk penentuan akurasi, presisi, dan LOQ ... 155 Lampiran 18. Perhitungan persen perolehan kembali (recovery), persen
CV, dan LOQ untuk sampel botol ... 165 Lampiran 19. Akurasi dan presisi adisi bisfenol A dalam ekstrak air dan
xxi INTISARI
Bisfenol A merupakan monomer dari polikarbonat, bahan pembuat botol minum, yang dapat terlepas dari botol akibat hidrolisis karena peningkatan suhu dan degradasi oleh sinar ultraviolet. Bisfenol A dapat menghalangi aktivitas hormon estrogen yang penting dalam sistem imunitas dan reproduksi. Tujuan penelitian ini untuk mengetahui kondisi optimum dan validitas dari metode KCKT sehingga dapat digunakan untuk penetapan kadar bisfenol A dalam ekstrak air dan ekstrak botol yang telah diberi perlakuan dengan sinar matahari.
Jenis rancangan penelitian ini adalah eksperimental deskriptif. Sistem KCKT fase terbalik dalam penelitian ini menggunakan fase diam C-18, detektor UV pada λ 278 nm. Optimasi dilakukan pada komposisi fase gerak asetonitril : air serta kecepatan alir.
Kondisi optimum yang diperoleh, yaitu komposisi fase gerak asetonitril : air (70 : 30) dengan kecepatan alir 1 mL/menit yang memenuhi kriteria untuk resolusi, tailing factor, N, HETP, ∝, dan k’. Metode ini pada kondisi yang optimum dapat memenuhi parameter validasi yang baik dengan selektifitas yang baik (resolusi > 1,5); linearitas dengan r > 0,98; recovery 80,13 – 104,34%; CV 0,72 – 10,13%; rentang 0,3 – 5 µg/mL; LOD 0,0473 µg/mL; LOQ untuk ekstrak air dan ekstrak botol, masing-masing 0,0063 µg/mL dan 8,4701 µg/g.
xxii ABSTRACT
Bisphenol A is a monomer of polycarbonate, material for drinking bottle, which can be released from the bottle because of the increased temperature due to hydrolysis and degradation by ultraviolet ray. Bisphenol A can block the activity of the hormone estrogen which is important in the immune and reproductive systems. The purpose of this study is to determine the optimum conditions and the validity of the HPLC method that can be used for the determination of bisphenol A in water extract and bottle extract that had been treated with sunlight.
This research design is experimental descriptive. Reversed-phase HPLC system in this study uses a C-18 stationary phase, UV detector at λ 278 nm. Optimization is done on the mobile phase composition of acetonitrile : water and flow rate.
The optimum conditions are obtained where mobile phase composition of acetonitrile : water (70: 30) with a flow rate of 1 mL/minute those meet the criteria for resolution, tailing factor, N, HETP, ∝, and k’. This method at optimum conditions has a good validation parameters with good selectivity (resolution > 1,5); linearity with r > 0,98; recovery 80,13 – 104,34%; CV 0,72 – 10,13%; range of 0,3 - 5 µg/mL; LOD 0,0473 µg/mL; LOQ for water extract and bottle extract, each of 0,0063 µg/mL and 8,4701 µg/mL.
1 BAB I PENDAHULUAN
A. Latar Belakang
Wadah dari bahan plastik sangat luas digunakan pada saat ini, terutama sebagai wadah makanan dan minuman. Bahan plastik diminati karena sifatnya yang kuat, ringan, dan harganya yang relatif terjangkau. Biasanya bahan plastik ini banyak digunakan sebagai bahan pembuat botol minum, karena sifatnya yang ringan sehingga mudah dibawa. Namun tidak semua wadah plastik penyusun botol minum itu aman. Jika tidak berhati-hati, materi yang berasal dari komponen penyusun plastik akan berdampak buruk bagi kesehatan.
Plastik terdiri atas berbagai bahan kimia. Dalam kondisi tertentu, kontak antara plastik dan makanan bisa menyebabkan migrasi bahan-bahan kimia dari wadah ke makanan. Migrasi terjadi akibat pengaruh suhu panas makanan, penyimpanan, atau proses pengolahannya. Semakin tinggi suhu maka semakin tinggi kemungkinan terjadi migrasi. Lamanya waktu penyimpanan makanan juga berpengaruh terhadap perpindahan materi berbahan kimia ini. Semakin lama kontak antara minuman dengan kemasan plastik, semakin tinggi jumlah bahan kimia yang bermigrasi ke minuman (Staples, et al., 1998).
bisfenol A). Bisfenol A memiliki struktur mirip dengan ekstrogen dalam tubuh dan dapat mengganggu aktifitas hormon ekstrogen yang penting dalam sistem imunitas dan reproduksi. Bisfenol A adalah endocrine discrupting chemical
(EDC) yang mengganggu produksi, pelepasan, transportasi, metabolisme, pengikatan, aksi, dan eliminasi hormon alami manusia (US-FDA, 2008). Pemejanan bisfenol A pada manusia salah satunya terjadi melalui minuman yang mengandung bisfenol A yang terlepas dari botol. Lepasnya suatu monomer bisfenol A dapat terjadi akibat hidrolisis yang disebabkan peningkatan suhu dan degradasi oleh sinar ultraviolet. Matahari merupakan sumber panas dan dapat memancarkan sinar ultraviolet yang diduga dapat menyebabkan lepasnya monomer bisfenol A dari botol ke minuman di dalam botol.
Indonesia merupakan salah satu negara dengan iklim tropis di dunia. Hal ini menyebabkan matahari bersinar sepanjang tahun dengan intensitas yang relatif tinggi dibandingkan dengan negara-negara lainnya. Botol minum plastik yang biasa dibawa ke mana pun orang-orang beraktifitas, memiliki kemungkinan besar terpapar oleh radiasi sinar matahari, terutama jika beraktifitas di luar ruangan. Paparan ini dapat menyebabkan putusnya ikatan polimer penyusun plastik. Putusnya ikatan polimer ini menyebabkan monomer-monomer penyusunnya meluruh dan bermigrasi menuju ke minuman yang ada di dalamnya dan terjadilah pemaparan zat berbahaya tersebut ke dalam minuman.
European Commission sebagai zat yang berasal dari luar tubuh dengan efek yang berbahaya bagi kesehatan manusia. Beberapa studi toksikologi dan biokimia menegaskan bahwa bisfenol A memiliki sifat estrogenik dan efek agonis terhadap reseptor estrogen. Dalam studi terbaru, bisfenol A diklasifikasikan sebagai xenobiotik yang mengganggu keseimbangan hormonal pada manusia dan hewan lainnya, sehingga disebut pengganggu endokrin. Bisfenol A terbukti memiliki aktifitas estrogenik bahkan pada konsentrasi di bawah 1 ng L-1 (Rykowska and Wasiak, 2006). Dosis perhari yang diperbolehkan (Tolerable daily intake/TDI)
dari bisfenol A telah ditetapkan oleh European Food Safety Authority adalah sebesar 0,05 mg/kgBB/hari (EFSA, 2013). Negara besar lainnya juga menetapkan TDI untuk bisfenol A, seperti Eropa 0,01 mg/kgBB/hari (SCF, 2012); Amerika Serikat dan Kanada 0,025 mg/kgBB/hari (Health Canada, 2008); dan Jepang 0,05 mg/kgBB/hari (AIST, 2007). Oleh karena itu, perlu dilakukan penetapan kadar bisfenol A pada air dalam botol plastik plikarbonat dan dari botol itu sendiri.
air dan susu akibat pemanasan dengan fase gerak asetonitril : air (75:25, v/v) dan fase diam C-18.
Pada penelitian ini, peneliti akan melakukan penetapan kadar bisfenol A pada ekstrak air dalam botol dan ekstrak botol air minum yang diberi pengaruh penyinaran matahari tropis Indonesia dengan metode kromatografi cair kinerja tinggi (KCKT) fase terbalik dengan fase gerak asetonitril : air dan fase diam C-18. KCKT dipilih untuk analisis bisfenol A karena mampu memisahkan dari suatu campuran sekaligus menentukan kadarnya, mudah, cepat, sensitif, serta bisfenol A dapat dianalisis menggunakan KCKT secara langsung tanpa derivatisasi terlebih dahulu. Detektor UV dipilih karena bisfenol A memiliki kromofor yang dapat memberikan serapan di daerah UV.
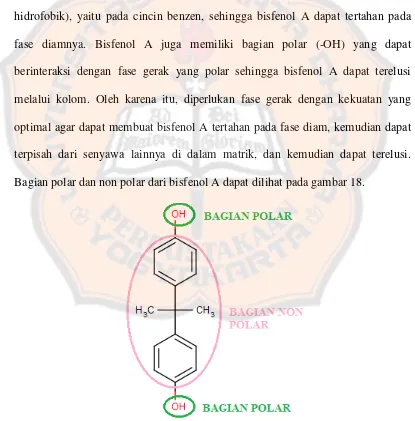
karena memiliki kekuatan elusi yang cukup besar pada fase diam C-18. Bisfenol A juga memiliki bagian polar (-OH) yang dapat berinteraksi dengan fase gerak yang polar sehingga bisfenol A dapat terelusi melalui kolom. Diperlukan fase gerak dengan kekuatan yang optimal agar dapat membuat bisfenol A tertahan pada fase diam, kemudian dapat terpisah dari senyawa lainnya di dalam matrik, dan kemudian dapat terelusi. Oleh karena itu, diperlukan optimasi komposisi fase gerak yang digunakan agar dapat memisahkan bisfenol A pada matrik.
Ekstraksi bisfenol A dari air dilakukan dengan ekstraksi fase padat atau
solid phase extraction (SPE). SPE digunakan untuk clean-up sampel-sampel yang kotor, misalnya sampel-sampel yang mempunyai kandungan matrik yang tinggi seperti garam-garam, protein, polimer, resin, dan lain-lain (Watson, 2007). Sementara itu, ekstraksi bisfenol A dari dalam botol dilakukan dengan cara ekstraksi menggunakan diklormetan dan aseton. Ekstraksi ini dilakukan untuk mengurangi pengotor pada matrik.
Metode KCKT fase terbalik untuk penetapan kadar bisfenol A pada air minum dalam botol plastik dan botol air minum yang diberi pengaruh penyinaran matahari tropis Indonesia dengan metode kromatografi cair kinerja tinggi fase terbalik dengan fase gerak asetonitril : air dan fase diam C-18 yang telah optimum perlu dilakukan validasi metode analisis agar hasil yang diperoleh dapat dipertanggungjawabkan serta memberikan jaminan bahwa metode telah memenuhi persyaratan analisis. Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis anatara lain selektifitas, linearitas, akurasi, presisi, rentang, Limit of Detection (LOD), dan Limit of Quantitation (LOQ).
Penelitian ini merupakan penelitian pendahulu dari penelitian lain mengenai penetapan kadar bisfenol A pada air dalam botol dan botol air minum yang diberi pengaruh penyinaran matahari tropis Indonesia dengan metode kromatografi cair kinerja tinggi fase terbalik dengan fase gerak asetonitril : air dan fase diam C-18.
1. Permasalahan
Berdasarkan latar belakang di atas, dapat dirumuskan permasalahan sebagai berikut.
b. Apakah metode KCKT fase terbalik menggunakan fase diam C-18 dengan komposisi fase gerak asetonitril : air dan kecepatan alir yang optimal dalam penetapan kadar bisfenol A dalam ekstrak air dan ekstrak botol air minum memiliki validitas yang baik dilihat dari selektifitas, linearitas, akurasi, presisi, rentang, LOD, dan LOQ yang dihasilkan?
2. Keaslian Penelitian
3. Manfaat Penelitian
Hasil penelitian ini nantinya diharapkan mempunyai manfaat sebagai berikut.
a. Manfaat Teoritis. Penelitian ini diharapkan dapat memberikan informasi mengenai optimasi perbandingan fase gerak asetonitril : air dan kecepatan alir serta parameter-parameter validitas dalam penetapan kadar bisfenol A dalam ekstrak air dan ekstrak botol air minum dengan metode KCKT fase terbalik dengan fase diam C-18.
b. Manfaat Praktis. Penelitian ini diharapkan dapat memberikan sumbangan bagi ilmu pengetahuan mengenai optimasi perbandingan fase gerak asetonitril : air dan kecepatan alir serta parameter-parameter validitas dalam penetapan kadar bisfenol A dalam ekstrak air dan ekstrak botol air minum dengan metode KCKT fase terbalik dengan fase diam C-18.
B. Tujuan Penelitian
1. Penelitian ini bertujuan untuk mengetahui kondisi optimum KCKT pada pemisahan bisfenol A dalam matrik sampel (ekstrak air dan ekstrak botol air minum) dilihat dari resolusi, N, ∝, k’, HETP, dan tailing factor yang dihasilkan. 2. Penetapan kadar bisfenol A dengan sistem KCKT yang optimal dapat
9 BAB II
PENELAAHAN PUSTAKA
A. Plastik Polikarbonat
Plastik polikarbonat merupakan plastik yang ringan, kuat, jernih, tahan terhadap suhu tinggi dan tahan terhadap pengaruh listrik. Karena sifat-sifat tersebut, polikarbonat digunakan dalam berbagai produk seperti peralatan elektronik, media digital (misalnya CD, DVD), mobil, kaca konstruksi, peralatan kesehatan olahraga, dan alat kesehatan. Daya tahannya terhadap panas dan sifatnya yang tidak mudah pecah menyebabkan polikarbonat menjadi pilihan ideal untuk peralatan makan termasuk botol yang dapat digunakan kembali dan wadah penyimpanan makanan yang dapat digunakan untuk penyimpanan di dalam kulkas dan microwave (Polycarbonate/BPA Global Group, 2013).
Menurut penelitian oleh para peneliti dari Harvard School of Public Health, ditemukan adanya bisfenol A dalam urin partisipan yang selama seminggu minum dari botol polikarbonat. Hal ini menunjukkan bahwa wadah minum polikarbonat dapat melepaskan bahan kimia penyusunnya ke dalam minuman sehingga dapat ditemukan bisfenol A pada urin manusia (Harvard School of Public Health, 2009).
B. Bisfenol A
Bisfenol A juga dikenal dengan 4,4’-(1-Methylethylidene)-bisphenol;
berdasarkan IUPAC 4-[2-(4-hydroxyphenyl)propan-2-yl]phenol (Chemaxon, 2013). Bisfenol A memiliki rumus C15H16O2; berat molekul 228,29 g/mol; C 78,92%; H 7,06%; O 14,02%. Diproduksi dari fenol dan aseton. Berbentuk kristal atau serpihan. Berbau fenolik ringan. Titik leleh 150-155oC. Ttitik didih 220oC. Praktis tidak larut dalam air. Larut dalam larutan basa, alkohol, aseton. Sedikit larut dalam karbon tertraklorida (The Merck Index, 2001). Menurut Cousins et al. (cit., WHO, 2006), bisfenol A memiliki koefisien partisi oktanol/air (Kow) 103,40 sehingga merupakan senyawa yang hidrofobik, namun sedikit polar karena memiliki dua gugus hidroksil. Bisfenol A memiliki pKa 9,59-11,30. Kelarutan bisfenol A dalam air adalah 120-300 mg/L pada 20-25oC (Staples, Dorn, Klecka,
O’Block, andHarris, 1998).
Gambar 1. Struktur bisfenol A (Wasiak and Rykowska, 2006)
bisfenol A ini dapat diakibatkan degradasi oleh sinar ultraviolet, pengaruh pH, turbulensi, dan sinar matahari (Staples, Dorn, Klecka, O’Block, andHarris,1998). Paparan bisfenol A pada manusia dapat terjadi karena mengkonsumsi makanan atau minuman yang tercemar bisfenol A akibat penggunaan wadah polikarbonat (atau yang mengandung monomer bisfenol A). Bisfenol A memiliki struktur mirip dengan ekstrogen dalam tubuh dan dapat mengganggu aktifitas hormon ekstrogen. Bisfenol A adalah endocrine discrupting chemical (EDC) yang mengganggu produksi, pelepasan, transportasi, metabolisme, pengikatan, aksi, dan eliminasi hormon alami manusia (US-FDA, 2008).
Dosis perhari yang diperbolehkan (Tolerable daily intake/TDI) dari bisfenol A telah ditetapkan oleh European Food Safety Authority adalah sebesar 0,05 mg/kgBB/hari (EFSA, 2013). TDI di beberapa negara besar seperti Eropa 0,01 mg/kgBB/hari (SCF, 2012); Amerika Serikat dan Kanada 0,025 mg/kgBB/hari (Health Canada, 2008); dan Jepang 0,05 mg/kgBB/hari (AIST, 2007).
C. Metode untuk Analisis Bisfenol A
1. Liquid chromatography – ultraviolet
Bisfenol A memiliki kromofor sehingga dapat dideteksi menggunakan detektor UV. LOD pada analisis menggunakan detektor UV paling kecil 15 kali lebih besar daripada yang dihasilkan menggunakan detektor fluoresen (Cao, 2010).
2. Liquid chromatography – fluorescence
Detektor fluoresen sering digunakan untuk analisis bisfenol A dalam makanan dan sampel biologis dengan metode kromatografi cair. Bisfenol A dapat dideteksi menggunakan detektor fluoresen karena memiliki elektron π terkonjugasi pada dua cincin benzen (Cao, 2010).
3. Liquid chromatography – mass spectrometry atau Liquid chromatography –
tandem mass spectrometry
LC-MS atau LC-MS/MS juga sering digunakan untuk analisis bisfenol A dalam makanan dan sampel biologis. Dengan kedua metode ini dapat diketahui spektrum massa analit sehingga dapat membantu dalam identifikasi puncak analit (Cao, 2010).
4. Gas chromatography – MS
D. Spektrofotometri Ultraviolet
Sinar ultraviolet mempunyai panjang gelombang antara 200-400 nm. Jika suatu molekul dikenai suatu radiasi elektromagnetik pada frekuensi yang sesuai sehingga energi molekul tersebut ditingkatkan ke level yang lebih tinggi, maka terjadi peristiwa penyerapan (absorpsi) energi oleh molekul. Untuk mengukur banyaknya radiasi yang diserap oleh suatu molekul sebagai fungsi frekuensi radiasi. Spektrum absorpsi merupakan suatu grafik yang menghubungkan antara banyaknya sinar yang diserap dengan frekuensi (dengan panjang gelombang) sinar. Allowed transtition untuk suatu molekul dengan struktur kimia yang berbeda adalah tidak sama sehingga spektra absorpsinya juga berbeda. Dengan demikian, spektra dapat digunakan sebagai bahan informasi yang bermanfaat untuk analisis kualitatif. Banyaknya sinar yang diabsorpsi pada panjang gelombang tertentu sebanding dengan banyaknya molekul yang menyerap radiasi, sehingga spektra absorpsi juga dapat digunakan untuk analisis kuantitatif (Gandjar dan Rohman, 2007).
Kromofor merupakan ikatan rangkap terkonjugasi yang dapat menyerap radiasi pada daerah UV dan visibel. Auksokrom merupakan gugus jenuh yang terikat pada kromofor yang dapat mengubah panjang gelombang dan intensitas serapan maksimum. Ciri auksokrom adalah gugus heteroatom yang langsung terikat pada kromofor, seperti –OCH3, –Cl, –OH, dan –NH2. Pergeseran batokromik merupakan pergeseran serapan ke arah panjang gelombang yang lebih panjang karena substitusi atau pengaruh pelarut, sedangkan pergeseran hipsokromik merupakan pergeseran serapan ke arah panjang gelombang yang lebih pendek karena substitusi atau pengaruh pelarut. Auksokrom dapat menyebabkan pergeseran batukromik (Sastrohamidjojo, 2001).
E. Kromatografi Cair Kinerja Tinggi 1. Definisi dan Instrumentasi
Kromatografi merupakan suatu proses pemisahan yang mana analit-analit dalam sampel terdistribusi antara 2 fase, yaitu fase diam dan fase gerak. Fase diam dapat berupa bahan padat atau porus dalam bentuk molekul kecil, atau dalam bentuk cairan yanng dilapiskan pada pendukung padat atau dilapiskan pada dinding kolom. Fase gerak dapat berupa gas atau cairan. Jika gas digunakan sebagai fase gerak maka prosesnya dikenal sebagai kromatogafi gas. Dalam kromatografi cair dan juga kromatografi lapis tipis, fase gerak yang digunakan selalu cair (Rohman, 2009).
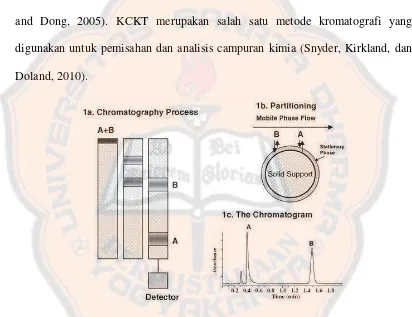
komponen penyusunnya (atau analit) dengan mendistribusikannya di antara fase gerak (fase cair yang mengalir) dan fase diam (sorben yang dikemas dalam kolom). Sebuah detektor secara online memonitor konsentrasi masing-masing komponen yang dipisahkan dalam kolom limbah dan menghasilkan kromatogram. KCKT adalah teknik analisis yang paling banyak digunakan untuk analisis kuantitatif obat-obatan, biomolekul, polimer, dan senyawa organik lainnya (Ahuja and Dong, 2005). KCKT merupakan salah satu metode kromatografi yang digunakan untuk pemisahan dan analisis campuran kimia (Snyder, Kirkland, dan Doland, 2010).
Gambar 2. Proses kromatografi. (1a) Proses kromatografi secara skematik yang menunjukkan perpindahan pita komponen melewati kolom; (1b) Penggambaran secara
mikroskopik proses partisi molekul analit A dan B pada fase diam yang terikat pada penyangga padat; (1c) Kromatogram yang menunjukkan sinyal dari detektor UV componen
A dan B yang telah terelusi (Dong, 2006)
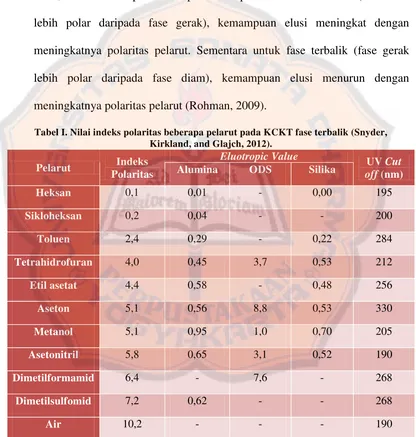
a. Wadah Fase Gerak dan Fase Gerak. Wadah fase gerak harus bersih dan lembam (inert). Fase gerak atau eluen biasanya terdiri dari campuran pelarut yang dapat bercampur yang berperan dalam daya elusi dan resolusi. Daya elusi dan resolusi ditentukan oleh polaritas keseluruhan pelarut, polaritas fase diam, dan sifat komponen-komponen sampel. Untuk fase normal (fase diam lebih polar daripada fase gerak), kemampuan elusi meningkat dengan meningkatnya polaritas pelarut. Sementara untuk fase terbalik (fase gerak lebih polar daripada fase diam), kemampuan elusi menurun dengan meningkatnya polaritas pelarut (Rohman, 2009).
Tabel I. Nilai indeks polaritas beberapa pelarut pada KCKT fase terbalik (Snyder, Kirkland, and Glajch, 2012).
Pelarut Indeks
Polaritas
Eluotropic Value UV Cut
besar indeks polaritas yang dimiliki campuran pelarut maka semakin bersifat polar pelarut yang digunakan. Namun juga terdapat nilai cutoff dalam tabel I yang menunjukkan bahwa solven yang memiliki nilai cutoff lebih tinggi dibandingkkan panjang gelombang sampel yang dianalisis maka solvent tersebut tidak dapat digunakan (Snyder, Kirkland, and Glajch, 2012).
Fase gerak yang akan digunakan harus disaring terlebih dahulu untuk menghindari partikel-partikel kecil. Selain itu, gas dalam fase gerak juga harus dihilangkan sebab gas dapat berkumpul dengan komponen lain terutama di pompa dan detektor sehingga akan mengacaukan analisis (Rohman, 2009).
Elusi dapat dilakukan dengan cara isokratik (komposisi fase gerak tetap selama elusi) atau dengan cara bergradien (komposisi fase gerak berubah-ubah selama elusi) yang analog dengan pemrograman suhu pada kromatografi gas. Elusi bergradien digunakan untuk meningkatkan resolusi campuran yang kompleks terutama jika sampel mempunyai kisaran polaritas yang luas (Rohman, 2009).
b. Pompa. Pompa yang cocok digunakan untuk KCKT adalah pompa yang inert
terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, teflon, dan batu nilam. Pompa yang digunakan sebaiknya mampu memberikan tekanan sampai 5000 psi dan mampu mengalirkan fase gerak dengan kecepatan alir 3 mL/menit. Untuk tujuan preparatif, pompa yang digunakan harus mampu mengalirkan fase gerak dengan kecepatan 20 mL/menit (Rohman, 2009).
Tujuan penggunaan pompa atau sistem penghantaran fase gerak adalah untuk menjamin proses penghantaran fase gerak berlangsung secara tepat, reprodusibel, konstan, dan bebas dari gangguan. Ada dua jenis pompa dalam KCKT, yaitu pompa dengan tekanan konstan dan pompa dengan aliran fase gerak yang konstan. Pompa dengan aliran fase gerak yang konstan sejauh ini lebih umum dibandingkan dengan tipe pompa dengan tekanan konstan (Rohman, 2009).
c. Tempat Penyuntikan Sampel. Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam fase gerak yang mengalir di bawah tekanan menuju kolom menggunakan alat penyuntik yang terbuat dari tembaga tahan karat dan katup teflon yang dilengkapi dengan keluk sampel (sample loop) internal atau eksternal (Rohman, 2009).
Kolom mikrobor mempunyai tiga keuntungan yang utama dibandingkan dengan kolom konvensional, yaitu:
Konsumsi fase gerak kolom mikrobor hanya 80% atau lebih kecil dibanding dengan kolom konvensional karena pada kolom mikrobor kecepatan alir fase gerak lebih lambat (10-100 µL/menit)
Adanya aliran fase gerak yang lebih lambat membuat kolom mikrobor lebih ideal jika digabung dengan spektrofotometer massa
Sensitivitas kolom mikrobor ditingkatkan karena solut lebih pekat, karenanya jenis kolom ini sangat bermanfaat jika jumlah sampel terbatas misal sampel klinis (Rohman, 2009).
Meskipun demikian, dalam prakteknya, kolom mikrobor ini tidak setahan kolom konvensional dan kurang bermanfaat untuk analisis rutin (Rohman, 2009).
Kebanyakan fase diam pada KCKT berupa silika yang dimodifikasi, atau polimer-polimer stiren dan divinil benzen. Permukaan silika adalah polar dan sedikit asam karena adanya residu gugus silanol (Si-OH) (Rohman, 2009).
Oktadesil silika (ODS atau C18) merupakan fase diam yang paling banyak diguunkan karena mampu memisahkan senyawa-senyawa dengan kepolaran yang rendah, sedang, maupun tinggi. Oktil atau rantai alkil yang lebih pendek lagi lebih sesuai untuk solut yang polar. Silika-silika aminopropil dan sianopropil (nitril) lebih cocok sebagai pengganti silika yang dimodifikasi. Silika yang tidak dimodifikasi akan memberikan waktu retensi yang bervariasi disebabkan karena adanya kandungan air yang digunakan (Rohman, 2009).
e. Detektor. Detektor pada KCKT dikelompokkan menjadi dua golongan yaitu detektor universal (yang mampu mendeteksi zat secara umum, tidak bersifat spesifik, dan tidak bersifat selektif) seperti detektor indeks bias dan detektor spektrofotometri massa; dan golongan detektor yang spesifik yang hanya akan mendeteksi analit secara spesifik dan selektif, seperti detektor UV-Vis, detektor fluorosensi, dan elektrokimia (Rohman, 2009).
Gambar 3 . Diagram sistem KCKT. (a) Wadah fase gerak; (b) pompa; (c) autosampler atau injektor; (d) kolom; (e) detektor; (f) sistem data (Synder, Kirkland and Dolan,
Idealnya, suatu detektor harus mempunyai karakteristik sebagai berikut: (1) mempunyai respon terhadap solut yang cepat dan reprodusibel; (2) mempunyai sensitifitas yang tinggi, yakni mampu mendeteksi solut pada kadar yang sangat kecil; (3) stabil dalam pengoperasiannya; (4) mempunyai sel volume yang kecil sehingga mampu meminimalkan pelebaran pita; (5) signal yang dihasilkan berbanding lurus dengan konsentrasi solut pada kisaran yang luas (kisaran dinamis linier); dan (6) tidak peka terhadap perubahan suhu dan kecepatan alir fase gerak (Rohman, 2009).
2. Pemisahan Puncak dalam Kromatografi
Tujuan utama pada kromatografi adalah pemisahan suatu campuran. Ada dua parameter yang digunakan untuk menilai kualitas pemisahan pada kromatografi, yaitu banyaknya pelebaran puncak (efisiensi) dan tingkat pemisahan puncak yang berdekatan (Gandjar dan Rohman, 2010). Kualitas pemisahan dengan kromatografi kolom dapat dikontrol dengan melakukan serangkaian uji kesesuaian sistem yang meliputi efisiensi kolom, resolusi atau daya pisah, simetrisitas puncak, dan faktor retensi atau kapasitas kolom (Rohman, 2009).
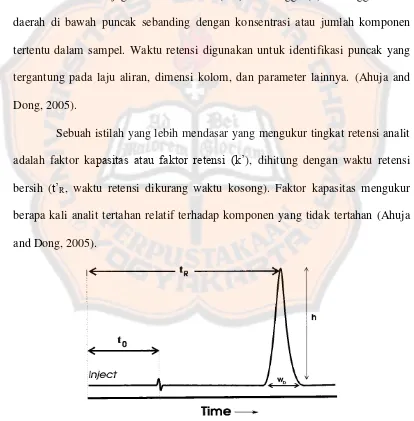
Gambar 4 menunjukkan kromatogram yang khas, yang mencakup sumbu waktu, titik injeksi, dan puncak analit. Waktu antara titik injeksi sampel dan analit mencapai detektor disebut waktu retensi (tR). Waktu retensi komponen yang tidak tertahan (sering ditandai oleh baseline pertama yang disebabkan oleh elusi sampel pelarut) disebut waktu void (t0). Waktu kosong berhubungan dengan volume kosong kolom (V0), yang merupakan parameter penting yang akan diuraikan kemudian. Puncak juga memiliki lebar (Wb) dan tinggi (h). Ketinggian atau daerah di bawah puncak sebanding dengan konsentrasi atau jumlah komponen tertentu dalam sampel. Waktu retensi digunakan untuk identifikasi puncak yang tergantung pada laju aliran, dimensi kolom, dan parameter lainnya. (Ahuja and Dong, 2005).
Sebuah istilah yang lebih mendasar yang mengukur tingkat retensi analit adalah faktor kapasitas atau faktor retensi (k’), dihitung dengan waktu retensi bersih (t’R, waktu retensi dikurang waktu kosong). Faktor kapasitas mengukur berapa kali analit tertahan relatif terhadap komponen yang tidak tertahan (Ahuja and Dong, 2005).
Gambar 4 . Kromatogram yang menunjukkan waktu retensi (tR), waktu kosong (t0), lebar
Nilai k’ nol berarti bahwa komponen tersebut tidak tertahan dan terelusi dengan pelarut. Nilai k’ 1 berarti bahwa komponen sedikit ditahan oleh kolom sementara k’ nilai 20 berarti bahwa komponen sangat dipertahankan dan menghabiskan banyak waktu berinteraksi dengan fase diam. Dalam kebanyakan
tes, analit terelusi dengan k’ antara 1 dan 20 sehingga memiliki kesempatan yang cukup untuk berinteraksi dengan fase diam yang mengakibatkan migrasi yang berbeda. Puncak yang terelusi pada di k’ yang besar (> 20) bermasalah karena jangka waktu panjang dan sensitifitas kecil yang dapat mengakibatkan puncak yang lebar (Ahuja and Dong, 2005).
Pada KCKT fase terbalik digunakan fase diam hidrofobik seperti C-18 dan fase gerak yang hidrofilik seperti campuran metanol dan air), partisi yang terjadi dianalogikan seperti ekstraksi cair-cair dua fase dalam corong pisah antara larutan non-polar (misalnya heksan) dan larutan polar (misalnya air). Pada KCKT fase terbalik, waktu retensi dipengaruhi oleh kekuatan atau polaritas fase gerak (Ahuja and Dong, 2005).
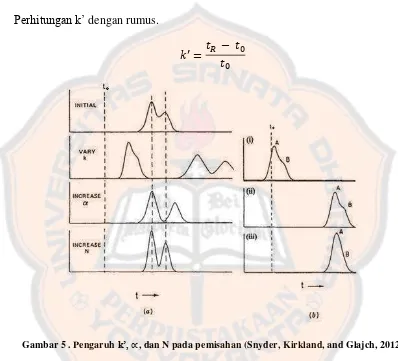
Selektifitas (∝) atau faktor pemisahan adalah ukuran retensi diferensial dua analit. Selektifitas didefinisikan sebagai rasio dari faktor kapasitas (k’) dari dua puncak seperti yang ditunjukkan pada Gambar 5. Selektivitas harus > 1,0 untuk pemisahan puncak. Selektivitas tergantung pada sifat dari fase diam dan komposisi fase gerak (Ahuja and Dong, 2005). Menurut Snyder, Kirkland, and Glajch (2012) nilai k’ harus memenuhi 0,5 < k’ < 20. Perhitungan selektifitas.
Jika nilai k’ menjadi lebih kecil (terelusi lebih awal) maka resolusi
menjadi lebih buruk. Ketika k’ dibuat lebih besar, resolusi meningkat. Jika ∝
meningkat, Rs akan meningkat juga. Nilai N dipengaruhi oleh kecepatan alir, panjang kolom, dan ukuran partikel (Snyder, Kirkland, and Glajch, 2012).
Perhitungan k’ dengan rumus.
�′ = � −
kromatografi. Jumlah lempeng (N) adalah ukuran kuantitatif dari efisiensi kolom (Ahuja and Dong, 2005). Persamaan untuk menghitung N.
� = , �
�/ �
Konsep lempeng secara tradisional berasal dari proses penyulingan di industri menggunakan kolom yang distilasi terdiri dari beberapa lempeng di mana cairan kondensasi berada dalam kesetimbangan dengan uap yang naik. Dengan demikian, semakin panjang kolom distilasi akan memiliki lebih banyak lempeng atau terjadinya equilibrium. Demikian pula dalam kromatografi, tinggi setara lempeng teoritis atau HETP (height equivalent theoretical plate) sama dengan panjang kolom (L) dibagi dengan jumlah lempeng teoritis (N) (Ahuja and Dong, 2005). HETP merupakan panjang kolom kromatografi (dalam mm) yang diperlukan sampai terjadinya satu kali kesetimbangan molekul analit dalam fase gerak dan fase diam (Gandjar dan Rohman, 2010). HETP dihitung dengan rumus.
���� =��
Dalam sistem kromatografi, diharapkan memiliki bilangan lempeng (N) yang tinggi yang menunjukkan efisiensi kolom yang tinggi. Beberapa parameter yang dapat meningkatkan efisiensi kolom pada kromatografi cair, antara lain ukuran partikel fase diam kecil, lapisan fase diam tipis, bentuk fase diam teratur, temperatur tinggi, lapisan fase diam merata, ukuran partikel fase diam sama, serta koefisien difusi yang tinggi pada fase diam dan fase gerak (Watson, 2003). Menurut WHO, nilai N hendaknya 2000 (cit., Yin, 2011).
Kolom yang efisien akan mempunyai resolusi yang baik. Tingkat pemisahan komponen dalam suatu campuran dengan metode kromatografi digambarkan dalam kromatogram yang dihasilkan. Untuk hasil pemisahan yang baik, puncak-puncak dalam kromatogram harus terpisah secara sempurna dari puncak lainnya dengan sedikit tumpang tindih (overlapping) atau tidak ada tumpang tindih sama sekali. Tingkat pemisahan antara puncak-puncak kromatografi yang bersebelahan merupakan fungsi jarak antara puncak maksimal dan lebar puncak yang berhubungan (Ahuja and Dong, 2005).
Dalam KCKT, resolusi didefinisikan sebagai perbedaan antara waktu retensi dua puncak yang saling berdekatan ∆ � = � − � ) dibagi dengan rata-rata lebar puncak (� + � .
Rumus unntuk menghitung resolusi adalah sebagai berikut.
� = �2∆+ ��
Sesuai persamaan di atas, resolusi yang besar akan tercapai jika perbedaan waktu retensi analit cukup besar dan lebar puncak analit dengan analit yang lainnya adalah sekecil mungkin. Sebagaimana ditunjukkan oleh persamaan tersebut, resolusi komponen-komponen dalam kromatografi tergantung pada waktu retensi relatif pada sistem kromatografi tertentu dan lebar puncak (Ahuja and Dong, 2005).
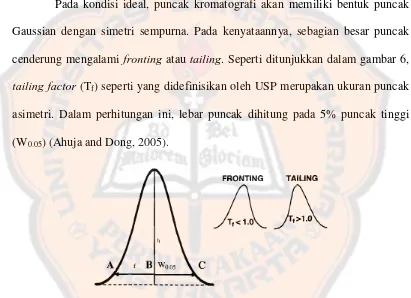
Pada kondisi ideal, puncak kromatografi akan memiliki bentuk puncak Gaussian dengan simetri sempurna. Pada kenyataannya, sebagian besar puncak cenderung mengalami fronting atau tailing. Seperti ditunjukkan dalam gambar 6,
tailing factor (Tf) seperti yang didefinisikan oleh USP merupakan ukuran puncak asimetri. Dalam perhitungan ini, lebar puncak dihitung pada 5% puncak tinggi (W0.05) (Ahuja and Dong, 2005).
Gambar 6 . Diagram yang menunjukkkan perhitungan tailing factor (Tf) serta diagram yang menunujukkan fronting dan tailing (Ahuja and Dong, 2005)
Kebanyakan puncak memiliki nilai tailing factor antara 0,9 dan 1,4; dengan nilai 1,0 mengindikasikan puncak yang simetris sempurna. Puncak yang
tailing biasanya disebabkan oleh adsorpsi atau interaksi kuat lainnya analit dengan fase diam, sedangkan puncak fronting dapat disebabkan oleh kolom yang
Dong, 2005). Menurut WHO, nilai tailing factor yang masih memenuhi kriteria penerimaan adalah 2 (cit., Yin, 2011).
Efektivitas pemisahan (Rs) dalam analisis HPLC tergantung pada kedua faktor termodinamika (retensi dan selektifitas) dan faktor kinetika (lebar puncak dan efisiensi kolom). Hubungan resolusi untuk parameter lain dapat dinyatakan
agak kuantitatif dalam persamaan resolusi: � = �′ �′+ +
∝− ∝ +
√� 4
Retensi Selektifitas Efisiensi (Ahuja and Dong, 2005). Dari persamaan resolusi tersebut menunjukkan bahwa Rs dikendalikan oleh retensi, selektifitas, dan efisiensi. Untuk memaksimalkan Rs, k’ harus relatif besar. Selektifitas dipengaruhi oleh kondisi kolom dan fase gerak. Jumlah lempeng (N) dimaksimalkan dengan menggunakan kolom panjang atau menggunakan kolom yang dikemas dengan partikel yang lebih kecil. Strategi untuk meningkatkan resolusi adalah menemukan kekuatan pelarut yang mengelusi semua zat antara k’ 1 dan 20 dan untuk memisahkan semua analit dengan memvariasikan pelarut organik dan pengubah fase gerak lainnya. Jika cara ini tidak berhasil, fase diam berbeda bisa dicoba (Ahuja and Dong, 2005).
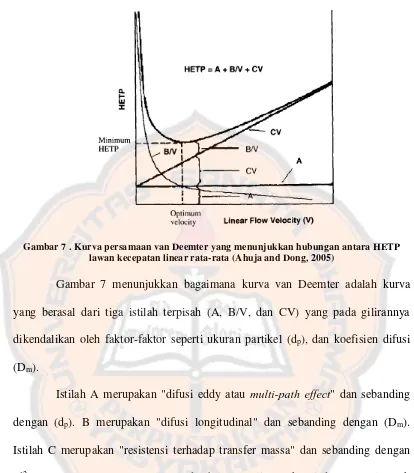
Gambar 7 . Kurva persamaan van Deemter yang menunjukkan hubungan antara HETP lawan kecepatan linear rata-rata (Ahuja and Dong, 2005)
Gambar 7 menunjukkan bagaimana kurva van Deemter adalah kurva yang berasal dari tiga istilah terpisah (A, B/V, dan CV) yang pada gilirannya dikendalikan oleh faktor-faktor seperti ukuran partikel (dp), dan koefisien difusi (Dm).
Gambar 8 . Kurva persamaan van Deemter dengan tiga kolom kemas ukuran partikel 10, 5, dan 3 µm (Ahuja and Dong, 2005)
Gambar 8 menunjukkan percobaan van Deemter kurva untuk tiga kolom kemas dengan ukuran partikel 10, 5, dan 3 µm. Gambar tersebut menunjukkan bahwa dp yang kecil menghasilkan HETP yang lebih rendah (atau kolom partikel kecil memiliki efisiensi lebih per satuan panjang) karena istilah A sebanding dengan dp (Ahuja and Dong, 2005).
Gambar 9 . Hubungan log k’ vs % organic solvent modifier untuk metanol, asetonitril, dan tetrahidrofuran (Ahuja and Dong, 2005)
Berikut penyebab terjadinya pelebaran pita akan dibahas satu per satu. a. Difusi Eddy. Penyebab difusi Eddy adalah karena kolom diisi dengan partikel
fase diam yang kecil. Fase gerak membawa analit yang melewati kolom sebagian akan terelusi terlebih dahulu meninggalkan yang lainnya karena melewati jalur yang lurus di dalam kolom. Analit lain terelusi setelah itu karena harus melewati beberapa penghalang di sepanjang kolom (Meyer, 2004).
Gambar 10 . Difusi Eddy (Meyer, 2004)
Gambar 11 . Distribusi aliran (Meyer, 2004)
c. Difusi longitudinal. Analit dalam fase gerak menyebar ke segala arah dengan difusi. Difusi terjadi dengan arah yang sama atau berlawanan dengan aliran fase gerak (Watson, 2003).
Gambar 12 . Pelebaran pita oleh difusi longitudinal (Meyer, 2004)
Gambar 13 . Transfer massa. Atas = Struktur pori partikel fase diam; Bawah = Transfer massa antara fase gerak dan fase diam (Meyer, 2004)
F. Validasi Metode Analisis
Validasi metode analisis adalah proses yang digunakan dalam penelitian laboratorium, di mana karakteristik kinerja dari metode yang digunakan sesuai dengan syarat ditentukan pada metode yang digunakan. Metode uji yang berbeda memiiki ketentuan yang berbeda pula. Berikut kategori uji yang paling biasa digunakan beserta data validasi yang diperlukan (The United States Pharmacopeia, 2007).
Kategori I, metode analisis untuk kuantitasi komponen utama dari senyawa obat atau senyawa aktif (termasuk pengawet) pada produk akhir sediaan farmasi. Kategori II, metode analisis untuk menentukan pengotor dalam senyawa obat atau senyawa degradasi pada produk akhir sediaan farmasi. Metode ini termasuk uji kuantitatif dan uji batas. Kategori III, metode analisis untuk menentukan karakteristik kinerja (contohnya kelarutan, pelepasan obat). Kategori IV, uji identifikasi (The United States Pharmacopeia, 2007).
Tabel II. Data yang diperlukan untuk uji validasi Parameter
Validasi Kategori 1
Kategori 2
Kategori 3 Kategori 4 Kuantitatif Uji Batas
*mungkin diperlukan, tergantung sifat dari uji yang spesifik
Validasi metode analisis dapat diverifikasi hanya dengan penelitian di laboratorium. Oleh karena itu, dokumentasi dari hasil penelitian yang berhasil merupakan persyaratan dasar untuk menentukan apakah metode ini cocok untuk aplikasi yang dimaksud. Dokumentasi yang sesuai harus menyertai setiap proposal baru atau revisi prosedur analitis kompendial (The United States Pharmacopeia, 2007).
Validasi metode analisis merupakan suatu proses tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan yang dilakukan di laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya. Parameter-parameter tersebut antara lain sebagai berikut.
a. Spesifisitas. Spesifisitas merupakan kemampuan suatu metode analisis untuk mengukur analit yang diinginkan dalam matriks tanpa mengalami gangguan dari analit lain (Gandjar dan Rohman, 2010).
proporsional dengan konsentrasi (jumlah) analit di dalam sampel. Rentang adalah jarak antara level terbawah dan teratas dari metode analisis yang telah dipakai untuk mendapatkan presisi, linearitas dan akurasi yang bisa diterima (The United States Pharmacopeia, 2007).
c. Presisi dan repeatability. Presisi merupakan derajat keterulangan hasil uji ketika metode dilakukan secara berulang pada sampel yang homogen dengan beberapa kali sampling. Repeatability adalah ukuran keterulangan yang dihasilkan dari prosedur analisis laboratorium dalam jangka waktu yang pendek, oleh analis dan peralatan yang sama (The United States Pharmacopeia, 2007).
d. Akurasi. Akurasi adalah kedekatan hasil uji yang diperoleh dengan nilai yang sebenarnya (The United States Pharmacopeia, 2007).
e. LOD (Limit of Detection) dan LOQ (Limit of Quantitation). LOD merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi dan masih memberikan respon signifikan dibandingkan dengan blangko. LOQ merupakan konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan (The United States Pharmacopeia, 2007).
G. Landasan Teori
manusia karena merupakan endocrine discrupting chemical (EDC) yang mengganggu produksi, pelepasan, transportasi, metabolisme, pengikatan, aksi, dan eliminasi hormon alami manusia. Informasi terbaru mengenai dosis bisfenol A harian yang dapat masuk ke dalam tubuh manusia menurut European Food Safety Authority adalah sebesar 0,05 mg/kgBB/hari.
Pemaparan pada manusia terjadi akibat migrasi bisfenol A yang lepas dari wadah plastik ke dalam makanan atau minuman. Lepasnya bisfenol A ini salah satunya disebabkan oleh panas dan sinar ultraviolet. Oleh karena itu, perlu dilakukan penetapan kadar bisfenol A dalam air minun yang diberi paparan sinar matahari tropis Indonesia sebagai sumber panas yang juga mengandung ultraviolet dan penetapan kadar bisfenol A yang meluruh dari botol akibat perlakuan tersebut.
Pada penelitian ini, peneliti akan melakukan penetapan kadar bisfenol A pada ekstrak air dalam botol dan ekstrak botol air minum yang diberi pengaruh penyinaran matahari tropis Indonesia dengan metode kromatografi cair kinerja tinggi (KCKT) fase terbalik dengan fase gerak asetonitril : air dan fase diam C-18. KCKT dipilih untuk analisis bisfenol A karena mampu memisahkan dari suatu campuran sekaligus menentukan kadarnya, mudah, cepat, sensitif, serta bisfenol A dapat dianalisis menggunakan KCKT secara langsung tanpa derivatisasi terlebih dahulu. Detektor UV dipilih karena bisfenol A memiliki kromofor yang dapat memberikan serapan di daerah UV.
3,40; fase diam ini digunakan untuk menganalisis senyawa dengan kepolaran yang rendah, sedang, maupun tinggi dan memiliki pH di antara 2,5-7,5. Bisfenol A memiliki koefisien partisi oktanol/air (Kow) 103,40 sehingga merupakan senyawa yang hidrofobik, namun sedikit polar karena memiliki dua gugus hidroksil serta memiliki pH ± 5 – 6. Interaksi pada C-18 didasarkan pada interaksi hidrofobik atau van der Waals. Bagian cincin benzen dari bisfenol A merupakan bagian hidrofobik yang akan berinteraksi dengan fase diam. Untuk dapat mengelusi bisfenol A, fase gerak air ditambahkan pelarut organik untuk mengurangi kepolaran dari fase gerak. Digunakan pelarut organik asetonitril karena memiliki kekuatan elusi yang cukup besar pada fase diam C-18. Bisfenol A juga memiliki bagian polar (-OH) yang dapat berinteraksi dengan fase gerak yang polar sehingga bisfenol A dapat terelusi melalui kolom.
Ekstraksi bisfenol A dari dalam minuman dilakukan dengan ekstraksi fase padat atau solid phase extraction (SPE). Sementara itu, ekstraksi bisfenol A dari dalam botol dilakukan dengan cara ekstraksi menggunakan diklormetan dan aseton. Ekstraksi ini dilakukan untuk mengurangi pengotor pada matrik.
yang diperoleh dapat dipercaya, dengan hasil yang memenuhi parameter selektifitas, linearitas, akurasi, presisi, rentang, LOD, dan LOQ.
H. Hipotesis
1. KCKT fase terbalik dengan fase gerak asetonitril : air dan fase diam C-18 dapat memisahkan bisfenol A dalam matrik sampel dengan baik dilihat dari resolusi, N, ∝, k’, HETP, dan tailing factor.
39 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang dilakukan ini termasuk jenis penelitian eksperimental dengan rancangan penelitian deskriptif.
B. Variabel Penelitian 1. Variabel bebas
Variabel bebas dalam penelitian ini adalah perbandingan komposisi volume fase gerak asetonitril : air, kecepatan alir, dan konsentrasi baku bisfenol A.
2. Variabel tergantung
Variabel tergantung dalam proses optimasi ini adalah resolusi (Rs),
tailing factor (Tf), jumlah lempeng (N), nilai HETP, ∝, dan k’ yang dihasilkan. Variabel tergantung dalam proses validasi adalah selektifiitas, linearitas, akurasi, presisi, rentang, Limit of Detection (LOD), dan Limit of Quantitation (LOQ).
3. Variabel pengacau terkendali
Variabel pengacau terkendali dalam penelitian ini antara lain sebagai berikut.
a. Kemurnian pelarut yang digunakan. Untuk mengatasinya digunakan pelarut
pro analysis yang memiliki kemurnian tinggi.
C. Definisi Operasional
1. Sistem Kromatografi Cair Kinerja Tinggi (KCKT) yang digunakan adalah seperangkat alat KCKT fase terbalik dengan fase diam C-18 dan fase gerak asetonitril : air dengan perbandingan yang optimum.
2. Optimasi yang dilakukan dengan mengubah-ubah komposisi fase gerak dan kecepatan alir.
3. Parameter pemisahan yang optimum dengan metode KCKT dapat dilihat dari resolusi (Rs), tailing factor (Tf), jumlah lempeng (N), nilai HETP, ∝, dan k’ yang dihasilkan.
4. Parameter validasi metode yang digunakan adalah selektifitas, linearitas, akurasi, presisi, rentang, Limit of Detection (LOD), dan Limit of Quantitation
(LOQ)
D. Bahan Penelitian
Bahan-bahan kimia yang digunakan dalam penelitian ini antara lain baku bisfenol A 97% for synthesis (E. Merck), metanol pro analysis (E. Merck), aseton
E. Alat Penelitian
Seperangkat alat spektrofotometri UV-Vis merek Shimadzu UVmini-1240, seperangkat alat KCKT Shimadzu model LC-2010C HT, Serial No. C21254706757 LP, Cat. No. 228-46703-38, kolom Oktadesilsilan (C18) merek Knauer C-18 No. 25EE181KSJ (B115YG20) Batch no. 0003358 SN. XI 27 dengan dimensi 250 x 4,6 mm; packing Kromasil 100-5 C18, seperangkat komputer merek Dell B6RDZ1S Connexant System RD01-D850 A03-0382 JP France S.A.S., printer Epson LX-300+II, ultrasonikator merek Retsch tipe T460 No. V935922013 EY, neraca analitik Ohaus Carat Series PAJ 1003 (max 60/120 g, min 0,001 g, d = 0,01/0,1 mg/s), penyaring milipore, mikropipet Socorex,
organic and anorganic solvent membrane filter merek Whatman ukuran pori 0,45 µm dan diameter 47 mm, seperangkat alat gelas (Pyrex).
F. Tata Cara Penelitian 1. Penyiapan fase gerak asetonitril : air
Asetonitril dan air yang akan digunakan sebagai fase gerak disaring menggunakan kertas saring Whatman nomor 45 dengan menggunakan kertas yang berbeda untuk pelarut organik dan anorganik.
Berikut ini merupakan % volume komponen penyusun fase gerak. Tabel III. Komposisi optimasi fase gerak
Fase gerak Asetonitril Air
I 75 25
II 80 20
Sebelum digunakan fase gerak ini terlebih dahulu di-degassing
menggunakan ultasonic bath.
2. Pembuatan seri larutan baku bisfenol A
a. Pembuatan larutan stok 2000 µg/mL baku bisfenol A. Baku bisfenol A ditimbang lebih kurang 50 mg dan dilarutkan dengan metanol dalam labu takar 25 mL hingga tanda.
b. Pembuatan larutan intermediet 100 µg/mL baku bisfenol A. Diambil 500 µL larutan stok bisfenol A menggunakan mikropipet, dimasukkan ke dalam labu takar 10 mL, kemudian diencerkan dengan metanol hingga tanda.
c. Pembuatan larutan intermediet 10 µg/mL baku bisfenol A. Diambil 50 µL larutan stok bisfenol A menggunakan mikropipet dimasukkan ke dalam labu takar 10 mL, kemudian diencerkan dengan metanol hingga tanda. d. Pembuatan larutan kerja 0,01; 0,05; 0,1; 0,2; 0,4; 0,6; dan 0,8 µg/mL.
Dibuat larutan kerja 0,01; 0,05; 0,1; 0,2; 0,4; 0,6; dan 0,8 µg/mL baku bisfenol A dengan mengambil masing-masing 10, 50, 100, 200, 400, 600, dan 800 µL dari larutan intermediet 10 µg/mL menggunakan mikropipet kemudian dimasukkan ke dalam labu 10 mL. Selanjutnya diencerkan dengan metanol hingga tanda. Setelah itu, larutan disaring dengan milipore dan di-degassing selama 15 menit.
menggunakan mikropipet kemudian dimasukkan ke dalam labu 10 mL. Selanjutnya diencerkan dengan metanol hingga tanda. Setelah itu, larutan disaring dengan milipore dan di-degassing selama 15 menit.
3. Penyiapan Sampel
a. Sampel air. Sebanyak 200 mL sampel air di-clean up menggunakan sistem ekstraksi fase padat (EFP) dan dielusikan menggunakan metanol dengan jumlah sesuai dengan hasil optimasi. Hasil ekstraksi kemudian dilarutkan dengan metanol (Pamungkas, in process).
b. Sampel botol. Ditimbang kurang lebih 0,250 g botol plastik yang telah dipotong kecil-kecil dan dicuci. Sampel ini kemudian dilarutkan dalam 10 mL diklormetan, diaduk hingga larut, lalu 30 mL aseton ditambahkan perlahan. Larutan didiamkan selama 10 menit. Larutan tersebut kemudian disaring dengan kertas saring untuk diambil supernatannya, kemudian diklormetan dan aseton diuapkan dengan menggunakan gas nitrogen lalu dilarutkan dengan metanol (Kristiyanto, in process).
4. Optimasi KCKT fase terbalik
b. Optimasi komposisi fase gerak dan kecepatan alir. Detektor pada alat KCKT di atur pada panjang gelombang maksimum. Sejumlah 20 µL larutan baku bisfenol A 30 ppm, sampel air yang telah diekstraksi dan sampel botol yang telah dekstraksi yang sudah disaring dengan millipore
dan di-degassing selama 15 menit, diinjeksikan pada sistem KCKT fase terbalik menggunakan fase gerak yang telah dibuat seperti pada langkah di atas. Sistem operasi KCKT fase terbalik dilakukan dengan mengubah-ubah % volume komposisi fase gerak dan flow rate. Pengubahan % volume komposisi asetonitril : air pada fase gerak tersebut meliputi perbandingan 60 : 40, 70 : 30, dan 80 : 20, serta flow rate yang meliputi 0,8; 1; dan 1,2 mL/menit untuk masing-masing fase gerak.
5. Validasi Penetapan Kadar Bisfenol A dengan KCKT Fase Terbalik a. Pembuatan kurva baku dan penentuan linearitas. Detektor pada alat
persamaan y = bx + a dan nilai koefisien korelasi (r) yang akan digunakan untuk penentuan parameter validasi linearitas dan rentang. b. Limit of Detection (LOD). Detektor pada alat KCKT di atur pada panjang
gelombang maksimum. Larutan kerja bisfenol A 0,01; 0,05; 0,1; 0,2; 0,4; 0,6; dan 0,8 µg/mL yang telah disaring dengan millipore dan
di-degassing selama 15 menit, diinjeksikan pada sistem KCKT fase terbalik sebanyak 20 µL menggunakan fase gerak dan flow rate hasil optimasi. Dihitung LOD dari persamaan kurva regresi linier yang diperoleh.
c. Penentuan persen perolehan kembali (recovery) dan presisi adisi baku bisfenol A dalam sampel air dan penentuan LOQ untuk sampel air. Baku 100 ppm sebanyak 0,15; 0,12; 0,09; 0,06; 0,03 mL ditambahkan air sampel hingga volumnya menjadi 100 mL. Sampel diekstraksi pada sistem EFP dan dielusikan menggunakan metanol dengan jumlah sesuai dengan hasil optimasi dan diadd sampai volum 10 mL. Baku dan sampel yang sudah terekstraksi diinjeksikan dalam sistem KCKT. Dilakukan replikasi sebanyak tiga kali, kemudian dihitung perolehan kembali, presisi, dan LOQ (Pamungkas, in process).
ditambahkan baku bisfenol A 1; 1,5; 2; 3; dan 5 µg/mL. Sampel ini kemudian dilarutkan dalam 10 mL diklormetan, diaduk hingga larut, lalu 30 mL aseton ditambahkan perlahan. Larutan didiamkan selama 10 menit. Larutan tersebut kemudian disaring dengan kertas saring untuk diambil supernatannya, kemudian diklormetan dan aseton diuapkan dengan menggunakan gas nitrogen, lalu dilarutkan dengan metanol ke dalam labu ukur 10 mL. Larutan ini kemudian disaring dengan millipore
dan di-degassing selama 15 menit, lalu diinjeksikan pada sistem KCKT fase terbalik sebanyak 20 µL menggunakan fase gerak dan flow rate hasil optimasi. Cara kerja ini dilakukan replikasi sebanyak tiga kali, kemudian dihitung perolehan kembali, presisi, dan LOQ (Kristiyanto, in process).
G. Analisis Hasil 1. Analisis Hasil Optimasi
a. Panjang gelombang maksimum. Pemilihan panjang gelombang maksimum dapat dilakukan dengan melihat hasil rekaman spektroskopi menggunakan alat spektrofotometer terhadap baku kuersetin pada beberapa konsentrasi.
c. Analisis pemisahan puncak bisfenol A. Data kromatogram yang diperoleh baik pada baku maupun sampel diamati sehingga dapat diketahui sistem KCKT fase terbalik yang memberikan pemisahan bisfenol A paling baik yaitu dengan mengamati nilai N (lempeng teoritis), tailing factor, HETP, nilai resolusi, bentuk peak yang dihasilkan, ∝, dan k’.
1) Daya pisah (Resolusi)
Nilai daya pisah atau bisfenol A merupakan nilai yang diperoleh dengan melakukan perhitungan puncak bisfenol A terhadap puncak terdekat. Dengan rumus :
� =�2∆+ ��
Nilai Resolusi yang baik adalah ≥ 1,5 (Snyder, Kirkland, and Glajch, 2012).
2) Jumlah lempeng (N) dan HETP
Nilai N (lempeng) berbanding terbalik terhadap efisiensi kolom (HETP). Nilai HETP dihitung dengan rumus HETP: � = �
�,
3) Bentuk puncak (peak)
Dilakukan perhitungan terhadap nilai dengan rumus :
A
(tailing factor) dilakukan 5% dari tinggi puncak.
Nilai Tf ≤ 1,2 dikatakan baik, karena tidak mengganggu atau berpengaruh terhadap pemisahan, sedangkan nilai Tf < 1,0 maka puncak dikatakan fronting. Namun apabila Tf > 2 dapat berpotensi mengganggu dan memberikan efek terhadap pemisahan secara rutin. (Snyder, Kirkland, and Glajch, 2012). Menurut WHO, nilai tailing factor yang masih memenuhi kriteria penerimaan adalah 2 (cit., Yin, 2011).
4) Faktor kapasitas (k’) dan selektifitas (∝)
Faktor kapasitas mengukur berapa kali analit tertahan relatif terhadap komponen yang tidak tertahan. Menurut Snyder, Kirkland, and Glajch (2012) nilai k’ harus memenuhi 0,5 < k’ < 20.
Perhitungan faktor kapasitas. ′ = � −
Perhitungan selektifitas.
∝= � −
� −
2. Analisis Hasil Validasi
a. Selektifitas. Selektifitas merupakan kemampuan suatu metode analisis untuk mengukur analit yang diinginkan dalam matriks tanpa mengalami gangguan dari analit lain. Dalam penelitian dengan HPLC, selektifitas dilihat dari nilai resolusi yang dihasilkan (Gandjar dan Rohman, 2010). Untuk memenuhi kriteria selektifitas, suatu metode dipersyaratkan memiliki resolusi ≥ 1,5 (Snyder, Kirkland, and Glajch, 2012).
b. Linearitas. Linearitas merupakan kemampuan suatu metode (pada rentang tertentu) untuk mendapatkan hasil uji yang secara langsung proporsional dengan konsentrasi (jumlah) analit di dalam sampel. Rentang adalah jarak antara level terbawah dan teratas dari metode analisis yang telah dipakai untuk mendapatkan presisi, linearitas dan akurasi yang bisa diterima (The United States Pharmacopeia, 2007). Berdasarkan Ahuja and Dong (2005), metode untuk analisis impurity dikatakan memiliki linearitas yang baik jika memiliki nilai koefisien korelasi (r) ≥ 0,98
c. Rentang. Rentang adalah jarak antara level terbawah dan teratas dari metode analisis yang telah dipakai untuk mendapatkan presisi, linearitas dan akurasi yang bisa diterima (The United States Pharmacopeia, 2007) d. Akurasi. Akurasi adalah kedekatan hasil uji yang diperoleh dengan nilai
dinyatakan dalam persen perolehan kembali (recovery), dapat dihitung dengan persamaan berikut.
�� �ℎ � � = �� � �� � � � �� x 100%
Tabel IV. Persen perolehan kembali yang dapat diterima pada beberapa tingkat konsentrasi analit berdasarkan Gonzales and Herrador (2007)