PENETAPAN KADAR KALIUM, KALSIUM, NATRIUM DAN MAGNESIUM DALAM BUNGA NANGKA
(Artocarpus heterophyllus Lam.) BETINA DAN JANTAN SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
ersitas Sumatera Uta
OLEH:
NANDA PUTRI MAULIDAR NIM 151524027
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2017
PENETAPAN KADAR KALIUM, KALSIUM, NATRIUM DAN MAGNESIUM DALAM BUNGA NANGKA
(Artocarpus heterophyllus Lam.) BETINA DAN JANTAN SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
ersitas Sumatera Uta
OLEH:
NANDA PUTRI MAULIDAR NIM 151524027
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
PENGESAHAN SKRIPSI
PENETAPAN KADAR KALIUM, KALSIUM, NATRIUM DAN MAGNESIUM DALAM BUNGA NANGKA
(Artocarpus heterophyllus Lam.) BETINA DAN JANTAN SECARA SPEKTROFOTOMETRI SERAPAN ATOM
OLEH:
NANDA PUTRI MAULIDAR NIM 151524027
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 04 Oktober 2017
Disetujui oleh:
Pembimbing I Panitia Penguji,
Prof. Dr. Masfria, M.S., Apt. Prof. Dr. Siti Morin Sinaga, M.Sc., Apt.
NIP 195707231986012001 NIP 195008281976032002
Prof. Dr. Masfria, M.S., Apt.
Pembimbing II, NIP 195707231986012001
Prof. Dr. Ginda Haro., M.Sc., Apt. Drs. Fathur Rahman Harun, M.Si., Apt.
NIP 195108161980031002 NIP 195201041980031002
Prof. Dr. Ginda Haro., M.Sc., Apt.
NIP 195108161980031002
Medan, November 2017 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
Prof. Dr. Masfria, M.S., Apt.
NIP 195707231986012001
KATA PENGANTAR
Bismillahirrahmanirrahiim,
Puji syukur penulis ucapkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan skripsi yang berjudul “Penetapan Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Bunga Nangka (Artocarpus heterophyllus Lam.) Betina dan Jantan secara Spektrofotometri Serapan Atom”. Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis hendak menyampaikan rasa hormat dan terima kasih yang sebesar-besarnya kepada Ibu Prof. Dr. Masfria, M.S., Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan fasilitas dan masukan selama masa pendidikan dan penelitian, kepada Ibu Prof. Dr. Masfria, M.S., Apt., dan Bapak Prof. Dr. Ginda Haro, M.Sc., Apt., selaku dosen pembimbing yang telah banyak memberikan bimbingan, arahan dan bantuan selama masa penelitian dan penulisan skripsi ini berlangsung.
Penulis juga menyampaikan ucapan terima kasih kepada Ibu Prof. Dr. Siti Morin Sinaga, M.Sc., Apt., dan Bapak Drs. Fathur Rahman Harun, M.Si., Apt., selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini, Bapak Ibu staf pengajar Fakultas Farmasi USU yang telah mendidik selama perkuliahan serta Bapak Ibu staf Balai Riset dan Standardisasi Industri Medan yang telah mendidik selama penelitian dan Ibu Prof.
Dr. Julia Reveny, M.Si., Apt., selaku dosen pembimbing akademik yang selalu membimbing selama masa pendidikan.
Penulis juga ingin menyampaikan rasa terima kasih serta penghargaan yang tulus dan tak terhingga kepada orang tua tersayang Ayahanda Dr. Ilyas Daud, M.Pd., dan Ibunda Dra. Cut Aja Nurjannah serta abang Muhammad Syukran, S.Si., adik Maghfira Maulani dan Muhammad Fajar Rizki juga seluruh keluarga atas doa dan dukungan baik moril maupun materil dan sahabat-sahabat penulis (Kak Eka, Arif, Nia, Hindri, Desy, Intan, Tasya dan Linda) juga seluruh teman-teman di Fakultas Farmasi Universitas Sumatera Utara yang telah membantu, memberikan dukungan dan menjadi penyemangat bagi penulis atas motivasi dan segala bantuan dalam penyelesaian skripsi ini yang tidak dapat disebutkan satu per satu.
Semoga Tuhan Yang Maha Kuasa memberikan balasan yang berlipat ganda kepada semua pihak yang telah membantu dalam penulisan skripsi ini.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu, sangat diharapkan kritik dan saran yang bersifat membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya bidang farmasi.
Medan, November 2017 Penulis,
Nanda Putri Maulidar NIM 151524027
SURAT PERNYATAAN TIDAK PLAGIAT
Saya yang bertanda tangan dibawah ini:
Nama : Nanda Putri Maulidar
Nomor Induk Mahasiswa : 151524027 Program Studi : Ekstensi Farmasi Judul Skripsi :
Dengan ini menyatakan bahwa skripsi ini ditulis berdasarkan data dari hasil pekerjaan yang saya lakukan sendiri dan belum pernah diajukan oleh orang lain untuk memperoleh gelar kesarjanaan di perguruan tinggi lain serta bukan plagiat karena kutipan yang ditulis telah disebutkan sumbernya di dalam daftar pustaka.
Apabila dikemudian hari ada pengaduan dari pihak lain karena didalam skripsi ini ditemukan plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi apapun oleh Program Studi Farmasi Fakultas Farmasi Universitas Sumatera Utara dan bukan menjadi tanggung jawab pembimbing.
Demikianlah surat pernyataan ini saya perbuat dengan sebenarnya untuk dapat digunakan jika diperlukan sebagaimana mestinya.
Medan, November 2017 Yang membuat pernyataan,
Nanda Putri Maulidar NIM 151524027
Penetapan Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Bunga Nangka (Artocarpus heterophyllus Lam.) Betina dan Jantan secara Spektrofotometri Serapan Atom
Materai Rp. 6000
PENETAPAN KADAR KALIUM, KALSIUM, NATRIUM DAN MAGNESIUM DALAM BUNGA NANGKA
(Artocarpus heterophyllus Lam.) BETINA DAN JANTAN SECARA SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Nangka merupakan salah satu buah tropis yang keberadaannya tidak mengenal musim. Tanaman nangka adalah tanaman berumah satu, artinya dalam satu tanaman dapat dijumpai bunga jantan dan bunga betina. Bunganya muncul pada ketiak daun pada pucuk yang pendek dan khusus yang tumbuh pada sisi batang atau cabang tua. Bunga jantan bentuknya langsing sedangkan bunga betina tampak gemuk. Bunga nangka kurang populer dikalangan masyarakat dan belum ada penelitian terdahulu yang meneliti tentang kandungan dalam sampel tersebut.
Penelitian ini membandingkan antara bunga nangka betina dan jantan untuk melihat perbedaan kadar antara kedua sampel tersebut. Tujuan penelitian ini adalah untuk mengetahui kandungan mineral kalium, kalsium, natrium dan magnesium dalam bunga nangka betina dan jantan.
Preparasi sampel dilakukan dengan proses dekstruksi kering. Penentuan kadar kalium, kalsium, natrium dan magnesium dilakukan dengan metode Spektrofotometri Serapan Atom (SSA) masing-masing pada panjang gelombang 766,5 nm; 422,7 nm; 589,0 nm dan 285,2 nm dengan nyala udara-asetilen.
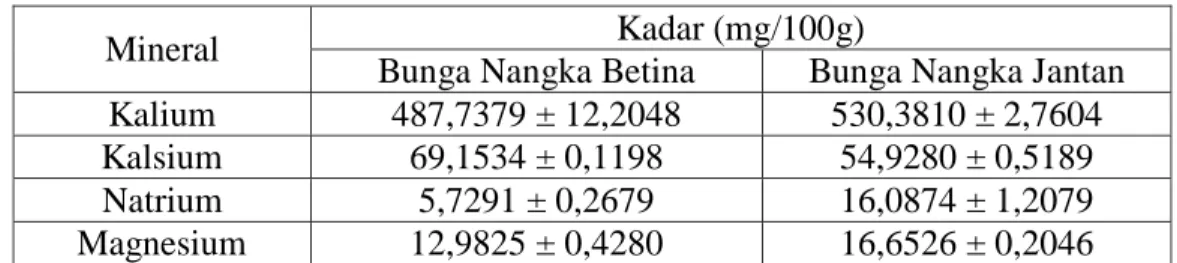
Hasil penelitian menunjukkan bahwa kadar kalium, kalsium, natrium dan magnesium pada bunga nangka betina yaitu 487,7379 ± 12,2048 mg/100g;
69,1534 ± 0,1198 mg/100g; 5,7291 ± 0,2679 mg/100g dan 12,9825 ± 0,4280 mg/100g sedangkan pada bunga nangka jantan yaitu
530,3810 ± 2,7604 mg/100g; 54,9280 ± 0,5189 mg/100g;
16,0874 ± 1,2079 mg/100g dan 16,6526 ± 0,2046 mg/100g.
Kadar kalium, kalsium, natrium dan magnesium pada bunga nangka jantan lebih besar secara keseluruhan dibandingkan bunga nangka betina. Kadar kalium, natrium dan magnesium lebih besar terdapat pada bunga nangka jantan sedangkan kadar kalsium lebih besar terdapat pada bunga nangka betina.
Kata kunci: bunga nangka betina, bunga nangka jantan, kalium, kalsium, natrium, magnesium, spektrofotometri serapan atom.
DETERMINATION OF POTASSIUM, CALCIUM, SODIUM AND MAGNESIUM IN JACKFRUIT FLOWERS
(Artocarpus heterophyllus Lam.) FEMALE AND MALE BY ATOMIC ABSORPTION SPECTROPHOTOMETRY
ABSTRACT
Jackfruit is one of the tropical fruit whose existence is not familiar with the season. Jackfruit plant is a single-rooted plant, meaning that in one plant can be found male flowers and female flowers. The flower appears on the leaf's armpits on short, special shoots that grow on the sides of the stems or old branches. Male flowers are slim shape while the female flowers look fat. Jackfruit flowers are less popular among the community and no previous research has examined the content in the sample. This study compared between female and male jackfruit flowers to see the difference in levels between the two samples. The purpose of this study was to determine the mineral content of potassium, calcium, sodium and magnesium in female and male jackfruit flowers.
Sample preparation was done by dry destruction process. Determination of potassium, calcium, sodium and magnesium levels was performed by Atomic Absorption Spectrophotometry (AAS) method at 766.5 nm wavelength; 422.7 nm;
589.0 nm and 285.2 nm with an air-acetylene flame.
The results showed that potassium, calcium, sodium and magnesium levels
in female jackfruit flower were 487.7379 ± 12.2048 mg/100g;
69.1534 ± 0.1198 mg/100g; 5.7291 ± 0.2679 mg/100g and 12.9825 ± 0.4280 mg/100 g while on male jackfruit flower is 530.3810 ± 2.7604 mg/100g; 54.9280 ± 0.5189 mg/100g;
16.0874 ± 1.2079 mg/100 g and 16.6526 ± 0.2046 mg/100 g.
Levels of potassium, calcium, sodium and magnesium in the male jackfruit flower larger overall compared with female jackfruit flowers. Level of potassium, sodium and magnesium more higher are found in the male jackfruit flower while the greater calcium content is found in the female jackfruit flower.
Keywords: female jackfruit flower, male jackfruit flower, potassium, calcium, sodium, magnesium, atomic absorption spectrophotometry.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN TIDAK PLAGIAT ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian... 3
1.5 Manfaat Penelitian... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Klasifikasi Nangka ... 4
2.2 Nangka ... 4
2.3 Bunga Nangka ... 6
2.4 Mineral ... 7
2.4.1 Kalium ... 7
2.4.2 Kalsium ... 8
2.4.3 Natrium... 9
2.4.4 Magnesium ... 10
2.5 Spektrofotometri Serapan Atom... 11
2.6 Instrumentasi Spektrofotometri Serapan Atom ... 12
2.7 Gangguan-gangguan pada Spektrofotometri Serapan Atom ... 15
2.8 Validasi Metode Analisis ... 15
2.8.1 Kecermatan (accuracy) ... 16
2.8.2 Keseksamaan (Precision) ... 16
2.8.3 Batas Deteksi dan Batas Kuantitasi ... 17
BAB III METODE PENELITIAN... 18
3.1 Tempat dan Waktu Penelitian ... 18
3.2 Alat ... 18
3.3 Bahan ... 18
3.3.1 Sampel ... 18
3.3.2 Pereaksi ... 18
3.4 Pembuatan Pereaksi... 19
3.4.1 Larutan HNO3 (1:1) ... 19
3.4.2 Larutan CsCl... ... 19
3.4.3 Larutan La2O3... ... 19
3.4.4 Larutan Larutan Kuning Titan 0,1% ... 19
3.4.5 Larutan NaOH 2 N ... 19
3.5 Prosedur Penelitian ... 20
3.5.1 Pengambilan Sampel ... 20
3.5.2 Penyiapan Sampel ... 20
3.5.3 Proses Destruksi Kering ... 20
3.5.4 Pembuatan Larutan Sampel ... 20
3.5.5 Analisa Kualitatif ... 21
3.5.5.1 Kalium ... 21
3.5.5.1.1 Dengan Uji Nyala ... 21
3.5.5.1.2 Uji Kristal Kalium dengan Asam Pikrat ... 21
3.5.5.2 Kalsium ... 21
3.5.5.2.1 Dengan Uji Nyala ... 21
3.5.5.2.2 Uji Kristal Kalsium dengan Asam Sulfat 1 N ... 22
3.5.5.3 Natrium ... 22
3.5.5.3.1 Dengan Uji Nyala ... 22
3.5.5.3.2 Uji Kristal Natrium dengan Asam Pikrat ... 22
3.5.5.4 Magnesium... 22
3.5.5.4.1 Dengan Reagensia Kuning Titan ... 22
3.5.6 Analisa Kuantitatif ... 23
3.5.6.1 Pembuatan Kurva Kalibrasi Kalium ... 23
3.5.6.2 Pembuatan Kurva Kalibrasi Kalsium ... 23
3.5.6.3 Pembuatan Kurva Kalibrasi Natrium ... 24
3.5.6.4 Pembuatan Kurva Kalibrasi Magnesium ... 24
3.5.7 Penetapan Kadar Mineral dalam Sampel ... 24
3.5.7.1 Penetapan Kadar Kalium ... 24
3.5.7.2 Penetapan Kadar Kalsium ... 25
3.5.7.3 Penetapan Kadar Natrium ... 25
3.5.7.4 Penetapan Kadar Magnesium ... 26
3.5.7.5 Perhitungan Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Sampel ... 27
3.5.8 Analisis Data Secara Statistik ... 27
3.5.8.1 Penolakan Hasil Pengamatan ... 27
3.5.9 Uji Perolehan Kembali (Recovery) ... 28
3.5.10 Simpangan Baku Relatif... 29
3.5.11 Penentuan Batas Deteksi dan Batas Kuantitasi ... 30
BAB IV HASIL DAN PEMBAHASAN ... 31
4.1 Identifikasi Tumbuhan ... 31
4.2 Analisis Kualitatif ... 31
4.3 Analisis Kuantitatif ... 32
4.3.1 Kurva Kalibrasi Kalium, Kalsium, Natrium dan Magnesium ... 32
4.3.2 Analisis Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Sampel ... 34
4.4 Uji Akurasi ... 38
4.5 Uji Presisi ... 39
4.6 Batas Deteksi dan Batas Kuantitasi ... 40
BAB V KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan... 41
DAFTAR PUSTAKA ... 42 LAMPIRAN ... 44
DAFTAR TABEL
Tabel Halaman
4.1 Hasil Analisis Kualitatif Kalium, Kalsium, Natrium dan
Magnesium dalam Bunga Nangka Betina... 31 4.2 Hasil Analisis Kualitatif Kalium, Kalsium, Natrium dan
Magnesium dalam Bunga Nangka Jantan ... 32 4.3 Hasil Analisis Kuantitatif Kadar Kalium, Kalsium, Natrium dan
Magnesium dalam Bunga Nangka Betina dan Jantan... 35 4.4 Persen Uji Perolehan Kembali (Recovery) Kalium, Kalsium,
Natrium dan Magnesium... 38 4.5 Hasil Uji Presisi Kalium, Kalsium, Natrium dan
Magnesium... ... 39 4.6 Batas Deteksi dan Batas Kuantitasi Kalium, Kalsium, Natrium
dan Magnesium dalam Sampel.... ... 40
DAFTAR GAMBAR
Gambar Halaman
2.1 Komponen Spektrofotometer Serapan Atom ... 14
4.1 Kurva Kalibrasi Larutan Standar Kalium ... 33
4.2 Kurva Kalibrasi Larutan Standar Kalsium ... 33
4.3 Kurva Kalibrasi Larutan Standar Natrium ... 33
4.4 Kurva Kalibrasi Larutan Standar Magnesium ... 34
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil Identifikasi Bunga Nangka ... 44
2 Surat Keterangan Telah Melakukan Penelitian... 45
3 Surat Keterangan Telah Melakukan Penelitian... 46
4 Surat Keterangan Telah Melakukan Penelitian... 47
5 Gambar Sampel yang digunakan... ... 48
6 Gambar Alat yang digunakan.... ... 49
7 Bagan Alir Proses Destruksi Kering Bunga Nangka ... 50
8 Bagan Alir Pembuatan Larutan Sampel ... 51
9 Hasil Uji Kualitatif Bunga Nangka... 52
10 Data Hasil Pengukuran Absorbansi Larutan Standar Kalium dan Perhitungan Persamaan Garis Regresi Kalium ... 54
11 Data Hasil Pengukuran Absorbansi Larutan Standar Kalsium dan Perhitungan Persamaan Garis Regresi Kalsium ... 56
12 Data Hasil Pengukuran Absorbansi Larutan Standar Natrium dan Perhitungan Persamaan Garis Regresi Natrium ... 58
13 Data Hasil Pengukuran Absorbansi Larutan Standar Magnesium dan Perhitungan Persamaan Garis Regresi Magnesium ... 60
14 Hasil Analisis Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Bunga Nangka Betina ... 62
15 Contoh Perhitungan Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Bunga Nangka Betina ... 63
16 Hasil Analisis Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Bunga Nangka Jantan ... 66 17 Contoh Perhitungan Kadar Kalium, Kalsium, Natrium dan
19 Perhitungan Statistik Kadar Kalium, Kalsium, Natrium dan
Magnesium dalam Bunga Nangka Jantan.... ... 80 20 Perhitungan Penambahan Volume Baku Kalium, Kalsium,
Natrium dan Magnesium Pada Uji Akurasi dalam Bunga
Nangka Jantan ... 90 21 Perhitungan Uji Akurasi Kadar Kalium, Kalsium, Natrium
dan Magnesium dalam Bunga Nangka Jantan ... 92 22 Perhitungan Uji Presisi Kadar Kalium, Kalsium, Natrium dan
Magnesium dalam Bunga Nangka Jantan ... 104 23 Perhitungan Batas Deteksi dan Batas Kuantitasi Kalium,
Kalsium, Natrium dan Magnesium ... 107 24 Hasil Analisis Kadar Kalium, Kalsium, Natrium dan
Magnesium Sebelum dan Sesudah Penambahan Masing-masing Larutan Standar dalam Bunga Nangka
Jantan.... ... 111 25 Tabel Distribusi t... 113
BAB I PENDAHULUAN
1.1 Latar Belakang
Nangka merupakan salah satu buah tropis yang keberadaannya tidak mengenal musim. Di Indonesia, pohon nangka dapat tumbuh hampir di setiap daerah. Nangka terdiri dari beberapa pulp kuning dan biji cokelat yang terbungkus dalam kulit keras dan kaya akan karbohidrat, vitamin B kompleks dan mineral.
Namun, hanya 15-20% buah yang digunakan sebagai makanan, yang bisa dimasak atau dipanggang di atas bara (Madruga, dkk., 2013).
Tanaman nangka adalah tanaman berumah satu, artinya dalam satu tanaman dapat dijumpai bunga jantan dan bunga betina. Bunganya muncul pada ketiak daun pada pucuk yang pendek dan khusus yang tumbuh pada sisi batang atau cabang tua. Bunga jantan dalam bongkol berbentuk langsing, 1-3 x 3-8 cm, bengkok, hijau tua, dengan serbuk sari kekuningan dan berbau harum samar apabila masak. Bunga betina dalam bongkol tunggal atau berpasangan, gemuk dan berwarna hijau (Novary, 1999).
Menurut United States Department of Agriculture (USDA) (2008), kandungan atau nilai gizi buah nangka per 100 gram diantaranya yaitu kalium 303 mg; kalsium 34 mg; natrium 3 mg; magnesium 37 mg serta mengandung energi, karbohidrat, protein, kolesterol, mineral dan vitamin yang lainnya.
Mineral merupakan kebutuhan tubuh manusia yang mempunyai peranan penting dalam pemeliharaan fungsi tubuh. Mineral banyak ditemukan dalam
jaringan tubuh dan komponen cairan tubuh yang bekerja bersama dengan enzim, hormon, vitamin dan bahan-bahan transport (Devi, 2010).
Kalium (K+) merupakan suatu kation seluler yang penting untuk fungsi jantung serta menjaga fungsi otot dan pencernaan yang normal. Kalsium (Ca2+) merupakan suatu mineral yang berfungsi mengatur pembekuan darah, selain itu kalsium juga dibutuhkan untuk pembentukan tulang dan gigi. Natrium (Na+) adalah kation utama dalam cairan ekstraseluler yang sangat berperan dalam pengaturan cairan tubuh termasuk tekanan darah. Magnesium (Mg2+) berfungsi memperkuat tulang, melawan radikal bebas, menyehatkan jantung, menurunkan tekanan darah dan mencegah diabetes (Kee dan Hayes, 1993).
Bunga nangka betina merupakan bakal buah yang akan menjadi nangka masak sedangkan bunga nangka jantan adalah bongkol bunga yang akan gugur dan menghitam semasa dipohon. Bunga nangka jantan atau biasa disebut babal sering dimanfaatkan oleh masyarakat di pulau Jawa sebagai penambah cita rasa dalam makanan rujak dan juga digunakan sebagai obat tradisional untuk diare.
Namun, kandungan dalam bunga nangka belum diketahui secara pasti.
Berdasarkan penjelasan di atas penulis melakukan penelitian tentang penetapan kadar kalium, kalsium, natrium dan magnesium yang terdapat pada bunga nangka betina dan jantan secara spektrofotometri serapan atom. Dalam hal ini peneliti memilih menggunakan spektrofotometri serapan atom karena
pelaksanaannya relatif cepat, bahan yang digunakan sedikit dan spesifik untuk setiap logam tanpa dilakukan pemisahan pendahuluan (Gandjar dan Rohman, 2012).
1.2 Perumusan Masalah
1. Apakah bunga nangka betina dan jantan mengandung kalium, kalsium, natrium dan magnesium?
2. Berapakah kadar kalium, kalsium, natrium dan magnesium pada bunga nangka betina dan jantan?
1.3 Hipotesis
1. Bunga nangka betina dan jantan diketahui mengandung kalium, kalsium, natrium dan magnesium.
2. Bunga nangka betina dan jantan diketahui memiliki kadar kalium, kalsium, natrium dan magnesium dalam jumlah tertentu.
1.4 Tujuan Penelitian
1. Untuk mengetahui kandungan kalium, kalsium, natrium dan magnesium dalam bunga nangka betina dan jantan.
2. Untuk menentukan kadar kalium, kalsium, natrium dan magnesium yang terdapat dalam bunga nangka betina dan jantan.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah dapat memberikan informasi kepada masyarakat tentang kandungan mineral kalium, kalsium, natrium dan magnesium yang terdapat dalam bunga nangka betina dan jantan.
BAB II
TINJAUAN PUSTAKA
2.1 Klasifikasi Nangka
Adapun urutan sistematika nangka secara lengkap menurut Rukmana (1997) sebagai berikut:
Kingdom : Plantae
Divisio : Spermatophyta Sub Divisio : Angiospermae Kelas : Dicotyledoneae Ordo : Morales
Famili : Moraceae Genus : Artocarpus
Spesies : Artocarpus heterophyllus Lam.
2.2 Nangka
Nangka (Artocarpus heterophyllus Syn. Artocarpus integra) berasal dari India bagian selatan. Nangka termasuk keluarga Moraceae yang masih satu marga dengan sukun, keluwih, cempedak, bendo (Nuswamarhaeni, dkk., 1999).
Nangka merupakan tanaman hutan yang pohonnya dapat mencapai tinggi 25 m. Seluruh bagian tanaman bergetah, yang biasa disebut pulut. Daunnya bulat, lonjong, lebar. Kayunya keras, apabila telah tua berwarna kuning sampai kemerahan. Bunganya ada dua macam, yakni bunga jantan dan bunga betina yang letaknya terpisah, tetapi dalam satu pohon (berumah satu, monoecious).
Bunga-bunganya keluar pada batang, cabang atau ranting dan menggantung seperti pada durian (Sunarjono, 1997).
Buah nangka relatif besar, berbiji banyak, kulitnya berduri lunak. Setiap biji dibalut oleh daging buah (endokarp) dan kulit buah (eksokarp) yang mengandung gelatin. Sebenarnya buah nangka itu adalah buah majemuk (sinkarpik), yakni berbunga banyak tersusun tegak lurus pada tangkai buah (porosnya), bentuknya bulat sampai bulat lonjong. Duri buah yang dapat dilihat sebenarnya adalah bekas kepala putiknya (Sunarjono, 1997).
Nangka yang matang berwarna kuning, kuning kecokelatan atau hijau, aromanya harum, dagingnya tebal, agak keras, warnanya kuning keemasan, kuning kemerahan atau kuning keputih-putihan (Nuswamarhaeni, dkk., 1999).
Nangka yang disukai konsumen adalah yang daging buahnya besar, tebal, berbiji kecil, manis, harum dan lunak. Secara umum ada dua golongan nangka yaitu nangka biasa dan nangka bubur. Nangka biasa dagingnya keras dan agak kesat, sedangkan nangka bubur dagingnya lunak dan berair (Nuswamarhaeni, dkk., 1999).
Selain dimanfaatkan buah tuanya, nangka muda pun sering dimanfaatkan sebagai sayuran yang diolah menjadi berbagai jenis masakan. Bahkan, buahnya yang masih sangat muda, disebut juga babal dapat dimanfaatkan sebagai rujak bebeg. Bunga nangka jantan memiliki rasa kelat dan juga dijadikan obat tradisional untuk diare (Novary, 1999).
Nangka muda mengandung zat gizi yang relatif lengkap walaupun dalam jumlah relatif kecil. Zat gizi yang dikandung nangka muda diantaranya vitamin A,
B1 dan C serta mineral Ca, P dan Fe. Dalam 100 g nangka muda mengandung 51 kalori (Novary, 1999).
2.3 Bunga Nangka
Tanaman nangka adalah tanaman berumah satu, artinya dalam satu tanaman dapat dijumpai bunga jantan dan bunga betina. Perbungaan muncul pada ketiak daun pada pucuk yang pendek dan khusus yang tumbuh pada sisi batang atau cabang tua. Bunga jantan dalam bongkol berbentuk langsing, 1-3 x 3-8 cm, bengkok, hijau tua, dengan serbuk sari kekuningan dan berbau harum samar apabila masak. Bunga nangka jantan disebut babal. Setelah melewati umur masaknya, babal akan membusuk (ditumbuhi kapang) dan menghitam semasa masih di pohon, sebelum akhirnya terjatuh. Bunga betina dalam bongkol tunggal atau berpasangan, gemuk dan berwarna hijau (Novary, 1999).
Menurut Rukmana (1997), bunga nangka mempunyai beberapa ciri yaitu:
a. Bunga tanaman nangka berukuran kecil, tumbuh berkelompok secara rapat tersusun dalam tandan. Bunga muncul dari ketiak cabang atau pada cabang-cabang besar.
b. Bunga jantan dan betina terdapat dalam satu pohon (monoecious) sehingga bersifat menyerbuk sendiri.
c. Bunga mengandung madu dan beraroma harum yang dapat mengundang datangnya serangga atau kumbang penyerbuk.
Babal (bunga nangka jantan) merupakan bunga yang masih sangat kecil (berukuran sebesar ibu jari). Apabila tidak dapat menjadi buah karena sebab-sebab tertentu, babal tersebut akan gugur. Babal yang gugur akan mempunyai aroma
yang menyerupai buah nangka matang. Oleh karena itu, sering kali dimanfaatkan sebagai bahan penyedap dalam pembuatan rujak manis (Suprapti, 2004).
2.4 Mineral
Mineral adalah bagian dari tubuh yang memegang peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ maupun fungsi tubuh secara keseluruhan. Di samping itu, mineral berperan dalam berbagai tahap metabolisme, terutama sebagai kofaktor dalam aktivitas enzim-enzim (Almatsier, 2009).
Mineral digolongkan ke dalam mineral makro dan mineral mikro. Mineral
makro adalah mineral yang dibutuhkan tubuh dalam jumlah lebih dari 100 mg sehari, sedangkan mineral mikro dibutuhkan kurang dari 100 mg sehari.
Jumlah mineral mikro dalam tubuh kurang dari 15 mg. Yang termasuk mineral makro adalah natrium, kalium, kalsium, fosfor, magnesium dan sulfur. Adapun yang termasuk mineral mikro adalah besi, seng, mangan dan tembaga (Almatsier, 2009).
2.4.1 Kalium
Kalium terutama terdapat di dalam sel, sebanyak 95% kalium berada di dalam cairan intraseluler. Kalium memegang peranan dalam pemeliharaan keseimbangan cairan dan elektrolit, keseimbangan asam basa serta isotonis sel.
Selain itu kalium juga mengaktivasi banyak reaksi enzim dan proses fisiologi, seperti transmisi impuls di saraf dan otot, kontraksi otot dan metabolisme
Kekurangan kalium dapat terjadi karena banyak kehilangan melalui saluran cerna dan ginjal. Kekurangan kalium menyebabkan lemah, lesu, kehilangan nafsu makan dan konstipasi. Kelebihan kalium akut dapat terjadi bila konsumsi tanpa diimbangi oleh kenaikan ekskresi (Almatsier, 2009).
Kalium terdapat di dalam semua makanan yang berasal dari tumbuh- tumbuhan dan hewan. Sumber utama adalah makanan mentah/segar, terutama buah, sayuran dan kacang-kacangan. Kebutuhan minimum kalium ditaksir sebanyak 2000 mg sehari (Almatsier, 2009).
2.4.2 Kalsium
Kalsium merupakan mineral yang paling banyak terdapat di dalam tubuh, yaitu 1,5-2% dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg. Dari jumlah ini, sebanyak 99% berada di dalam jaringan keras, yaitu tulang dan gigi, selebihnya tersebar luas di dalam tubuh. Di dalam cairan ekstraselular dan intraselular, kalsium memegang peranan penting dalam mengatur fungsi sel, seperti untuk transmisi impuls di saraf, kontraksi otot, penggumpalan darah dan menjaga permeabilitas membran sel (Almatsier, 2009).
Sumber kalsium utama adalah susu dan hasil susu, seperti keju. Ikan dimakan dengan tulang, termasuk ikan kering merupakan sumber kalsium yang baik. Serelia, kacang-kacangan dan hasil kacang-kacangan, tahu dan tempe dan sayuran hijau merupakan sumber kalsium yang baik juga, tetapi bahan makanan ini mengandung banyak zat yang menghambat penyerapan kalsium seperti serat, fitat dan oksalat (Almatsier, 2009).
Angka kecukupan rata-rata sehari untuk kalsium bagi orang Indonesia yang ditetapkan adalah 300 mg – 400 mg pada bayi, 500 mg pada anak-anak,
600 mg – 700 mg pada remaja, 500 mg – 800 mg pada orang dewasa serta lebih besar 400 mg pada ibu hamil dan menyusui. Kekurangan kalsium pada masa pertumbuhan dapat menyebabkan gangguan pertumbuhan seperti tulang kurang kuat, mudah bengkok dan rapuh. Konsumsi kalsium hendaknya tidak melebihi 2500 mg sehari. Kelebihan kalsium dapat menimbulkan batu ginjal atau gangguan ginjal. Disamping itu, dapat menyebabkan konstipasi (susah buang air besar) (Almatsier, 2009).
2.4.3 Natrium
Natrium adalah kation utama dalam cairan ekstraseluler. Sebanyak 35-40% natrium ada didalam kerangka tubuh. Cairan saluran cerna, sama seperti cairan empedu dan pankreas, mengandung banyak natrium. Sumber utama natrium adalah garam dapur atau NaCl. Garam dapur di dalam makanan sehari-hari berperan sebagai bumbu dan berperan sebagai bahan pengawet. Pada tahun 1937 baru diketahui peranannya sebagai zat gizi esensial secara pasti (Almatsier, 2009).
Sebagai kation utama dalam cairan ekstraseluler, natrium menjaga keseimbangan cairan dalam kompartemen tersebut. Natrium mengatur tekanan osmosis yang menjaga cairan tidak keluar dari darah dan masuk ke dalam sel-sel.
Natrium menjaga keseimbangan asam basa di dalam tubuh dengan mengimbangi zat-zat yang membentuk asam. Natrium berperan dalam transmisi saraf dan kontraksi otot. Natrium berperan pula dalam absorpsi glukosa dan sebagai alat angkut zat-zat gizi lain melalui membran, terutama melalui dinding usus sebagai
Makanan sehari-hari biasanya cukup mengandung natrium yang dibutuhkan tubuh. Oleh karena itu, tidak ada penetapan kebutuhan natrium sehari.
Taksiran kebutuhan natrium sehari untuk orang dewasa adalah sebanyak 500 mg.
WHO tahun 1990 menganjurkan pembatasan konsumsi garam dapur hingga 6 gram sehari (ekivalen dengan 2400 mg natrium). Pembatasan ini dilakukan
mengingat peranan potensial natrium dalam menimbulkan tekanan darah tinggi (hipertensi) (Almatsier, 2009).
Kekurangan natrium menyebabkan kejang, apatis dan kehilangan nafsu makan. Kekurangan natrium dapat terjadi sesudah muntah, diare, keringat berlebihan dan bila menjalankan diet yang sangat terbatas dalam natrium.
Kelebihan natrium dapat menimbulkan keracunan yang dalam keadaan akut menyebabkan edema dan hipertensi (Almatsier, 2009).
2.4.4 Magnesium
Magnesium didalam tubuh berfungsi memperkuat tulang, melawan radikal bebas, menyehatkan jantung, menurunkan tekanan darah dan mencegah diabetes (Fatmah, 2010).
Magnesium banyak terdapat dalam sayuran karena terdapat dalam bentuk klorofil. Sumber lain magnesium bisa berasal dari makanan sumber laut dan ikan tawar segar, padi-padian, kacang-kacangan dan air minum. Daging dan hasil olahan sumber hewani juga mengandung banyak magnesium (Fatmah, 2010).
Angka Kecukupan Gizi (AKG) magnesium berdasarkan Widyakarya
Nasional Pangan dan Gizi (WNPG) tahun 2004 pada lansia pria berusia 50-64 tahun dan diatas 65 tahun sebesar 300 mg/hari, sedangkan pada lansia
wanita sebesar 270 mg/hari. Kekurangan magnesium dapat menyebabkan deposit
kalsium menjadi tidak normal di berbagai jaringan dan menyebabkan batu ginjal, denyut jantung yang tidak beraturan, sulit tidur, kram kaki dan tangan gemetaran (Fatmah, 2010).
2.5 Spektrofotometri Serapan Atom
Metode Spektrofotometri Serapan Atom (SSA) mendasarkan pada prinsip absorbsi cahaya oleh atom. Atom-atom akan menyerap cahaya pada panjang gelombang tertentu, tergantung pada sifat unsurnya. Sebagai contoh, natrium menyerap pada 589 nm, uranium pada 385,5 nm sementara kalium menyerap pada panjang gelombang 766,5 nm. Cahaya pada panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom bersifat spesifik.
Dengan menyerap suatu energi, maka atom akan memperoleh energi sehingga suatu atom pada keadaan dasar dapat ditingkatkan energinya ke tingkat eksitasi (Rohman, 2007).
Spektrofotometri serapan atom digunakan untuk analisis kuantitatif unsur-unsur logam. Cara analisis ini memberikan kadar total unsur logam dalam suatu sampel dan tidak tergantung pada bentuk molekul logam dalam sampel tersebut. Cara ini cocok untuk analisis logam karena mempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm) dan pelaksanaannya relatif sederhana.
Spektrofotometri serapan atom didasarkan pada penyerapan energi sinar oleh atom-atom netral dan sinar yang diserap biasanya sinar tampak atau ultraviolet.
Dalam garis besarnya prinsip spektrofotometri serapan atom sama dengan spektroskopi sinar tampak dan ultraviolet. Perbedaannya terletak pada bentuk
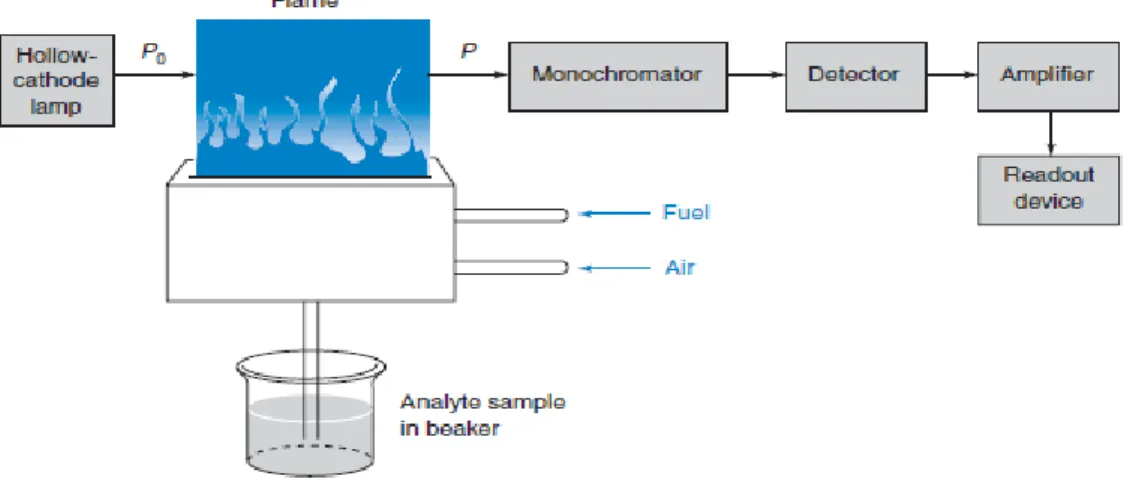
2.6 Instrumentasi Spektrofotometri Serapan Atom
Menurut (Rohman, 2007) instrumentasi Spektrofotometri Serapan Atom (SSA) terdiri dari:
1. Sumber sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow cathode lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda dan anoda. Katoda berbentuk silinder berongga yang terbuat dari logam atau dilapisi dengan logam tertentu. Setiap pengukuran harus menggunakan lampu katoda berongga khusus, atom-atom unsur dari katoda ini kemudian akan mengalami eksitasi ke tingkat energi elektron yang lebih tinggi dan akan memancarkan spektrum pancaran dari unsur yang sama dengan unsur yang akan dianalisis. Salah satu kelemahan penggunaan lampu katoda berongga adalah satu lampu digunakan untuk satu unsur, akan tetapi saat ini telah banyak dijumpai suatu lampu katoda berongga kombinasi, yakni satu lampu dilapisi dengan beberapa unsur sehingga dapat digunakan untuk analisis beberapa unsur sekaligus (Rohman, 2007).
2. Tempat sampel
Dalam analisis dengan spektrofotometer serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral. Ada berbagai macam sumber atomisasi yang digunakan untuk mengubah sampel menjadi uap atom-atomnya, yaitu:
a. Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa cairan menjadi bentuk uap atom dan untuk proses atomisasi. Suhu yang dapat dicapai oleh nyala
tergantung pada gas yang digunakan, misalnya untuk gas asetilen-udara suhunya sebesar 2200oC. Sumber nyala asetilen-udara ini merupakan sumber nyala yang paling banyak digunakan. Pada sumber nyala ini asetilen sebagai bahan pembakar, sedangkan udara sebagai bahan pengoksidasi (Rohman, 2007).
b. Tanpa Nyala (Flameless)
Pengatoman dilakukan dalam tungku dari grafit. Sejumlah sampel diambil sedikit (hanya beberapa µL), lalu diletakkan dalam tabung grafit kemudian tabung tersebut dipanaskan dengan sistem elektris dengan cara melewatkan arus listrik pada grafit. Akibat pemanasan ini, maka zat yang akan dianalisis berubah menjadi atom-atom netral dan pada fraksi atom ini dilewatkan suatu sinar yang berasal dari lampu katoda berongga sehingga terjadilah proses penyerapan energi sinar yang memenuhi kaidah analisis kuantitatif.
Pemanasan tabung ini dilakukan dengan arus listrik yang biasa berlangsung dalam tiga tahap, yaitu pengeringan, pengabuan dan pembakaran cairan sampel masing-masing dengan temperatur 500, 700, 3000ºC. Semua proses tahapan tersebut berjalan secara elektrik dan otomatik yang dikontrol dengan komputer (Rohman, 2007).
3. Monokromator
Monokromator merupakan alat untuk memisahkan radiasi yang tidak diperlukan dari spektrum radiasi lain yang dihasilkan oleh hollow chatode lamp dan memilih spektrum sesuai dengan panjang gelombang yang digunakan dalam analisis (Rohman, 2007).
4. Detektor
Detektor merupakan alat yang mengubah energi cahaya menjadi energi listrik, yang memberikan suatu isyarat listrik berhubungan dengan daya radiasi yang diserap oleh permukaan yang peka. Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman (Rohman, 2007).
5. Sistem Pengolah (Amplifier)
Sistem pengolah atau amplifier merupakan suatu alat untuk memperkuat signal yang diterima dari detektor sehingga dapat dibaca alat pencatat hasil atau readout (Rohman, 2007).
6. Pencatat hasil (Readout)
Pencatat hasil atau readout merupakan suatu alat penunjuk atau suatu sistem pencatatan hasil yang berupa hasil pembacaan. Hasil pembacaan dapat berupa angka atau berupa kurva yang menggambarkan absorbansi atau intensitas emisi (Rohman, 2007). Komponen spektrofotometer serapan atom dapat dilihat pada Gambar 2.1.
Gambar 2.1 Komponen Spektrofotometer Serapan Atom (Harris, 1995).
2.7 Gangguan-Gangguan pada Spektrofotometer Serapan Atom
Gangguan-gangguan (interference) yang ada pada spektrofotometri serapan atom adalah peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel (Rohman, 2007).
Menurut Rohman (2007), gangguan-gangguan yang dapat terjadi dalam spektrofotometri serapan atom sebagai berikut:
1. Gangguan yang berasal dari matriks sampel yang mana dapat mempengaruhi banyaknya sampel yang mencapai nyala.
2. Gangguan kimia yang dapat mempengaruhi jumlah atau banyaknya atom di dalam nyala.
3. Gangguan oleh absorbansi yang disebabkan oleh bukan dari absorbansi atom yang dianalisis, yakni absorbansi oleh molekul-molekul yang tidak terdisosiasi di dalam nyala.
4. Gangguan oleh penyerapan non-atomik (Rohman, 2007).
2.8 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya. Tindakan ini dilakukan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel dan tahan akan kisaran analit yang akan dianalisis (Harmita, 2004).
2.8.1 Kecermatan (accuracy)
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan ditentukan dengan dua cara yaitu:
a. Metode simulasi (spiked-placebo recovery)
Dalam metode simulasi, sejumlah analit bahan murni ditambahkan ke dalam campuran bahan pembawa sediaan farmasi lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya) (Harmita, 2004).
b. Metode penambahan baku (standard addition method)
Dalam metode penambahan baku, sampel dianalisis lalu sejumlah tertentu analit yang diperiksa ditambahkan ke dalam sampel, dicampur dan dianalisis lagi.
Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya (hasil yang diharapkan) (Harmita, 2004).
Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya. Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode tersebut.
Persen perolehan kembali ditentukan dengan menentukan berapa persen analit yang ditambahkan tadi dapat ditemukan (Harmita, 2004).
2.8.2 Keseksamaan (precision)
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi yang merupakan ukuran yang menunjukkan derajat kesesuaian
antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukan adanya keseksamaan metode yang dilakukan (Harmita, 2004).
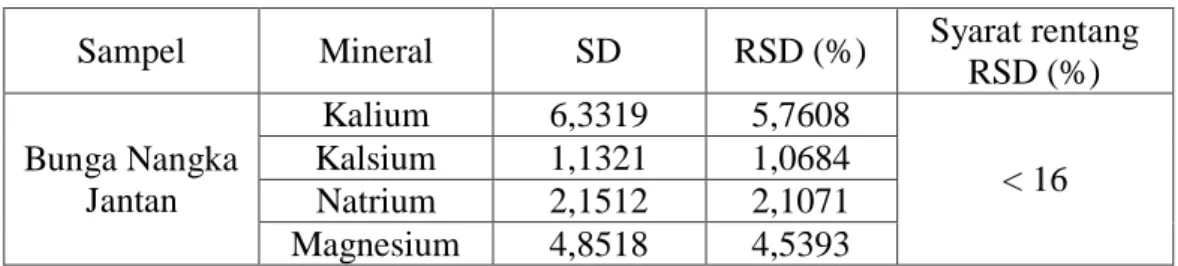
Nilai simpangan baku relatif (RSD) untuk analit dengan kadar part per million (ppm) adalah tidak lebih dari 16% dan untuk analit dengan kadar
part per billion (ppb) RSDnya adalah tidak lebih dari 32% (Harmita, 2004).
2.8.3 Batas Deteksi dan Batas Kuantitasi
Batas deteksi (limit of detection) adalah jumlah analit terkecil dalam sampel yang dapat dideteksi. Batas kuantitasi (limit of quantitation) merupakan parameter pada analisis dan diartikan sebagai kuantitas analit terkecil dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kimia Farmasi Kualitatif,
Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara dan Balai Riset dan Standardisasi Industri Medan pada bulan Februari 2017 – Juni 2017.
3.2 Alat
Alat-alat yang digunakan dalam penelitian ini adalah Spektrofotometer Serapan Atom (Shimadzu AA-7000) dengan nyala udara asetilen lengkap dan lampu katoda K, Ca, Na dan Mg, neraca analitik (BOECO germany), tanur (Stuart), hot plate, kertas saring Whatman no. 42, krus porselen, blender, spatula, botol kaca dan alat-alat gelas lainnya (Pyrex dan Oberol).
3.3 Bahan 3.3.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah bunga nangka betina dan bunga nangka jantan. Gambar sampel dapat dilihat pada Lampiran 5, halaman 48.
3.3.2 Pereaksi
Pereaksi yang digunakan dalam penelitian ini adalah pro analisis keluaran E. Merck yaitu asam nitrat 65% b/v, larutan standar kalium (1000 µg/ml), larutan standar kalsium (1000 µg/ml), larutan standar natrium (1000 µg/ml), larutan
standar magnesium (1000 µg/ml), larutan CsCl, larutan La2O3, larutan kuning titan 0,1%, larutan NaOH 2 N, larutan H2SO4 1 N dan akuademineralisata (Laboratorium Balai Riset dan Standardisasi Industri Medan).
3.4 Pembuatan Pereaksi 3.4.1 Larutan HNO3 (1:1)
Larutan HNO3 65% b/v sebanyak 500 ml diencerkan dengan 500 ml air suling (Dirjen POM RI, 1979).
3.4.2 Larutan CsCl
6,325 g CsCl ditambahkan dengan 25 ml HCl (p) dan dicukupkan dengan akuades hingga 250 ml (Antanasopoulos, 1996).
3.4.3 Larutan La2O3
5,875 g La2O3 ditambahkan dengan 50 ml HCl (p) dan dicukupkan dengan akuades hingga 250 ml (Antanasopoulos, 1996).
3.4.4 Larutan Kuning Titan 0,1%
Larutan kuning titan 0,1% b/v dibuat dengan cara melarutkan 0,1 g kuning titan dalam 100 ml air suling (Dirjen POM RI, 1979).
3.4.5 Larutan NaOH 2 N
Sebanyak 4 gram NaOH dilarutkan dengan akuades hingga 50 ml (Dirjen POM RI, 1979).
3.4.6 Larutan H2SO4 1 N
Sebanyak 28 ml larutan H2SO4 96% diencerkan dengan akuades hingga 1000 ml (Dirjen POM RI, 1979).
3.5 Prosedur Penelitian 3.5.1 Pengambilan Sampel
Sampel yang digunakan adalah bunga nangka betina dan jantan yang diambil secara purposif dari pohon nangka di Langsa, Aceh Timur. Metode pengambilan sampel dilakukan dengan cara sampling purposive yang dikenal juga sebagai sampling pertimbangan, dimana sampel ditentukan atas dasar
pertimbangan bahwa semua sampel mempunyai karakteristik yang sama dengan sampel yang diteliti (Budiarto, 2003).
3.5.2 Penyiapan Sampel
Sebanyak ± 250 g masing-masing bunga nangka betina dan jantan dibersihkan dari bagian kulit dengan cara mengupasnya, dicuci bersih lalu
ditiriskan, dikeringkan dengan cara diangin-anginkan. Selanjutnya masing-masing sampel diiris kecil-kecil dan dihaluskan dengan blender.
3.5.3 Proses Destruksi Kering
Sampel yang telah dihaluskan masing-masing ditimbang sebanyak ± 25 g didalam krus porselen, diarangkan diatas hot plate pada suhu 2000C, lalu
diabukan dengan tanur pada temperature awal 100oC dan dinaikkan perlahan-lahan hingga 500oC dengan interval 25oC setiap 5 menit. Pengabuan dilakukan selama 24 jam dan dibiarkan hingga dingin didalam tanur hingga suhu tanur mencapai suhu ruangan ± 27 oC (Isaac, 1990).
3.5.4 Pembuatan Larutan Sampel
Sampel hasil destruksi ditambahkan 5 ml HNO3 (1:1), lalu dimasukkan ke dalam labu tentukur 100 ml, krus porselen dibilas hingga tiga kali kemudian larutan dicukupkan dengan akuademineralisata hingga garis tanda dan
dihomogenkan. Selanjutnya larutan disaring dengan kertas Whatman no. 42 dan 5 ml filtrat pertama dibuang untuk menjenuhkan kertas saring kemudian filtrat selanjutnya ditampung dalam wadah botol kaca.
3.5.5 Analisa Kualitatif 3.5.5.1 Kalium
3.5.5.1.1 Dengan Uji Nyala
Dibersihkan kawat Ni/Cr dengan HCl pekat lalu dipijar pada api bunsen sampai tidak memberikan warna khusus pada nyala bunsen. Kemudian celupkan kedalam sampel lalu dipijar pada api bunsen, amati warna yang terjadi pada nyala bunsen. Jika terdapat kalium akan terbentuk warna ungu pada nyala bunsen (Vogel, 1979).
3.5.5.1.2 Uji Kristal Kalium dengan Asam Pikrat
Larutan sampel diteteskan 1-2 tetes pada object glass kemudian ditetesi dengan asam pikrat, biarkan ± 5 menit lalu diamati dibawah mikroskop. Jika terdapat kalium, akan terlihat kristal berbentuk jarum besar (Vogel, 1979).
3.5.5.2 Kalsium
3.5.5.2.1 Dengan Uji Nyala
Dibersihkan kawat Ni/Cr dengan HCl pekat lalu dipijar pada api bunsen sampai tidak memberikan warna khusus pada nyala bunsen. Kemudian celupkan kedalam sampel lalu dipijar pada api bunsen, amati warna yang terjadi pada nyala bunsen. Jika terdapat kalsium akan terbentuk warna merah bata pada nyala bunsen (Vogel, 1979).
3.5.5.2.2 Uji Kristal Kalsium dengan Asam Sulfat 1 N
Larutan sampel diteteskan 1-2 tetes pada object glass kemudian ditetesi dengan asam sulfat 1 N dan etanol 96% v/v akan terbentuk endapan putih lalu diamati dibawah mikroskop. Jika terdapat kalsium, akan terlihat kristal berbentuk jarum (Vogel, 1979).
3.5.5.3 Natrium
3.5.5.3.1 Dengan Uji Nyala
Dibersihkan kawat Ni/Cr dengan HCl pekat lalu dipijar pada api bunsen sampai tidak memberikan warna khusus pada nyala bunsen. Kemudian celupkan kedalam sampel lalu dipijar pada api bunsen, amati warna yang terjadi pada nyala bunsen. Jika terdapat natrium akan terbentuk warna kuning keemasan pada nyala bunsen (Vogel, 1979).
3.5.5.3.2 Uji Kristal Natrium dengan Asam Pikrat
Larutan sampel diteteskan 1-2 tetes pada object glass kemudian ditetesi dengan asam pikrat, biarkan ± 5 menit lalu diamati dibawah mikroskop. Jika terdapat natrium, akan terlihat kristal berbentuk jarum kecil (Vogel, 1979).
3.5.5.4 Magnesium
3.5.5.4.1 Dengan Reagensia Kuning Titan
Larutan sampel diteteskan 1-2 tetes pada tabung reaksi kemudian ditetesi dengan larutan kuning titan dan natrium hidroksida 2 N, jika terdapat magnesium akan menghasilkan warna atau endapan merah (Vogel, 1979).
3.5.6 Analisa Kuantitatif
3.5.6.1 Pembuatan Kurva Kalibrasi Kalium
Larutan baku kalium (1000 µg/ml) dipipet sebanyak 1 ml, dimasukkan kedalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 10 µg/ml) (larutan induk baku II).
Larutan untuk kurva kalibrasi kalium dibuat dengan memipet larutan induk baku II sebanyak 1 ml; 2 ml; 3 ml; 4 ml dan 5 ml dilarutkan dalam labu 50 ml lalu ditambahkan 2,5 ml larutan CsCl dan dicukupkan sampai garis tanda dengan akuademineralisata sehingga didapatkan konsentrasi berturut-turut 0,2 µg/ml; 0,4 µg/ml; 0,6 µg/ml; 0,8 µg/ml dan 1,0 µg/ml lalu diukur pada panjang gelombang 766,5 nm.
3.5.6.2 Pembuatan Kurva Kalibrasi Kalsium
Larutan baku kalsium (1000 µg/ml) dipipet sebanyak 5 ml, dimasukkan kedalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 50 µg/ml) (larutan induk baku II).
Larutan untuk kurva kalibrasi kalsium dibuat dengan memipet larutan induk baku II sebanyak 1 ml; 2 ml; 3 ml; 4 ml dan 5 ml dilarutkan dalam labu 50 ml lalu ditambahkan 2,5 ml larutan La2O3 dan dicukupkan sampai garis tanda dengan akuademineralisata sehingga didapatkan konsentrasi berturut-turut 1,0 µg/ml; 2,0 µg/ml; 3,0 µg/ml; 4,0 µg/ml dan 5,0 µg/ml lalu diukur pada panjang gelombang 422,7 nm.
3.5.6.3 Pembuatan Kurva Kalibrasi Natrium
Larutan baku natrium (1000 µg/ml) dipipet sebanyak 1 ml, dimasukkan kedalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 10 µg/ml) (larutan induk baku II).
Larutan untuk kurva kalibrasi natrium dibuat dengan memipet larutan induk baku II sebanyak 0,5 ml; 1 ml; 1,5 ml; 2 ml dan 2,5 ml dilarutkan dalam labu 50 ml lalu ditambahkan 2,5 ml larutan CsCl dan dicukupkan sampai garis tanda dengan akuademineralisata sehingga didapatkan konsentrasi berturut-turut 0,1 µg/ml; 0,2 µg/ml; 0,3 µg/ml; 0,4 µg/ml dan 0,5 µg/ml lalu diukur pada panjang gelombang 589,0 nm.
3.5.6.4 Pembuatan Kurva Kalibrasi Magnesium
Larutan baku magnesium (1000 µg/ml) dipipet sebanyak 0,5 ml, dimasukkan kedalam labu tentukur 100 ml dan dicukupkan hingga garis tanda dengan akuademineralisata (konsentrasi 5 µg/ml) (larutan induk baku II).
Larutan untuk kurva kalibrasi magnesium dibuat dengan memipet larutan induk baku II sebanyak 0,2 ml; 0,4 ml; 0,6 ml; 0,8 ml dan 1,0 ml dilarutkan dalam labu 50 ml lalu ditambahkan 2,5 ml larutan La2O3 dan dicukupkan sampai garis tanda dengan akuademineralisata sehingga didapatkan konsentrasi berturut-turut 0,02 µg/ml; 0,04 µg/ml; 0,06 µg/ml; 0,08 µg/ml dan 0,1 µg/ml lalu diukur pada panjang gelombang 285,2 nm.
3.5.7 Penetapan Kadar Mineral dalam Sampel 3.5.7.1 Penetapan Kadar Kalium
Larutan sampel hasil destruksi dipipet sebanyak 1 ml lalu dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan dengan akuademineralisata sampai
garis tanda (faktor pengenceran = 100 ml/1 ml = 100 kali) (Labu I). Selanjutnya dipipet dari labu I sebanyak 5 ml lalu dimasukkan ke dalam labu tentukur 100 ml dan ditambahkan 5 ml larutan CsCl kemudian dicukupkan dengan
akuademineralisata sampai garis tanda (faktor pengenceran = 100 ml/5 ml
= 20 kali) (Labu II). Total faktor pengenceran adalah 100 x 20 = 2000 kali. Lalu diukur absorbansinya pada panjang gelombang 766,5 nm menggunakan alat spektrofotometer serapan atom yang telah disesuaikan kondisinya dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalium. Konsentrasi kalium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.7.2 Penetapan Kadar Kalsium
Larutan sampel hasil destruksi dipipet sebanyak 2 ml lalu dimasukkan ke dalam labu tentukur 100 ml dan ditambahkan 5 ml larutan La2O3 kemudian dicukupkan dengan akuademineralisata sampai garis tanda (faktor pengenceran
= 100 ml/2 ml = 50 kali). Lalu diukur absorbansinya pada panjang gelombang 422,7 nm menggunakan alat spektrofotometer serapan atom yang telah
disesuaikan kondisinya dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalsium.
Konsentrasi kalsium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.7.3 Penetapan Kadar Natrium
Pada bunga nangka betina larutan sampel hasil destruksi dipipet sebanyak
(faktor pengenceran = 100 ml/2 ml = 50 kali). Pada bunga nangka jantan larutan sampel hasil destruksi dipipet sebanyak 1 ml lalu dimasukkan ke dalam labu tentukur 100 ml dan ditambahkan 5 ml larutan CsCl kemudian dicukupkan dengan akuademineralisata sampai garis tanda (faktor pengenceran = 100 ml/1 ml
= 100 kali). Lalu diukur absorbansinya pada panjang gelombang 589,0 nm menggunakan alat spektrofotometer serapan atom yang telah disesuaikan kondisinya dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku natrium. Konsentrasi natrium dalam sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.7.4 Penetapan Kadar Magnesium
Larutan sampel hasil destruksi dipipet sebanyak 1 ml lalu dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan dengan akuademineralisata sampai garis tanda (faktor pengenceran = 100 ml/1 ml = 100 kali) (Labu I). Selanjutnya dipipet dari labu I sebanyak 10 ml lalu dimasukkan ke dalam labu tentukur 100 ml dan ditambahkan 5 ml larutan La2O3 kemudian dicukupkan dengan
akuademineralisata sampai garis tanda (faktor pengenceran = 100 ml/10 ml
= 10 kali) (Labu II). Total faktor pengenceran adalah 100 x 10 = 1000 kali. Lalu diukur absorbansinya pada panjang gelombang 285,2 nm menggunakan alat spektrofotometer serapan atom yang telah disesuaikan kondisinya dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku magnesium. Konsentrasi magnesium dalam sampel
ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.7.5 Perhitungan Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Sampel
Kadar kalium, kalsium, natrium dan magnesium dalam sampel dapat dihitung dengan cara berikut:
3.5.8 Analisis Data Secara Statistika 3.5.8.1 Penolakan Hasil Pengamatan
Menurut Sudjana (2005) kadar kalium, kalsium, natrium dan magnesium yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis dengan metode standar deviasi menggunakan rumus sebagai berikut:
SD =
√
Keterangan: Xi = Kadar sampel (mg/100g)
Xi = Kadar rata-rata sampel (mg/100g) n = Jumlah pengulangan
Untuk mencari t hitung digunakan rumus:
t hitung = | | √
dan untuk menentukan kadar mineral di dalam sampel dengan interval kepercayaan 95%, α = 0,05; dk = n-1, dapat digunakan rumus:
Kadar mineral: µ = Xi ± (t(α/2, dk) x SD /√ )
Keterangan: Xi = Kadar rata-rata sampel (mg/100 g) SD = Standar Deviasi
dk = Derajat kebebasan (dk = n-1) α = Interval kepercayaan
n = Jumlah pengulangan 3.5.9 Uji Perolehan Kembali (Recovery)
Uji perolehan kembali atau recovery dilakukan dengan metode
penambahan larutan standar (standard addition method). Dalam metode ini, kadar mineral dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan
penentuan kadar mineral dalam sampel setelah penambahan larutan baku standar dengan konsentrasi tertentu (Harmita, 2004).
Larutan baku yang ditambahkan yaitu 13,0 ml larutan baku kalium (konsentrasi 1000 µg/ml); 1,4 ml larutan baku kalsium (konsentrasi 1000 µg/ml);
4,0 ml larutan baku natrium (konsentrasi 100 µg/ml) dan 4,0 ml larutan baku magnesium (konsentrasi 100 µg/ml). Perhitungan penambahan volume baku kalium, kalsium, natrium dan magnesium pada uji akurasi dalam bunga nangka jantan dapat dilihat pada Lampiran 20, halaman 90-91.
Sampel yang telah dihaluskan masing-masing ditimbang secara seksama
± 25 g di dalam krus porselen, lalu ditambahkan 13,0 ml larutan baku kalium (konsentrasi 1000 µg/ml); 1,4 ml larutan baku kalsium (konsentrasi 1000 µg/ml);
4,0 ml larutan baku natrium (konsentrasi 100 µg/ml) dan 4,0 ml larutan baku magnesium (konsentrasi 100 µg/ml) kemudian dilanjutkan dengan prosedur destruksi kering seperti yang telah dilakukan sebelumnya.
Menurut (Harmita, 2004) persen perolehan kembali dapat dihitung dengan rumus di bawah ini:
% perolehan kembali =
x 100%
Keterangan: CA =kadar logam dalam sampel sebelum penambahan baku CF =kadar logam dalam sampel setelah penambahan baku C*A =kadar larutan baku yang ditambahkan
3.5.10 Simpangan Baku Relatif
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang
memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan (Harmita, 2004).
Menurut (Harmita, 2004) rumus untuk menghitung simpangan baku relatif adalah sebagai berikut:
RSD =
x 100%
Keterangan: Xi = Kadar rata-rata sampel SD = Standar Deviasi
RSD = Relative Standard Deviation (Simpangan Baku Relatif)
3.5.11 Penentuan Batas Deteksi dan Batas Kuantitasi
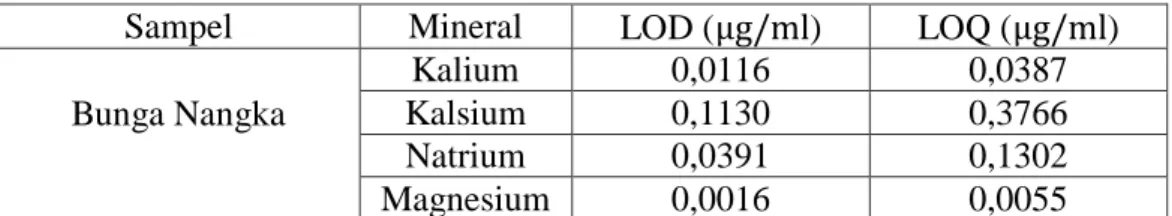
Batas deteksi (limit of detection, LOD) merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko. Batas deteksi merupakan parameter uji batas sedangkan batas kuantitasi (limit of quantitation, LOQ) merupakan parameter pada analisa renik dan diartikan sebagai kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
Menurut (Harmita, 2004) batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus sebagai berikut:
Simpangan Baku Residual ( ⁄ ) =
√
Batas deteksi (LOD) = ( ⁄ )
Batas kuantitasi (LOQ) = ( ⁄ )
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Laboratorium Taksonomi Tumbuhan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan. Hasil identifikasi menunjukkan bahwa
tumbuhan yang digunakan adalah bunga nangka dengan jenis Artocarpus heterophyllus Lam. dari suku Moraceae. Hasil identifikasi bunga
nangka dapat dilihat pada Lampiran 1, halaman 44.
4.2 Analisis Kualitatif
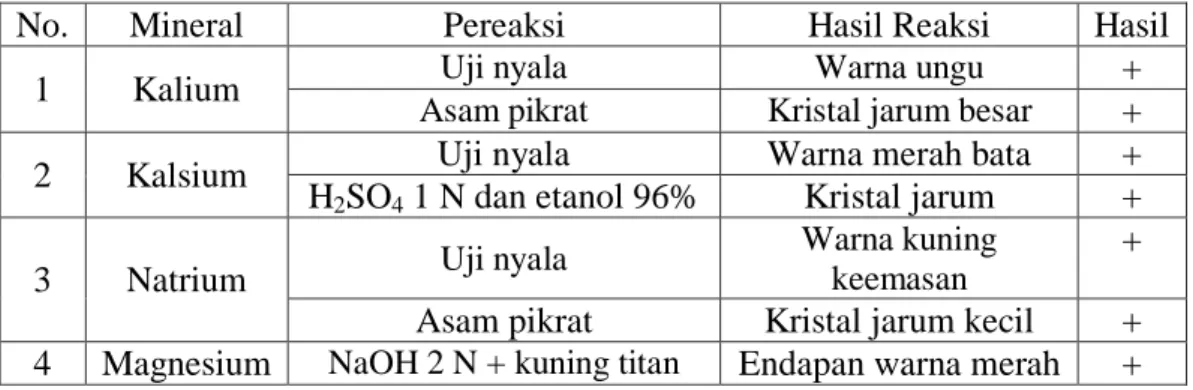
Analisis kualitatif dilakukan sebagai analisis pendahuluan untuk mengetahui secara kualitatif mineral kalium, kalsium, natrium dan magnesium dalam sampel. Hasil analisis kualitatif kalium, kalsium, natrium dan magnesium dalam bunga nangka betina dan bunga nangka jantan dapat dilihat pada Tabel 4.1 dan 4.2.
Tabel 4.1 Hasil Analisis Kualitatif Kalium, Kalsium, Natrium dan Magnesium dalam Bunga Nangka Betina
No. Mineral Pereaksi Hasil Reaksi Hasil
1 Kalium Uji nyala Warna ungu +
Asam pikrat Kristal jarum besar +
2 Kalsium Uji nyala Warna merah bata +
H2SO4 1 N dan etanol 96% Kristal jarum + Warna kuning +
(0,1% b/v) Keterangan : (+) mengandung mineral
Tabel 4.2 Hasil Analisis Kualitatif Kalium, Kalsium, Natrium dan Magnesium dalam Bunga Nangka Jantan
No. Mineral Pereaksi Hasil Reaksi Hasil
1 Kalium Uji nyala Warna ungu +
Asam pikrat Kristal jarum besar +
2 Kalsium Uji nyala Warna merah bata +
H2SO4 1 N dan etanol 96% Kristal jarum +
3 Natrium Uji nyala
Warna kuning keemasan
+ Asam pikrat Kristal jarum kecil + 4 Magnesium NaOH 2 N + kuning titan
(0,1% b/v)
Endapan warna merah + Keterangan : (+) mengandung mineral
Pada Tabel 4.1 dan 4.2 menunjukkan bahwa sampel bunga nangka betina dan jantan mengandung mineral kalium, kalsium, natrium dan magnesium.
Sampel dinyatakan positif mengandung mineral tersebut sesuai dengan uji yang terdapat pada Tabel 4.1 dan 4.2. Hasil uji kualitatif bunga nangka dapat dilihat pada Lampiran 9, halaman 52-53.
4.3 Analisis Kuantitatif
4.3.1 Kurva Kalibrasi Kalium, Kalsium, Natrium dan Magnesium
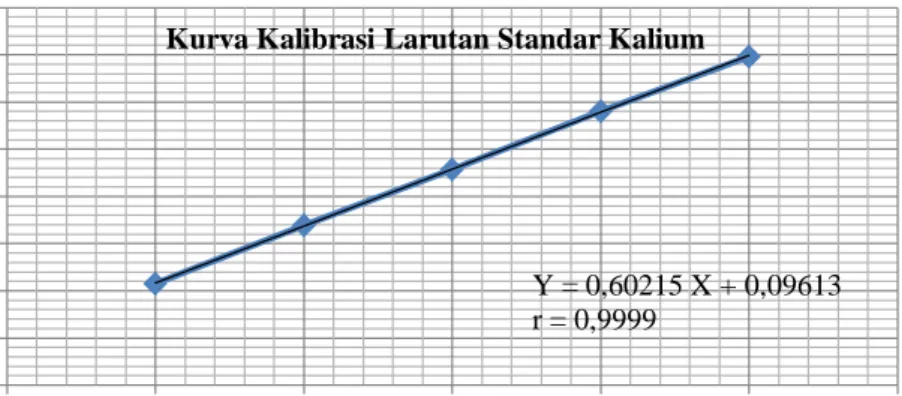
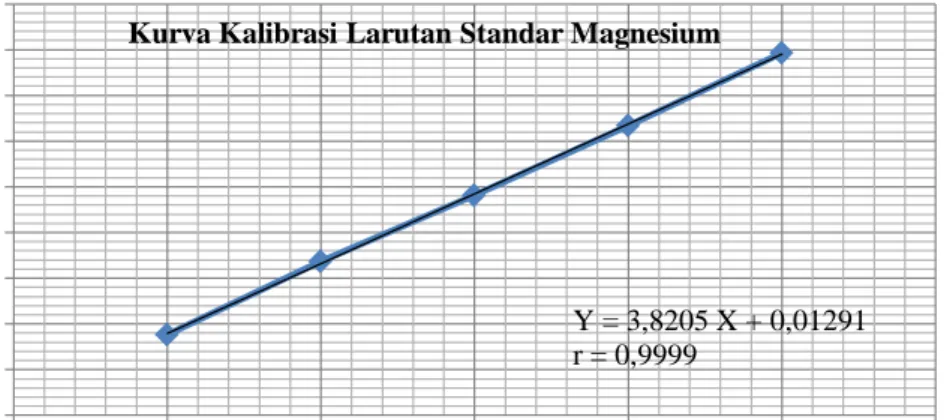
Kurva kalibrasi kalium, kalsium, natrium dan magnesium diperoleh dengan cara mengukur absorbansi dari larutan standar pada panjang gelombang 766,5 nm untuk kalium, 422,7 nm untuk kalsium, 589,0 nm untuk natrium dan 285,2 nm untuk magnesium. Dari pengukuran kurva kalibrasi diperoleh
persamaan garis regresi yaitu Y= 0,60215X + 0,096130 untuk kalium, Y= 0,075950X + 0,022190 untuk kalsium, Y= 0,78680X + 0,12560 untuk natrium
dan Y= 3,8205X + 0,012910 untuk magnesium.
Kurva kalibrasi larutan standar kalium, kalsium, natrium dan magnesium dapat dilihat pada Gambar 4.1-4.4.
Gambar 4.1 Kurva Kalibrasi Larutan Standar Kalium
Gambar 4.2 Kurva Kalibrasi Larutan Standar Kalsium
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8
0 0.2 0.4 0.6 0.8 1 1.2
Absorbansi
Konsentrasi (µg/ml)
Y = 0,60215 X + 0,09613 r = 0,9999
Kurva Kalibrasi Larutan Standar Kalium
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45
0 1 2 3 4 5 6
Absorbansi
Konsentrasi (µg/ml)
Y = 0,07595 X + 0,02219 r = 0,9998
Kurva Kalibrasi Larutan Standar Kalsium
0.2 0.3 0.4 0.5 0.6
Absorbansi
Kurva Kalibrasi Larutan Standar Natrium
Gambar 4.3 Kurva Kalibrasi Larutan Standar Natrium
Gambar 4.4 Kurva Kalibrasi Larutan Standar Magnesium
Pada gambar di atas diperoleh hubungan yang linier antara konsentrasi dan absorbansi, dengan koefisien korelasi (r) kalium sebesar 0,9999, kalsium sebesar 0,9998, natrium sebesar 0,9975 dan magnesium sebesar 0,9999. Nilai r ≥ 0,97 menunjukkan adanya korelasi linier yang menyatakan adanya hubungan antara X (konsentrasi) dan Y (absorbansi) (Ermer dan McB. Miller, 2005). Data hasil pengukuran absorbansi larutan standar kalium, kalsium, natrium dan magnesium dan perhitungan persamaan garis regresi dapat dilihat pada Lampiran 10-13, halaman 54-61.
4.3.2 Analisis Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Sampel
Penentuan kadar kalium, kalsium, natrium dan magnesium dilakukan secara spektrofotometri serapan atom. Konsentrasi logam kalium, kalsium, natrium dan magnesium dalam sampel ditentukan berdasarkan persamaan garis regresi kurva kalibrasi larutan standar masing-masing mineral. Hasil analisis kuantitatif kadar kalium, kalsium, natrium dan magnesium dalam bunga nangka
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45
0 0.02 0.04 0.06 0.08 0.1 0.12
Absorbansi
Konsentrasi (µg/ml)
Y = 3,8205 X + 0,01291 r = 0,9999
Kurva Kalibrasi Larutan Standar Magnesium
betina dan jantan dapat dilihat pada Tabel 4.3. Hasil analisis kadar dan contoh perhitungan dapat dilihat pada Lampiran 14-17, halaman 62-69. Analisis dilanjutkan dengan perhitungan statistik yang dapat dilihat pada Lampiran 18-19, halaman 70-89.
Tabel 4.3 Hasil Analisis Kuantitatif Kadar Kalium, Kalsium, Natrium dan Magnesium dalam Bunga Nangka Betina dan Jantan
Mineral Kadar (mg/100g)
Bunga Nangka Betina Bunga Nangka Jantan Kalium 487,7379 ± 12,2048 530,3810 ± 2,7604
Kalsium 69,1534 ± 0,1198 54,9280 ± 0,5189
Natrium 5,7291 ± 0,2679 16,0874 ± 1,2079
Magnesium 12,9825 ± 0,4280 16,6526 ± 0,2046 Pada Tabel 4.3 menunjukkan bahwa dalam bunga nangka betina dan jantan terdapat kandungan kalium, kalsium, natrium dan magnesium. Dari data tersebut juga menunjukkan bahwa kandungan kalium, natrium dan magnesium pada bunga nangka jantan lebih besar dibandingkan dengan bunga nangka betina sedangkan kandungan kalsiumnya lebih besar terdapat pada bunga nangka betina dibandingkan bunga nangka jantan. Bunga nangka jantan memiliki kadar mineral kalium, kalsium, natrium dan magnesium yang secara keseluruhan lebih besar dibandingkan dengan bunga nangka betina karena bunga nangka jantan merupakan bongkol bunga yang tidak akan menjadi buah dan akan gugur semasa masih dipohon. Kadar mineral yang terdapat pada bunga nangka betina lebih kecil dibandingkan bunga nangka jantan karena bunga nangka betina merupakan bakal buah yang akan menjadi nangka masak dan untuk pemanfaatannya bunga nangka betina lebih baik dimanfaatkan setelah menjadi nangka masak karena masih